Tras un episodio de hemorragia subaracnoidea inicial fallecen hasta el 50% de los pacientes, y el 30-40% de los enfermos sufren un nuevo sangrado durante el primer mes. El porcentaje de defunciones debido al resangrado se encuentra entre el 60 y el 75%. Tanto la embolización endovascular como la cirugía disminuyen la tasa de mortalidad y mejoran la calidad de vida de los supervivientes.
ObjetivoEl objetivo de este estudio ha sido describir una serie de pacientes con hemorragia subaracnoidea espontánea, secundaria a rotura aneurismática, tratados en el Hospital Universitario de Getafe entre los años 2010 y 2019, estudiar las diferentes opciones de diagnóstico y de tratamiento, y definir los factores pronósticos más importantes. Además, se compararon los resultados de ambos tratamientos (quirúrgico y endovascular).
Material y métodosSe ha llevado a cabo un estudio descriptivo, retrospectivo, de revisión de historias clínicas, recogiendo las principales variables epidemiológicas y clínicas.
ResultadosSe ha estudiado a 110 pacientes, 58 varones y 52 mujeres, con una edad media de 40,8 años. Del total, 25 pacientes han sido tratados quirúrgicamente y 85 mediante embolización endovascular. En este estudio, la situación clínica neurológica al ingreso, el volumen y la distribución de sangre en la tomografía computarizada y la edad del paciente parecen ser las variables más influyentes en el resultado evolutivo final.
DiscusiónSe ha establecido que el mejor manejo en este tipo de pacientes es la realización de tomografía computarizada de cráneo y arteriografía cerebral, así como el ingreso para vigilancia en UCI. La cirugía sigue teniendo un papel importante en el tratamiento de los aneurismas que originan hemorragia subaracnoidea, y las indicaciones de la embolización endovascular están cada vez mejor definidas. La embolización endovascular es un método seguro y efectivo en el tratamiento de los aneurismas cerebrales.
After an episode of initial subarachnoid hemorrhage, up to 50% of patients die, and 30-40% of patients suffer from new bleeding during the first month. The percentage of deaths due to rebleeding is between 60% and 75%. Both endovascular embolization and surgery decrease the mortality rate, and improve the quality of life of survivors.
ObjectiveThe objective of this study has been to describe a series of patients with spontaneous subarachnoid hemorrhage, secondary to aneurysmal rupture, treated at the University Hospital of Getafe between 2010 and 2019, study the different diagnostic and treatment options, and define the most important prognostic factors. In addition, compare the results of both treatments (surgical and endovascular).
Material and methodsA descriptive, retrospective study of review of medical records has been carried out, including epidemiology.
ResultsA total of 110 patients, 58 men and 52 women, with a mean age of 40.8 years have been studied. Of the total, 25 patients have been treated surgically and 85 by endovascular embolization. In this study, the clinical neurological situation at admission, the volume and distribution of blood on computed tomography and the patient's age appear to be the most influential variables in the final result.
DiscussionIt has been established that the best management in this type of patients is the performance of computed tomography of the skull and cerebral arteriography, as well as admission for surveillance in the ICU. Surgery continues to play an important role in the treatment of aneurysms that cause subarachnoid hemorrhage, and the indications of endovascular embolization are increasingly well defined. Endovascular embolization is a safe and effective method in the treatment of cerebral aneurysms.
La hemorragia subaracnoidea (HSA) es el cuadro resultante de la extravasación de sangre en el espacio subaracnoideo. La causa más frecuente es el traumatismo craneoencefálico. La HSA primaria o espontánea es con mayor frecuencia causada por la rotura de un aneurisma cerebral, aunque existen otras causas como las malformaciones vasculares, tumores cerebrales, alteraciones de la pared vascular y alteraciones de la coagulación1. La HSA corresponde del 6 al 8% de todas las enfermedades vasculares cerebrales agudas. Sin embargo, aunque su incidencia es menor que la del ictus isquémico, afecta a pacientes de menor edad y tiene una elevada morbimortalidad2. A pesar de que el tratamiento precoz de los aneurismas está cada vez más extendido, el resangrado continúa siendo una causa importante de morbimortalidad3. El riesgo de resangrado con tratamiento conservador de los aneurismas es de hasta un 30% en el primer mes, y se estabiliza posteriormente en un 3% al año1. El riesgo de resangrado aumenta en enfermos con presión arterial elevada, mal grado clínico y en aquellos en los que el periodo entre el diagnóstico y el tratamiento es mayor3.
El síntoma más frecuente es una cefalea brusca. Aunque no existe una escala perfecta, hoy día las más validadas son la de Hunt y Hess y la propuesta por la Federación Mundial de Sociedades Neuroquirúrgicas (WFNS) basada en la escala de coma de Glasgow, cuya puntuación desglosada debe quedar también registrada4. La tomografía computarizada (TC) es la prueba más sensible para el diagnóstico de la HSA y siempre se debe practicar lo antes posible cuando existe la sospecha clínica. La cuantificación del depósito hemático en el espacio subaracnoideo puede ser difícil de determinar5; para ello, la escala más utilizada es la de Fisher6. Sin embargo, la prueba estándar para el diagnóstico de la etiología y la localización del aneurisma causante de la HSA sigue siendo la angiografía cerebral7.
No existe aún un consenso general entre los autores para tratar los diferentes aspectos de esta enfermedad y los protocolos de manejo han cambiado de manera considerable a lo largo del tiempo: varían entre distintos centros y países4. En la actualidad, se tiende a adoptar en la mayoría de los centros un protocolo de manejo más uniforme, especialmente diseñado para mejorar la evolución global de la enfermedad y no solo de los casos seleccionados para la cirugía1. Para ajustarse con éxito a estos protocolos, es necesaria la estrecha colaboración entre neurólogos, neurocirujanos, intensivistas y neurorradiólogos intervencionistas.
En muchos estudios se han empleado las escalas de Glasgow, tanto la escala de Glasgow para el coma como el índice de situación clínica del paciente durante el ingreso, como la escala evolutiva o pronóstica de Glasgow, que evalúa el resultado clínico final del tratamiento de la HSA aneurismática7. Sin embargo, ambas escalas tienen una alta variabilidad interpersonal y son dependientes del estado clínico residual pretratamiento, por lo que no son universalmente aceptadas, ya que plantean algunos interrogantes. El objetivo último, tanto de la cirugía como de la embolización, es evitar el resangrado, manteniendo la mejor situación neurológica posible3. El resultado final del tratamiento de la HSA también depende de los cuidados médicos del paciente, tales como las medidas antivasoespasmo, la profilaxis de crisis comiciales y el tratamiento de complicaciones asociadas, procedimientos bien descritos en gran número de protocolos. Los méritos relativos del tratamiento quirúrgico convencional y de la embolización endovascular dependen tanto de su seguridad (riesgo de complicaciones médicas asociadas, estancia hospitalaria o integridad neurológica, entre otros) como de su capacidad para prevenir el resangrado1.
El objetivo de este trabajo es describir la evolución clínica de una serie de pacientes con HSA aneurismática, tratados mediante cirugía y abordaje endovascular.
Material y métodosSe ha realizado un estudio descriptivo y retrospectivo, mediante revisión de historias clínicas, de los pacientes que presentaron HSA aneurismática tratada en el Hospital Universitario de Getafe desde el año 2015 hasta 2019. El diagnóstico se hizo con TC de cráneo y arteriografía cerebral.
Los criterios de inclusión fueron:
1. Diagnóstico de HSA espontánea por rotura aneurismática, tratados mediante pinzamiento quirúrgico clásico o embolización endovascular.
Los criterios de exclusión fueron:
- 1.
HSA traumática o de causa indeterminada (no aneurismática).
- 2.
Pacientes que ingresaron para tratamiento de aneurismas arteriales cerebrales asintomáticos («no rotos» o aneurismas incidentales).
- 3.
Pacientes tratados en otros centros hospitalarios.
- 4.
Pacientes en los que se decidió no efectuar tratamiento, bien fuera por edad o por situación clínica.
- 5.
Historia o datos clínicos incompletos.
Con la revisión de las historias clínicas se recogieron las variables que se muestran en la tabla 1.
Variables analizadas en nuestro estudio
| Variables analizadas |
|---|
| 1.- Edad |
| 2.- Sexo |
| 3.- Fecha de ingreso |
| 4- Situación clínica al ingreso según la Escala WFNS |
| 5- Antecedentes médicos |
| 6- Escala de Fisher (volumen de la hemorragia) |
| 7- Escala de Hunt y Hess |
| 8- Número de aneurismas encontrados en la arteriografía |
| 9- Localización anatómica del aneurisma causante del sangrado |
| 10- Tipo de tratamiento realizado (pinzamiento quirúrgico clásico versus embolización endovascular), fecha |
| 11- Si se ha requerido nuevo tratamiento |
| 12- Número de días de estancia en UCI |
| 13- Complicaciones |
| 14- Morbilidad |
| 15- Desarrollo de resangrado |
| 16- Evolución final al alta hospitalaria, según la escala de Glasgow |
| 17- Evolución mediante entrevista posterior al alta |
Fueron comparados aquellos pacientes tratados mediante cirugía con los tratados por vía endosvacular con relación al resultado final, la duración del ingreso hospitalario, las complicaciones presentadas y la necesidad de retratamiento verdadero. Se compararon ambos tratamientos, quirúrgico y endovascular, según la estancia hospitalaria global media, el número de ingresos medio por paciente, el número de pacientes que reingresaron, la estancia media en UCI, el tiempo de demora entre el inicio de la HSA y el tratamiento, el número de pacientes con morbilidad postratamiento, el número de pacientes que precisaron retratamiento, el número de pacientes que desarrollaron resangrado y la evolución final, como resultado «bueno» (buena recuperación o incapacidad moderada) o «malo» (incapacidad grave, estado vegetativo persistente o fallecimiento). La evolución final del paciente con HSA se determinó en el momento de su alta hospitalaria.
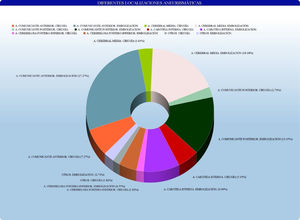
Con los datos obtenidos en el trabajo se calculó la incidencia de HSA con relación al área sanitaria dependiente del Hospital Universitario de Getafe, la estancia hospitalaria global, la estancia en UCI, el número de ingresos hospitalarios por paciente en el Servicio de Neurocirugía, el número de reingresos precisados en planta, el número de reingresos en UCI, el tiempo de demora entre la HSA y el tratamiento y la estancia hospitalaria postratamiento. Se agruparon las localizaciones aneurismáticas en arteria comunicante anterior, comunicante posterior, carótida interna, cerebral media, circulación cerebral posterior u otros.
Análisis estadísticoPara el estudio bivariable se empleó la prueba de χ?. El límite de significación estadística se estableció en un intervalo de confianza del 95% (p<0,05). Se utilizó el paquete estadístico IBM SPSS 22.0 (IBM Corp. Released 2013. IBM SPSS Statistics for Windows, Version 22.0. Armonk, NY: IBM Corp.) para el estudio multivariable.
ResultadosSe revisaron 166 historias clínicas; fueron excluidos 56 pacientes por no cumplir los criterios de inclusión o presentar algún criterio de exclusión, por lo que finalmente en este estudio se han analizado los datos de 110 pacientes. De ellos, 25 fueron tratados mediante cirugía y 85 con embolización endovascular. Se ha evidenciado presencia de aneurismas múltiples en el 15,73% de los pacientes (pinzados=12,94% versus embolizados=21,79%). Los pacientes ingresaron inicialmente en el Servicio de Cuidados Intensivos y pasaron después a la planta de hospitalización de Neurocirugía.
Del total de 110 pacientes, 52 fueron mujeres (47,28%) y 58 varones (52,72%). El rango de edad comprendió de los 14 a los 82 años, con una edad media de 40,8? ±?13 años. La incidencia anual media estimada en el estudio ha sido de 1,85? ± 0,64 por cada 100.000 habitantes al año (considerando el área sanitaria dependiente de nuestro centro como de 863.000 habitantes). No se encontraron diferencias estadísticamente significativas en los 2grupos con relación a la edad media al ingreso (p=0,13) y al sexo (p=0,12).
Existen diferencias estadísticamente significativas en cuanto a lo siguiente:
- 1.
La evolución final según la situación clínica durante el ingreso (valorada con las escalas de Glasgow, utilizando WFNS y Hunt y Hess) (p<0,05).
- 2.
El volumen de sangre en la TC (escala de Fisher), con una p<0,05.
- 3.
Resangrado «verdadero» (p<0,01).
- 4.
Rapidez de instauración de tratamiento (p<0,05).
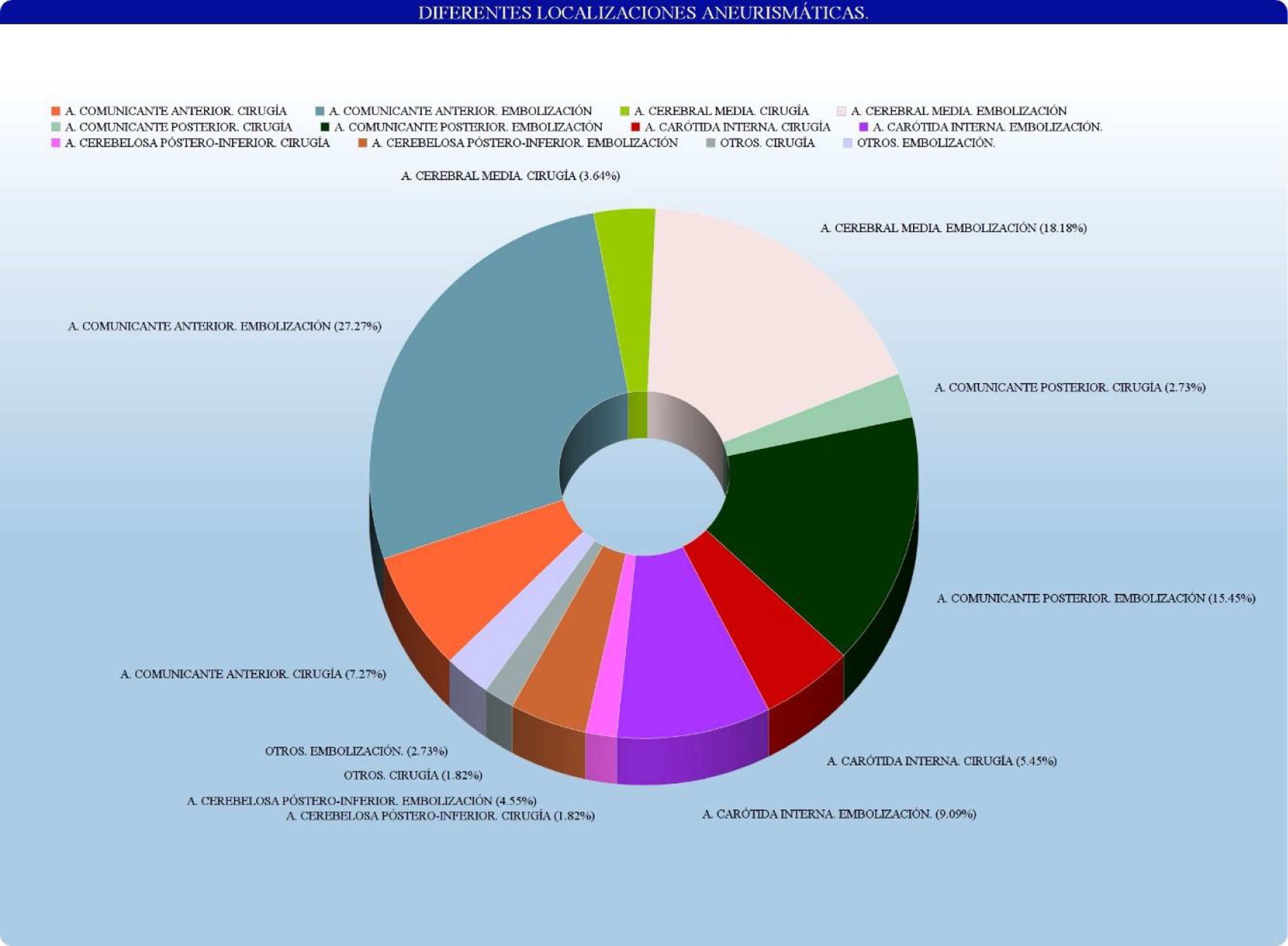
No existe diferencia estadísticamente significativa con respecto a la presencia de aneurismas múltiples (p=0,08). Por otra parte, se encontraron diferencias estadísticamente significativas (p<0,04) en la localización aneurismática, según los grupos antes descritos. Los datos se encuentran reflejados en la tabla 2 y en la figura 1.
Características epidemiológicas de los pacientes con hemorragia subaracnoidea
| Cirugía | Embolización | p | |
|---|---|---|---|
| Edad media en años | 49 ± 13 | 52 ± 13 | 0,13 |
| Sexo n (%) | |||
| Masculino | 51,36 | 53,1 | 0,12 |
| Femenino | 48,64 | 46,9 | 0,12 |
| A. múltiples: | 12,94 | 21,79 | 0,08 |
| Localizaciones aneurismáticas agrupadas n (%): | <0,04 | ||
| Territorio de arteria comunicante anterior | 10 (39,41) | 28 (34,62) | |
| Territorio de la arteria carótida interna | 7 (31,76) | 29 (36,62) | |
| Territorio de la arteria cerebral media | 6 (25,29) | 18 (17,95) | |
| Territorio cerebral posterior | 1 (3,53) | 6 (12,82 |
Las localizaciones específicas de los aneurismas cerebrales rotos tratados en nuestro hospital han sido, por orden de frecuencia, arteria comunicante anterior (pinzados quirúrgicamente=35,88% versus embolizados por vía endovascular=33,33%), arteria cerebral media (pinzados 25,29% vs. embolizados 17,95%), arteria comunicante posterior (23,53% vs. 20,51%), arteria carótida interna (7,06% vs. 8,97%), arteria cerebelosa posteroinferior (PICA) (2,94% vs. 3,84%) y otras localizaciones (5,24% vs. 15,38%).
Un total de 19 pacientes precisaron nuevo tratamiento. De ellos, en 9 se debió a presencia de múltiples aneurismas. Pero solo 10 de ellos requirieron «verdadero» retratamiento en el aneurisma inicial. Se encontraron diferencias estadísticamente significativas con relación al número de pacientes que precisaron retratamiento (tanto por aneurismas múltiples como por «verdadero» retratamiento): el grupo endovascular fue aquel en el que más porcentaje de pacientes precisó retratamiento (pinzados 8% vs. embolizados 20%; p <0,007). Al excluir los retratamientos debidos a aneurismas múltiples (incidentales), se mantienen las diferencias significativas. Hay un mayor porcentaje de pacientes que precisaron un «verdadero» retratamiento entre los pacientes previamente embolizados (pinzados 4% vs. embolizados 11,76%; p <0,003).
Un total de 10 pacientes desarrollaron resangrado. De ellos, 4 enfermos presentaron resangrado pretratamiento y 6 postratamiento. Todos ellos fueron secundarios a resangrado de los aneurismas iniciales, aunque en 4 de ellos coexistían aneurismas incidentales múltiples a distancia. Analizando el total de resangrados, si bien no se alcanzaron diferencias significativas entre ambos procedimientos, los resultados muestran una mayor tendencia en el grupo de embolizados (pinzados 8% vs. embolizados 11,76%; p=0,06).
Esta tendencia alcanzó la significación estadística al excluir a los pacientes que habían sangrado antes del tratamiento y analizar los que verdaderamente resangraron postratamiento (pinzados 4% vs. embolizados 10,58%; p?<0,006), si bien es cierto que la muestra es pequeña, por lo que esta característica queda pendiente de confirmación.
Al comparar ambos tipos de tratamiento no se encontraron diferencias estadísticamente significativas en los siguientes aspectos:
- 1.
La estancia hospitalaria global media (pinzados 32 días vs. embolizados 28 días; p=0,29), el número de ingresos de cada paciente y el número de pacientes que necesitaron nuevo ingreso (60% vs. 64,7%; p=0,37).
- 2.
La estancia media en UCI (7,99 días vs. 9,17 días; p=0,47).
- 3.
El tiempo transcurrido desde la HSA y el tratamiento aplicado (6,12 días vs. 4,37 días; p=0,13).
- 4.
La estancia media postoperatoria (23,14 días vs. 23,05 días; p=0,98).
- 5.
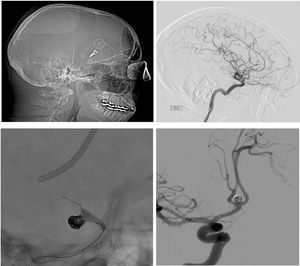
La morbilidad que se desarrolló tras ambos procedimientos quirúrgico o vascular (52% vs. 52,94%; p=0,62) (tabla 3 e imágenes ilustrativas de fig. 2).
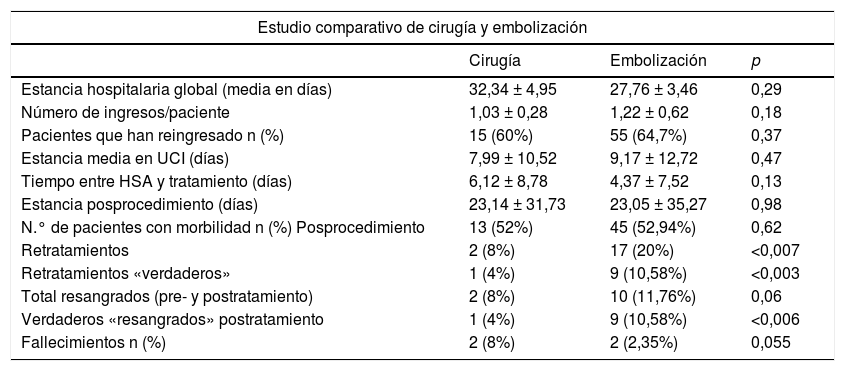
Tabla 3.Estudio comparativo entre tratamiento quirúrgico y embolización endovascular (retratamientos: aneurismas múltiples + «verdaderos» retratamientos)
Estudio comparativo de cirugía y embolización Cirugía Embolización p Estancia hospitalaria global (media en días) 32,34 ± 4,95 27,76 ± 3,46 0,29 Número de ingresos/paciente 1,03 ± 0,28 1,22 ± 0,62 0,18 Pacientes que han reingresado n (%) 15 (60%) 55 (64,7%) 0,37 Estancia media en UCI (días) 7,99 ± 10,52 9,17 ± 12,72 0,47 Tiempo entre HSA y tratamiento (días) 6,12 ± 8,78 4,37 ± 7,52 0,13 Estancia posprocedimiento (días) 23,14 ± 31,73 23,05 ± 35,27 0,98 N.° de pacientes con morbilidad n (%) Posprocedimiento 13 (52%) 45 (52,94%) 0,62 Retratamientos 2 (8%) 17 (20%) <0,007 Retratamientos «verdaderos» 1 (4%) 9 (10,58%) <0,003 Total resangrados (pre- y postratamiento) 2 (8%) 10 (11,76%) 0,06 Verdaderos «resangrados» postratamiento 1 (4%) 9 (10,58%) <0,006 Fallecimientos n (%) 2 (8%) 2 (2,35%) 0,055
No se encontraron diferencias estadísticamente significativas con relación al porcentaje de defunciones hospitalarias entre los pacientes tratados en nuestro centro, aunque hay una tendencia a un mayor porcentaje de fallecimientos entre los pacientes intervenidos quirúrgicamente (pinzados 8% vs. embolizados 2,35%; p=0,055) (tabla 3).
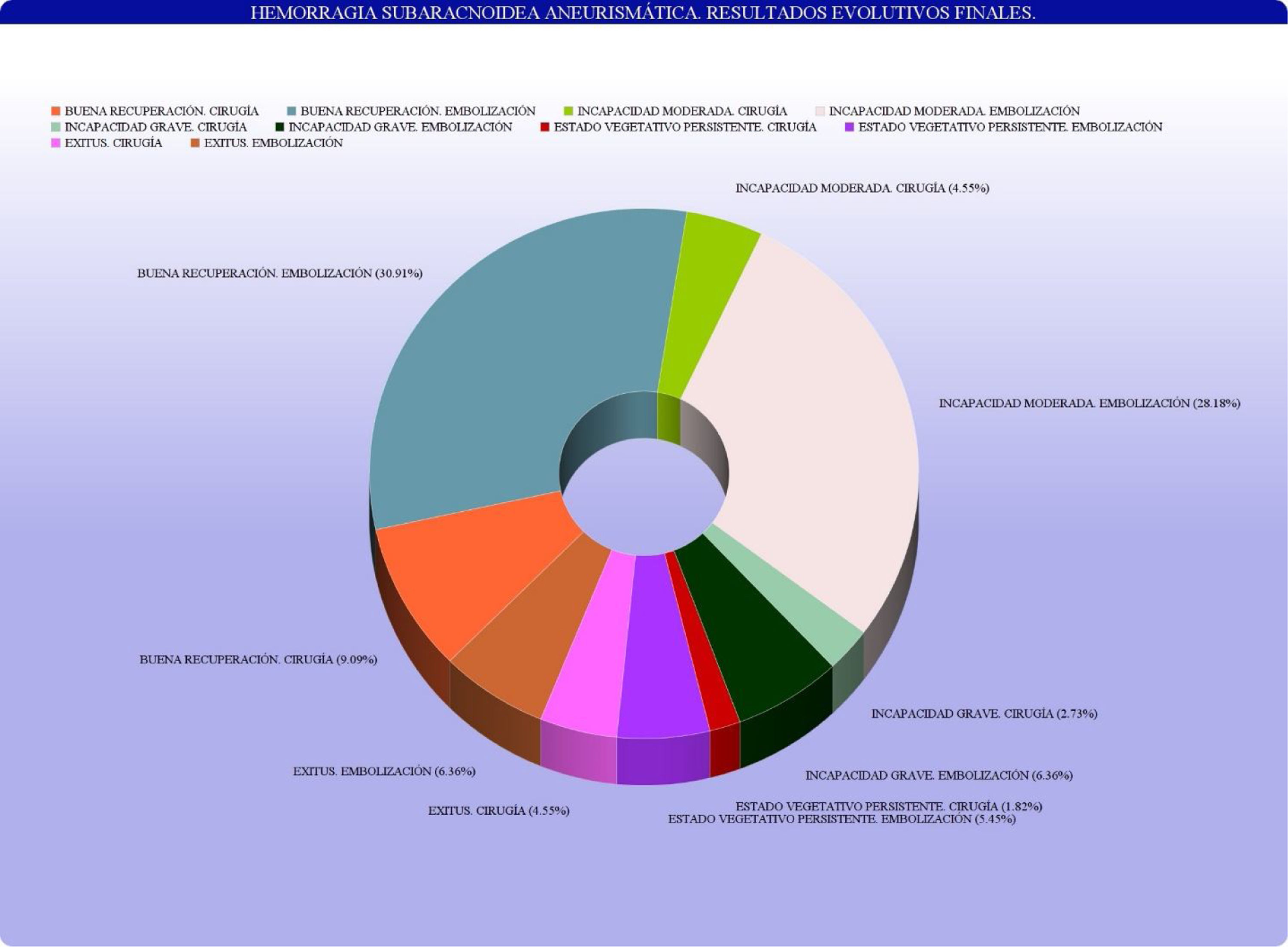
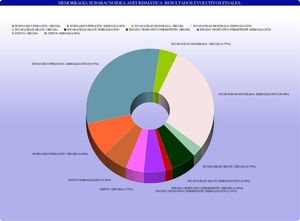
Principales variables pronósticasLos resultados evolutivos finales, según la escala evolutiva de Glasgow, quedan recogidos en la figura 3.
Las distintas variables que demostraron significación estadística en el resultado final (p <0,05), en el estudio multivariable de regresión lineal fueron la situación clínica y neurológica al ingreso, según la escala de Glasgow para el coma y los datos de focalidad de la escala WFNS, el volumen de la hemorragia, según los hallazgos en la TC, medidos con la escala de Fisher y la edad del paciente (peor pronóstico en mayores de 55 años). Estos se muestran en la tabla 4.
Variables influyentes en la evolución final según el estudio multivariable (regresión lineal)
| Estudio multivariable: |
| 1. Situación clínica y neurológica al ingreso, según la escala de Glasgow para el coma (WFNS) |
| 2. Escala de Fisher, según los hallazgos en la TC (volumen de la hemorragia) |
| 3. Edad del paciente (peor pronóstico en mayores de 55 años) |
La incidencia de ictus en general ha disminuido en la última década, fundamentalmente por la disminución del hábito tabáquico y el mejor control de la hipertensión arterial1,7. Dado que ambos factores también lo son de riesgo para la HSA se esperaría encontrar una disminución similar en dicho riesgo. Sin embargo, la disminución encontrada en un metaanálisis reciente de diferentes estudios epidemiológicos ha sido de tan solo un 0,6% en las 2últimas décadas2. Un análisis detallado de los estudios epidemiológicos publicados hasta la fecha demuestra que la incidencia de HSA oscila alrededor de 9/100.000 habitantes/año3,4. En Finlandia o Japón, por motivos desconocidos, se han reportado cifras que triplican esta incidencia8. No existen datos epidemiológicos generales en España sobre la incidencia de esta enfermedad, aunque sí hay algún dato parcial referido a alguna comunidad autónoma: la incidencia calculada de la HSA es menor que en otros países, ya que en estos estudios no supera los 5 casos anuales por cada 100.000 habitantes3. Su incidencia no ha cambiado significativamente en los últimos años. Muchos estudios encuentran un predominio del sexo femenino entre los 55 y 85 años; sin embargo, reconocen que hubo más casos del sexo masculino en adultos con edades comprendidas entre 25 y 45 años, lo cual se corresponde con lo reflejado en nuestra investigación. En lo referente a la edad, hay un predominio del grupo de edades comprendidas entre 44 y 56 años, lo cual coincide con muchas publicaciones de diferentes autores7-9. En diversos estudios encuentran un predominio en el grupo de edad de 45 a 65 años, con mayor número de mujeres que de hombres, y en otras series se publica un predominio de individuos con edades medias de 55 años2.
Por norma general, tan pronto como se haya hecho el diagnóstico y el paciente se haya estabilizado en sus funciones cardiovascular y respiratoria, debe ser trasladado a un centro que disponga de las adecuadas opciones diagnósticas y terapéuticas (neurocirugía, neurorradiología intervencionista y UCI neurológicos). Es fundamental el ingreso del paciente en UCI para un adecuado tratamiento del dolor, evitar factores causales de lesión cerebral secundaria e iniciar administración de nimodipino precozmente. Se debe evitar la hipotensión y la hipovolemia desde los primeros momentos, con adecuada reposición de sueros salinos isotónicos.
En los pacientes analizados predominó el grupo clínico de menor gravedad (Hunt y Hess grados I y II), lo cual coincide con varios autores. La condición clínica inicial tuvo asociación estadísticamente significativa con el estado al alta hospitalaria. Sin embargo, si bien hubo un predominio de grados clínicos bajos, al aplicar el análisis multivariable, la variable grado clínico III, IV y V de Hunt y Hess resultó significativa, lo que implica un riesgo de evolución desfavorable 14,3 veces mayor que los pacientes con grados clínicos iniciales I y II. Diversos autores publican que los grados III y IV de la escala Hunt y Hess se comportan como predictores de mortalidad e incapacidad grave después de la hemorragia, lo que relacionan también con un deterioro neurológico temprano en las horas posteriores al sangrado subaracnoideo10. En otro estudio se evidencia un predominio de los pacientes que presentan grados menos graves (I y II), sin encontrar asociación significativa entre esta variable y el estado al alta hospitalaria5. Los objetivos fundamentales para un correcto tratamiento de esta enfermedad son un diagnóstico precoz, considerando que en el 20% de los casos no se diagnostica adecuadamente la primera hemorragia9. Es esencial el traslado inmediato a un centro hospitalario con servicios de neurocirugía, UCI y neurorradiología. El neurocirujano sería el responsable de coordinar a los distintos especialistas integrados en el manejo de la HSA. La prevención del resangrado mediante cirugía o embolización. A principios de los años 90 se introdujo la embolización endovascular con espirales (coil) de platino11.
El resangrado es el que se demostró como predictor independiente de mala evolución3,7,12. Los factores de riesgo de resangrado son, esencialmente, la demora en el ingreso y en el inicio de tratamiento, la tensión arterial elevada, aunque está más relacionado con cambios en la presión sanguínea que con una cifra determinada, y la mala situación neurológica al ingreso. En la investigación realizada y en diversos estudios, esta variable resultó ser un factor de evolución desfavorable según lo demostrado en el análisis de regresión logística, con una estimación predictiva de mal pronóstico 9,7 veces mayor que los pacientes sin resangrado. Según lo reflejado por diferentes autores, en nuestro trabajo también predominó la rotura de aneurisma intracraneal como principal causa de sangrado subaracnoideo (60%). La principal localización de los aneurismas fue en la arteria cerebral anterior (42,9%), lo cual se corresponde con lo publicado en diferentes trabajos. A pesar de que se encontró asociación estadísticamente significativa entre las causas de la HSA y el estado al alta hospitalaria, no hubo significación estadística entre la causa aneurismática y la evolución desfavorable al realizar el análisis multivariable en diversas publicaciones2,4,13.
Sin duda, el tratamiento de los pacientes con HSA es todo un reto13. Durante la última década se ha apreciado una disminución de la mortalidad, atribuida en parte a un tratamiento cada vez más precoz y al incremento del empleo de las nuevas tecnologías en el campo del diagnóstico por la imagen y de los procedimientos quirúrgicos. Las cifras de tensión arterial sistólica superiores a 160mmHg fueron un factor independiente de mal pronóstico, pero no se analizó si esto se debe a su relación con el resangrado8. También es necesario señalar que la mala evolución de los pacientes con ventilación mecánica y en tratamiento en una unidad de cuidados intensivos se debe a la mayor gravedad del curso de su enfermedad, no a una deficiente atención en estas unidades14.
Dentro de las limitaciones que tiene este trabajo se encuentran las propias que se derivan del diseño (observacional retrospectivo), además de que el pronóstico tiene una relación multicausal que, indiscutiblemente, no solo agrupa las variables que abordamos. En nuestro estudio recogemos 2grupos de pacientes, homogéneos, uniformes y comparables, que podrían agruparse en aquellos intervenidos con cirugí y en los pacientes con aneurismas embolizados. Se pueden observar diferencias significativas en la localización aneurismática. Para el tratamiento de los pacientes atendidos en el Hospital Universitario de Getafe se siguieron las guías clínicas universalmente aceptadas en cada momento15. Presuponemos que la situación neurológica al ingreso es equiparable en los 2grupos (determinada por la escala de Glasgow y la clasificación Hunt y Hess). Diversos factores influyen en la evolución de los pacientes con HSA. Entre ellos destaca la gravedad del sangrado inicial por la importante repercusión que tiene en la evolución final de la enfermedad. Por supuesto, la existencia de comorbilidad, como en otros cuadros graves, dificultará el tratamiento y empeorará el resultado final del enfermo. Por otro lado, hay factores relacionados con la localización y morfología del aneurisma causante del sangrado que también influyen en el pronóstico, tales como el tamaño del aneurisma, su localización en la circulación posterior y posiblemente su morfología. Por otro lado, parece cada vez más evidente que existen factores relacionados con la institución hospitalaria que realiza el tratamiento, tales como la disponibilidad de tratamiento endovascular y el volumen de pacientes que trata.
La incidencia de HSA recogida en nuestro trabajo es inferior a la esperable según los estudios publicados tanto en la literatura nacional como en la internacional1. Se sospecha que la causa de esta diferencia podría relacionarse con un posible sesgo de la selección, ya que uno de los criterios de exclusión ha sido no recibir tratamiento quirúrgico o terapia endovascular, o ser pacientes derivados a otros centros, debido a la dispersión del área sanitaria correspondiente al Hospital Universitario de Getafe. La distribución de las localizaciones aneurismáticas recogidas en la literatura es arteria cerebral anterior (31-36%), arteria carótida interna (21-36%), arteria cerebral media (21%) y vasos de la circulación posterior (6-10%). Los casos tratados en el Hospital Universitario de Getafe muestran una tendencia a tener más pacientes intervenidos quirúrgicamente en el territorio de la arteria cerebral anterior y arteria cerebral media, y más pacientes embolizados en el territorio de la circulación posterior. Esta tendencia es similar a la publicada en la literatura, tanto a nivel nacional como en los estudios internacionales4,15,16.
La TC es la prueba diagnóstica de elección cuando se sospecha esta entidad; una vez confirmado el diagnóstico, en el mismo acto se puede realizar una angio-TC de polígono de Willis, que definirá la presencia y características de la mayoría de los aneurismas. Si el paciente está en situación de urgencia neurológica por un gran hematoma con efecto de masa, con estas exploraciones de calidad adecuada puede ser intervenido quirúrgicamente. Se debe intentar la exclusión precoz de los aneurismas de la circulación para evitar el resangrado. Es importante realizar arteriografía cerebral y, si se descubre un aneurisma causante del sangrado susceptible de embolización, efectuar el tratamiento endovascular en el mismo acto. Si el aneurisma no es susceptible de embolización, se debe programar cirugía urgente, al menos en pacientes en buen grado clínico. Como principio general, durante la estancia del paciente en la UCI se debe tratar su situación presente y prevenir, si es posible, o detectar precozmente y tratar las muchas y graves complicaciones neurológicas y sistémicas a que estos pacientes están expuestos.
Con relación al tiempo de demora entre la hemorragia y el tratamiento, no ha habido diferencias estadísticamente significativas en nuestro trabajo, aunque sí hay una tendencia a tener periodos más largos para la cirugía. Esta tendencia concuerda con la descrita en la literatura. Además, en el International Subarachnoid Aneurysm Trial (ISAT) también se confirman estos datos8; el periodo entre diagnóstico y tratamiento ha sido mayor para la cirugía (p 17. Dado el sesgo de selección demostrado por la baja incidencia de la HSA y la baja tasa de mortalidad, junto a la pequeña muestra de pacientes intervenidos en nuestro estudio, se podría argumentar que las conclusiones sobre el resangrado pierden su validez estadística. Sin embargo, las tasas de resangrado no son diferentes a las que se encuentran en la literatura, y el sesgo histórico de nuestro estudio, en principio, penalizaría a los pacientes operados, ya que estos son mucho menores. Hay que tener en cuenta que en el Hospital Universitario de Getafe a lo largo de la última década se ha sustituido la cirugía convencional por la embolización endovascular. Estos resultados indican que la embolización endovascular es un excelente tratamiento para la HSA aneurismática, pero que no puede determinarse con rotundidad su indicación absoluta frente a la cirugía18. Por todo ello, cualquier toma de decisión en el tipo de tratamiento debería incluir una comparación del riesgo natural, con la eficacia, morbimortalidad asociada al procedimiento dependiendo de la localización, tamaño y morfología del aneurisma, sin olvidar la voluntad del paciente.
Como reflexión para el futuro, son esperables mejores resultados en el tratamiento endovascular, pero el papel del neurocirujano seguirá siendo trascendental. En lo referente a los factores pronósticos, se establecen claramente criterios clínicos y radiológicos, según los estudios más recientes, que permiten orientación de cara al tratamiento ideal, así como del momento oportuno o timing, tan controvertido en el campo neuroquirúrgico.
Es importante destacar lo novedoso de la medición del volumen de sangre en la TC, con un programa informático desarrollado por el Servicio de Radiodiagnóstico de nuestro hospital, algo que condiciona claramente el resultado final y que mejora la mera clasificación de los pacientes según la escala de Fisher, tal y como se ha considerado hasta hoy en día. Por otra parte, los modelos de regresión logística nos permiten conocer, introduciendo las variables analizadas, el «teórico» pronóstico evolutivo final del paciente y, según esto, decidir cuál es el tratamiento ideal para cada paciente y el momento adecuado, siempre siguiendo los principios de «optimismo» lógicos que hacen que se administren todas las posibilidades terapéuticas válidas, aunque el enfermo se encuentre en una mala situación clínica y neurológica, lo que facilitará las decisiones diagnósticas y terapéuticas, así como las implicaciones pronósticas, en un futuro cercano. A pesar de todo, no se debe olvidar que la «n» comparada en este caso es bastante pequeña y que el tamaño de la muestra puede no tener suficiente potencia estadística.
En próximos estudios, el Servicio de Neurocirugía del Hospital de Getafe, recogiendo datos de pacientes entre 1995 y 2019, valorará la influencia de diversas variables sobre un modelo previamente establecido, en general, buena o mala evolución, para posibilitar la elaboración de una escala de factores pronósticos y, mediante diversos modelos matemáticos, un índice de fiabilidad pronóstica.
Conclusiones- 1.
La hemorragia subaracnoidea es más frecuente en varones (1,2/1) y predomina en pacientes cuyas edades oscilan entre los 45 y los 55 años. La incidencia en nuestro medio puede establecerse en 1,5 casos por 100.000 habitantes por año, por debajo de las cifras recogidas en las publicaciones científicas. La HSA es una entidad devastadora que requiere una actuación urgente multidisciplinaria. La escala de Glasgow para el coma modificada (WFNS) y la escala evolutiva de Glasgow se relacionan bien con la situación clínica y con el pronóstico final del paciente con HSA.
- 2.
El tratamiento mediante embolización endovascular, tal como está descrito en la literatura, parece mejorar el pronóstico y la supervivencia global de los pacientes con rotura aneurismática.
- 3.
Todos los enfermos deben ser examinados con TC, justo después de ser recibidos en el hospital, así como ingresados en UCI, para una posterior arteriografía. La medición del volumen de sangre en la TC es útil; ha quedado demostrado que a mayor volumen de sangre, peor pronóstico. En el manejo clínico de la HSA, los enfermos pueden clasificarse de acuerdo con los factores de riesgo que presentan, según la situación neurológica, la edad y los antecedentes médicos y las características encontradas en la TC (escala de Fisher).
- 4.
Los parámetros más influyentes en el pronóstico final en los pacientes con HSA son la situación neurológica al ingreso (WFNS), la cantidad de sangre en la TC de cráneo (escala de Fisher) y la edad.
Los autores declaran no tener ningún conflicto de intereses.