Se estima que ocurren entre 90.000 y 100.000 strokes isquémicos cada año en la Argentina, donde la enfermedad carotídea extracraneal es responsable de aproximadamente el 11% de los casos. El tratamiento de la enfermedad carotídea extracraneal siempre ha sido y continúa siendo motivo de controversia. Este trabajo revisa la anatomía; los conceptos diagnósticos e imagenológicos; los aspectos preventivos y fisiopatológicos; los tratamientos médico, quirúrgico e intervencionista, y el pronóstico de la enfermedad. Si bien los resultados de algunos estudios importantes, como el CREST (Carotid Revascularization Endarterectomy vs. Stent Trial), no se habían comunicado aún al finalizar la redacción de este artículo, esta revisión constituye una actualización y un extenso análisis de la evidencia científica publicada antes de diciembre de 2009.
It is estimated that 90,000 to 100,000 ischemic strokes occur every year in Argentina, where carotid artery disease accounts for about 11% of the cases. Management of extracranial carotid artery disease has always been and continues to be a matter of controversy. This paper reviews the anatomy; diagnostic and vascular imaging concepts; pathophysiological and preventive aspects; medical, surgical, and interventional treatment; and prognosis of extracranial artery disease. Though the results of important studies like CREST (Carotid Revascularization Endarterectomy vs. Stent Trial) were ready to be released soon after the writing of this paper, this extensive review constitutes an update and thorough analysis of scientific evidence published before December 2009.
Entre un 10 y un 15% de los strokes isquémicos son ocasionados por enfermedad carotídea. El significado de esta última en términos de pronóstico o de riesgo de ocurrencia de eventos cerebrovasculares suele ser confuso, debido a la gran cantidad de información disponible. Lo mismo ocurre en lo referente a las posibilidades de tratamiento. Esta revisión está organizada en dos partes; la primera incluye conceptos epidemiológicos, anatómicos, nociones fisiopatológicas, manifestaciones clínicas y una aproximación diagnóstica. En la primera sección también analizamos exhaustivamente el valor presente de la endarterectomía carotídea (EC). En la segunda parte consideramos aspectos actuales de angioplastia carotídea (AC) y del tratamiento médico respectivamente. En esta sección también abordamos estrategias para el tratamiento de la enfermedad carotídea y la enfermedad coronaria cuando se presentan de forma concomitante.
Hemos intentado abordar la enfermedad carotídea desde un punto de vista práctico, buscando responder a inquietudes que se plantean en la práctica asistencial mediante un análisis exhaustivo de la evidencia científica más reciente.
Anatomía, fisiopatología, etiopatogenia y diagnósticoLa importancia de las arterias carótidas y su relación con la circulación cerebral ha sido reconocida desde el año 438 a. C. por los griegos1. Más de 1.500 años después, en 1951, Miller Fisher describe una serie de pacientes con accidentes isquémicos transitorios (AIT) portadores de enfermedad carotídea, y plantea por primera vez que “es concebible que algún día la cirugía vascular pueda encontrar la forma de saltear la porción ocluida de la arteria durante el periodo de síntomas fugaces ominosos”2. Entre 1969 y 1970 tienen lugar los primeros estudios aleatorizados con el fin de evaluar la utilidad de la EC3. Desde entonces se ha generado gran cantidad de evidencia científica, avalando tanto el tratamiento médico como intervenciones quirúrgicas para la disminución del riesgo cerebrovascular.
Según las series internacionales, entre el 10 y el 15% de los strokes isquémicos son producidos por enfermedad carotídea4,5. Un análisis (comunicación personal de los autores) de 10 estudios realizados en hospitales argentinos sobre la frecuencia de subtipos de stroke isquémico, que incluyó 5.043 pacientes, evidenció un 11% de casos atribuibles a enfermedad carotídea según la clasificación TOAST6. Considerando una estimación de 100.000 strokes isquémicos anuales en Argentina, 11.000 de esos casos podrían deberse a enfermedad carotídea. La importancia de estos datos epidemiológicos radica en que la enfermedad carotídea es una de las causas prevenibles del stroke isquémico7, dato no menor si se considera que además es el subtipo de stroke con la tasa más elevada de recurrencia, llegando al 26% a los tres meses en pacientes con AIT4,8.
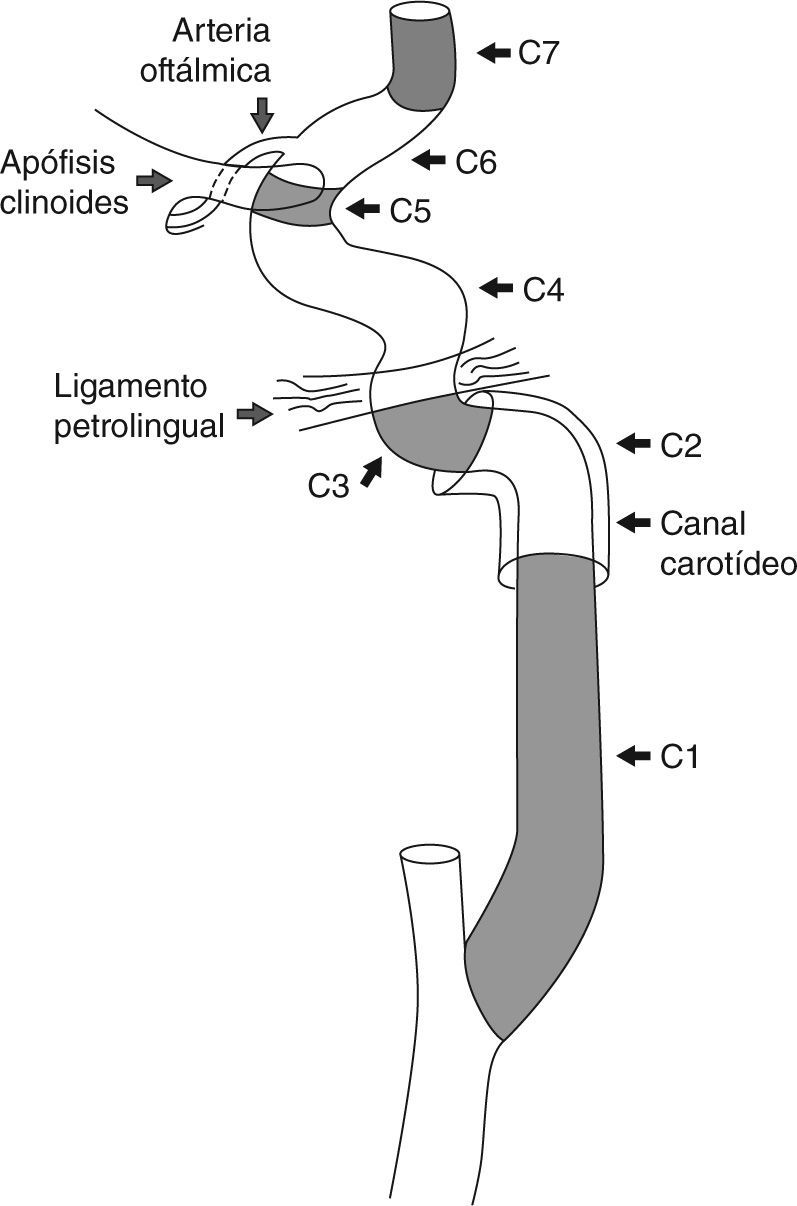
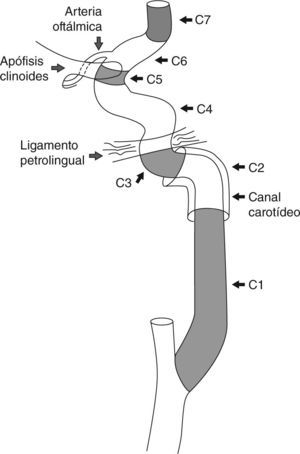
Anatomía básica de la arteria carótida internaLa arteria carótida interna (ACI) puede dividirse en 7 segmentos (fig. 1)9. Se origina en la arteria carótida común (ACC) o primitiva, a la altura de las vértebras C3-C4 o C4-C5. El primer segmento (C1) es el cervical, comprendiendo al bulbo carotídeo y al segmento ascendente. El bulbo carotídeo es el segmento de mayor diámetro (7,5mm) y es el que más frecuentemente se afecta por aterosclerosis. El segmento ascendente tiene un diámetro promedio de 4,7mm. El segmento C2 o “petroso” comienza cuando la ACI entra en el canal carotídeo en el hueso petroso (temporal). Consta de dos subsegmentos, el primero ascendente y el segundo horizontal. El segmento C3 o lacerum se extiende desde el final del conducto petroso hasta el ligamento petrolingual. El segmento C4 o “cavernoso” se origina después del ligamento petrolingual, transcurre por dentro del seno cavernoso y consiste en tres subsegmentos: posterior-ascendente, horizontal y anterior-ascendente. Las uniones del segundo subsegmento con el primero y el tercero conforman la rodilla posterior y anterior respectivamente. El segmento C5 o “clinoideo” consta de un corto trayecto en forma de cuña que se origina a partir del anillo dural proximal y finaliza en el anillo dural distal. El segmento C6 u “oftálmico” se origina después del anillo dural distal, culmina justo antes del origen de la arteria comunicante posterior (ACoP) y da origen a la arteria oftálmica. El último tramo es el C7 o “comunicante”, y finaliza cuando la ACI da sus dos ramas terminales, la arteria cerebral media (ACM) y la arteria cerebral anterior (ACA). Como su nombre indica, da origen a la ACoP.
Fisiopatología de la aterotrombosis carotídeaLa gravedad de la estenosis parece ser el factor de mayor importancia en cuanto al riesgo de desarrollar un stroke isquémico10. Sin embargo, recientemente se ha enfatizado la importancia de la conformación estructural de la placa ateromatosa11, por lo que es más adecuado utilizar el término “enfermedad carotídea” en lugar de “estenosis carotídea”.
El endotelio vascular es el responsable de mantener la indemnidad de la pared arterial mediante la liberación equilibrada de sustancias pro-aterogénicas (tromboxano, angiotensina II, trombina, endotelina, etc.) y anti-aterogénicas (prostaciclinas, óxido nítrico, serotonina, histamina, etc.). Los factores de riesgo vascular, efectos hemodinámicos y algunos productos humorales específicos pueden ocasionar disfunción endotelial, un proceso sistémico y potencialmente reversible. Esta disfunción es el gatillo para la formación de la placa ateromatosa carotídea que comienza con la integración de colesterol y la incorporación de células inflamatorias en la pared vascular12. Factores reológicos locales y el despulimiento del endotelio (shear stress), ocasionado por el jet sanguíneo sobre determinadas regiones del árbol arterial, como el bulbo carotídeo, favorecen estos fenómenos patológicos.
Si no se interviene precozmente en el control de los factores de riesgo, la placa ateromatosa evoluciona a la vulnerabilidad: reducción del espesor de la cápsula fibrosa13, ulceración14, hemorragia intraplaca por rotura de vasa vasorum15, core lipídico necrótico de gran tamaño (> 40%)16,17 o trombosis in situ18. Histológicamente, la placa vulnerable exhibe un abundante infiltrado inflamatorio-macrofágico19. Recientemente se ha descrito un aumento de la neovascularización de la placa a través de los vasa vasorum20. Cada uno de estos factores se asocia a un mayor riesgo de fenómenos embólicos arteria-arteria. Sin embargo, no todas las placas vulnerables tienen la capacidad de generar embolias. De hecho, también pueden ser encontradas en las arterias carótidas de pacientes asintomáticos14. Para explicar este fenómeno se ha descrito la teoría del “paciente vulnerable”, que incorpora el concepto de trombofilia o estado pro-trombótico transitorio propiciado por diversos gatillos21. Se ha observado que estos pacientes muestran valores elevados de proteína C reactiva, leucocitos en sangre, metaloproteinasas, enzimas proteolíticas y otros marcadores biológicos22–24. Estos marcadores, íntimamente relacionados con procesos inflamatorios y de estrés oxidativo, serían mediadores para la transformación de placas no vulnerables en vulnerables.
Etiopatogenia del stroke isquémico en pacientes con enfermedad carotídeaEl stroke isquémico ocurrido en pacientes con enfermedad carotídea puede explicarse por fenómenos dependientes de la misma estenosis arterial, o por mecanismos no relacionados, como la cardioembolia, la enfermedad de pequeña arteria o más raramente estados de hipercoagulabilidad. De los 1.021 strokes que ocurrieron en 2.885 pacientes del NASCET, el 11% fueron por cardioembolia, el 21% por enfermedad de pequeño vaso y el 68% por enfermedad carotídea. Al analizar sólo los strokes que ocurrieron en el territorio de las ACI asintomáticas (contralaterales a la ACI intervenida) con estenosis > 70% se observó que el 45% era atribuible a cardioembolia o enfermedad de pequeño vaso25. Estos hallazgos concuerdan con el concepto de múltiples mecanismos planteado por Caplan26.
En cuanto a los mecanismos relacionados directamente con la enfermedad carotídea debemos considerar los fenómenos hemodinámicos causantes de hipoflujo grave (< 20% del flujo sanguíneo cerebral con respecto al hemisferio contralateral)27, la trombosis local sobre una placa vulnerable con subsecuente embolización distal28,18 o la formación de microtrombos sobre las superficies de arterias con endotelio macro y microscópicamente indemne (disfunción endotelial sin daño estructural)29,30. Infrecuentemente pueden encontrarse émbolos de origen cardiaco impactados sobre una estenosis carotídea preexistente.
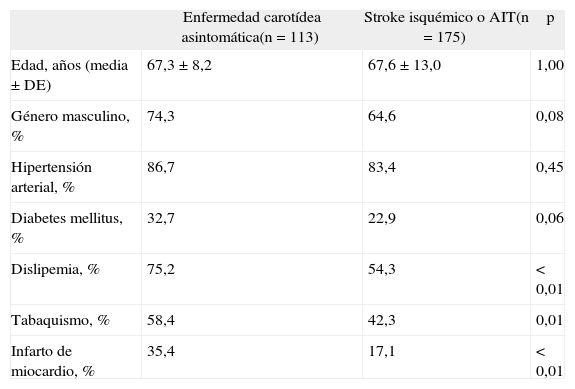
Factores de riesgoEn líneas generales, los factores de riesgo que predisponen a la formación de la placa ateromatosa carotídea son los mismos que llevan al compromiso aterosclerótico de otros vasos como los intracraneales, coronarios, de miembros inferiores, etc.: hipertensión arterial, dislipemia, tabaquismo, diabetes, sedentarismo, obesidad, procesos infecciosos y síndrome metabólico, entre otros. Tal vez el punto más interesante es que la “carga de factores riesgo” de los pacientes con enfermedad carotídea, aún asintomática, es mayor que en aquellos que han sufrido un stroke isquémico de causa no carotídea. Este hallazgo se expone en la tabla 1, donde se compara la carga de factores de riesgo en pacientes portadores de enfermedad carotídea asintomática con aquellos que sufrieron un stroke isquémico de causa no carotídea. La dislipemia y el tabaquismo parecen ser los factores diferencialmente asociados a enfermedad carotídea. Estos datos sustentan aún más la hipótesis que plantea que la acumulación de factores de riesgo es necesaria para que se generen placas ateromatosas con posterior evolución a la vulnerabilidad, pero no es suficiente para producir un stroke isquémico.
Carga de factores de riesgo en pacientes con enfermedad carotídea asintomática y en pacientes con stroke isquémico no-carotídeo
| Enfermedad carotídea asintomática(n = 113) | Stroke isquémico o AIT(n = 175) | p | |
| Edad, años (media ± DE) | 67,3 ± 8,2 | 67,6 ± 13,0 | 1,00 |
| Género masculino, % | 74,3 | 64,6 | 0,08 |
| Hipertensión arterial, % | 86,7 | 83,4 | 0,45 |
| Diabetes mellitus, % | 32,7 | 22,9 | 0,06 |
| Dislipemia, % | 75,2 | 54,3 | < 0,01 |
| Tabaquismo, % | 58,4 | 42,3 | 0,01 |
| Infarto de miocardio, % | 35,4 | 17,1 | < 0,01 |
Centro de Stroke. Instituto de Neurociencias de la Fundación Favaloro (1 de enero de 2007 a 31 de diciembre de 2008).
Los strokes isquémicos producidos por enfermedad carotídea suelen ocasionar cuadros neurológicos de mayor gravedad que los producidos por otros mecanismos, como la enfermedad de pequeño vaso. La mayor gravedad se debe a que los infartos suelen ser de gran tamaño. Clásicamente se los ha definido como mayores de 15mm, aunque este punto de corte ha sido puesto en duda recientemente31. Su localización suele ser córtico-subcortical, con predominio por el territorio de la ACM. Por ello, además de los signos clásicos deficitarios motores y/o sensitivos, el paciente con stroke isquémico de causa carotídea suele presentar signos corticales como afasia, neglect, anosognosia, extinción sensitiva o alteraciones visuoespaciales.
Un hallazgo clínico distintivo es el compromiso retiniano bajo la forma de ceguera monocular transitoria (amaurosis fugax) ipsilateral a la enfermedad carotídea. Menos frecuentemente puede producirse un cuadro no reversible. Suele instalarse en pocos segundos como un telón (desplazamiento vertical de arriba hacia abajo) o una cortina (desplazamiento lateral) que rápidamente afecta la visión de un solo ojo hasta producir la amaurosis. Ésta suele durar escasos segundos o minutos (generalmente menos de 10 minutos). También puede comenzar como un oscurecimiento progresivo de la visión en el ojo afectado. Estos fenómenos transitorios se producen por hipoflujo en la arteria oftálmica o por microembolización desde la ACI a la arteria central de la retina, con posterior recanalización mediada por el sistema fibrinolítico endógeno32.
Algunas manifestaciones clínicas como mareo, vértigo o síncope no son atribuibles a la enfermedad carotídea33.
Diagnóstico de la enfermedad carotídeaTodo paciente que ha sufrido un stroke isquémico debe ser evaluado para determinar la presencia o ausencia de enfermedad carotídea, tanto extra como intracraneal. Con respecto a la población general que nunca ha sufrido un stroke o AIT la indicación para la evaluación de la enfermedad carotídea es más cuestionable. Según la Preventive Services Task Force de Estados Unidos (USPSTF), el potencial beneficio derivado de la identificación y posterior resolución quirúrgica de una estenosis carotídea >70% en pacientes asintomáticos no sobrepasa el riesgo generado por la angiografía por sustracción digital (A-SD) cerebral preoperatoria y la cirugía en sí. En conclusión, la USPSTF recomienda no realizar el rastreo de enfermedad carotídea en la población general (nivel de evidencia D)34.
Cuantificación del grado de estenosis carotídeaSe han postulado diversas estrategias o algoritmos diagnósticos para la evaluación del paciente con enfermedad carotídea. El método utilizado para determinar el grado de estenosis no es un detalle menor. Muchas de las discrepancias en los resultados de diversos estudios aleatorizados sobre el abordaje quirúrgico de la enfermedad carotídea pueden explicarse por variaciones en las mediciones35,36.
El doppler color de vasos del cuello (DVC) es el método más utilizado en la práctica clínica37. Esto se debe a su bajo coste relativo y a su mayor disponibilidad. Sin embargo, es una técnica que depende de la experiencia del observador. Como limitación, la imposibilidad de evaluar la ACC proximal y la porción distal de la ACI dificulta la detección de estenosis en tándem38. Por otra parte, al no evaluar circulación intracraneal se pierde la posibilidad de detectar aneurismas, hallazgos que podrían modificar la decisión terapéutica38. Cabe señalar que la circulación intracraneal podría evaluarse mediante doppler transcraneal (DTC), aunque es un método que requiere mayor entrenamiento por la interposición ósea, lo que redunda en su baja utilización. Finalmente, las imágenes impresas no suelen tener la calidad suficiente como para ser evaluadas por un profesional que no haya estado presente durante el estudio, por lo que el médico tratante debe confiar ciegamente en el informe. A pesar de estas observaciones, existe una tendencia creciente mundialmente a definir conductas quirúrgicas en función de DVC realizados por dos operadores distintos o un DVC junto con otro método no invasivo en reemplazo de la A-SD. Si bien se han reportado excelentes correlaciones entre el DVC y la A-SD, éstas nunca fueron perfectas, criterio indispensable para decidir una conducta quirúrgica39. Varios estudios confirman que la decisión quirúrgica no puede tomarse basándose en la información obtenida exclusivamente a partir del DVC40,41.
La angiorresonancia magnética nuclear (A-RMN) con tiempo de vuelo (TOF, time of light) no requiere el uso de contraste paramagnético. Sin embargo, el contraste administrado de forma dinámica para la visualización de todo el árbol arterial, desde su inicio en el cayado aórtico hasta los vasos terminales, ha logrado mejorar sustancialmente la calidad de las imágenes. Este método es conocido por su acrónimo en inglés como CEMRA (contrast enhanced MR angiography). Al igual que la A-RMN sin contraste, sobreestima el grado de estenosis en obstrucciones graves preoclusivas. Por otra parte, requiere periodos más prolongados de adquisición, aunque menores que los de la A-RMN por TOF, lo que puede resultar en una disminución de la calidad de las imágenes si el paciente se mueve. Algunos autores plantean que es el más certero de los métodos diagnósticos no invasivos, tiene una excelente correlación anatómica y permite evaluar adecuadamente la circulación intracraneal38,42.
La angio-tomografía computarizada multicorte (A-TCM) incorpora la posibilidad de obtener imágenes de todo el árbol arterial en un tiempo menor que el CEMRA, evitando de esta manera los artificios por movimiento. Requiere contraste yodado que debe ser administrado mediante una bomba por personal entrenado, y el paciente es expuesto a una elevada dosis de radiación. Esta técnica permite visualizar con mayor exactitud los aspectos anatómicos de la arteria, así como los componentes de la placa. Basándonos en nuestra propia experiencia el rédito diagnóstico parece ser mayor cuando se evalúan las imágenes en forma dinámica desde el monitor de la consola del tomógrafo que cuando se observan las placas en un negatoscopio o una selección digitalizada. La desventaja radica en que es necesario esperar a la reconstrucción de las imágenes, lo que puede demandar algunas horas de espera. Finalmente la A-TCM permite visualizar con notable nitidez y detalle la circulación intracraneal.
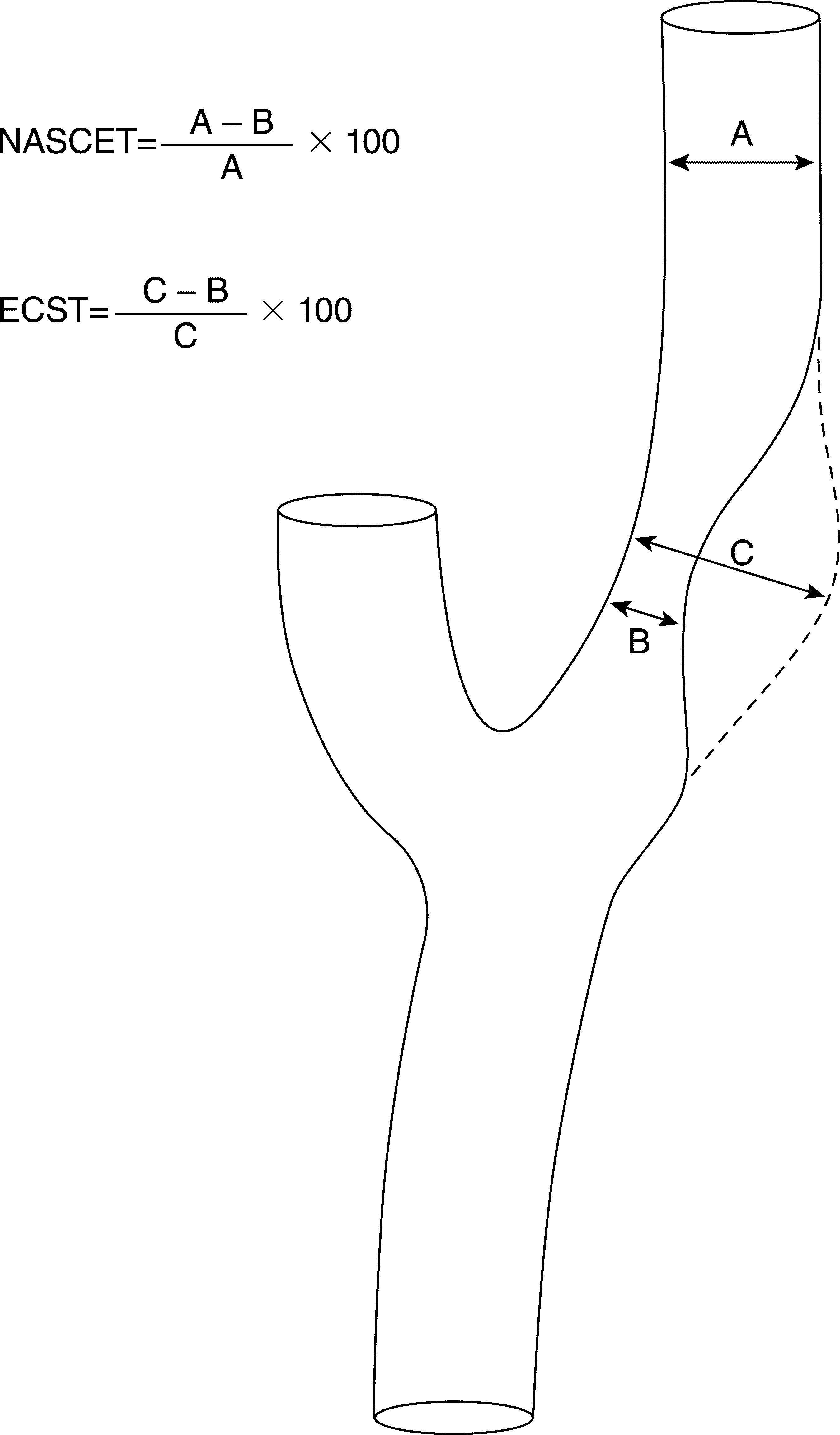
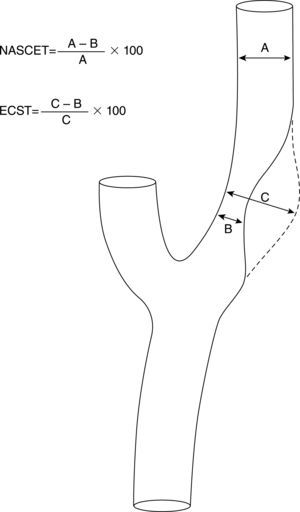
La A-SD es considerada el estándar de oro para la evaluación de las arterias cerebrales extra e intracraneales. Requiere la colocación de un catéter intraarterial para la inyección de contraste yodado y genera una exposición considerable a la radiación. Como complicación puede ocasionar strokes isquémicos con tasas que varían entre el 1% (discapacitantes y/o fatales) y el 4% (leves)43. Además puede presentar otro tipo de complicaciones como hematomas en el sitio de punción. Otra desventaja es que no provee información acerca de la morfología de la placa, dado que sólo permite identificar ulceraciones. En cuanto a la medición del grado de estenosis existen varios métodos. Los más difundidos son los que fueron utilizados en los estudios NASCET y ECST (European Carotid Surgery Trial) (fig. 2)44,45. El más ampliamente utilizado es el del NASCET46. Si bien ambos métodos son fiables y tienen una buena correlación, es necesario aplicar una fórmula para homologar las mediciones: ECST= 40 + (0,6 × NASCET).
En conclusión, el DVC es un método adecuado para el rastreo del grado de estenosis carotídea en pacientes que han sufrido un stroke isquémico o AIT. Es preferible a otros métodos por su mayor disponibilidad y menor coste. Cuando la potencial presencia de enfermedad intracraneal pueda repercutir en modificaciones de conductas terapéuticas, será necesario realizar estudios no invasivos adecuados (A-RMN o A-CTM). Tanto el NASCET como el ECST utilizaron A-SD para confirmar el grado de estenosis44,45. Extrapolar las conclusiones de estos dos estudios a poblaciones de pacientes evaluados mediante estudios complementarios no invasivos como la A-RMN, DVC o A-TCM podría resultar arriesgado, precipitando decisiones equivocadas. A pesar de esta salvedad, las guías para el manejo del AIT de la American Heart Association/American Stroke Association refieren que con la concordancia de dos métodos no invasivos (DVC, A-RMN o A-TCM) no es necesaria la realización de una A-SD. Este estudio podría reservarse para los casos en que no haya coincidencia entre métodos no invasivos (nivel de evidencia B, clase IIa)47.
Las recomendaciones de las guías de la American Heart Association/American Stroke Association con respecto a la evaluación del grado de estenosis de las ACI extracraneales y la selección de candidatos para la EC son las siguientes: a) no debe utilizarse el DVC como único método diagnóstico si se contempla la posibilidad de una endarterectomía (nivel de evidencia A, clase III); b) el método de elección para la determinación del grado de estenosis es la A-SD (nivel de evidencia A, clase I); c) pueden utilizarse dos métodos no invasivos (DVC, A-RMN o A-CTM) para la evaluación del grado de estenosis, aunque con menor exactitud que con la utilización de la A-SD, lo que puede aumentar la posibilidad de indicar un tratamiento erróneo (nivel de evidencia B, clase IIa), y d) las lesiones suboclusivas son detectadas con más exactitud por la A-SD, seguidas de cerca por la A-CTM (nivel de evidencia B, clase IIa)48.
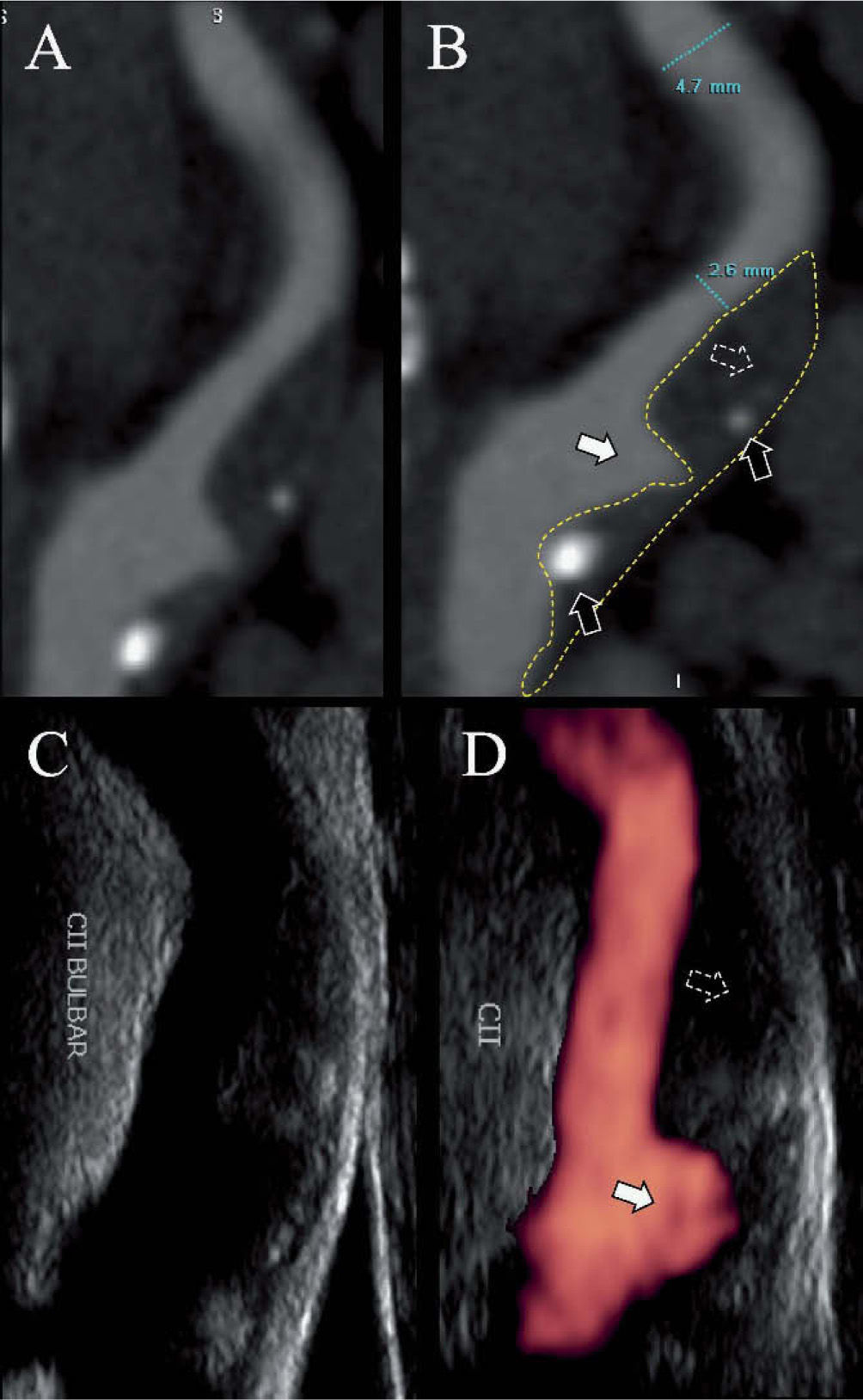
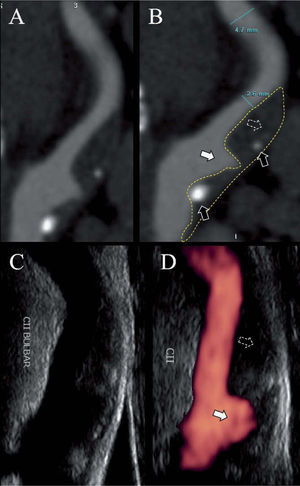
Espesor íntima-media, morfología, área y volumen de la placa carotídeaEn los últimos años se han logrado grandes avances en cuanto a la visualización e identificación de los componentes de la placa vulnerable mediante técnicas ultrasonográficas y la incorporación del doppler intravascular (IVUS, intravascular doppler ultrasound), A-RMN y A-TCM. La utilización de estos exámenes complementarios en la práctica diaria ya es corriente en varios centros especializados nacionales e internacionales (fig. 3). Otros métodos más sofisticados sólo se usan con fines de investigación: tomografía por emisión de positrones (PET), tomografía por emisión de fotón simple (SPECT) con acetazolamida, termografía extra o intravascular, tomografía de coherencia óptica (OCT) y elastografía, entre otros.
Ecodoppler con power-doppler y angiotomografía de arteria carótida interna. A y B: tomografía computarizada multicorte de la arteria carótida interna, que muestra una estenosis a nivel bulbar por una placa con componente fibrolipídico (flechas punteadas), escaso componente cálcico (flechas negras) y una gran úlcera (flechas blancas). C y D: la misma arteria evaluada por eco doppler (C) y power-doppler.
El espesor íntima-media (EIM) aumentado ha sido identificado como un predictor de infarto agudo de miocardio y stroke en la población general. Por cada 0,1mm de aumento en el EIM, el riesgo ajustado (por edad y sexo) de stroke aumenta un 18% (OR: 1,18; IC 95%: 1,16-1,21)49. El área de la placa es un mejor marcador de riesgo de stroke que el EIM, aunque puede resultar más difícil de cuantificar50. Ambos parámetros son considerados fenotipos ateroscleróticos con diferencias biológicas y genéticas50. A pesar del valor pronóstico de estos indicadores su uso en la práctica clínica no ha sido avalado todavía. Más recientemente se ha comenzado a utilizar un tercer marcador carotídeo de riesgo, el volumen de la placa cuantificado mediante doppler con reconstrucción tridimensional51.
Los signos de vulnerabilidad de la placa carotídea pueden ser visualizados con DVC, A-TCM y A-RMN. El método que ofrece mayor detalle es el IVUS.
En nuestra experiencia, la valoración de la morfología de la placa nos ha sido de gran utilidad no sólo para la orientación de la prevención secundaria (ver sección de tratamiento médico), sino también para la toma de decisiones en algunos pacientes (ver el caso clínico al final de la sección endarterectomía carotídea). Aunque también algunos centros internacionales han comenzado a utilizarlos para la monitorización del tratamiento médico52, el verdadero rol de la medición del EIM, área, volumen y morfología de la placa carotídea en la práctica asistencial debe ser confirmado en el contexto de grandes estudios prospectivos para que puedan recomendarse formalmente (nivel de evidencia B, clase IIa)47,53. Por el momento, de las anormalidades arteriales que pueden objetivarse mediante estudios complementarios sólo el porcentaje de estenosis persiste en los modelos multivariados, además de ser el de mayor valor predictivo para el stroke isquémico ipsilateral54.
Endarterectomía carotídeaSólo 7 meses después de que Miller Fisher imaginara la primera cirugía carotídea2 Raúl Carrea realiza la primera intervención en un paciente con obstrucción carotídea, resecando la placa aterosclerótica y anastomosando la arteria carótida externa (ACE) con la ACI55,56. La primera EC con la técnica que aún se utiliza en la actualidad (salvo mínimas modificaciones) es realizada por Michael DeBakey en 1953, aunque el caso se publica en 197557. El paciente es controlado durante 19 años y fallece como consecuencia de un infarto agudo de miocardio. En 1954, Eascott realiza una reparación mediante la resección parcial de una sección parcialmente trombosada de ACI y ACC y posterior anastomosis directa58. Con el transcurso de los años, el número de endarterectomías aumenta gradualmente hasta la década de 1980, cuando algunos estudios comienzan a advertir sobre elevadas tasas de stroke y muerte postoperatoria59–61. A comienzos de la década de 1990, después de la publicación del NASCET y el ECST, renace el entusiasmo por la EC y se abre un nuevo capítulo en la prevención primaria y secundaria del stroke45,51,62.
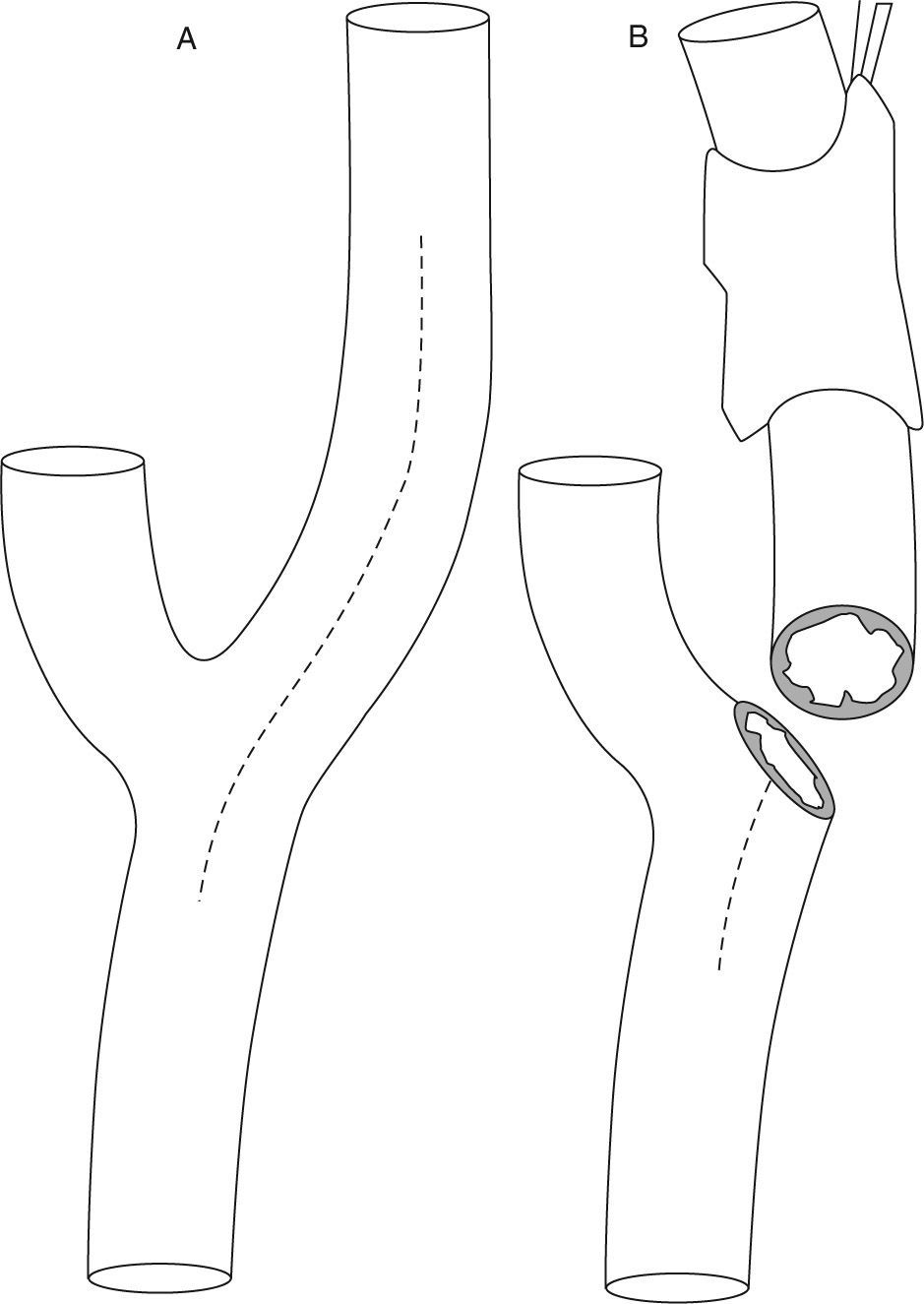
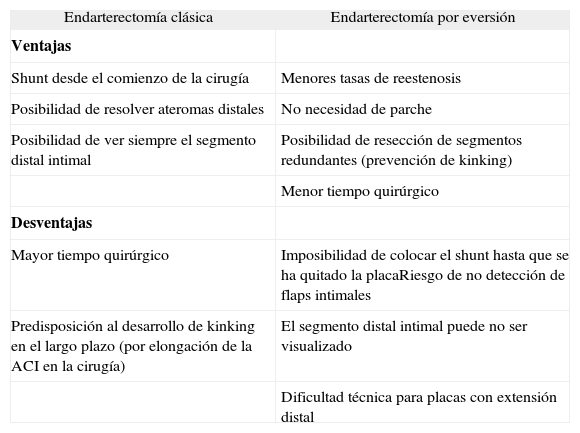
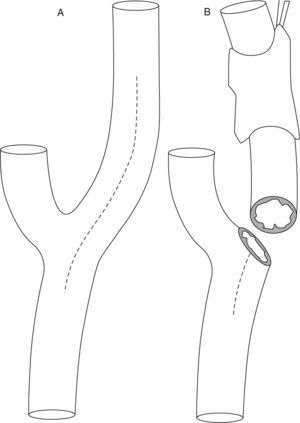
Tipos de endarterectomíasExisten dos técnicas quirúrgicas: la clásica y la técnica por eversión (fig. 4). La primera consiste en realizar una sección longitudinal de la ACI para quitar la placa ateromatosa63. La segunda requiere la sección transversal del origen de la ACI, abarcando toda su circunferencia, con posterior eversión de la adventicia y de la media. Con este procedimiento el tubo de ateroma de la ACI es expulsado. Posteriormente se realiza la endarterectomía de la ACC mediante la técnica clásica. Finalmente se reanastomosa el bulbo de la ACI en la bifurcación64.
Las ventajas y desventajas de ambas técnicas quirúrgicas se resumen en la tabla 2. Una revisión sistemática de estudios aleatorizados que comparan la endarterectomía clásica con la técnica por eversión (2.590 cirugías) no mostró diferencias significativas en cuanto a stroke perioperatorio, stroke, muerte o complicaciones locales65.
Ventajas y desventajas de la endarterectomía clásica y la endarterectomía por eversión
| Endarterectomía clásica | Endarterectomía por eversión |
| Ventajas | |
| Shunt desde el comienzo de la cirugía | Menores tasas de reestenosis |
| Posibilidad de resolver ateromas distales | No necesidad de parche |
| Posibilidad de ver siempre el segmento distal intimal | Posibilidad de resección de segmentos redundantes (prevención de kinking) |
| Menor tiempo quirúrgico | |
| Desventajas | |
| Mayor tiempo quirúrgico | Imposibilidad de colocar el shunt hasta que se ha quitado la placaRiesgo de no detección de flaps intimales |
| Predisposición al desarrollo de kinking en el largo plazo (por elongación de la ACI en la cirugía) | El segmento distal intimal puede no ser visualizado |
| Dificultad técnica para placas con extensión distal |
ACI: arteria carótida interna.
Uno de los riesgos o potenciales complicaciones de la EC es la reestenosis. La reestenosis a largo plazo suele ser consecuencia del inadecuado control de los factores de riesgo. En cambio, la que ocurre dentro del primer año es causada por hiperplasia neointimal66. Con el fin de evitar la hiperplasia neointimal se han utilizado diversos tipos de parches. Si bien éstos pueden asociarse a infecciones o hematomas (en caso de rotura), su uso ha significado un avance mayor en cuanto a la disminución de tasas de complicaciones graves.
Una revisión sistemática realizada sobre 10 estudios aleatorizados que comprendieron 2.157 cirugías en 1.967 pacientes comparó el resultado de endarterectomías realizadas con parches autólogos (venosos) o sintéticos frente a cirugías con cierre primario (sin parche)67. La utilización de parche demostró una reducción del riesgo de stroke ipsilateral a los 30 días (OR: 0,31; IC 95%: 0,2-0,6; p = 0,001). En el seguimiento a largo plazo también se asoció a una menor reestenosis (OR: 0,24; IC 95%: 0,2-0,3; p < 0,00001) y un menor riesgo de stroke o muerte (0,59; IC 95%: 0,4-0,8; p < 0,0001). Los autores concluyen que los resultados avalan el uso de parche en la EC.
Shunting intraoperatorioDurante el procedimiento quirúrgico, mientras se elimina la placa ateromatosa, es necesario detener la circulación al nivel de la ACI intervenida. Esto puede realizarse con o sin shunt. Con la primera opción se logra mantener el flujo sanguíneo hemisférico mediante la colocación de un shunt desde la ACC a la ACI distal al clampeo. Por el contrario, si se opta por la segunda modalidad, el flujo sanguíneo cerebral dependiente de la ACI clampeada debería mantenerse mediante circulación colateral proveniente del polígono de Willis, o a través de la circulación extracraneal dependiente de la ACE. Un estudio que utilizó monitorización permanente de flujo sanguíneo cerebral y electroencefalográfico durante la EC evidenció que en algunos pacientes el flujo sanguíneo hemisférico llegaba a cero si no se utilizaba shunt68. Este hallazgo es equivalente al efecto que se produce sobre el cerebro durante el paro cardiorrespiratorio. La utilización de shunt brinda más tiempo al cirujano y funciona como un sistema de protección cerebral para disminuir el riesgo de stroke isquémico por hipoflujo. Sin embargo, la mayoría de los strokes isquémicos relacionadas con la EC se producen por embolización de partículas adheridas a la pared arterial y no por hipoflujo. De hecho, la colocación del shunt podría favorecer la embolización desde la ACC, así como también la ocurrencia de disecciones. Hasta la actualidad sólo se han realizado dos estudios aleatorizados que evalúan el beneficio potencial del shunting69,70. Entre ambos incluyeron 590 pacientes y mostraron una tendencia no significativa a la reducción del riesgo de stroke o muerte perioperatoria. Dada la falta de resultados concluyentes, no pueden realizarse recomendaciones respecto del uso de shunt durante la EC.
Anestesia local o generalLa EC puede realizarse con anestesia local o general. Las ventajas teóricas relacionadas con la primera modalidad son varias. En primer lugar, podría no ser necesario el shunt, dado que el paciente está despierto y es evaluable de forma constante durante la cirugía. Esto permitiría colocar el shunt sólo ante la evidencia de un déficit neurológico focal. Por estamisma razón tampoco sería necesaria la monitorización del flujo sanguíneo cerebral ni electroencefalográfico. Cabe destacar que no todos los pacientes toleran el procedimiento, requiriendo la conversión a anestesia general.
A pesar de las ventajas teóricas de la anestesia local, el estudio aleatorizado GALA, que comparó anestesia local frente a general en la EC, no pudo demostrar diferencias con respecto al riesgo de stroke, infarto agudo de miocardio o muerte a los 30 días71. Una revisión sistemática de 4.335 cirugías que incluyó a los 3.526 casos del estudio GALA no mostró diferencias en cuanto al riesgo de stroke o muerte con respecto al tipo de anestesia utilizada72. En función de estos resultados la modalidad anestésica debería quedar a elección del equipo interviniente.
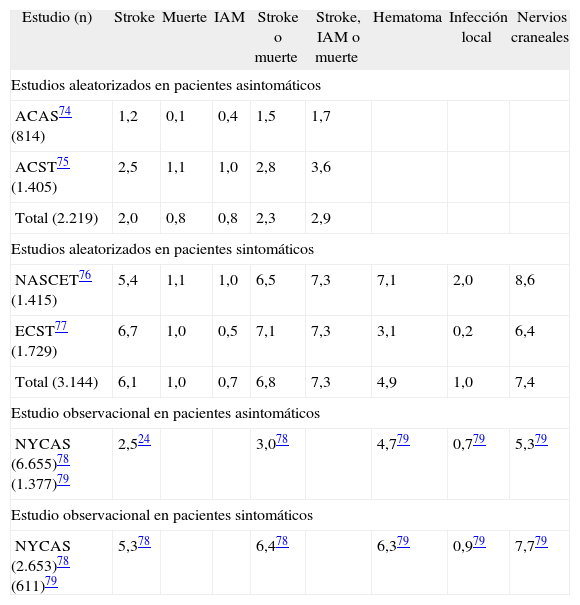
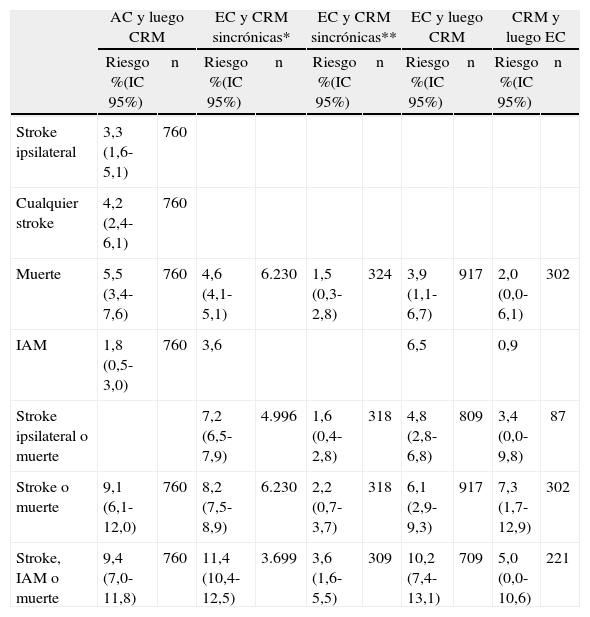
Complicaciones posprocedimientoTodo procedimiento quirúrgico tiene la potencialidad de complicarse. La EC puede presentar complicaciones locales, neurológicas y sistémicas. Las tasas de complicaciones reportadas por la gran cantidad de estudios publicados son extremadamente heterogéneas73. Esto se debe principalmente a cuestiones metodológicas. Una aproximación relativamente fiable es analizar los reportes bajo dos criterios: a) aquellos realizados en pacientes con enfermedad carotídea sintomática frente a asintomática y b) aquellos realizados en el contexto de estudios aleatorizados frente a observacionales (tabla 3)74–79.
Complicaciones de la endarterectomía carotídea
| Estudio (n) | Stroke | Muerte | IAM | Stroke o muerte | Stroke, IAM o muerte | Hematoma | Infección local | Nervios craneales |
| Estudios aleatorizados en pacientes asintomáticos | ||||||||
| ACAS74 (814) | 1,2 | 0,1 | 0,4 | 1,5 | 1,7 | |||
| ACST75 (1.405) | 2,5 | 1,1 | 1,0 | 2,8 | 3,6 | |||
| Total (2.219) | 2,0 | 0,8 | 0,8 | 2,3 | 2,9 | |||
| Estudios aleatorizados en pacientes sintomáticos | ||||||||
| NASCET76 (1.415) | 5,4 | 1,1 | 1,0 | 6,5 | 7,3 | 7,1 | 2,0 | 8,6 |
| ECST77 (1.729) | 6,7 | 1,0 | 0,5 | 7,1 | 7,3 | 3,1 | 0,2 | 6,4 |
| Total (3.144) | 6,1 | 1,0 | 0,7 | 6,8 | 7,3 | 4,9 | 1,0 | 7,4 |
| Estudio observacional en pacientes asintomáticos | ||||||||
| NYCAS (6.655)78 (1.377)79 | 2,524 | 3,078 | 4,779 | 0,779 | 5,379 | |||
| Estudio observacional en pacientes sintomáticos | ||||||||
| NYCAS (2.653)78 (611)79 | 5,378 | 6,478 | 6,379 | 0,979 | 7,779 | |||
Todos los valores se expresan en porcentajes. IAM: infarto agudo de miocardio.
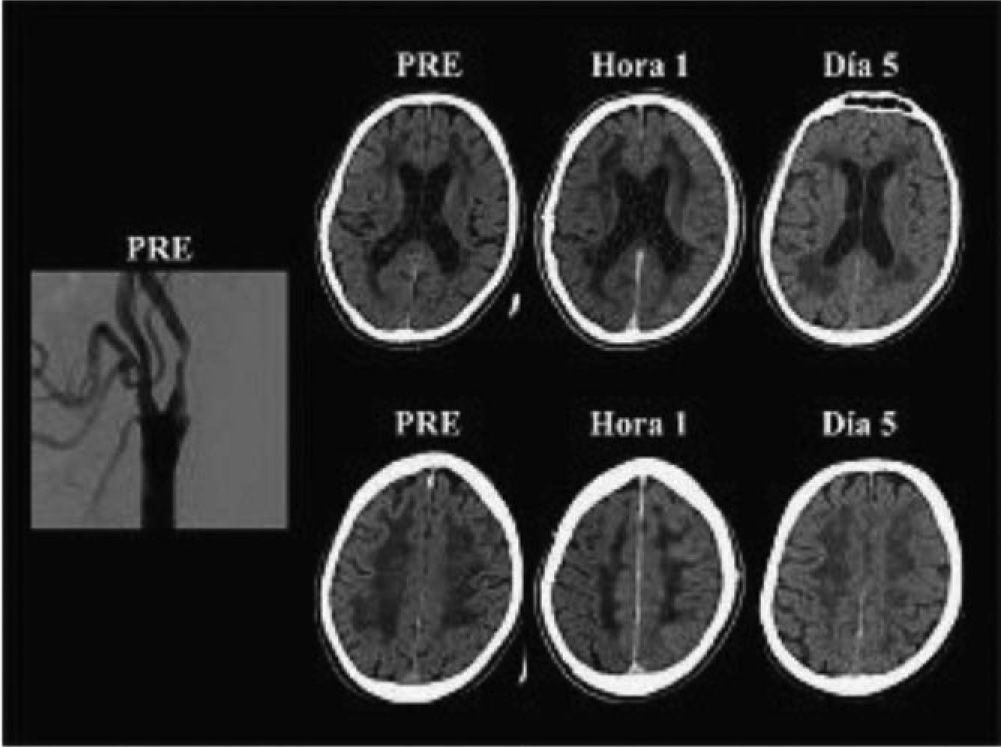
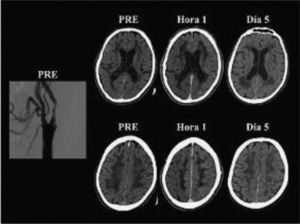
El síndrome de hiperperfusión (SHP) puede ocurrir después de la endarterectomía o de la angioplastia, con una frecuencia que varía entre el 0 y el 3% en la mayoría de las comunicaciones80–83. Puede presentarse clínicamente con cefalea difusa o con localización facial, ocular, periorbitaria o frontotemporal; vómitos, confusión, convulsiones o déficit motor. Hemodinámicamente se define como un aumento mayor del 100% en el flujo sanguíneo cerebral del hemisferio revascularizado con respecto a los valores preoperatorios84. La disfunción endotelial mediada por radicales libres y la consiguiente alteración de la autorregulación cerebral serían fenómenos centrales en la cascada fisiopatológica. La imagen característica en las neuroimágenes es el edema cerebral difuso unilateral, aunque también puede observarse en el hemisferio contralateral (fig. 5). Infrecuentemente, el SHP puede complicarse con hemorragia intracraneal (HIC). Los factores de riesgo más importantes para la HIC son la hipertensión postoperatoria, la disminución de la reserva cerebrovascular, la hiperperfusión (↑ FSC > 100%) prolongada después de la intervención, la oclusión de ACI contralateral, la escasa circulación colateral y la estenosis severa de la ACI intervenida, entre otros85. De esta manera, la medida de mayor impacto para la prevención del sangrado es el control estricto de la presión arterial postoperatoria. En un relevamiento sobre un total de 122.856 EC y 13.047 angioplastias realizadas en los Estados Unidos en el año 2005, la frecuencia de HIC fue de 0,016 y 0,15% respectivamente86; es decir, que esta complicación fue 10 veces más frecuente en las angioplastias que en las EC. En este estudio la angioplastia fue un predictor independiente de HIC (OR: 5,9; IC 95%: 3,1-11,1; p < 0,001).
Angiografía por sustracción digital y tomografía computarizada sin contraste de un paciente con síndrome de hiperperfusión post angioplastia carotídea izquierda. La figura muestra la angiografía digital de un hombre de 65 años y las tomografías computarizadas de cerebro realizadas antes (PRE), a la hora y 5 días después de una angioplastia con stent en la arteria carótida interna izquierda. Obsérvese la estenosis carotídea izquierda y el edema hemisférico izquierdo en las tomografías hechas una hora y 5 días después de la angioplastia.
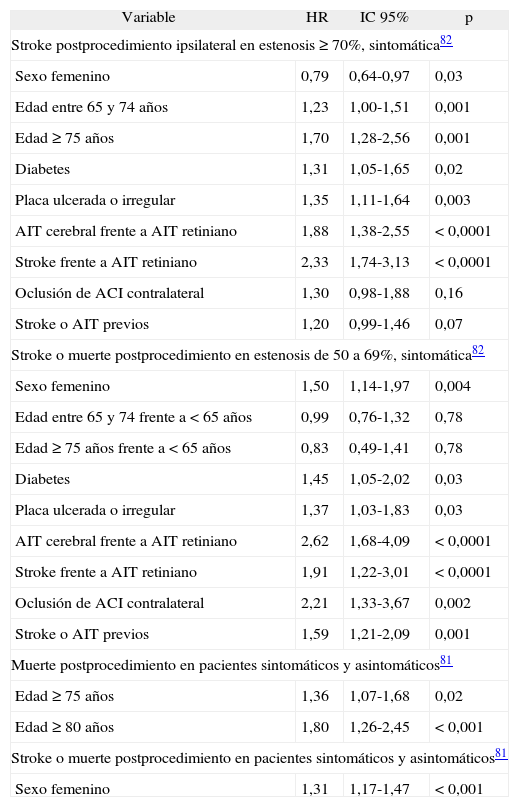
El riesgo de complicaciones secundarias a la EC depende de gran cantidad de variables. Como puede verse en la tabla 3, las complicaciones son más frecuentes en los procedimientos realizados por estenosis sintomáticas que en aquellos practicados en estenosis asintomáticas. Estos datos coinciden con una revisión de 59 estudios que demostró un mayor riesgo en pacientes sintomáticos (OR: 1,62; IC 95%: 1,45-1,81; p < 0,00001)87. En la tabla 4 se resumen las principales variables que afectan el riesgo de complicaciones post EC88,89.
Variables que afectan el riesgo de complicaciones a los 30 días post-endarterectomía carotídea
| Variable | HR | IC 95% | p |
| Stroke postprocedimiento ipsilateral en estenosis ≥ 70%, sintomática82 | |||
| Sexo femenino | 0,79 | 0,64-0,97 | 0,03 |
| Edad entre 65 y 74 años | 1,23 | 1,00-1,51 | 0,001 |
| Edad ≥ 75 años | 1,70 | 1,28-2,56 | 0,001 |
| Diabetes | 1,31 | 1,05-1,65 | 0,02 |
| Placa ulcerada o irregular | 1,35 | 1,11-1,64 | 0,003 |
| AIT cerebral frente a AIT retiniano | 1,88 | 1,38-2,55 | < 0,0001 |
| Stroke frente a AIT retiniano | 2,33 | 1,74-3,13 | < 0,0001 |
| Oclusión de ACI contralateral | 1,30 | 0,98-1,88 | 0,16 |
| Stroke o AIT previos | 1,20 | 0,99-1,46 | 0,07 |
| Stroke o muerte postprocedimiento en estenosis de 50 a 69%, sintomática82 | |||
| Sexo femenino | 1,50 | 1,14-1,97 | 0,004 |
| Edad entre 65 y 74 frente a < 65 años | 0,99 | 0,76-1,32 | 0,78 |
| Edad ≥ 75 años frente a < 65 años | 0,83 | 0,49-1,41 | 0,78 |
| Diabetes | 1,45 | 1,05-2,02 | 0,03 |
| Placa ulcerada o irregular | 1,37 | 1,03-1,83 | 0,03 |
| AIT cerebral frente a AIT retiniano | 2,62 | 1,68-4,09 | < 0,0001 |
| Stroke frente a AIT retiniano | 1,91 | 1,22-3,01 | < 0,0001 |
| Oclusión de ACI contralateral | 2,21 | 1,33-3,67 | 0,002 |
| Stroke o AIT previos | 1,59 | 1,21-2,09 | 0,001 |
| Muerte postprocedimiento en pacientes sintomáticos y asintomáticos81 | |||
| Edad ≥ 75 años | 1,36 | 1,07-1,68 | 0,02 |
| Edad ≥ 80 años | 1,80 | 1,26-2,45 | < 0,001 |
| Stroke o muerte postprocedimiento en pacientes sintomáticos y asintomáticos81 | |||
| Sexo femenino | 1,31 | 1,17-1,47 | < 0,001 |
AIT: accidente isquémico transitorio; HR: hazard ratio. IC: intervalo de confianza.
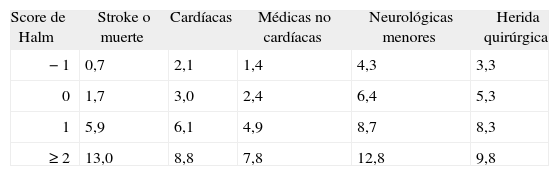
En función de los predictores de riesgo independientes se han ensayado dos modelos para estratificar el riesgo asociado a la EC90,91. El modelo de Halm parece ser el más adecuado para predecir las complicaciones neurológicas, médicas y quirúrgicas (tabla 5)79,91. Este score se obtiene sumando un punto por cada uno se los siguientes factores: a) enfermedad coronaria activa (angina GIV o angina inestable); b) cirugía realizada por un stroke (no por AIT), y c) estenosis de ACI contralateral ≥ 50%. También debe restarse un punto si se utiliza anestesia local. De esta manera, la máxima puntuación es 3 y la mínima es −1. Se utiliza para predecir los siguientes grupos de complicaciones hasta los 30 días postoperatorios: a) stroke o muerte; b) cardiacas (taquicardia ventricular, angina inestable, infarto agudo de miocardio e insuficiencia cardiaca congestiva); c) médicas no cardiológicas (requerimiento de asistencia respiratoria mecánica, neumonía postoperatoria, sepsis, insuficiencia renal, tromboembolismo de pulmón, trombosis venosa profunda o hemorragia digestiva); d) neurológicas menores (AIT, convulsiones o compromiso de pares craneales), y e) de la herida quirúrgica (hematoma o infección).
Score de Halm para la predicción de complicaciones post-endarterectomía carotídea
| Score de Halm | Stroke o muerte | Cardíacas | Médicas no cardíacas | Neurológicas menores | Herida quirúrgica |
| −1 | 0,7 | 2,1 | 1,4 | 4,3 | 3,3 |
| 0 | 1,7 | 3,0 | 2,4 | 6,4 | 5,3 |
| 1 | 5,9 | 6,1 | 4,9 | 8,7 | 8,3 |
| ≥ 2 | 13,0 | 8,8 | 7,8 | 12,8 | 9,8 |
Todos los valores se expresan en porcentajes
Como parte de su práctica asistencial, el neurólogo suele verse en la necesidad de definir a qué pacientes con enfermedad carotídea se les debe realizar una endarterectomía. Las tasas de complicaciones y la estratificación de riesgo sólo sirven para estimar qué posibilidades tiene un determinado paciente de sufrir una complicación postprocedimiento. No deben ser utilizadas para definir si un paciente debe operarse o no. La decisión a favor o en contra de la cirugía en el caso particular de cada paciente debe basarse en dos criterios fundamentales: a) la estratificación individual del riesgo de recurrencia si se le brindara el mejor tratamiento médico y b) la aplicabilidad de los resultados de los estudios aleatorizados al paciente en cuestión en función de diversos criterios como el grado de estenosis, la edad, el sexo, etc. (ver más adelante)92.
Indicaciones para la endarterectomía carotídea en pacientes sintomáticosEn 1991 se publica el NASCET, estudio que demostró categóricamente la utilidad del procedimiento quirúrgico para la reducción del riesgo de recurrencia de stroke en pacientes sintomáticos44. Siete años más tarde se reportan los resultados finales del ECST, contraparte europea con conclusiones muy similares45.
Ese mismo año se publica un análisis sobre los resultados a largo plazo del NASCET93. El Veterans Affairs Trial 309 (VA309) debe ser interrumpido cuando se conocen los resultados del NASCET y un análisis interino del ECST en 199144,94,95. Todos estos estudios exigían a los cirujanos participantes el antecedente de una tasa de complicaciones menor del 6%.
Los tres grandes estudios aleatorizados demostraron la utilidad de la EC en pacientes sintomáticos con estenosis mayores del 70%. Para entender el alcance de estas conclusiones y su aplicabilidad en la práctica asistencial es indispensable aclarar el concepto de “enfermedad carotídea sintomática”, dado que no cualquier síntoma debe ser considerado como propio de la ACI. Tanto el NASCET como el ECST definieron enfermedad carotídea sintomática como el antecedente de stroke isquémico o AIT en territorio carotídeo ocurrido en los 4 (NASCET) o 6 meses (ECST) previos a la aleatorización. Aunque no es exactamente lo mismo, la definición a utilizar en la práctica asistencial debería ser “cualquier stroke isquémico o AIT con manifestaciones clínicas atribuibles a territorio carotídeo, ocurrido en los 6 meses previos a la primera consulta”. El parámetro temporal, como veremos más adelante, no es un detalle menor. Si bien no existe evidencia al respecto, consideramos que la enfermedad carotídea en pacientes con lesiones isquémicas silentes en las neuroimágenes no debería ser considerada como “sintomática”, excepto que se pueda demostrar, por secuencia de difusión en la RMN o por comparación con estudios previos, que esas lesiones tienen un tiempo de evolución menor de 6 meses.
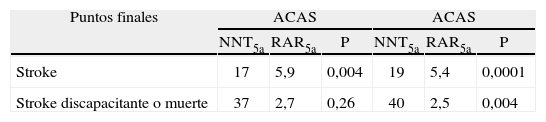
Estratificación del riesgo individual bajo tratamiento médicoExisten diversas herramientas para predecir el riesgo en pacientes bajo tratamiento médico. La más sofisticada es la Carotid Stenosis Prediction Tool, disponible en la Web: www.stroke.ox.ac.uk. Esta herramienta fue desarrollada por Rothwell et al, de la Universidad de Oxford, en función del análisis de los datos del ECST y posteriormente validada con los del NASCET96. Este sistema clasifica a los pacientes en quintilos. Aquellos comprendidos en los 3 quintilos inferiores no se beneficiarían con la EC a los 5 años (RAR5a 0-2%), los ubicados en el cuarto escalón tendrían un beneficio moderado (RAR5a 10,8%, IC 95%: 1,0-20,6) y los del último obtendrían el máximo rédito (RAR5a 32,0%; IC 95%: 21,9-42,1). Una alternativa a este modelo son las tablas de estratificación de riesgo por colores disponibles en la misma Web.
Aplicabilidad o validez externa de los estudios aleatorizadosUna vez determinado el riesgo individual del paciente, el neurólogo debería preguntarse si dicho individuo podría beneficiarse con la EC. Para ello es necesario saber si el paciente en cuestión cumple con los criterios surgidos del análisis de los estudios aleatorizados. Concretamente, debemos determinar si la edad, el sexo, el grado de estenosis y otras variables particulares del enfermo se ajustan a las características de los diversos subgrupos que se beneficiaron con la EC en el NASCET y el ECST.
Como se ha explicado previamente, el dato más relevante a la hora de decidir la conducta quirúrgica en pacientes con enfermedad carotídea sigue siendo el grado de estenosis54. Sin embargo, no es el único criterio que debe utilizarse. Diversas variables interaccionan significativamente con el grado de estenosis, modificando el impacto de la cirugía sobre la reducción del riesgo de recurrencia del stroke isquémico35. En la tabla 6 se muestra el número necesario de pacientes a tratar con EC para prevenir un stroke o muerte postoperatoria a 5 años (NNT5a) y la reducción absoluta de riesgo para el mismo outcome a 5 años (RAR5a), estratificados por grado de estenosis y la interacción de otras variables89.
NNT5a y RAR5a de la endarterectomía carotídea para prevenir un stroke o muerte postoperatoria en pacientes sintomáticos estratificada por grado de estenosis y otras variables
| Variables | NNT5a | RAR5a |
| Todos los pacientes | 24 | 4,1 (2,3-6,0) |
| Estenosis > 70% | 7 | 13,5 (9,8-20,7) |
| Hombres | 6 | 6,0 (3,8-8,2) |
| Mujeres | 10 | 9,9 (1,8-18,0) |
| Edad < 65 años | 10 | 9,8 (3,8-15,7) |
| Edad 65–74 años | 7 | 13,5 (6,5-20,5) |
| Edad ≥ 75 años | 3 | 37,2 (22,9-51,5) |
| Con antecedente de diabetes | 6 | 16,7 (6,0-27,4) |
| Sin antecedente de diabetes | 8 | 12,9 (8,1-17,7) |
| Placa ulcerada | 6 | 17,1 (11,6-22,6) |
| Con oclusión de ACI contralateral | 4 | 23,6 (3,2-44,0) |
| Sin oclusión de ACI contralateral | 8 | 12,7 (8,3-17,1) |
| Tiempo síntomas a cirugía < 14 días | 4 | 23,0 (13,6-32,4) |
| Tiempo síntomas a cirugía 14–30 días | 6 | 15,9 (6,6-25,2) |
| Tiempo síntomas a cirugía 30–90 días | 13 | 7,9 (1,3-14,4) |
| Tiempo síntomas a cirugía > 90 días | 14 | 7,4 (−3,3-18,1) |
| Síntoma ocular (amaurosis fugax o infarto) | 18 | 5,5 (−1,2-12,1) |
| Síntoma calificante = AIT | 7 | 15,4 (7,7-23,1) |
| Síntoma calificante = stroke | 18 | 17,7 (9,9-25,5) |
| Estenosis 50-69% | 13 | 7,8 (3,1-12,5) |
| Hombres | 13 | 8,0 (3,4-12,5) |
| Mujeres | NA | −2,7 (−8,8-3,5) |
| Edad < 65 años | 77 | 1,3 (−4,0-6,7) |
| Edad 65–74 años | 19 | 5,4 (−0,4-11,2) |
| Edad ≥ 75 años | 9 | 10,7 (−0,2-21,6) |
| Con antecedente de diabetes | 16 | 6,2 (−4,1-16,5) |
| Sin antecedente de diabetes | 23 | 4,3 (0,4-8,2) |
| Placa ulcerada | 18 | 5,7 (0,7-10,6) |
| Con oclusión de ACI contralateral | NA | −16,0 (−34,8-2,8) |
| Sin oclusión de ACI contralateral | 18 | 5,7 (1,9-9,5) |
| Tiempo síntomas a cirugía < 14 días | 7 | 14,8 (6,2-23,4) |
| Tiempo síntomas a cirugía 14–30 días | 30 | 3,3 (−6,3-13,0) |
| Tiempo síntomas a cirugía 30–90 días | 25 | 4,0 (−1,7-9,7) |
| Tiempo síntomas a cirugía > 90 días | NA | −2,9 (−10,2-4,3) |
| Síntoma ocular (amaurosis fugax o infarto) | 67 | 1,5 (−5,5-8,4) |
| Síntoma calificante = AIT | 26 | 3,8 (−2,6-10,1) |
| Síntoma calificante = stroke | 13 | 7,5 (1,6-13,5) |
| Estenosis < 50% | 39 | 2,6 (−1,7-6,9) |
Los valores de RAR5a se expresan en porcentajes con intervalos de confianza para el 95%. ACI: arteria carótida interna; AIT: accidente isquémico transitorio; NA: no aplicable.
Los datos de la tabla 6 deben ser analizados con prudencia. Salvo para los casos con lesiones suboclusivas, la EC reduce el riesgo de stroke o muerte en todos los pacientes con estenosis > 70%. La lesión suboclusiva es la que cumple con los siguientes criterios angiográficos: a) colapso postestenótico de la ACI; b) llenado más rápido de la ACE que la ACI, y c) llenado preferencial de la circulación intracraneal a través de colaterales7. Por lo general se asocia a estenosis ≥ 99%. En este subgrupo específico no pudo demostrarse el beneficio de la EC en el análisis combinado de NASCET, ECST y VA309 (RAR5a –0,1; IC 95%: –10,3-10,2)35. A pesar de esta aparente ausencia de beneficio, algunos pacientes con lesiones suboclusivas podrían verse favorecidos con la intervención. Entre ellos estarían aquellos con AIT a repetición a pesar del tratamiento médico. De hecho, en el ECST la EC mostró una significativa RAR5a de AIT en pacientes con lesiones suboclusivas (RAR5a 15%; NNT5a 7; p = 0,007)97.
Tal como puede apreciarse en la tabla 6, los pacientes con estenosis menores del 50% no se benefician con la EC.
El grupo que requiere un análisis más detallado es aquel con estenosis entre el 50 y el 69%. En estos pacientes la presencia de otras variables puede inclinar la decisión a favor o en contra de la cirugía. En este subgrupo la intervención no fue efectiva en mujeres, en diabéticos, ni en pacientes con oclusión de la ACI contralateral; tampoco fue beneficiosa para aquellos cuyo síntoma calificante fue un evento retiniano o un AIT89.
Todo lo expresado es el sustrato para las siguientes recomendaciones de la American Heart Association/American Stroke Association: a) se recomienda la EC para pacientes con stroke isquémico o AIT en los últimos 6 meses (a pesar de que el NASCET sólo incluyó pacientes con un máximo de 4 meses de evolución) y estenosis carotídea entre el 70 y 99% ipsilateral, siempre y cuando la morbimortalidad perioperatoria del cirujano sea menor del 6% (nivel de evidencia A, clase I); b) se recomienda la endarterectomía para pacientes con stroke isquémico o AIT en los últimos 6 meses y estenosis carotídea entre 50 y 69%, dependiendo de factores específicos de cada paciente como la edad, el sexo, las comorbilidades y la gravedad de los síntomas iniciales (nivel de evidencia A, clase I), y c) cuando la estenosis es menor del 50% no está recomendada la EC (nivel de evidencia A, clase III)98.
Edad y endarterectomía carotídeaLa relación entre la edad de los pacientes con enfermedad carotídea sintomática y el rédito potencial de la endarterectomía merece ser abordada específicamente, porque puede prestarse a confusiones. Por un lado, la mortalidad postoperatoria es mayor a partir de los 75 (OR: 1,36; IC 95%: 1,07-1,68; p = 0,02) y de los 80 años de edad (OR: 1,80; IC 95%: 1,26-2,45; p < 0,001)88. Una tendencia similar, aunque no significativa, se ha observado con respecto al riesgo de stroke y muerte postoperatoria en ambos grupos de edad. A pesar de ello, como puede apreciarse en la tabla 6, el beneficio de la endarterectomía aumenta con la edad. Los datos precedentes pueden parecer contradictorios. Sin embargo, el mayor beneficio de la intervención quirúrgica en pacientes de 75 años o más se explica porque su riesgo de recurrencia bajo tratamiento médico sobrepasa ampliamente al riesgo de stroke o muerte perioperatorios. Basándonos en lo expresado, no hay motivos para contraindicar la EC en pacientes ≥ 75 años que tengan una expectativa de vida ≥ 5 años. A pesar de esto, algunas guías (ver en la sección correspondiente a angioplastia) recomiendan la AC en pacientes mayores de 80 años. Un interesante metaanálisis reporta los siguientes riesgos en pacientes mayores de 80 años sometidos a AC y EC respectivamente: infarto agudo de miocardio 0,93 frente a 2,20% (p = 0,083), mortalidad 1,98 frente a 1,11% (p = 0,253), stroke 7,04 frente a 1,91% (p < 0,01). Según los autores la única diferencia significativa fue evidenciada en la frecuencia de stroke en pacientes sometidos a AC99. Sin embargo, si hacemos un reanálisis de los datos del mismo trabajo, la OR de la EC para los distintos outcomes muestra un menor riesgo de stroke (OR: 0,26; IC 95%: 0,19-0,35) y muerte (OR: 0,57; IC 95%: 0,33-0,98), pero un mayor riesgo de infarto agudo de miocardio (OR: 2,49; IC 95%: 1,09–5,70) con la EC. En resumen, la EC parece asociarse a un menor riesgo de stroke y muerte, pero a una mayor frecuencia de infarto agudo de miocardio en ancianos.
Importancia del tiempo entre síntomas y cirugíaEl tiempo transcurrido entre el comienzo de los síntomas y la cirugía es clave para la estratificación del beneficio. Éste será mayor cuanto antes se realice el procedimiento. La relación inversa entre el tiempo transcurrido hasta la cirugía y el beneficio de la intervención fue objetivada en los estudios aleatorizados de la década de 1990, y puede explicarse por varios mecanismos. Por un lado, el riesgo de recurrencia es máximo en los primeros días después del primer evento, y va disminuyendo con el transcurso del tiempo, probablemente gracias al efecto del tratamiento médico sobre la estabilización de la placa ateromatosa14,100. Por otro lado, es lógico suponer que el tiempo también favorezca la formación de circulación colateral. Finalmente, después de unas semanas, al balancear el potencial efecto de la EC con el riesgo de la recurrencia, el resultado es neutro y ya no tiene sentido la intervención quirúrgica.
Como se desprende de la tabla 6, el periodo de mayor rédito para la EC es en los primeros 14 días. En pacientes con estenosis sintomática >70% el efecto favorable de la intervención se pierde si se difiere más allá de los 90 días, mientras que en aquellos con estenosis sintomática entre un 50 y 69% se pierde transcurridos los primeros 14 días, por lo que no tendría sentido indicar el procedimiento fuera de las respectivas ventanas de tiempo.
El significado de “los primeros 14 días” debe ser analizado con cuidado. En primer lugar, este periodo corresponde al tiempo transcurrido entre la aleatorización y la cirugía en estudios como el NASCET y ECST. Esta ventana de tiempo no debe ser considerada como sinónimo del tiempo transcurrido entre el síntoma inicial y la cirugía. En el NASCET y ECST los pacientes fueron aleatorizados por síntomas ocurridos hasta 4 y 6 meses, respectivamente, antes. Esto significa que al tiempo aleatorización-cirugía que reportan estos estudios habría que sumarle el tiempo síntomas-aleatorización (hasta 6 meses). De esta manera, podríamos asumir que la ventana real en la cual la EC fue beneficiosa en los estudios aleatorizados fue mucho mayor que 14 días. En segundo lugar, que la EC sea más efectiva en los primeros 14 días no necesariamente significa que todos los pacientes deban ser operados en ese tiempo. Los casos paradigmáticos que escapan a la regla de la cirugía inmediata son el del AIT crescendo y el del stroke en evolución. El AIT crescendo puede ser definido de varias maneras. Las más apropiadas son: a) dos o más episodios en las últimas 24 horas101; b) tres o más episodios en los últimos 3 días78; c) tres o más episodios en los últimos 7 días102, y d) al menos un episodio diario103. Stroke en evolución es el que presenta progresión de los síntomas neurológicos. Intuitivamente sería lógico suponer que los pacientes con AIT crescendo o con strokes en evolución causados por una estenosis carotídea grave pueden beneficiarse con una endarterectomía de urgencia (realizada en la primera semana)104,105. Sin embargo, una revisión sistemática evidenció que la EC de urgencia en pacientes con AIT crescendo o stroke isquémico en evolución se asoció a un mayor riesgo de stroke y muerte postoperatorios que la cirugía diferida (OR: 4,6; IC 95%: 3,4-6,3; p = 0,001)106. El riesgo absoluto de stroke o muerte postoperatorio atribuible a la EC de urgencia fue de 20,2 (IC 95%: 12,02–8,4) para el stroke en evolución y 11,4 (IC 95%: 6,1-16,7) para el AIT crescendo. Como contraparte, la cirugía de emergencia en pacientes con stroke menor o AIT cursando cuadros neurológicos estables no se asoció a un mayor riesgo perioperatorio (OR: 1,2; IC 95%: 0,9-1,7; p = 0,17).
Indicaciones para la endarterectomía carotídea en pacientes asintomáticosEl riesgo anual de stroke ipsilateral en pacientes con estenosis carotídea > 50% es del 0,34%107, mientras que a los 15 años es del 16,6% (IC 95%: 1–32)108. El riesgo de infarto agudo de miocardio y muerte vascular no relacionada con el stroke parece ser mayor: (24%, IC 95%: 14–34)108. La edad y la diabetes aumentan el riesgo108.
El análisis de los resultados de los grandes estudios aleatorizados de EC en pacientes asintomáticos es mucho menos complejo que el de los realizados en pacientes sintomáticos. Los de mayor relevancia son el ACAS109 y el ACST75 (tabla 7). El VACS (Veterans Affairs Cooperative Study) fue realizado sólo en hombres110. El CASANOVA (Carotid Artery Stenosis with Asymptomatic Narrowing: Operation Vs Aspirin) tuvo un diseño criticado por el bajo número de pacientes y por haber excluido a aquellos con estenosis mayores del 90%111. Finalmente, el MACE (Mayo Clinic Asymptomatic Carotid Endarterectomy), que comparaba aspirina frente a EC, debió suspenderse por razones de seguridad al detectar un exceso de muertes por infarto agudo de miocardio en la rama aleatorizada a EC112.
El ACAS reclutó pacientes asintomáticos con estenosis carotídea entre 60 y 99%109, y el ACST pacientes sin historia de stroke o AIT en los 6 meses previos, con estenosis ≥ 60%75. Ambos estudios mostraron el beneficio de la EC para la reducción del riesgo de stroke.
Si bien tanto el ACAS como ACST sirven de sustrato para el análisis sobre la utilidad de la EC en pacientes asintomáticos, no son exactamente iguales y poseen características diferenciales. El dato más conflictivo del ACAS es que los cirujanos que participaron debían tener una tasa de morbimortalidad perioperatoria menor del 3%. Ésta es una diferencia de importancia con respecto a otros estudios como el ECST, NASCET y ACST, en los que los cirujanos debían tener una tasa de complicaciones menor del 6%. Incluso, a algunos cirujanos originalmente seleccionados se les impidió seguir participando por los resultados desfavorables de sus primeros pacientes operados113. Esta particularidad del ACAS resultó en una llamativa baja tasa de complicaciones quirúrgicas. En la tabla 3 pueden compararse las tasas de stroke y mortalidad postoperatoria de este estudio con las del ACST (1,5 frente a 2,8%; p = 0,07) y las de un estudio observacional realizado con 6.655 pacientes asintomáticos en el estado de New York (1,5 frente a 3,0%; p = 0,02)78. Como puede observarse, la mortalidad postoperatoria del ACAS fue 8 veces menor que en los otros dos estudios. Un metaanálisis de EC realizadas fuera del contexto de estudios aleatorizados también mostró una frecuencia de complicaciones 8 veces mayor que el ACAS114. La baja tasa de complicaciones observada en este último podría limitar la reproducibilidad de sus conclusiones en la práctica asistencial. Más aún si se tiene en cuenta el desconocimiento acerca de las propias estadísticas quirúrgicas en gran cantidad de centros.
En cuanto al ACST, el dato más cuestionable es que los pacientes fueron aleatorizados y operados con un DVC no auditado centralmente115. Este hecho pudo haber causado un elevado subregistro de lesiones suboclusivas, así como errores en la estimación del grado de estenosis116.
Una conclusión común a ambos estudios, que debe ser tomada con prudencia, es que grados crecientes de estenosis no se relacionaron con un mayor rédito de la endarterectomía, a diferencia de los estudios de carótidas sintomáticas. Basándonos en esta observación, el único dato relacionado con el grado de estenosis que debería utilizarse para indicar la cirugía es si ésta es mayor o menor del 60%.
Al igual que para la enfermedad carotídea sintomática, otras variables pueden inclinar la decisión a favor o en contra de la intervención quirúrgica. El sexo parece ser el determinante con mayor nivel de interacción sobre el resultado de la EC en pacientes asintomáticos. Un metaanálisis del ACAS y ACST evidenció una reducción del riesgo de stroke y muerte perioperatoria a 2,3 años en hombres (OR: 0,49; IC 95%: 0,36–0,66), pero no así en mujeres (OR: 0,96; IC 95%: 0,63-1,45)117.
Por lo tanto, no sería recomendable la EC en mujeres asintomáticas.
La progresión de la placa ateromatosa carotídea puede ocurrir en aproximadamente el 9% de los pacientes en el transcurso de 6 a 9 meses118. Se define como el paso de una categoría inferior a una superior en la escala que estratifica el grado de estenosis en 6 niveles: 0 a 29%, 30 a 49%, 50 a 69%, 70 a 89%, 90 a 99% y 100%. No sólo se asocia a un mayor riesgo de stroke ipsilateral (HR: 2,0; IC 95%: 1,0-4,1; p = 0,04)118–120, sino también a un mayor riesgo de infarto agudo de miocardio (HR: 2,4; IC 95%: 1,1-5,4; p = 0,04) y muerte cardiovascular (HR: 1,8; IC 95%: 1,0-3,0; p = 0,04)118. Si bien la asociación planteada es clara, no existe evidencia aún para recomendar la endarterectomía únicamente en función de la progresión de la placa carotídea, aunque puede ser un elemento más a considerar en el momento de decidir.
Con respecto a la edad, la diferencia en el riesgo de stroke en territorio carotídeo entre operados y no operados en el ACST fue de 7,8% (IC 95%: 4,3-11,3; p < 0,0001) en menores de 65 años y de 7,5% (IC 95%: 4,7-10,3; p < 0,0001) en pacientes de 65 a 74 años75. Por el bajo número de pacientes no fue posible determinar si la endarterectomía es beneficiosa para los mayores de 75 años. La forma en que fueron presentados estos datos debe ser considera con cuidado, dado que no se reporta el RAR5a para el outcome combinado de stroke de cualquier causa y muerte perioperatoria.
Otro marcador de riesgo en pacientes asintomáticos es la presencia de microémbolos detectados por DTC. En un estudio reciente, la tasa anual de eventos en pacientes asintomáticos con estenosis carotídea entre 60 y 99% con DTC positivo fue del 4,6%, mientras que en aquellos con DTC negativo fue del 2,4% (p = 0,032)121. El valor de la detección de microémbolos en la práctica asistencial no ha sido determinado aún.
Como conclusión, en el caso de pacientes asintomáticos la EC debe reservarse para un selecto grupo. Hasta ahora, este grupo está definido por hombres menores de 75 años, con una estenosis > 60%, siempre y cuando la morbimortalidad del equipo quirúrgico sea menor del 3%. Es muy probable que en muy poco tiempo surja evidencia suficiente a favor del tratamiento médico (no quirúrgico) sobre el quirúrgico. De esta manera, la EC dejará de ser una opción para la gran mayoría de pacientes asintomáticos, y la conducta más importante será optimizar el tratamiento médico y jerarquizar la disminución del riesgo coronario, principal causa de mortalidad en estos pacientes.
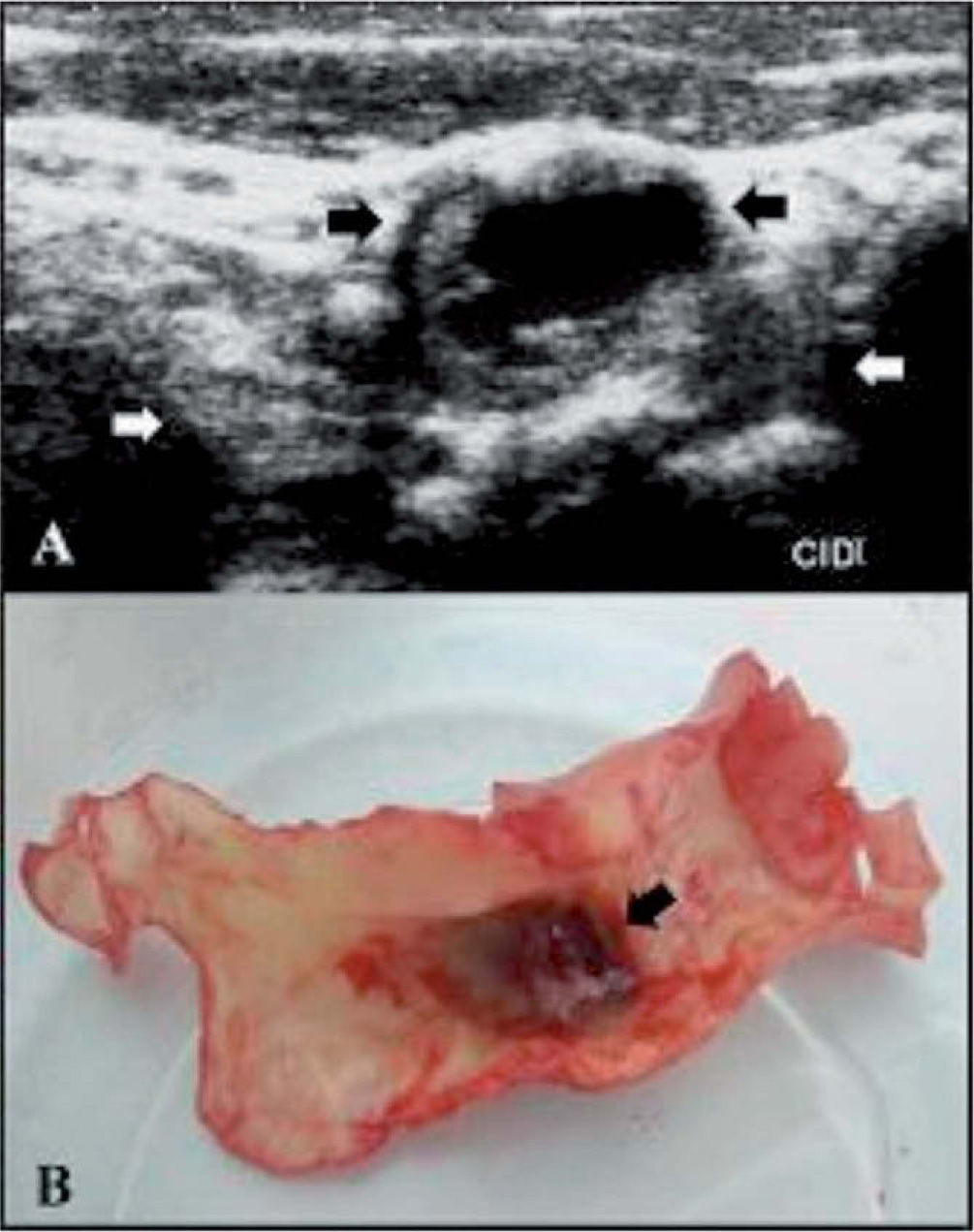
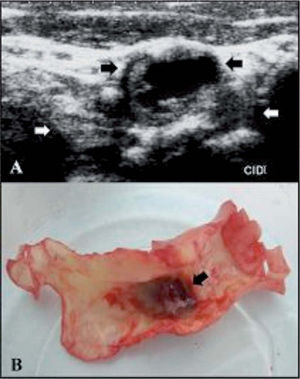
Caso clínico. Pacientes que no pueden encuadrarse en las guíasPresentamos, a modo de ejemplo, un paciente de 67 años con un stroke isquémico frontotemporal derecho y 2 AIT recurrentes en el mismo territorio, separados por tres meses y ocurridos dos años antes de la consulta. Fue evaluado con Holter, monitorización de eventos de 7 días y ecocardiograma transesofágico sin evidencia de fuentes de cardioembolia. Un electroencefalograma prolongado con activación compleja y una polisomnografía descartaron actividad comicial. Dos DVC demostraron una extensa placa en ACI derecha con remodelación positiva y un gran hematoma intraplaca (fig. 6). La estenosis, medida tanto por DVC como por A-RMN, no era mayor del 50%. De acuerdo con las guías de práctica clínica, este paciente no tendría indicación quirúrgica. Sin embargo, dados los signos de vulnerabilidad de la placa y considerando que presentaba recurrencias, a pesar de estar bajo tratamiento médico (aspirina, atorvastatina y enalapril), se decidió realizar una EC.
A: doppler color de vasos del cuello de placa ateromatosa en la arteria carótida interna derecha que evidencia hematoma intraplaca (flechas negras) y remodelación externa (flechas blancas). B: placa resecada mediante endarterectomía carotídea en la que se observa el hematoma recubierto por una muy adelgazada capa fibrosa, que ha sido retraída para una mejor visualización.
A pesar de que la EC ha sido el procedimiento más comúnmente realizado para minimizar el riesgo de stroke en los pacientes con estenosis carotídea sintomática y asintomática, la evolución de las técnicas percutáneas ha llevado al desarrollo de la AC y la AC con stent (ACS).
El primer caso de AC fue descrito por Mathias et al en 1977122,123.
Dentro de las ventajas potenciales de la AC y la ACS se señala su naturaleza menos invasiva (ya que pueden ser realizadas bajo anestesia local y sedación) con la posibilidad de ingresos hospitalarios más breves y una menor probabilidad de presentar complicaciones asociadas a enfermedad coronaria concomitante. A diferencia de la EC, que se encuentra limitada a la carótida cervical, los procedimientos endovasculares pueden ser realizados en lesiones mucho más cefálicas, e incluso en la carótida intracraneana. Un grupo especial de pacientes que podrían beneficiarse de la AC y de la ACS son aquellos con “cuellos difíciles u hostiles” que presentan mayor riesgo de complicaciones con la EC. Se incluyen en este grupo los enfermos previamente sometidos a radioterapia, aquellos con cirugía cervical previa o los pacientes traqueostomizados124,125.
A pesar de sus ventajas, los procedimientos percutáneos presentan sus propios riesgos. Se ha planteado que la movilización y eventual desplazamiento de la placa aterosclerótica resultaría en una incidencia mayor de eventos neurológicos asociados126.
En el caso de AC y de la ACS, algunas otras consideraciones deben ser enfatizadas:
- 1.
Los beneficios de la EC en los pacientes sintomáticos se han demostrado y la tasa de complicaciones es baja cuando es realizada por cirujanos experimentados. Por lo tanto, los resultados, las complicaciones y la estancia hospitalaria de las técnicas percutáneas deben ser comparadas con aquellas de la EC.
- 2.
La morbilidad y la mortalidad de la manipulación de los dispositivos intravasculares deben ser claramente definidas.
- 3.
La oclusión aguda de la carótida intraprocedimiento, a diferencia de las oclusiones agudas en otros territorios, puede que no sea posible su corrección quirúrgica de emergencia.
- 4.
La reestenosis posterior a un procedimiento percutáneo puede ser muy dificultosa o aun imposible de ser reparada quirúrgicamente.
Si bien la angioplastia percutánea se ha usado extensamente en patología vascular periférica y coronaria, se ha aplicado mucho más cautelosamente en patología carotídea debido al riesgo de disección y de stroke embólico. Más aún, y dado que la etiología principal del stroke de origen carotídeo es predominantemente embólica, el aumento del diámetro carotídeo con una AC tiene un sentido biológico menos atractivo que la remoción del foco embolígeno. Si bien los estudios iniciales referían una tasa de stroke mayor y menor de 1,4 y de 2,7%, respectivamente127, otras series demostraron complicaciones embólicas hasta en el 12% de los casos128. En algunas series se describió la reestenosis hasta en el 15% de los casos y la disección hasta en el 5%, complicaciones que se redujeron significativamente con la incorporación del stent129.
La AC, al realizarse en un paciente despierto, permite una monitorización neurológica en tiempo real durante el procedimiento. Sin embargo, a diferencia de la EC, en la que la intolerancia al clampaje puede ser tratada con la colocación de un shunt, poco puede hacerse cuando se instala una isquemia de origen embólico durante una AC o una ACS, por lo que todos los esfuerzos se han dirigido a minimizar el riesgo de la embolización intraprocedimiento. Por otro lado, el tiempo de isquemia en la AC es menor a un minuto, a diferencia de lo que ocurre en la EC, en la que el clampaje de la arteria es mucho mayor. Desde el advenimiento de los modernos stents, la AC es excepcionalmente realizada sin ellos.
StentsLos primeros stents expandibles con balón fueron reemplazados muy favorablemente por los stents autoexpandibles. Los primeros, de cromo-cobalto, han sido reemplazados por los actuales de nitinol, una aleación de níquel con titanio que tiene memoria térmica y una mayor adaptabilidad a la pared del vaso. Cualquiera de ellos puede ser, de acuerdo a la apertura de la malla, de celda abierta (más navegables y más adaptables a las tortuosidades vasculares), de celda cerrada (con mayor tensión radial, mejor contención de la placa y probablemente menor potencial embolígeno) y los stents híbridos (de celdas cerradas en el centro y celdas abiertas en los extremos).
Sistemas de protecciónCon el fin de minimizar el riesgo de embolización distal se utilizan filtros, balones de oclusión proximal y balones de oclusión distal.
Los filtros de protección distal son alambres guías que atraviesan la lesión y tienen en su extremo un receptáculo en forma de bolsa con perforaciones de 80 a 140 micrones, destinados a capturar las partículas desprendidas. Son de fácil maniobrabilidad y los más ampliamente utilizados130. Su principal desventaja es la necesidad de atravesar la lesión sin el sistema funcionando, por lo que no son de utilidad en las lesiones críticas, con trombos visibles o en pacientes con síntomas a repetición.
Los balones de oclusión proximal bloquean el flujo a través del vaso con la oclusión por balón de la ACE y de la ACC por debajo de la obstrucción131.
En el sistema creado por Parodi, el catéter guía tiene una entrada auxiliar desde donde se establece un flujo invertido desde la carótida interna hacia la vena femoral a través del mismo. En ambos casos se atraviesa la lesión y se coloca el stent mientras no hay flujo a través de la carótida, aspirando todo el material residual posible antes de la finalización del procedimiento132. Estos sistemas son útiles en las lesiones críticas, con trombos visibles o con síntomas a repetición. Sus desventajas son su mayor diámetro y el mayor entrenamiento necesario para su uso.
Los balones de oclusión distal también requieren que la guía atraviese la lesión (con el consiguiente riesgo). Posteriormente debe inflarse un balón distal a la estenosis para forzar el desvío del flujo hacia la ACE, mientras se instrumenta la placa. Si bien son de uso más simple, su utilización está cada vez más restringida133.
Estudios comparativosUna revisión sistemática que identificó 10 estudios aleatorizados controlados con 3.178 pacientes sintomáticos y asintomáticos que compararon EC frente a ACS, publicados hasta marzo de 2007, señaló las siguientes observaciones134: a) el outcome primario de nuevo stroke o muerte a los 30 días favoreció la EC usando el modelo de efectos fijos, pero el resultado no alcanzó significación estadística usando el modelo de efectos aleatorizados (que es menos proclive a subestimar los intervalos de confianza); b) en el seguimiento a largo plazo no hubo diferencias significativas entre la EC y el tratamiento endovascular en el riesgo de stroke o muerte; c) de todos modos los datos fueron considerados difíciles de interpretar debido a que los intervalos de confianza eran muy amplios, existía mucha heterogeneidad en los estudios y algunos de ellos fueron interrumpidos de forma preliminar, por lo que los revisores concluyeron que no existía evidencia suficiente para generar un cambio en la recomendación de la EC como tratamiento de elección para la enfermedad carotídea.
Dentro de estos estudios sobresalen algunas observaciones: el estudio CAVATAS incluyó 504 pacientes con estenosis carotídea o vertebral. A los 30 días la incidencia de muerte o stroke incapacitante (10% en cada grupo) o de cualquier stroke (6% en cada grupo) no fue significativamente diferente entre ambos procedimientos135. A tres años tampoco se encontraron diferencias significativas. Aunque no hubo diferencias en el riesgo de stroke o muerte relacionados con el procedimiento entre la angioplastia y la endarterectomía, las conclusiones son limitadas ya que la población ha sido heterogénea y además en sólo un 25% de los pacientes se usaron stents. Estudios recientes de seguimiento han mostrado que la tasa de reestenosis en los pacientes con AC fue tres veces superior a la del grupo EC, aunque el riesgo de stroke ipsilateral fue bajo136,137.
El SPACE fue un estudio europeo que incluyó 1.183 pacientes destinado a probar la no inferioridad de la ACS frente a la EC para el tratamiento de la estenosis carotídea grave sintomática. Se excluyeron pacientes de alto riesgo, con hipertensión no controlada o con reestenosis138. A los 30 días el outcome compuesto de stroke ipsilateral o muerte fue igual en ambos grupos (6,8 frente a 6,3%), aunque no pudo demostrarse la no inferioridad de la ACS frente a la EC. En un análisis post hoc la edad avanzada en el grupo de ACS (pero no en el de EC) se asoció a mayor riesgo de stroke ipsilateral o muerte139. En el seguimiento a dos años no se observaron diferencias significativas en el endpoint compuesto de stroke periprocedimiento, isquémico ipsilateral o muerte140. Una de las críticas al SPACE fue que el uso de dispositivos de protección embólica fue optativo y sólo se usaron en el 27% de los casos, aunque a 30 días (cuando se evalúa la influencia periprocedimiento) no se observaron resultados diferentes.
En el EVA-3S, de origen francés, también se evaluó la hipótesis de que la ACS no es inferior a la EC en pacientes con estenosis carotídea grave sintomática141. El estudio excluyó pacientes de alto riesgo con angina inestable, diabetes descompensada o hipertensión no controlada, así como pacientes con revascularización previa. La incidencia de cualquier stroke o muerte a los 30 días fue mayor con ACS que con EC (9,6 frente a 3,9% con un RR de 2,5). El estudio se suspendió en forma prematura debido a un exceso de mortalidad en la rama ACS. En el seguimiento a 4 años también se vio una mayor incidencia del outcome negativo combinado para ACS frente a EC (11,1 frente a 6,2%)142. La diferencia a 4 años estaba principalmente determinada por el alto número de strokes periprocedurales, mientras que en el seguimiento posterior no hubo diferencias significativas. Las principales críticas al estudio han sido la falta de experiencia de muchos de los operadores, el uso de diversos tipos de stents y dispositivos de protección y que el empleo de estos últimos fue opcional.
A diferencia de los estudios anteriores, el SAPPHIRE evaluó la no inferioridad de la ACS frente a EC en pacientes con estenosis carotídea sintomática (> 50%) y asintomática (> 80%) considerados de alto riesgo quirúrgico143,144. Más del 70% eran asintomáticos. Todos usaron un stent con dispositivo de protección embólica. Al año la ACS no fue inferior a la EC y hubo una disminución del endpoint combinado de stroke, infarto agudo de miocardio y muerte en el grupo ACS frente a EC. Más allá del año no pudo demostrarse la no inferioridad de la ACS frente a EC y no hubo diferencias significativas en el endpoint secundario (endpoint primario más stroke ipsilateral o muerte entre el primer y tercer año).
A pesar de las dificultades, probablemente deba ser considerada válida la conclusión de que la ACS no es inferior a la EC en pacientes de alto riesgo para el grupo en estudio (tabla 8)145.
Condiciones de alto riesgo para la realización de una endarterectomía carotídea (EC)
| ICCS-SPREAD | SAPPHIRE |
| Parálisis del nervio laríngeo contralateral | Parálisis del nervio laríngeo contralateral |
| Antecedente de radiación cervical | Antecedente de irradiación cervical |
| EC previa con estenosis recurrente | EC previa con estenosis recurrente |
| Antecedente de cirugía radical en cuello | |
| Lesión de ACI alta | |
| Lesión de ACC infraclavicular | |
| Lesiones graves en tándem | |
| Edad superior a 80 años | Edad superior a 80 años |
| Grave enfermedad pulmonar | Grave enfermedad pulmonar |
| Graves comorbilidades vasculares o cardiacas | |
| Insuficiencia cardiaca congestiva (clase III-IV de la NYHA) y/o grave alteración de la función sistólica del ventrículo izquierdo | Insuficiencia cardiaca congestiva |
| Necesidad de cirugía cardiaca dentro de las próximas 6 semanas | Necesidad de cirugía cardiaca |
| Infarto agudo de miocardio reciente (más de 24 horas y menos de 4 semanas) | |
| Angina inestable (clase II-IV de la Canadian Cardiovascular Society) | Pruebas de apremio anormales |
| Oclusión carotídea contralateral | Oclusión carotídea contralateral |
ACC: arteria carótida común; ACI: arteria carótida interna.
El ICCS-SPREAD Joint Committee, reunión de múltiples sociedades científicas italianas relacionadas con el tratamiento de la patología vascular, ha hecho recomendaciones referidas a la organización del equipo multidisciplinario necesario para la toma de decisión en los pacientes con estenosis carotídea, así como los requisitos académicos y de entrenamiento para la realización de los procedimientos de revascularización, insistiendo en que las guías deberán ser ajustadas a las evidencias que surjan de los estudios en curso146.
En la tabla 8 se enumeran las condiciones de “alto riesgo” para EC según el ICCS-SPREAD Joint Committee y el SAPPHIRE143,146. En pacientes con estas características y con las adecuadas condiciones técnicas y de certificación de calidad del equipo interviniente, la ACS podría ser priorizada ante la EC.
Sin embargo, Rothwell y Roffi, en dos recientes comentarios independientes, llaman a la reflexión sobre la falta de evidencia para la realización de la ACS en pacientes que reúnan condiciones adecuadas para la realización de una EC. Por ello, la EC debería considerarse como la primera elección ante la necesidad de revascularización carotídea147,148.
Tratamiento médicoEl mejor tratamiento médico (MTM) de la enfermedad vascular es la base sobre la cual se sustenta la prevención. Incluye: a) diagnóstico de los factores de riesgo; b) abandono de hábitos nocivos (tabaquismo, consumo excesivo de alcohol, sedentarismo, drogas de uso recreacional, etc.); c) dieta (específica para cada perfil de riesgo) y descenso de peso; d) antiagregantes plaquetarios; e) antihipertensivos, y f) estatinas149. Un aspecto importante del tratamiento médico (TM) es que, excepto contadas excepciones, también sirve para prevenir el riesgo vascular general. No sólo previene el stroke, sino también el infarto agudo de miocardio, la insuficiencia cardiaca, la enfermedad vascular periférica, etc. Además, no disminuye el riesgo de un solo subtipo de stroke: a diferencia de la endarterectomía o la angioplastia, no sólo previene el stroke carotídeo, sino también el de pequeño vaso y el cardioembólico.
El TM en pacientes con enfermedad carotídea no difiere sustancialmente del que debe indicarse a pacientes con enfermedad cerebrovascular de otras causas. En esta sección abordaremos la relación específica entre algunas intervenciones farmacológicas específicas y la enfermedad carotídea. Para una lectura más profunda sobre estrategias generales de prevención primaria y secundaria del stroke isquémico recomendamos la consulta de las guías de la American Heart Association/American Stroke Association98,150.
Intervenciones farmacológicas específicas y su relación con la enfermedad carotídeaCuando analizamos los métodos diagnósticos para la enfermedad carotídea nos referimos a la utilidad del EIM, el área de la placa y su volumen como marcadores de riesgo de stroke. Los estudios más importantes de prevención de enfermedades vasculares como el ARIC (Atherosclerosis Risk in Communities), el CHS (Cardiovascular Health Study) y el Rotterdam Study han utilizado la reducción en el EIM como proxy de regresión de la placa carotídea151–153. Por ello analizaremos la evidencia acerca del impacto de los antiagregantes plaquetarios, antihipertensivos y estatinas sobre la reducción del EIM y la estabilización de la placa.
Antiagregantes plaquetariosLos antiagregantes plaquetarios disminuyen el riesgo de stroke y son componentes indispensables de cualquier esquema de prevención primaria y secundaria98,150. Tal vez por este motivo casi no existen estudios que hayan evaluado su efecto sobre la regresión de la placa carotídea. La evidencia actual más fuerte al respecto es para pacientes con diabetes, en quienes la administración de aspirina o ticlopidina redujo significativamente el EIM154.
AntihipertensivosLa hipertensión arterial es un factor de riesgo para el stroke isquémico y para el aumento del EIM155. Los antihipertensivos no sólo disminuyen el riesgo de stroke en pacientes de alto riesgo sin antecedentes cerebrovasculares, sino también en pacientes con historia de stroke156,157. Además, estos fármacos reducen el EIM155. Las guías de prevención secundaria del stroke recomiendan el uso de antihipertensivos en todo paciente que ha sufrido un stroke (nivel de evidencia A, clase I), sea o no sea hipertenso (nivel de evidencia B, clase IIa)98. El efecto protector parece depender del descenso de presión arterial y no de una clase específica de antihipertensivos156. Para el tratamiento de hipertensos sin antecedente de stroke o AIT recomendamos la lectura del JNC (Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure 7)158.
EstatinasLa asociación entre hiperlipidemia y stroke es inconsistente159,160. Sin embargo, las estatinas han demostrado reducir el riesgo de stroke en pacientes con historia de stroke161 (HR: 0,84; IC 95%: 0,71-0,99; p = 0,03) y sin ella (HR: 0,82; IC 95%: 0,77-0,87; p < 0,0001). Este efecto protector es mayor en pacientes con enfermedad carotídea (HR: 0,67; IC 95%: 0,47-0,94; p = 0,02)162. Por otra parte, varios estudios han demostrado la efectividad de las estatinas para enlentecer la progresión e incluso lograr la regresión de la placa carotídea163.
Un aspecto que genera algunas dudas es el aumento del riesgo de hemorragias intracraneales en pacientes con historia de stroke tratados con estatinas en altas dosis (RR: 1,73; IC 95%: 1,19-2,50). Estos datos surgen de un metaanálisis realizado con todos los pacientes del SPARCL y algunos del HPS (Heart Protection Study) reclutados por un stroke previo164,165. El riesgo de hemorragias intracraneales no pudo demostrarse en pacientes sin historia de stroke161. Hasta que se identifiquen los predictores de sangrado intracraneal parece lógico evitar el uso de estatinas en altas dosis en pacientes con antecedente de stroke hemorrágico.
Desde la publicación del SPARCL han surgido algunas dudas en cuanto a la seguridad y factibilidad del uso de la dosis de 80mg/día de atorvastatina. A favor de la utilización de esta dosis debemos decir que el perfil de seguridad en el estudio fue aceptable. En lo referente a los ensayos de prevención primaria con estatinas, el tratamiento intensivo (altas dosis) se asoció a una reducción del 13% en el riesgo de stroke en comparación con el tratamiento estándar (HR, 0,87, IC 95% 78–96)161. Con respecto a la prevención secundaria, las bajas dosis de estatinas (20 a 40mg) en el HPS no mostraron beneficios en cuanto a la prevención del stroke165. Un análisis posthoc del SPARCL mostró una reducción del 28% en el riesgo de stroke en pacientes que alcanzaron el objetivo de concentraciones plasmáticas de 70mg/dl de colesterol ligado a lipoproteínas de baja densidad (LDL-c) con respecto a aquellos que tenían niveles mayores de 100mg/dl166. Si bien esta evidencia surge de estudios post-hoc, nada indica que los pacientes con enfermedad carotídea y stroke no puedan recibir dosis de 80mg/día de atorvastatina con un perfil razonable de seguridad.
La monitorización del EIM parece no ser necesaria para el seguimiento clínico de pacientes tratados con estatinas. Por un lado, estos fármacos ya han demostrado cabalmente su beneficio en cuanto a la prevención de eventos cerebrovasculares (outcome clínico), por lo que no sería demasiado útil utilizar en la práctica asistencial una medida de outcome intermedio como el EIM. Por otra parte, si bien el aumento del EIM se asocia a un mayor riesgo de stroke, tampoco sería correcto considerarlo como una medida de outcome final, dado que hasta la actualidad no ha sido posible determinar si su reducción mediante intervenciones farmacológicas tiene implicaciones directas sobre la reducción del riesgo de stroke. Dado que la reducción de riesgo de stroke está directamente relacionada con los niveles plasmáticos de LDL-c (21,1% por cada 39mg/dl de reducción), la determinación del LDL-c o el ratio de colesterol ligado a lipoproteínas de alta densidad (HDL-c)/LDL-c son los parámetros de mayor utilidad para la monitorización del tratamiento161.
En pacientes de alto riesgo, en quienes por diversos motivos debe diferirse la EC, sería de gran utilidad contar con fármacos que rápidamente pudieran estabilizar la placa carotídea vulnerable. La reducción del EIM comienza entre los 2 y 12 meses después del inicio del tratamiento con estatinas167,168, sin embargo el efecto estabilizante sobre la placa puede notarse rápidamente, a los 30 días169. Este efecto estaría mediado por una disminución de la carga inflamatoria de la placa, expresada por una reducción de mediadores inflamatorios y menor infiltración por linfocitos T activados y macrófagos170,171. Esta estabilización de la placa vulnerable podría resultar en una disminución de las complicaciones cardiovasculares postoperatorias en pacientes tratados con estatinas antes de cirugías vasculares. Este efecto protector podría extenderse hasta un periodo de 6 meses después de la cirugía172.
Mejor tratamiento médico frente a endarterectomía carotídea en la enfermedad carotídea asintomáticaEn los últimos años ha surgido una intrigante inquietud: ¿Podrá el MTM reemplazar a la EC y la AC en pacientes con enfermedad carotídea? Ya hemos puntualizado que ningún estudio aleatorizado avala la ACS como la mejor estrategia de prevención147,148. Por lo tanto, este tratamiento sólo es una opción para casos muy seleccionados en los que el paciente no reúne las condiciones adecuadas para una EC. En función de esta observación, en lo que resta de esta sección sólo abordaremos la relación entre el TM y la EC en pacientes sintomáticos y asintomáticos.
De acuerdo con los resultados de estudios como NASCET y ECST es improbable que el MTM actual pueda ser mejor que la EC en pacientes sintomáticos. Por lo tanto, el rol del actual del MTM en pacientes con enfermedad carotídea sintomática es el de potenciador del beneficio de la EC.
La situación es distinta para la enfermedad carotídea asintomática. Si consideramos el beneficio marginal de la EC en pacientes asintomáticos es factible que el MTM, tal como ha evolucionado hasta la actualidad, sí sea mejor que la intervención quirúrgica173.
Los estudios aleatorizados que evaluaron la utilidad de la EC en pacientes asintomáticos iniciaron sus reclutamientos en el año 1983112 y finalizaron en julio de 200375. Estos estudios demostraron que la cirugía sumada al MTM, iniciado en el momento de la aleatorización y mantenido durante el seguimiento, eran mejores que el MTM solo. Sin embargo, en los últimos 25 años el TM ha evolucionado espectacularmente, desarrollándose nuevos fármacos y descubriéndose nuevas propiedades de otros más antiguos. Esto ha llevado a cuestionamientos recientes sobre la aplicabilidad actual de las conclusiones de estudios como el ACAS y ACST.
Una reciente revisión sistemática marca un punto de inflexión en la historia de la EC frente a MTM en pacientes asintomáticos con estenosis carotídea ≥ 50%174. La importancia de este trabajo, con su excepcional análisis sobre la evolución y el impacto del MTM sobre las tasas de stroke en pacientes con enfermedad carotídea asintomática en los últimos 25 años, justifica el comentario detallado de sus resultados y conclusiones más destacadas.
El hallazgo más significativo es una progresiva reducción en la tasa de eventos cerebrovasculares en pacientes bajo MTM incluidos en estudios observacionales hospitalarios entre 1985 y 2007: stroke ipsilateral −1,4% (p < 0,0012) y stroke en cualquier territorio −2,3% (p < 0,00012). Según el análisis, al comparar el efecto del MTM en los sucesivos años con el de la EC realizada en los estudios aleatorizados, la intervención quirúrgica dejó de ser mejor que el MTM a mediados de la década de 1980 para prevenir el stroke ipsilateral, a mediados de la década de 1990 para el stroke de cualquier territorio y en 2001 para el stroke o AIT de cualquier territorio. Esto sucedió a pesar de un aumento en la prevalencia de hipertensión arterial (↑ 5%) y de la edad promedio de los pacientes (↑ 5,5 años), aunque sí hubo una disminución significativa de fumadores (↓ 15%), hombres (↓ 8%), enfermedad coronaria (↓ 37%) y enfermedad vascular periférica (↓ 11%). La principal conclusión es que desde el año 2001 el MTM es al menos tan efectivo como la EC combinada con el MTM de 10 a 20 años atrás. Si a este dato le sumamos que el MTM es 3 a 8 veces menos costoso (otra conclusión del estudio) para prevenir un stroke, la balanza se inclina indudablemente a favor de la primera opción.
Pueden hacerse al menos dos observaciones a este excelente trabajo de Abbott. Basándonos en su estudio sabemos que, para pacientes asintomáticos con estenosis carotídea mayor del 50%, el MTM actual es al menos tan efectivo como la EC sumada al MTM de hace 10 a 20 años. Sin embargo, para determinar cuál es la mejor opción terapéutica en el año 2010 debería compararse el MTM actual (en el año 2010) contra la EC sumada al MTM actual (en el año 2010). Un estudio aleatorizado diseñado para tal fin requeriría un número muy elevado de pacientes, por la paridad en la efectividad de las dos intervenciones terapéuticas. Por ello, su coste sería difícil de justificar; más aún si tenemos en cuenta los problemas de aplicabilidad o validez externa que podrían existir. Una opción para dilucidar esta incógnita sería la creación de grandes registros multicéntricos. La segunda observación que podemos hacer al estudio de Abbott es que los datos sobre los que realizó su análisis provienen de países con un gran desarrollo socioeconómico (Holanda, Canadá, Estados Unidos y Australia). Conociendo los problemas que países menos desarrollados han evidenciado en términos de prevención secundaria, resulta arriesgado extrapolar las conclusiones del estudio a nuestro país175. Al menos podríamos plantear que la introducción de políticas de salud orientadas a optimizar programas de prevención vascular podrían tener un enorme impacto. Sea cual fuere la conclusión con respecto a la inquietud planteada, todo paciente con enfermedad carotídea, sintomática o asintomática, deberá ser tratado con el MTM actual; en algunos pocos además se indicará la EC.
Antitrombóticos antes, durante y después de la endarterectomía carotídeaLa agregabilidad y adhesividad plaquetarias aumentan durante la EC, especialmente en el momento del clampeo y desclampeo de la ACI176. Este fenómeno podría potenciarse por una disminución del efecto antiagregante de la aspirina durante la cirugía177. Como consecuencia, en el postoperatorio es posible detectar trombos en el lecho quirúrgico en el 2,7% de los casos178. Independientemente de esta trombosis local, un 5% de los pacientes desarrolla un elevado grado de microembolización detectada por DTC en las primeras dos horas luego de la cirugía178. De este grupo, un 30 a 60% de los casos sufrirá un stroke isquémico en las horas subsiguientes179,180.
Antitrombóticos antes de la endarterectomía carotídeaEl uso de la combinación de aspirina (330mg/día) y dipiridamol (75mg/día) redujo significativamente la acumulación de plaquetas en el sitio de la endarterectomía181. Estos datos coinciden con el efecto positivo demostrado por la aspirina, administrada en dosis de 75mg/día antes de la cirugía, sobre la reducción del número de strokes graves en el primer mes comparada con placebo182. El ACE (Aspirin and Carotid Endarterectomy Trial) demostró que las menores dosis de aspirina (81mg/día y 325mg/día) administradas antes y después de la EC se asociaron a un menor riesgo de stroke, infarto agudo de miocardio y muerte a los tres meses (6,2 frente a 8,4%; p = 0,03) con respecto a las dosis mayores (650mg/día y 1.300mg/ día)183. La combinación de aspirina (150mg/día) y clopidogrel (75mg/día) administrada en los 5 días previos a la EC también redujo el número de microembolias en las primeras tres horas postoperatorias (OR: 0,10; IC 95%: 0,01-0,79) comparada con a aspirina sola (150mg/día) sin aumentar el número de sangrados184. Con respecto al uso específico del clopidogrel, si bien pequeños estudios han demostrado una relativa seguridad cuando es administrado antes de la cirugía185, el propio laboratorio que lo produce recomienda suspenderlo de 5 a 7 días antes de cualquier cirugía electiva186.
Una situación relativamente frecuente en la práctica asistencial es la del paciente que presenta AIT crescendo o stroke progresivo por enfermedad carotídea. Si bien se ha investigado la utilidad de la heparina sódica intravenosa (con o sin bolo previo) y la heparina de bajo peso molecular, ninguna de las dos opciones ha demostrado ser de utilidad para disminuir el daño neurológico del stroke ni para prevenir la recurrencia temprana187. En función de estos datos y debido al mayor riesgo de sangrados cerebrales y no cerebrales, las guías de la American Heart Association/American Stroke Association desaconsejan su utilización después del AIT o stroke isquémico agudo187.
En conclusión, el uso de aspirina (75 a 100mg/día) antes de la EC parece ser seguro y necesario para disminuir el riesgo de microembolización y stroke postprocedimiento (recomendación grado IA del American College of Chest Physicians)188. Hasta que no exista una fuerte evidencia a favor del beneficio y seguridad del clopidogrel, su uso no resulta recomendable en el periodo preoperatorio. Tampoco existe evidencia para retrasar la cirugía en pacientes previamente tratados con este fármaco. Finalmente, mientras el paciente espera la EC tampoco debe ser tratado con anticoagulación.
Antitrombóticos durante la endarterectomía carotídeaSe han ensayado diversas opciones terapéuticas con el fin de disminuir el riesgo de embolización durante la EC, especialmente antes del clampaje y desclampaje.
Si bien algunos estudios han demostrado la disminución de la carga microembólica y del riesgo de stroke periprocedimiento mediante la administración de dextrano en pacientes sometidos a EC, su uso no ha sido ampliamente aceptado por el riesgo de insuficiencia cardiaca y otras complicaciones189,190.
La recomendación del American College of Chest Physicians para el manejo antitrombótico intraoperatorio es la heparina sódica no fraccionada intravenosa188. También es aconsejable un adecuado control de los tiempos de coagulación durante el procedimiento.
El punto controvertido con respecto a la anticoagulación intravenosa intraoperatoria es si debe ser revertida con protamina al finalizar el procedimiento, dado que ésta suele asociarse a alteraciones hemodinámicas y no necesariamente disminuye el riesgo de sangrado postprocedimiento188,191. Por otra parte, la reversión de la anticoagulación con protamina puede asociarse a mayor riesgo de trombosis local192.
En conclusión, antes del clampaje de la ACI debe iniciarse la anticoagulación con heparina sódica no fraccionada intravenosa. No hay evidencia suficiente para recomendar o desaconsejar la reversión de la anticoagulación con protamina.
Antitrombóticos después de la endarterectomía carotídeaUn reciente metaanálisis evidenció que los antiagregantes plaquetarios reducen el riesgo de stroke (OR: 0,58; IC 95%: 0,34-0,98; p = 0,04) después de la EC, pero no parecen tener un efecto significativo sobre la mortalidad (OR: 0,77; IC 95%: 0,48-1,24) ni tampoco sobre el riesgo de sangrado postoperatorio (OR: 1,71; IC 95%: 0,73-4,03)193. El antitrombótico de elección debe ser elegido de acuerdo con el perfil de riesgo de cada paciente. El American College of Chest Physicians recomienda el uso de aspirina (81 a 100mg) de forma indefinida188. Dado que hasta un 30% de los pacientes con enfermedad de gran vaso puede presentar una fuente de cardioembolia, recomendamos siempre la búsqueda de fuentes cardioembólicas mediante ecocardiograma transesofágico, dado que en esos casos, después de la EC, el tratamiento antitrombótico de elección sería la anticoagulación oral además de la antiagregación plaquetaria194.
Antitrombóticos antes, durante y después de la angioplastia carotídeaEl racional para el uso de antitrombóticos en pacientes sometidos a AC es la prevención de la formación de trombos en el periodo inmediato post-intervención, así como la reducción del riesgo de reestenosis temprana (primeros 30 días) o tardía.
El daño intimal por traumatismo mecánico que se produce durante la ACS ocasiona la exposición del colágeno y otras proteínas endoteliales, que estimulan la agregabilidad y la adhesividad plaquetaria. La subsecuente reparación endotelial conlleva un intenso infiltrado celular del trombo parietal, además de la proliferación y migración de células del músculo liso. La exacerbación de este proceso se denomina hiperplasia neointimal y es la principal causa de reestenosis en los primeros 30 días195. La reestenosis que se produce de forma tardía, por lo general responde a fenómenos ateroscleróticos relacionados con el inadecuado control de los factores de riesgo vascular196.
Antitrombóticos antes de la angioplastia carotídeaLas microembolias asintomáticas detectadas mediante DTC han cobrado una progresiva importancia como predictoras de stroke y AIT197 y son más frecuentes en la enfermedad carotídea sintomática que en la asintomática198. El CARESS (Clopidogrel and Aspirin for Reduction of Emboli in Symptomatic Carotid Stenosis Trial) es un estudio aleatorizado que comparó la combinación de clopidogrel (carga de 300mg más mantenimiento con 75mg/día durante 7 días) + aspirina (75mg/día) frente a aspirina sola (75mg/día) en 107 pacientes con estenosis carotídea ≥ 50%, recientemente (últimos tres meses) sintomática199. El número de microembolias asintomáticas fue menor en el grupo de terapia dual (reducción del riesgo relativo de 39,8%, IC 95%: 13,8-58,0; p = 0,005). La frecuencia de strokes recurrentes fue de 0,0% en el grupo bajo terapia dual frente a 7,1% en el grupo tratado sólo con aspirina (p = 0,44). En ninguno de los dos grupos se evidenciaron sangrados mayores. No hemos comentado los resultados del CARESS en la sección de antitrombóticos para la EC porque ya hemos expresado que no es recomendable el uso de clopidogrel en los días previos a la cirugía. Sin embargo, la combinación de clopidogrel y aspirina sí podría ser una opción interesante en el pequeño y adecuadamente seleccionado grupo de pacientes con estenosis carotídea sintomática a 70% que aguarda una angioplastia.
La mayoría de los ensayos de AC utilizaron aspirina en dosis de 100 a 300mg diarios con 75mg diarios de clopidogrel durante los tres días previos al procedimiento.
Antitrombóticos durante la angioplastia carotídeaComo rutina, después de la angiografía diagnóstica confirmatoria de resultados previos y antes de la introducción de la guía que transcurrirá a través de la estenosis, se administran de 5.000 a 7.500 unidades de heparina sódica no fraccionada a través del catéter intraarterial200. Posteriormente, y durante todo el procedimiento, se realizan infusiones de solución fisiológica heparinizada200. Algunos centros utilizan abciximab durante el procedimiento.
Antitrombóticos después de la angioplastia carotídeaBasados en la experiencia de la angioplastia coronaria, todos los estudios aleatorizados de AC han utilizado la combinación de aspirina y clopidogrel en dosis y tiempos variables. Además, estudios aleatorizados y experiencias de registros de angioplastias han demostrado la utilidad de este abordaje terapéutico201,202. En la tabla 9 se resumen los esquemas de terapia dual utilizados después de la AC en los principales estudios aleatorizados. En la actualidad el paciente sometido a una AC debe recibir la combinación de aspirina y clopidogrel al menos durante 30 días.
Esquemas de terapia dual utilizados en los principales estudios aleatorizados de angioplastia carotídea
| Estudio | Dosis post-stenting | Duración |
| ARCHeR203 | Aspirina* 325mg/día + clopidogrel** 75mg/día o ticlopidina** 500mg/día | *12M. **14 D |
| BEACH204 | Aspirina* 325mg/día + clopidogrel** 75mg/día o ticlopidina** 500mg/día | *12M. **30 D |
| CAVATAS135 | Aspirina* 150mg/día + heparina sódica no fraccionada IV sólo por 24h | *> 12M |
| EVA-3S142 | Aspirina 100 a 300mg/día + clopidogrel 75mg o ticlopidina 500mg/día | 30 D |
| SPACE139 | Aspirina 100mg/día + clopidogrel 75mg/día | 30 D |
| SAPPHIRE143 | Aspirina 81 a 325mg/día + clopidogrel 75mg/día | 14 a 28 D |
D: días; M: meses.
Dado que la aterosclerosis es una condición que predomina en ancianos, el envejecimiento gradual de la población ha llevado un aumento constante y proporcional de portadores de enfermedad coronaria y enfermedad carotídea o ambas205. La prevalencia de enfermedad carotídea en pacientes sometidos a cirugías de revascularización miocárdica (CRM) varía en las distintas series. En 5 estudios que reportaron los resultados del DVC en pacientes sometidos a CRM, la prevalencia de estenosis carotídea ≥ 80% fue del 6,0% (IC 95%: 5,4-6,6)206–211. En una cohorte de 176 pacientes sometidos a EC en el Hospital Universitario de la Fundación Favaloro entre 2006 y 2008, el 54,5% (IC 95%: 47,2-61,7) tenía antecedente de enfermedad coronaria definida como angor crónico estable, angor inestable, antecedente de CRM, de angioplastia coronaria o de infarto agudo de miocardio. Estos datos coinciden con los de otros autores211,212.
La enfermedad carotídea y la enfermedad coronaria son factores que predisponen a las complicaciones en pacientes sometidos a CRM213 y EC214, respectivamente. El 17% de los pacientes con enfermedad coronaria no tratada sufre un infarto en el periodo perioperatorio de la EC214. El riesgo de stroke isquémico después de la CRM con y sin bomba es del 3,8 y 1,9%, respectivamente215.
Rastreo de enfermedad carotídea en pacientes sometidos a cirugía de revascularización miocárdicaEl rastreo de enfermedad carotídea en pacientes que serán sometidos a una CRM puede hacerse en forma selectiva o no selectiva. Los factores predictores de enfermedad carotídea identificados por varios autores son la edad216–218, soplo carotídeo218–220, stroke o AIT previos218–220, antecedente de EC219, enfermedad vascular periférica218,219 y el antecedente de tabaquismo, hipertensión arterial y diabetes217,218. Las guías de manejo de pacientes sometidos a CRM del American College of Cardiology y la American Heart Association recomiendan el rastreo de enfermedad carotídea en pacientes con edad mayor de 65 años, enfermedad del tronco de la arteria coronaria izquierda, enfermedad vascular periférica, tabaquismo, antecedente de stroke o AIT y soplo carotídeo (nivel de evidencia C)221.
Rastreo de enfermedad coronaria en pacientes sometidos a endarterectomía carotídeaEl 25% de los pacientes sometidos a una EC es portador de una enfermedad coronaria asintomática según estudios que utilizaron SPECT o prueba de esfuerzo graduado222,223. Sin embargo, cuando la evaluación se realiza mediante cinecoronariografía, esta proporción puede llegar al 84%224. En función de esta evidencia, las guías de la American Heart Association/ American Stroke Association recomiendan la búsqueda de enfermedad coronaria en pacientes que han sufrido un stroke o AIT de causa carotídea, pero enfatizando que son necesarios estudios aleatorizados para confirmar la recomendación225. Hasta el momento no existen pautas claras para el rastreo de enfermedad coronaria antes de la EC en pacientes con enfermedad carotídea asintomática.
Finalmente, planteamos algunos interrogantes para los que no tenemos una respuesta definitiva: a) ¿es peligroso realizar una prueba de apremio a un paciente con enfermedad carotídea grave?; b) ¿y si ésta es bilateral?; c) dado que la EC debe realizarse lo antes posible en pacientes sintomáticos, ¿es aconsejable retrasar los tiempos quirúrgicos para el estudio de la circulación coronaria?, y d) si el paciente tuviera una enfermedad coronaria concomitante, ¿cuál sería la conducta a adoptar?
Abordaje terapéutico en pacientes con enfermedad carotídea y coronaria concomitantesLas tres complicaciones más graves de la CRM y la EC son el stroke, el infarto agudo de miocardio y la muerte. Por este motivo, y por la escasez de evidencia científica definitiva, durante años se ha discutido cuál es la mejor estrategia terapéutica para pacientes con enfermedad carotídea y coronaria concomitantes.
Antes de analizar la evidencia es necesario plantear los dos escenarios posibles: a) el paciente que debe ser sometido a una CRM, a quien se diagnostica una enfermedad carotídea ≥ 50% mediante la evaluación preoperatoria, y b) el paciente que debe someterse a una EC por una enfermedad carotídea sintomática, a quien se le diagnostica una enfermedad coronaria.
En lo referente al primer escenario, una reciente revisión sistemática cuyo objetivo fue comparar la CRM+MTM frente a CRM+MTM+EC, no encontró ningún estudio que pudiera ser seleccionado para realizar la revisión226. A pesar de la falta de evidencia, resulta interesante comentar un estudio realizado en 3.942 pacientes sometidos a cirugías cardiovasculares227. El 6% (239 de ellos) tenía enfermedad carotídea ≥ 50%. La frecuencia de stroke fue mayor en este grupo que en los que no tenían enfermedad carotídea ≥ 50% (7,5% frente a 1,5% respectivamente; p < 0,001). El dato más novedoso de este trabajo es que de los 18 strokes isquémicos que ocurrieron en pacientes con enfermedad carotídea ≥ 50%, sólo 4 (20%) se dieron en el territorio ipsilateral a la carótida enferma. El resto ocurrió en otros o múltiples territorios. Esto significa que los strokes ocurridos en pacientes sometidos a CRM son más frecuentes en pacientes con enfermedad carotídea, aunque el mecanismo no está relacionado directamente con ella. De hecho, el mecanismo más frecuente del stroke en estos pacientes es la embolia de material particulado proveniente de la aorta torácica en el momento del clampaje y desclampaje, así como de la bomba de circulación extracorpórea228. Este estudio contribuye a la incertidumbre sobre la necesidad de tratar la enfermedad carotídea en pacientes que deben someterse a una CRM.
Para el segundo escenario planteado en esta sección (el paciente que debe someterse a una EC por una enfermedad carotídea sintomática, a quien se le diagnostica una enfermedad coronaria) pueden esbozarse diversas estrategias: a) EC y luego CRM; b) CRM y luego EC; c) EC y CRM sincrónicas (con bomba); d) EC y CRM sincrónicas (sin bomba), y e) AC y luego CRM. Presentamos la evidencia disponible para cada uno de ellos en la tabla 10229–231.
Outcome de las distintas estrategias quirúrgicas según los metaanálisis
| AC y luego CRM | EC y CRM sincrónicas* | EC y CRM sincrónicas** | EC y luego CRM | CRM y luego EC | ||||||
| Riesgo %(IC 95%) | n | Riesgo %(IC 95%) | n | Riesgo %(IC 95%) | n | Riesgo %(IC 95%) | n | Riesgo %(IC 95%) | n | |
| Stroke ipsilateral | 3,3 (1,6-5,1) | 760 | ||||||||
| Cualquier stroke | 4,2 (2,4-6,1) | 760 | ||||||||
| Muerte | 5,5 (3,4-7,6) | 760 | 4,6 (4,1-5,1) | 6.230 | 1,5 (0,3-2,8) | 324 | 3,9 (1,1-6,7) | 917 | 2,0 (0,0-6,1) | 302 |
| IAM | 1,8 (0,5-3,0) | 760 | 3,6 | 6,5 | 0,9 | |||||
| Stroke ipsilateral o muerte | 7,2 (6,5-7,9) | 4.996 | 1,6 (0,4-2,8) | 318 | 4,8 (2,8-6,8) | 809 | 3,4 (0,0-9,8) | 87 | ||
| Stroke o muerte | 9,1 (6,1-12,0) | 760 | 8,2 (7,5-8,9) | 6.230 | 2,2 (0,7-3,7) | 318 | 6,1 (2,9-9,3) | 917 | 7,3 (1,7-12,9) | 302 |
| Stroke, IAM o muerte | 9,4 (7,0-11,8) | 760 | 11,4 (10,4-12,5) | 3.699 | 3,6 (1,6-5,5) | 309 | 10,2 (7,4-13,1) | 709 | 5,0 (0,0-10,6) | 221 |
IAM: infarto agudo de miocardio.
Los autores agradecen a la Dra. Patricia Riccio la lectura crítica y sus observaciones sobre esta revisión.