La neuromielitis óptica es una enfermedad desmielinizante que afecta principalmente el nervio óptico y la médula espinal; se caracteriza por brotes recurrentes y discapacidad severa. En la actualidad no existen estudios epidemiológicos publicados en Costa Rica acerca de esta enfermedad.
ObjetivoDescribir la epidemiología de la neuromielitis óptica en la Caja Costarricense de Seguro Social.
Pacientes y métodoSe revisaron los expedientes de pacientes con neuromielitis óptica que cumplieran los criterios publicados en 2006 durante el periodo de agosto de 2011 a diciembre de 2015 en los hospitales de la Caja Costarricense de Seguro Social que cuentan con neurólogo de adultos.
ResultadosEl número total de pacientes con diagnóstico de neuromielitis óptica fueron 40, con una incidencia acumulada por año de la enfermedad de 0,13 a 0,44 por 100.000 habitantes. El 62% de los pacientes fueron mujeres, con un ratio mujeres/hombres de 1,6:1. El número de pacientes seropositivos para acuaporina-4 (AQP-4) fueron 15; sin embargo, 17 pacientes no contaban con la realización de la prueba. La mayoría de los pacientes presentaba una neuromielitis óptica de tipo recurrente (97,5%) y algunos asociaban otras enfermedades concomitantes, tales como Sjögren, porfiria aguda intermitente, hipotiroidismo, púrpura trombocitopénica trombótica, lupus eritematoso sistémico y síndrome antifosfolípido.
ConclusionesLa incidencia de neuromielitis óptica en Costa Rica fue mayor de lo esperado, caracterizada por ser más frecuente en mujeres, de tipo recurrente y con una mediana de edad de 35,5años.
Neuromyelitis optica is a demyelinating disease that affects mainly optic nerve and spinal cord, presenting recurrent relapses and important disability. There are none studies published from Costa Rica.
ObjectiveDescribe the epidemiology of neuromyelitis optica in the Caja Costarricense de Seguro Social.
Patients and methodReview of medical records from patients that fulfilled 2006 neuromyelitis optica criteria, from August 2011 until December 2015 in the hospitals of the Caja Costarricense de Seguro Social.
ResultsThe total of patients with diagnosis of neuromyelitis optica were 40, with an accumulated incidence from 0.13 to 0.44 per 100,000 per year. 62% of the patients were women, with a ratio of 1.6:1. The total of patients with a positive antibody against AQP-4 were 15, however 17 patients did not have the test done. Most of the patients had recurrent type (97.5%) and some were associated with other diseases, such as Sjogren, porphyria, hypothyroidism, thrombotic thrombocytopenic purpura, systemic lupus erythematous and antiphospholipid syndrome.
ConclusionsPrevalence of neuromyelitis optica was greater than expected, being much more frequent in women, of recurrent type and with an average age of 35.5 years.
La neuromielitis óptica (NMO), o enfermedad de Devic, es un desorden inflamatorio desmielinizante del sistema nervioso central, con brotes severos que afectan principalmente el nervio óptico y la médula espinal1-4.
Posterior a su primera descripción era consideraba una enfermedad monofásica. Sin embargo, ahora se conoce que son comunes los ataques recurrentes de neuritis óptica y mielitis transversa en un 80-90% de los casos5-6.
En 1936, la NMO se describió como una variante de esclerosis múltiple e inclusive algunos la consideraron como encefalomielitis. Aunado a esto, el descubrimiento en 2004 de los anticuerpos aquaporina-4 (AQP-4) permitió realizar descripciones diferentes a la esclerosis múltiple tanto en su fisiopatología como en hallazgos de imágenes, histología y tratamiento7-9.
La NMO es una enfermedad poco frecuente, con una prevalencia aproximada de 1/100.000 habitantes en países del occidente, siendo más común en personas no caucásicas y con menor descendencia genética europea, tales como indios del oeste (40%), japoneses (20-30%), africanos caribeños, africanos americanos y asiáticos del este, incluyendo Hong Kong (36%), Singapur (48%) e India (10,23%)10,11.
Existen escasos estudios epidemiológicos que describan su incidencia y su prevalencia a nivel mundial. Algunos estudios poblacionales han reportado una prevalencia de 0,52 a 4,4 por 100.000 habitantes y una incidencia de 0,053 a 0,4 por 100.000 habitantes. Específicamente en Cuba se reportó una incidencia de 0,5 por 100.000 habitantes, 1 en México, 1,4-2,8 en Estados Unidos, 0,9 en Japón y 4,4 en Dinamarca12-20.
En Centroamérica se desconoce la prevalencia y la incidencia en la mayoría de los países, con un único estudio publicado en Panamá con 13 casos diagnosticados del año 2005 al 2012, una incidencia anual de 0,03 a 0,11 por 100.000 habitantes y una prevalencia de 0,03 a 0,29 casos por 100.00021.
Por lo tanto, el principal objetivo de este estudio fue la descripción de la epidemiología de la NMO en Costa Rica, iniciando con la gran población adscrita a la Caja Costarricense de Seguro Social (CCSS), que asegura el 85,5% de la población costarricense. Con dicho estudio, además, se analizaron las técnicas diagnósticas utilizadas, las características clínicas de los pacientes y el tiempo que demora el diagnóstico en realizarse.
De esta manera, se caracterizó la NMO en los hospitales públicos de Costa Rica y se valoró la necesidad de realizar mejoras diagnósticas en esta enfermedad, donde un diagnóstico temprano y su distinción, principalmente con la esclerosis múltiple, evitará un mayor grado de discapacidad en esta población, que tiende a ser de un grupo etario joven.
Pacientes y métodosSe realizó un estudio descriptivo y retrospectivo de los pacientes con diagnóstico de NMO en los servicios de adultos de neurología de la CCSS de agosto de 2011 a diciembre de 2015.
Al ser un estudio multicéntrico, se obtuvo la aprobación del protocolo de investigación por el Comité Ético Científico Institucional (CECI), con el número de protocolo R015-SABI00077.
A partir de esta gestión, se solicitó la lista de pacientes con el diagnóstico de NMO (G36.0), otras enfermedades desmielinizantes (G37.8) y enfermedad desmielinizante del sistema nervioso central, no especificada (G37.9), a cada centro de estadística de los hospitales de adultos de la CCSS que cuentan específicamente con neurólogo en su centro: Hospital San Juan de Dios, Hospital Calderón Guardia, Hospital México, Hospital Max Peralta, Hospital San Rafael de Alajuela, Hospital Escalante Pradilla, Hospital San Carlos y Hospital Monseñor Sanabria.
Se omitió la solicitud para revisar expedientes en el Hospital de Heredia y el Hospital de Limón, debido a que los neurólogos de dichos centros indicaron que en el Hospital de Heredia no había pacientes con diagnóstico de NMO y los pacientes del área de Limón con dicho diagnóstico seguían bajo control en el Hospital Calderón Guardia.
Se excluyó el Hospital Nacional de Niños, debido a que se incluyeron únicamente pacientes diagnosticados en hospitales de atención de población adulta (mayores de 13años según criterios de la institución) y no se incluyeron hospitales privados debido a que varios médicos neurólogos indicaron no tener pacientes con este diagnóstico fuera de la institución debido a lo poco frecuente de la enfermedad, el costo que implicaba para el paciente la atención de la misma y que la mayoría de la población costarricense se encontraba asegurada por la CCSS (85,5% de la población).
Además, los datos fueron solicitados solo en centros que cuentan con la atención de médicos neurólogos, debido a que la NMO es una enfermedad neurológica rara, diagnosticada por estos especialistas.
Asimismo, se decidió incluir los pacientes diagnosticados a partir de agosto de 2011, debido a que es el momento en que la CCSS cuenta con la disponibilidad de resonancia magnética en la institución.
Para la inclusión de pacientes se utilizaron los criterios diagnósticos publicados en 2006 por los investigadores de la Clínica Mayo22-27. Se trata de los pacientes con neuritis óptica y mielitis transversa asociados a dos de los siguientes criterios:
- •
Mielitis transversa extensa longitudinal (MTLE) que abarque 3 o más segmentos medulares.
- •
Resonancia magnética de cerebro que no cumple los criterios de esclerosis múltiple.
- •
Anticuerpos AQP-4 positivos.
En 2015 se describieron nuevos criterios de NMO. Sin embargo, se utilizaron los criterios de inclusión de 2006 debido a que fueron los que se aplicaron para el diagnóstico durante el periodo que comprende el estudio27,28.
Variables del estudioEn los pacientes seleccionados se evaluaron, como variables de estudio demográfico: edad del paciente al inicio de los síntomas, sexo, lugar de procedencia y hospital donde se realizó el diagnóstico. Las variables clínicas y de laboratorio fueron la duración del diagnóstico posterior al primer brote, la evaluación del Expanded Disability Status Scale (EDSS), los síntomas de la enfermedad, las enfermedades autoinmunes asociadas, el resultado de los anticuerpos de NMO, el resultado de las bandas oligoclonales, el resultado de los leucocitos y proteínas en el líquido cefalorraquídeo, el resultado de la resonancia magnética del sistema nervioso central, el resultado de la resonancia magnética medular y otros resultados de laboratorio: virus de la inmunodeficiencia humana (VIH), Venereal Disease Research Laboratory (VDRL), anticuerpos antinucleares (ANA), thyroid stimulating hormone (TSH), velocidad de eritrosedimentación (VES), vitamina B12, factor reumatoide, human T-lymphotropic virus type 1 (HTLV-1), anti-Ro/SS-A, anti-La/SS-B, anti-double stranded DNA (anti-dsDNA).
Se valoró el resultado de VIH, VDRL, vitamina B12 y HTLV-1 como parte del diagnóstico diferencial de la mielitis transversa y la neuritis óptica. El descarte de otras enfermedades permitió asegurar el diagnóstico de NMO, e inclusive parte de los nuevos criterios de NMO de 2015 es la exclusión de otras patologías asociadas que expliquen los síntomas presentados por los pacientes27,28
En cuanto al resto de los laboratorios, se evaluó la presencia de otras enfermedades asociadas tales como lupus eritematoso sistémico (LES) (anti-dsDNA, ANA), enfermedad tiroidea de etiología autoinmune (TSH), síndrome de Sjögren (anti-Ro/SS-A, anti-La/SS-B) y elevación de la velocidad de eritrosedimentación que pueda indicar alguna otra enfermedad autoinmune, si previamente se ha descartado infección como causa del aumento de la misma.
Las pruebas de laboratorio descritas fueron realizadas en la institución, a excepción de los anticuerpos AQP-4, que al momento del estudio debían ser comprados por el paciente o mediante trámite de compra en la institución. Por lo tanto, fueron realizados en diferentes centros de laboratorios privados mediante la técnica de enzyme-linked immnunosorbent assay (ELISA).
Análisis estadísticoSe realizó un análisis estadístico basado en técnicas de estadística descriptiva y utilizando el programa Microsoft Excel. Se determinó la incidencia de la enfermedad en la CCSS con su respectivo intervalo de confianza al 95%. Para el análisis de las variables cualitativas se utilizaron distribuciones de frecuencia absoluta y relativa, y para las variables cuantitativas se emplearon medidas de tendencia central y de dispersión.
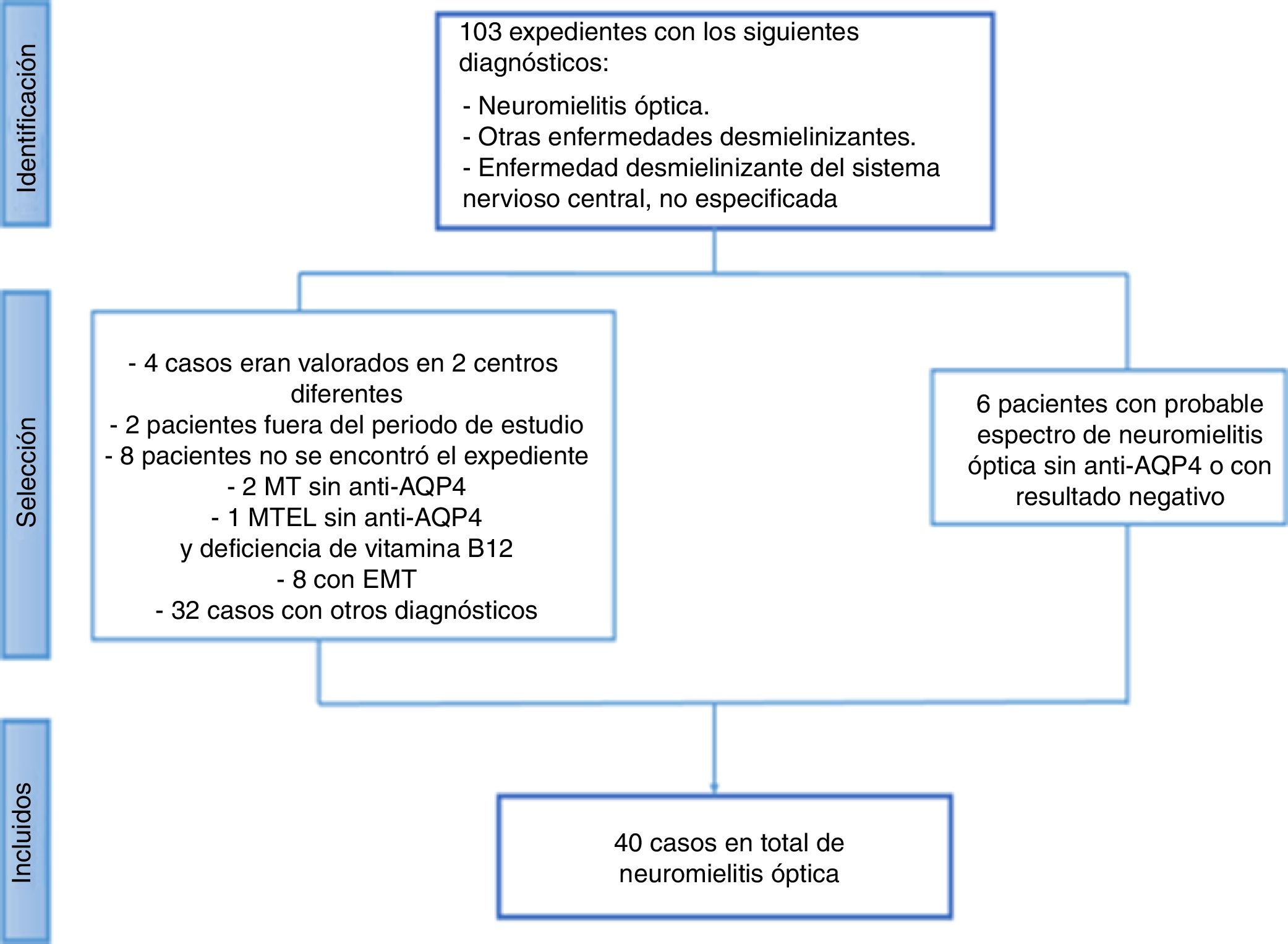
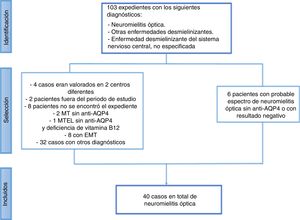
ResultadosSe revisaron un total de 103 casos y se excluyeron 63 (fig. 1). De estos, 6 pacientes podrían corresponder al diagnóstico de espectro de NMO, pero no se logró confirmar el diagnóstico por las siguientes características:
- •
Dos pacientes presentaban LES y MTLE sin neuritis óptica. Sin embargo, la etiología de la mielitis fue descrita como consecuencia del LES y no se solicitaron los anticuerpos AQP-4.
- •
Una paciente presentó neuritis óptica bilateral con lesiones desmielinizantes en cerebro y fue diagnosticada como esclerosis múltiple, sin solicitarse los anticuerpos AQP-4.
- •
Otra paciente presentó neuritis óptica bilateral con síntomas diencefálicos pero con anticuerpos AQP-4 negativos.
- •
Dos pacientes presentaron MTLE de etiología viral, sin solicitarse anticuerpos AQP-4 ni potenciales evocados visuales.
Revisión de los expedientes con diagnóstico de neuromielitis óptica de agosto de 2011 a diciembre de 2015 en la Caja Costarricense de Seguro Social.
Anti-AQP4: anticuerpos aquaporina 4; EMT: esclerosis mesial temporal; MT: mielitis transversa; MTEL: mielitis transversa extensa longitudinal.
El resto de los pacientes presentaban diagnóstico de crisis convulsivas, ictus, neuritis óptica, mielitis transversa u otras enfermedades desmielinizantes, como enfermedad desmielinizante multifocal aguda (ADEM) o esclerosis múltiple.
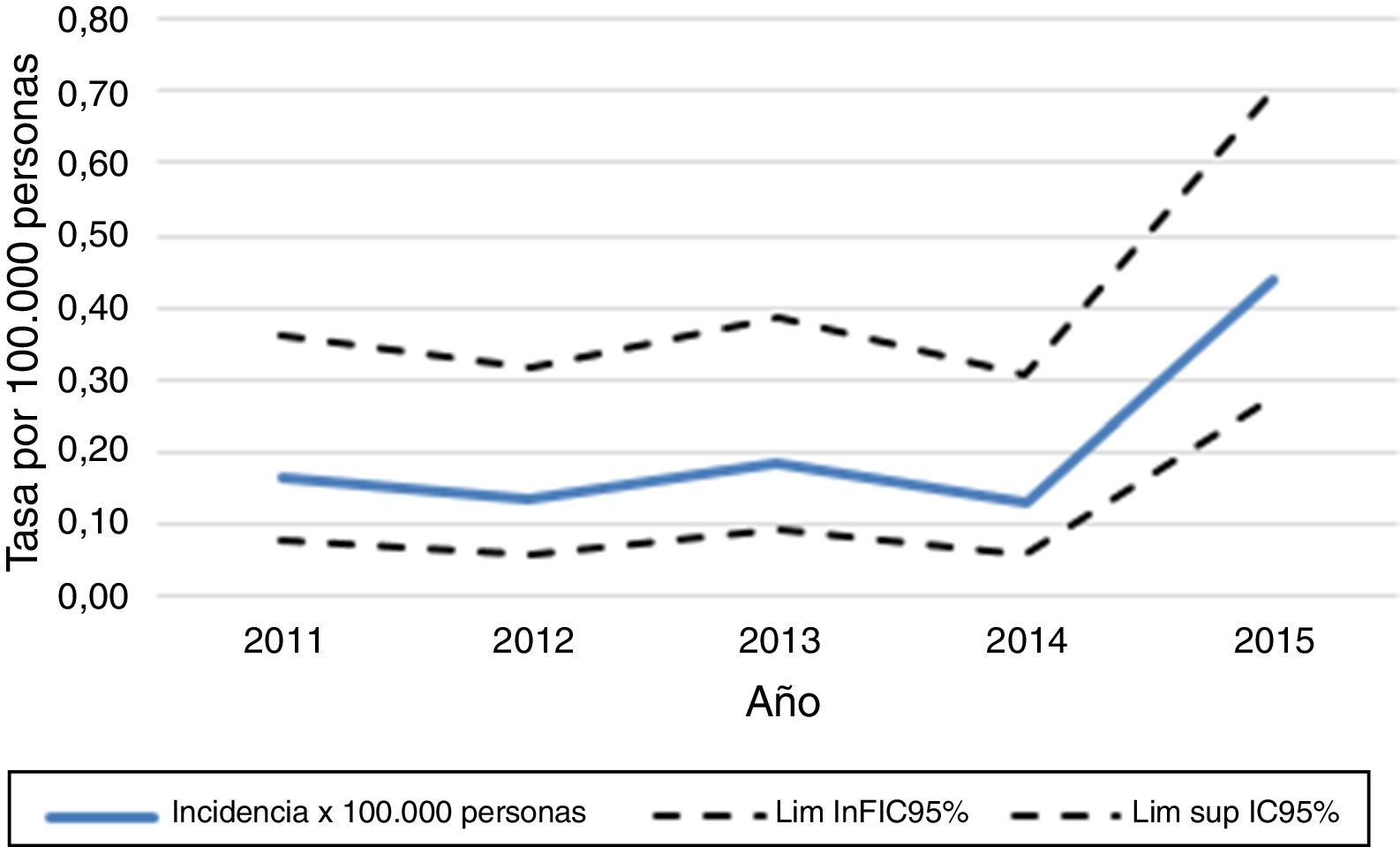
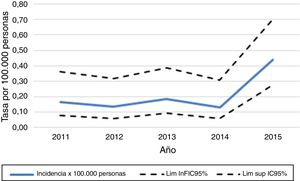
Posterior a esta exclusión, el número total de pacientes con diagnóstico de NMO en los servicios de Neurología de adultos de los hospitales de la CCSS, de agosto del 2011 a diciembre del 2015, fueron 40. La incidencia acumulada por año de la enfermedad fue de 0,13 a 0,44 por 100.000 habitantes (fig. 2).
De estos 40 pacientes, el 62% (25) de los pacientes fueron mujeres, con un ratio hombres/mujeres de 1:1,6. La mediana de edad fue de 35,5años (intervalo intercuantílico 25-49,5) y un rango de edad que abarcaba de los 16 a los 66años.
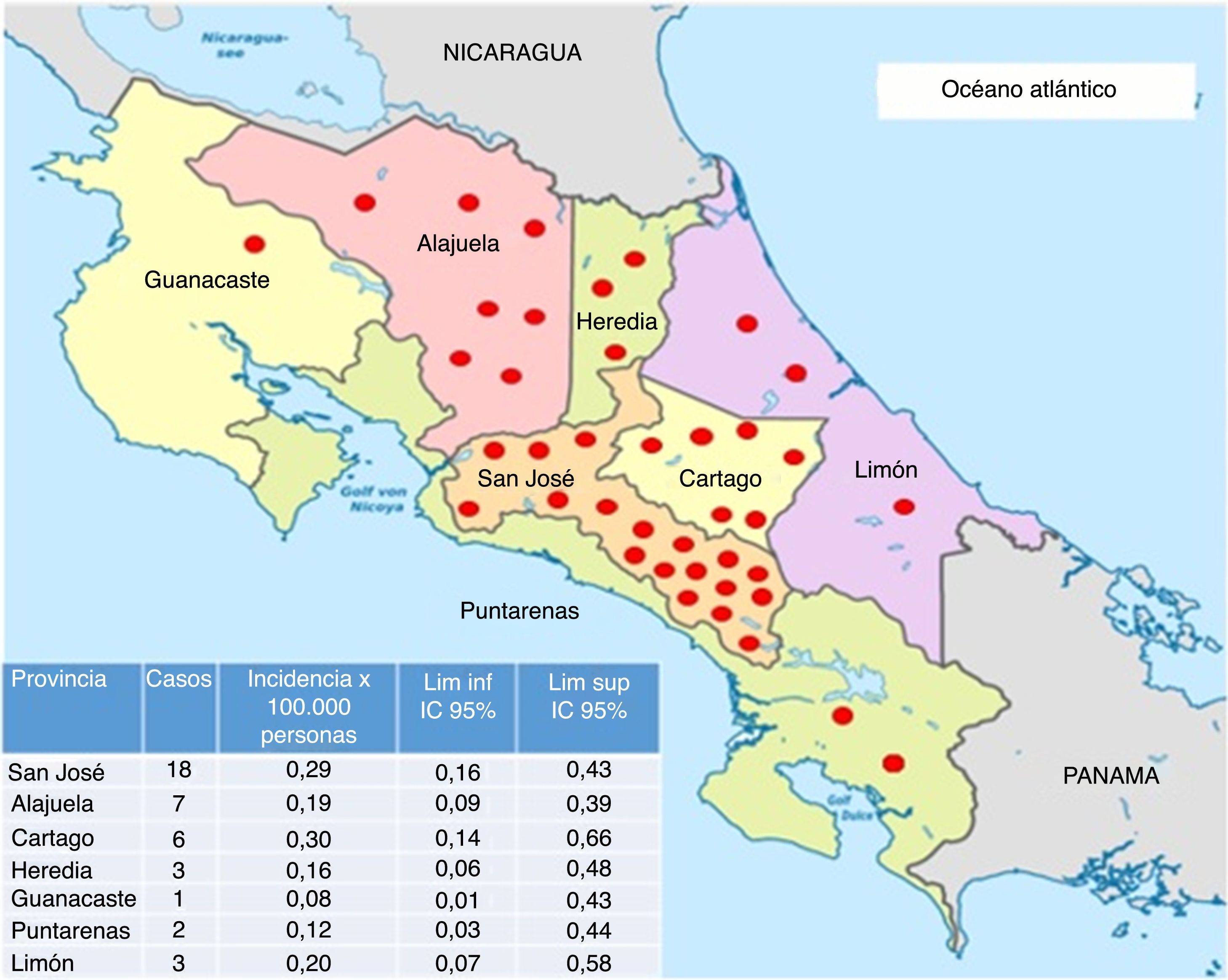
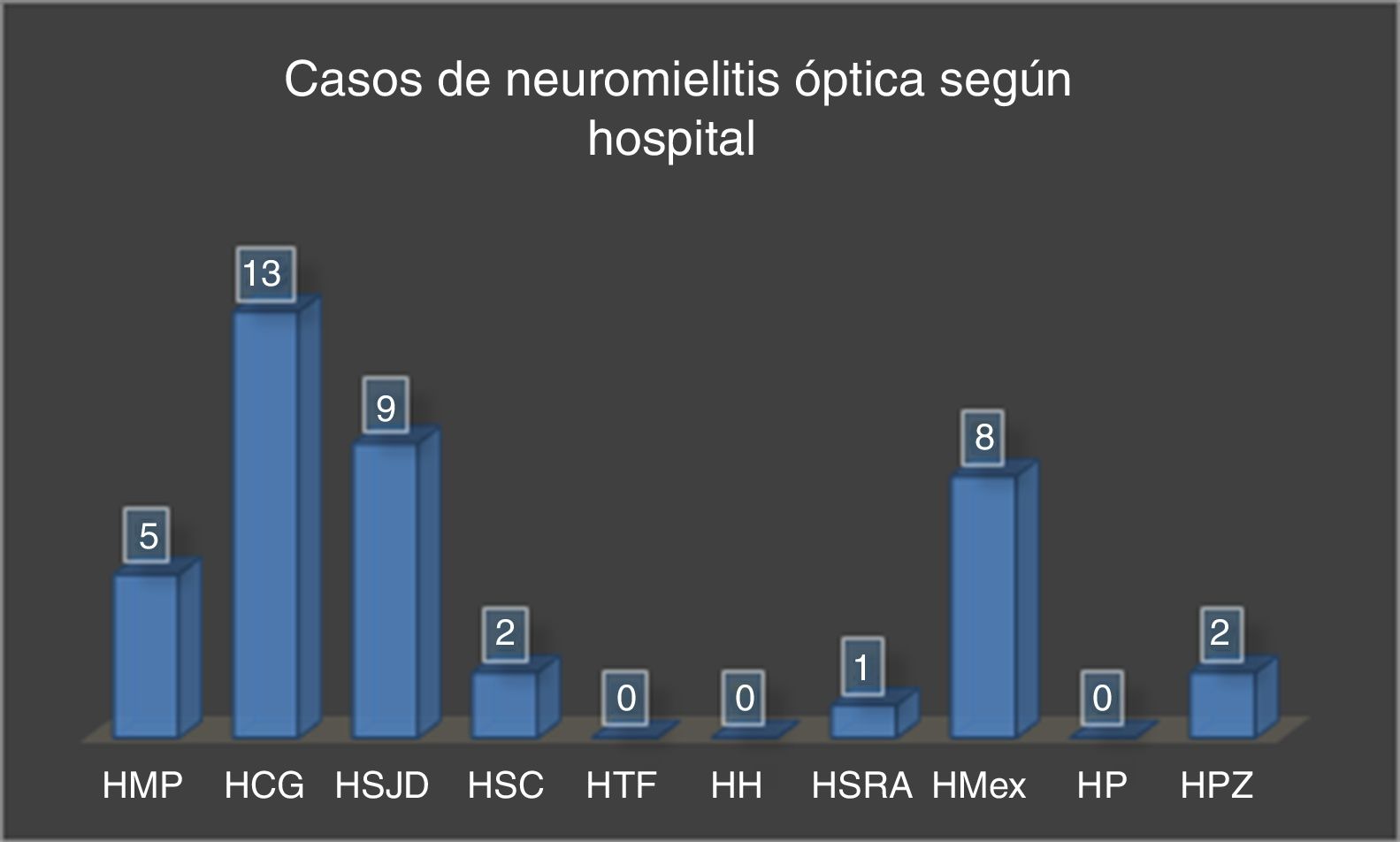
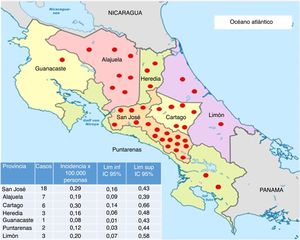
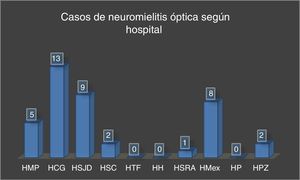
La mayoría de los pacientes del estudio residían en la provincia de San José (fig. 3) y fueron diagnosticados principalmente en el Hospital Calderón Guardia (13 casos). El detalle de la distribución de los casos según la provincia y hospital de diagnóstico se detallan en las figuras 3 y 4, respectivamente.
Mapa con la distribución de los casos de neuromielitis óptica en Costa Rica e incidencia acumulada por provincia, entre 2011 y 2015. Cada punto rojo coincide con un caso de neuromielitis óptica.
IC: intervalo de confianza; Lim inf: límite inferior; Lim sup: límite superior.
Mapa tomado de http://www.lahistoriaconmapas.com/atlas/mapas-paises/mapa-de-provincias-de-costa-rica-htm y modificado por la autora.
Casos de NMO de agosto de 2011 a diciembre de 2015 según hospital de diagnóstico.
HCG: Hospital Calderón Guardia; HH: Hospital de Heredia; HMex: Hospital México; HMP: Hospital Max Peralta; HP: Hospital de Puntarenas; HPZ: Hospital de Pérez Zeledón; HSC: Hospital de San Carlos; HSJD: Hospital San Juan de Dios; HSRA: Hospital San Rafael de Alajuela; HTF: Hospital Tony Facio.
El tiempo de evolución de la enfermedad presentó un promedio de 9,24años, con un rango que comprende desde los 3 meses hasta los 33años, mientras que el tiempo de diagnóstico posterior al primer brote presentó una mediana de 2años con un intervalo intercuantílico de 0,22 y 9,75, siendo un mes el menor tiempo de diagnóstico posterior al primer brote y el mayor tiempo de 39años posterior al primer brote.
A pesar de que la CCSS al momento del estudio no contaba con la realización de los Anticuerpos AQP-4, la mayoría de los pacientes tenía la prueba realizada, para un total de 23 pacientes. De estos, 15 pacientes fueron seropositivos y 8 pacientes fueron seronegativos.
En cuanto al primer síntoma de los pacientes, la mayoría tuvo una mielitis transversa (42,5%) y neuritis óptica unilateral (22,5%); solo en un caso se presentaron ambos síntomas de manera simultánea (tabla 1). En el 25% de los casos se presentó el vómito intratable como manifestación clínica; sin embargo, en la mayoría de los casos fue diagnosticada primeramente una gastritis aguda y no se consideró en dicho momento una lesión del área postrema hasta la presentación clínica del resto de los síntomas.
Características clínicas y radiológicas de los pacientes diagnosticados con NMO en la Caja Costarricense de Seguro Social de agosto de 2011 a diciembre de 2015
| Características | Datos, n (%) |
|---|---|
| Total pacientes | n=40 |
| MTL | 40 (100) |
| NO unilateral | 15 (37,5) |
| NO bilateral | 12 (30) |
| Vómito intratable | 10 (25) |
| Síntomas de tallo | 9 (22,5) |
| Dolor talámico | 2 (5) |
| Trastorno movimiento | 1 (2,5) |
| Evento inicial | |
| Mielitis transversa | 17 (42,5) |
| NO unilateral | 10 (22,5) |
| NO bilateral | 2 (5) |
| Mielitis transversa simultáneo NO | 1 (2,5) |
| Vómito intratable | 3 (7,5) |
| Hemiparesia | 2 (5) |
| Hemihipoestesia | 1 (2,5) |
| Monoparesia | 3 (7,5) |
| Espasmos tónicos | 2 (5) |
| RM medular | |
| Normal | 1 (2,5) |
| ML cervical | 12 (30) |
| ML dorsal | 17 (42,5) |
| ML lumbar | 0 (0) |
| Mielitis no longitudinal | 0 (0) |
| Más de 2 regionesa | 8 (20) |
| Ausencia de RM medular | 2 (5) |
| Realce con gadolinio | 0 (0) |
| RM cerebro | |
| Normal | 17 (42,5) |
| Lesiones supratentoriales | 16 (40) |
| Lesión ganglios basales | 0 |
| Lesión tallo | 12 (30) |
| Lesiones hipotalámicas | 1 (2,5) |
| Captación de gadolinio | 0 |
ML: mielitis longitudinal; MTL: mielitis transversa longitudinal; NMO: neuromielitis óptica; NO: neuritis óptica; RM: resonancia magnética.
Por otro lado, la mayoría de los pacientes presentó una NMO de tipo recurrente (97,5%) y solo un paciente fue catalogado como una enfermedad monofásica.
Algunos pacientes con NMO tenían otras enfermedades concomitantes, tales como Sjögren en un paciente, porfiria aguda intermitente en un paciente, hipotiroidismo en 3 pacientes, purpura trombocitopénica trombótica en un caso, y LES y síndrome antifosfolípido (SAF) en un mismo paciente.
En cuanto a los resultados de la resonancia magnética medular y de cerebro, se describen con detalle en la tabla 1.
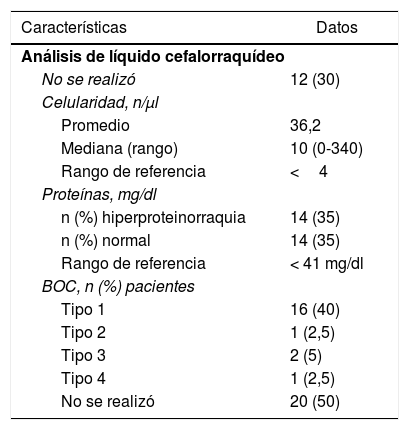
El líquido cefalorraquídeo presentó leucocitos en un rango normal en 12 casos (rango de referencia menor a 4 leucocitos/μl). Solo 5 pacientes presentaron leucocitos mayores a 50 leucocitos/μl, con un valor máximo de 340 leucocitos/μl (tabla 2). La característica de la celularidad fue de predominio linfocitario en la mayoría de los casos, algunos presentaron polimorfonucleares y ninguno asoció eosinófilos en el resultado.
Características del líquido cefalorraquídeo de los casos de neuromielitis óptica
| Características | Datos |
|---|---|
| Análisis de líquido cefalorraquídeo | |
| No se realizó | 12 (30) |
| Celularidad, n/μl | |
| Promedio | 36,2 |
| Mediana (rango) | 10 (0-340) |
| Rango de referencia | <4 |
| Proteínas, mg/dl | |
| n (%) hiperproteinorraquia | 14 (35) |
| n (%) normal | 14 (35) |
| Rango de referencia | < 41 mg/dl |
| BOC, n (%) pacientes | |
| Tipo 1 | 16 (40) |
| Tipo 2 | 1 (2,5) |
| Tipo 3 | 2 (5) |
| Tipo 4 | 1 (2,5) |
| No se realizó | 20 (50) |
BOC: bandas oligoclonales.
El resultado de las bandas oligoclonales (BOC) se describe en la tabla 2. Los pacientes con BOC tipo3 y4 no presentaron ninguna otra enfermedad autoinmune asociada.
Se revisaron algunos resultados séricos que permitieron descartar otros diagnósticos diferenciales y valorar enfermedades autoinmunes asociadas, los cuales se describen en la tabla 3.
Características de laboratorio de la neuromielitis óptica
| Características | Datos, n (%) |
|---|---|
| Medidas séricas | n=40 |
| VIH | |
| Positivo | 0 (0) |
| Negativo | 29 (72,5) |
| No se realizó | 11 (27,5) |
| VDRL | |
| Reactivo | 2 (5) |
| No reactivo | 32 (80) |
| No se realizó | 6 (15) |
| Velocidad eritrosedimentación (mm/h) | |
| Normal | 18 (45) |
| Aumentada | 12 (30) |
| No se realizó | 10 (25) |
| Vitamina B12(pg/ml) | |
| Normal | 19 (47,5) |
| Disminuida | 4 (10) |
| No se realizó | 17 (42,5) |
| Rango | ≥ 300 |
| Anticuerpo antinuclear | |
| Normal | 17 (42,5) |
| Aumentado | 5 (12,5) |
| No se realizó | 18 (45) |
| TSH (mIU/l) | |
| Normal | 13 (32,5) |
| Aumentado | 2 (5) |
| No se realizó | 25 (62,5) |
| Rango | 0,4-4 |
| HTLV-1 | |
| Normal | 13 (32,5) |
| Aumentado | 0 |
| No se realizó | 27 (67,5) |
| Factor reumatoide (U/ml) | |
| Normal | 10 (25) |
| Aumentado | 1 (2,5) |
| No se realizó | 28 (70) |
HTLV: virus linfotrópico humano; TSH: hormona estimulante del tiroides; VDRL: Veneral Disease Research Laboratory; VIH: virus de la inmunodeficiencia humana.
Durante el presente estudio se logró identificar 40 casos de NMO de agosto de 2011 a diciembre de 2015 en 8 centros de la CCSS, así como describir las características clínicas y epidemiológicas de estos pacientes.
La población de Costa Rica para el año 2015 tenía un estimado de 4.832.227 habitantes según datos del Instituto Nacional de Estadística y Censos (INEC), siendo la población en estudio (mayor de 13años) de 3.875.811. La distribución de los habitantes por provincia es la siguiente: San José, 1.592,521; Alajuela, 960.748; Cartago, 521.504; Heredia 490.426; Guanacaste, 365.542; Puntarenas, 467.963; Limón, 433.52329.
En cuanto a las características étnicas, la composición de la población es mixta. Posterior a la colonización, hubo una mezcla de habitantes indígenas con españoles. Aunado a esto, la migración de africanos por la compra de esclavos negros, principalmente en el área del Caribe, y la inmigración de chinos en 1850, contribuyó aún más con el mestizaje de Costa Rica30,31.
En 2013, Campos et al. evaluaron la composición genética ancestral en la población costarricense, con un resultado promedio mixto: 45,6% de ancestro europeo, 33,5% nativo americano, 11,7% africano y 9,2% chino. Sin embargo, esto varía según la región de Costa Rica, con una mayor contribución africana en la Región Caribe del país (provincia de Limón)30,31.
La incidencia de la enfermedad durante este estudio fue de 0,13 a 0,44 por 100.000 habitantes, mayor a lo descrito en Cuba, Dinamarca, Reino Unido y Panamá12,13,16,32-34. Inclusive en Panamá fueron descritos 13 casos en 7años, mientras que en Costa Rica, con un número de habitantes similar, se presentaron 40 casos en 4,5años21.
Sin embargo, los casos registrados se encuentran en el rango reportado promedio del estudio de la revista Sclerosis Multiple Journal (incidencia: 0,05-0,4)19.
La cantidad de casos encontrados durante este estudio es menor al total de pacientes con NMO en el país porque no se incluyeron los pacientes pediátricos ni los hospitales privados, ya que no todos los pacientes se encuentran asegurados por la CCSS: solamente un 85,5% de la población costarricense. Además, probablemente exista un subdiagnóstico por la ausencia de la realización de anticuerpos AQP-4 en la institución durante el estudio, ya que los pacientes debían asumir el costo o el médico tratante solicitar un trámite de compra que implica un tiempo largo de respuesta y no siempre resultaba en su aprobación. Inclusive no se lograron identificar espectros de NMO por la ausencia de dichos anticuerpos y se presentó un aumento del diagnóstico durante 2015 por una mayor facilidad en realizar la prueba en la institución.
Por otro lado, debido al mecanismo de registro de estadística de los hospitales, algunos pacientes con NMO pueden estar registrados bajo otro diagnóstico y no ser captados en este estudio. Para disminuir el sesgo anterior se solicitaron no solo los pacientes diagnosticados con NMO sino con otras enfermedades desmielinizantes, e inclusive varios casos fueron captados bajo este otro diagnóstico.
Por lo descrito anteriormente, es probable que la cantidad de casos sea mayor a lo encontrado en este estudio.
En cuanto a la distribución por sexo, la mayoría fueron mujeres, como lo reportado en la literatura35-39. Sin embargo, está descrito un ratio de mujeres:hombres de 3:1 hasta 9:11,37-39, mientras que en Costa Rica se presentó un ratio muy similar entre mujeres y hombres, de 1,6:1.
La mediana de edad fue de 35,5años (intervalo intercuartílico: 25-49,5), lo cual coincide con la literatura1,2,38,39; inclusive la mayoría de los pacientes se encontraban en un rango entre los 25 y los 49años durante el primer brote.
Por otro lado, la mayoría de los pacientes residen en el área central, lo cual podría deberse a la mayor cantidad de habitantes en esta región y al subdiagnóstico en áreas lejanas, donde se dificulta la realización de estudios de imágenes, la disponibilidad de especialistas en neurología y los laboratorios que cuenten con la prueba de NMO-IgG.
En la provincia de Limón se detectaron pocos casos, a pesar de predominar una población con mayor descendencia africana30,31, en la cual se ha descrito una frecuencia más alta de la enfermedad. Se desconoce la causa de dicho fenómeno.
El tiempo de diagnóstico posterior al primer brote presentó una mediana de 2años, con un tiempo de hasta 39años en un paciente posterior al primer brote. La mayoría de estos pacientes presentaban un diagnóstico de esclerosis múltiple previamente y el diagnóstico fue revalorado posteriormente al cumplir con los criterios diagnósticos de la NMO. Si bien es necesario disminuir el tiempo de diagnóstico posterior al primer brote, con el fin de administrar un tratamiento temprano y evitar las recaídas, se debe considerar que algunos pacientes asociaron estos brotes cuando no se habían descrito los criterios diagnósticos de 2006 y era considerada una variante de esclerosis múltiple.
En cuanto a los anticuerpos AQP-4, la mayoría de los pacientes a los cuales se les realizó la prueba fueron seropositivos (15pacientes), para un total de 65% de los casos a los cuales se les valoró la prueba, cantidad que coincide con lo descrito en la literatura8,40-43.
Sin embargo, en 17 pacientes no se logró realizar la prueba, y el diagnóstico no se pudo establecer hasta la manifestación clínica de otro brote. Inclusive existen varios casos con una única manifestación clínica, en espera de la realización de la prueba para descartar o realizar el diagnóstico. Es decir, hasta la presentación clínica de otros síntomas discapacitantes se puede diagnosticar el paciente e iniciar el tratamiento, mientras que con la prueba de anti-AQP4 podrían prevenirse brotes que generan gran discapacidad.
Además, por los trámites institucionales, la prueba de anti-AQP4 se realiza generalmente de manera tardía posterior al brote, lo que implica una mayor cantidad de pacientes seronegativos. Esto ha provocado una disminución de la sensibilidad de la prueba, debido al tratamiento con esteroides e inmunosupresores que reducen la cantidad de anticuerpos séricos.
Por lo tanto, es imprescindible contar con la realización de la prueba de manera rápida en aquellos casos donde la sospecha es alta y se requiera la prueba para asegurar el diagnóstico, tales como neuritis óptica recurrente, neuritis óptica bilateral, mielitis longitudinal extensa, síndrome del área postrema, narcolepsia con una lesión hiperintensa hipotalámica en resonancia, o pacientes con esclerosis múltiple que no han mejorado con el tratamiento y presentan alguno de estos síntomas.
De esta manera, se podrá ofrecer a los pacientes, de una manera más pronta, el tratamiento inmunosupresor y evitar un mayor grado de discapacidad en personas jóvenes.
Con respecto a las características clínicas, a pesar de que los principales síntomas fueron la neuritis óptica y la mielitis transversa, como era esperable en esta patología1-3,44,45, una importante cantidad de pacientes (25%) asociaron vómito intratable y en la mayoría de los casos fue diagnosticada una gastritis aguda sin considerar la NMO como un diagnóstico diferencial.
La mielitis transversa fue la primera manifestación clínica, como lo reportado, hasta en un 43% de los casos. Sin embargo, la neuritis óptica fue el primer síntoma en solo el 22,5% de los casos, mientras que está descrito hasta en un 41% en las publicaciones3,46. El vómito intratable fue el siguiente síntoma en frecuencia, manifestándose hasta en un 7,5% de los casos. El resto de los pacientes presentaron síntomas sugerentes de esclerosis múltiple, tales como monoparesia y hemiparesia, planteándose el diagnostico hasta la evolución de la enfermedad.
Solo 7 pacientes asociaron otras enfermedades, siendo más frecuente el hipotiroidismo en 3 casos; sin embargo, no se realizaron anticuerpos antitiroideos para valorar etiología autoinmune asociada en estos pacientes. Entre las enfermedades más frecuentemente asociadas, solo un paciente asoció síndrome de Sjögren, y otro, LES y SAF. No obstante, fue mayor la cantidad de pacientes con anticuerpos ANA positivos (5 casos) sin clínica de LES asociada, lo cual se ha publicado previamente en la literatura y cuya etiología es desconocida12,42,47,48. Se ignora la asociación de estas enfermedades en el resto de la población estudiada, debido a que dichos estudios no fueron solicitados.
En cuanto a la resonancia magnética medular, los resultados coinciden con lo publicado, con una mayor frecuencia a nivel de las regiones cervical y dorsal, y ningún caso lumbar. Todos las que mostraron alteraciones coincidían con una mielitis longitudinal extensa, como lo descrito en esta enfermedad1-3,25,49,50.
De igual manera, la resonancia magnética de cerebro coincide con la literatura1,27,49,50, en donde la mayoría no presentaba alteraciones. Sin embargo, las lesiones supratentoriales anotadas variaron desde hallazgos inespecíficos hasta lesiones sugerentes de esclerosis múltiple, por lo que este no debe ser un criterio para descartar una NMO si existen otros datos clínicos que lo sugieran.
Por otro lado, a pesar de la descripción de leucocitosis mayor a 50 en los pacientes con NMO1-3,34-37, solo 5 pacientes mostraron estos hallazgos y ninguno presentó eosinófilos reportados en líquido cefalorraquídeo. Inclusive, la mediana fue de 10leucocitos/μl, y en una gran cantidad de pacientes a los cuales se les realizó el líquido (12 casos) fue normal.
Las bandas oligoclonales realizadas fueron de predominio tipo1, como se describe en la literatura35-39,45, y solo un paciente presentó BOC tipo2, lo cual es más frecuente en esclerosis múltiple. Los pacientes con BOC tipo3 y4 no asociaban ninguna otra enfermedad sistémica, por lo que debe considerarse una vigilancia estrecha ante la presencia de otra manifestación clínica que sugiera una enfermedad aparte de la NMO.
En conclusión, este estudio es el primero en determinar la incidencia y la caracterización de la NMO en Costa Rica, con hallazgos clínicos e imagenológicos similares a otras poblaciones.
Conflicto de interesesNo existen conflictos de intereses.