El infarto isquémico secundario a anomalía del desarrollo venoso es infrecuente y su fisiopatología no se conoce con certeza.
Caso clínicoPresentamos el caso de un paciente con antecedente de adenocarcinoma de próstata, quien durante el posoperatorio mediato presentó cefalea intensa y crisis generalizadas tónico-clónicas. El resultado de la tomografía de cerebro inicial fue interpretado como metástasis. La resonancia magnética y la tomografía computarizada evidenciaron una anomalía del desarrollo venoso e isquemia periférica a la malformación.
ConclusiónEs importante evitar el sesgo diagnóstico de los hallazgos en las neuroimágenes de pacientes oncológicos y, así, plantear los diagnósticos diferenciales, incluso los infrecuentes.
Ischemic infarction secondary to developmental venous anomaly is uncommon, and its pathophysiology is not known with certainty.
Case reportWe describe a patient with a history of prostate adenocarcinoma, who presented severe headache and seizures on the 5th postoperative day. The result of the initial brain scan was interpreted as metastasis. Subsequently, magnetic resonance imaging and computed tomography evidenced a developmental venous anomaly with an extensive peripheral ischemic infarction to the venous angioma.
ConclusionIt is important to avoid the diagnostic bias of the findings in the neuroimaging of oncological patients and thus raise the differential diagnoses, even infrequent ones.
Las anomalías del desarrollo venoso (ADV) están entre las malformaciones vasculares intracraneales más frecuentes, con una incidencia aproximada del 3%1. Comúnmente estas malformaciones son silentes, pero a veces pueden presentarse con crisis epilépticas o hemorragia2. Las isquemias secundarias a ADV son infrecuentes3,4. Presentamos un paciente oncológico con un infarto isquémico secundario a ADV.
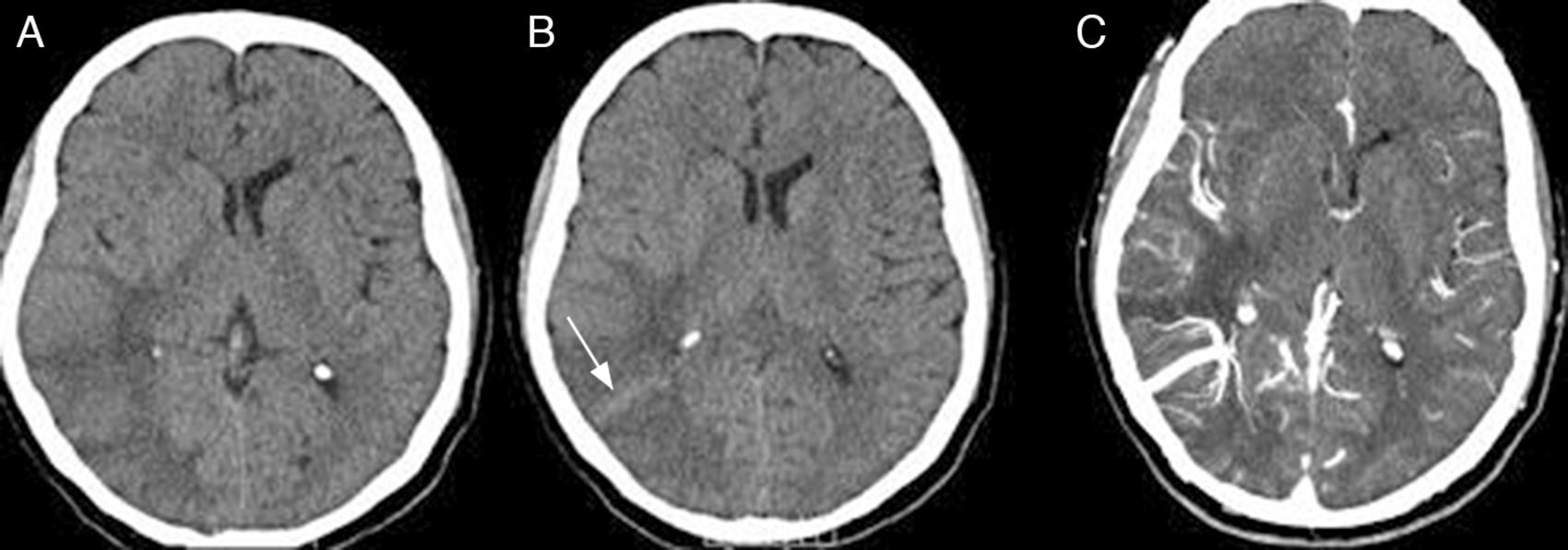
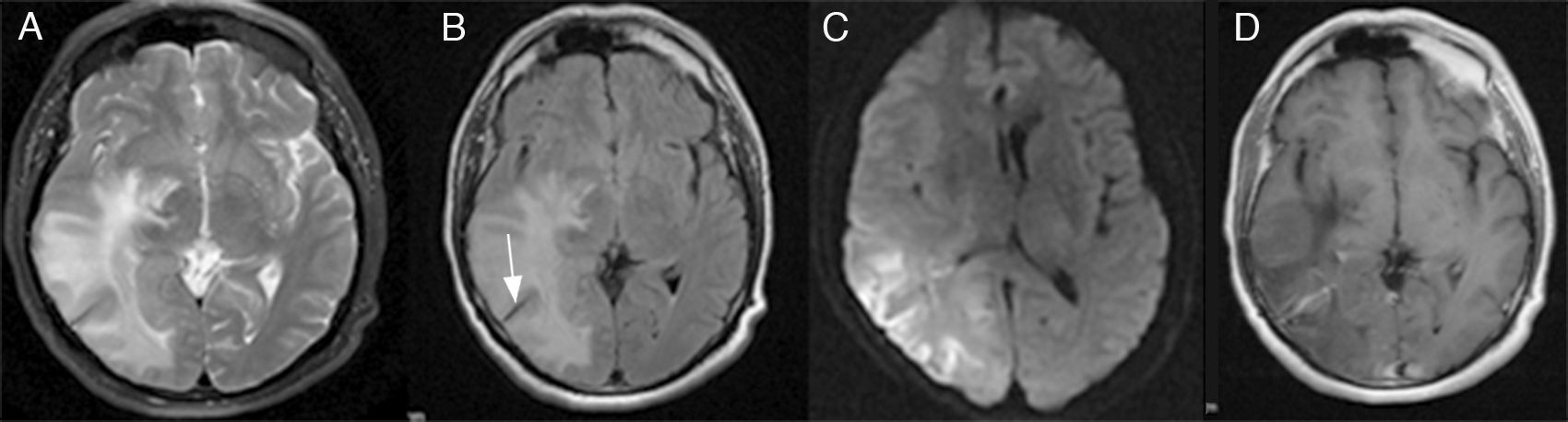
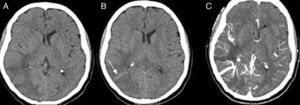
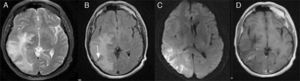
Caso clínicoVarón de 61 años, con antecedentes de adenocarcinoma de próstata y extabaquista, que en el 5.° día posquirúrgico de prostatectomía radical suprapúbica transvesical abierta presentó bruscamente cefalea opresiva frontoparietal derecha con extensión periorbitaria asociada a vómitos. Consultó en la guardia de nuestro instituto, donde se efectuó una tomografía computada (TC) de cerebro que mostró en los cortes sin contraste intravenoso una hipodensidad corticosubcortical parietotemporooccipital derecha, con discreto efecto de masa sobre la encrucijada y el asta posterior del ventrículo lateral derecho, y una imagen lineal corticosubcortical isodensa con respecto al parénquima cerebral (fig. 1A-B). En los cortes con contraste intravenoso, se evidenció la presencia de estructuras vasculares prominentes y confluentes en topografía de la sustancia blanca profunda temporooccipital derecha, hallazgo sugestivo de angioma venoso (fig. 1C). La lesión fue considerada como un evento isquémico en evolución. El paciente fue trasladado a un centro con Unidad de Ataque Cerebral. En dicho centro se solicitó resonancia magnética (RM) de cerebro, donde se reinterpretaron las imágenes —por el antecedente oncológico del paciente— como metástasis. Egresó con contrarreferencia para continuar con el tratamiento neurooncológico de la lesión cerebral. En el 10.° día posoperatorio presentó 3 crisis generalizadas tónico-clónicas. Inició tratamiento con 500mg de levetiracetam c/12h. El examen físico objetivó hemianopsia homónima izquierda y una paresia braquial izquierda 4/5 con Hoffman positivo. La RM de cerebro en cuestión (fig. 2 A-D) mostró una hiperintensidad en T2 y FLAIR en la misma región, con restricción de la señal en DWI, y un realce vascular tras la administración de gadolinio extendido desde la profundidad del lóbulo parietal hasta la corteza temporal derecha compatible con ADV.
A-B) TC cerebral s/c; hipodensidad corticosubcortical parietotemporooccipital derecha con moderado efecto de masa (borramiento de surcos e incipiente desplazamiento de la línea media). Nótese la isodensidad lineal (flecha). C) TC cerebral c/c; estructuras vasculares confluentes que conforman la característica «cabeza de medusa» en topografía de sustancia blanca temporoparietal derecha.
RM de cerebro. A-B) T2 y FLAIR; hiperintensidad temporooccipital con extensión a ganglios de la base e ínsula posterior; hipointensidad lineal correspondiente a vacío de flujo de la vena colectora de la ADV (flecha). C) Difusión/DWI; restricción de la señal. D) RM con Gd; realce vascular lineal con la característica «cabeza de medusa» que se extiende desde la profundidad del lóbulo parietal hacia la corteza temporal derecha.
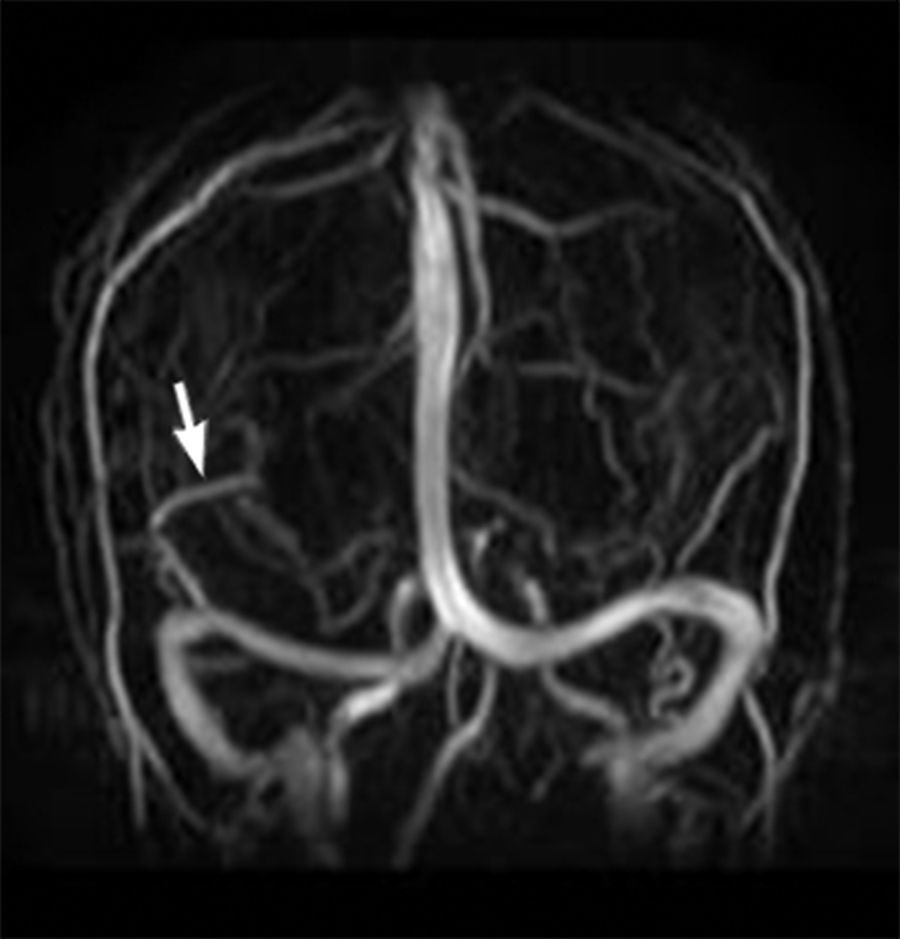
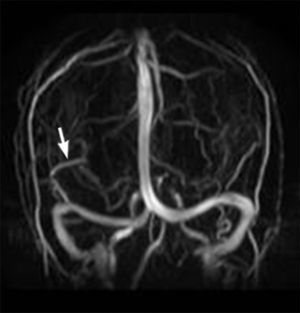
La angio-RM mostró mayor señal de flujo en los ramos distales de tercer orden dependientes de la arteria cerebral media derecha, comparada con su contralateral, y la ADV con drenaje en seno lateral derecho (fig. 3).
El perfil protrombótico fue negativo. Se instauró prevención secundaria con ácido acetil salicílico (100mg/día).
Tuvo mejoría sintomática progresiva en las siguientes 4 semanas. El Karnofsky fue de 90/100; la hemianopsia homónima izquierda permaneció sin cambios. El paciente presentó una nueva crisis generalizada tónico-clónica muy breve coincidiendo con infección urinaria baja, que fue tratada. Desde entonces continúa asintomático de su epilepsia secundaria.
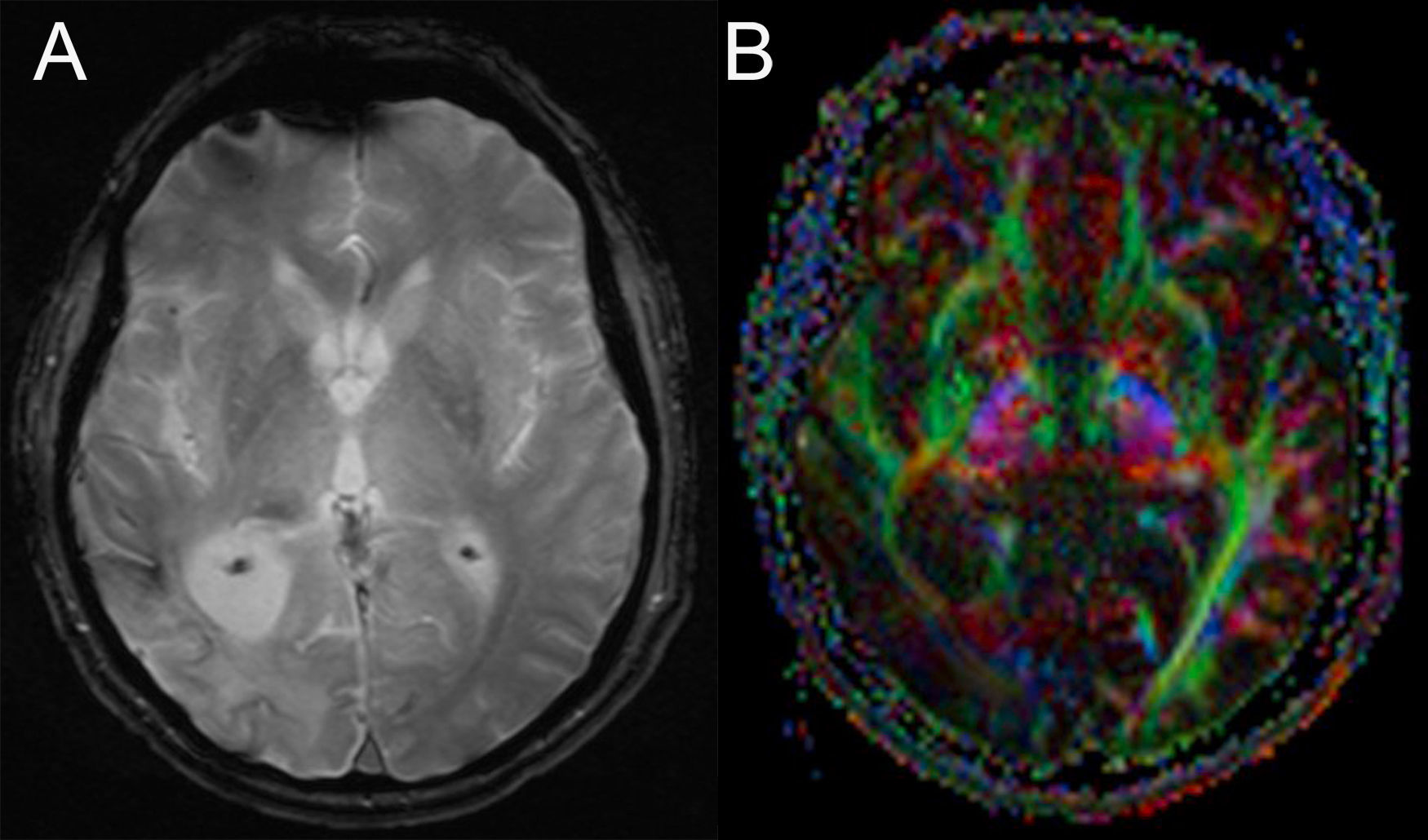
La RM de control mostró secuela de infarto, con mínimos restos de hemosiderina, parietooccipital derecho (consultar imágenes complementarias y campimetría en la web).
DiscusiónEn 1887, Pfannenstiel describió la enfermedad de las malformaciones venosas, pero en 1928 Cushing y Bailey las reconocieron como entidades patológicas distintas. Sin embargo, fue McCormick quien realizó la descripción clásica en 19665. Veinte años después, Lasjaunias y su equipo acuñaron la denominación ADV6.
Las ADV o angiomas venosos están compuestos por conglomerados de venas varicosas, separadas unas de otras por tejido cerebral habitualmente normal. Desde un punto de vista histológico, las ADV se componen de vasos de paredes delgadas con drenaje en una vena de mayor calibre. Presentan marcada ausencia de la capa muscular lisa y de la lámina elástica7. La angiografía por sustracción digital revela un racimo de pequeñas venas que convergen en «cabeza de medusa», desde donde drena la sangre a través de una gran vena central, de forma periférica dentro de las leptomeninges o de forma central a un seno venoso8,9.
Las ADV corresponden aproximadamente al 60% de todas las malformaciones vasculares cerebrales reportadas en estudios radiológicos. Son las malformaciones vasculares incidentales más comunes en estudios por neuroimágenes10–12. Pueden estar asociadas a otras malformaciones vasculares, sobre todo los cavernomas13,14.
Los síntomas que presentó el paciente como complicación de la ADV son similares a los ya descriptos en la literatura: cefalea, epilepsia y déficit neurológico8,14.
El infarto secundario a trombosis del ADV es poco frecuente y su fisiopatología no se conoce con certeza3,4,15. Aunque la mayoría de estas lesiones son benignas y asintomáticas, pueden incurrir en déficits relacionados con el aumento del shunt arteriovenoso o congestión venosa, entre otras15. Se postulan diferentes mecanismos que generan un desequilibrio en el flujo sanguíneo de la ADV, con el consecuente aumento de la presión intra-ADV. Esto se produciría debido a un incremento de la afluencia del flujo por la existencia de micro-shunts cuando coexiste con la presencia de una malformación arteriovenosa, o un decremento del flujo de salida por una trombosis de la vena colectora o estenosis en algún punto del drenaje de esta13,14. En el caso aquí presentado, el infarto isquémico podría haber sido ocasionado por una alteración en la dinámica de flujo vascular, ya que no se objetivó la presencia de trombosis, sin que pueda descartarse una estenosis recanalizada de la vena colectora de la ADV.
Si bien en este caso el perfil protrombótico fue negativo, sí presentaba factores de riesgo protrombóticos, a saber: enfermedad oncológica, antecedente quirúrgico y tabaquismo.
ConclusiónEn este paciente la causa de infarto isquémico sería multifactorial y habría ocasionado una alteración en la dinámica de flujo de la ADV.
Asimismo, es importante no sesgar los hallazgos en las neuroimágenes de los pacientes oncológicos y, así, plantear los diagnósticos diferenciales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNinguno.
Al Dr. Julio Fernández Mendy por su generosa colaboración en la realización de la campimetría computarizada. A los Sres. Agustina Casas y Juan Olivera, por la edición de las imágenes.