¿Cuál sería la conducta de un neurólogo si recibe en su consultorio a un paciente que refiere sentir que el tiempo pasa demasiado rápido? Como toda patología, debemos indagar en el tema y evaluar la bibliografía. Conocer si esto es posible y a qué podría deberse solo puede ser posible gracias a los aportes de la evidencia médica constatada por otros autores con la misma problemática. El siguiente artículo realiza una revisión de conceptos vinculados a cronometría en neurología desde una perspectiva clínica con la finalidad de ser útil en la demanda diaria. También introducirnos a un campo, quizás, poco explorado en la clínica neurológica.
What would be the medical act of a neurologist if receives a patient that feels that time passes too quickly? To know if this is possible we must inquire into the topic and evaluate the literature. The following article makes a revision of time perception from a clinical perspective in order to be useful in daily neurological demand. Also introduce us to a field, perhaps, little explored in the neurological clinic.
En la evaluación neurológica se dirige el interrogatorio y el examen para interpretar conceptos anatómicos, topográficos, cognitivos y conductuales donde tenemos información sobre si el paciente está orientado en persona, lugar, espacio y tiempo; también por su modo de hablar y la rapidez de sus respuestas interpretamos especulativamente que su pensamiento es normal o no. En esta instancia, sin direccionar la entrevista, un neurólogo general habitualmente evalúa la percepción del tiempo en forma implícita.
Es limitada la literatura en donde se reporte distorsión de la percepción del tiempo como motivo de una consulta médica, en donde se desarrolle el caso clínico y la etiología que le dio origen. Esta situación puede ser debida a patologías neurológicas o psiquiátricas con pronósticos y conductas desiguales difícilmente discernibles sin conocimiento detallado de las estructuras o sistemas implicados en medición temporal1-3.
Ante un motivo de consulta tan infrecuente como alteraciones sensoperceptivas del tiempo, las dificultades diagnósticas abundan y podrían reducirse al conocer las estructuras implicadas, como así también las interconexiones y neurotransmisores; de esta forma, podríamos hipotetizar a qué se debe y en dónde estaría la lesión
El objetivo del presente trabajo es revisar la bibliografía para poner de manifiesto el vínculo entre neurología y percepción de tiempo en el marco con la intención de mejorar la atención médica.
MétodoSe consultaron las bases de datos PubMed-NCBI y Lilacs utilizando las palabras «percepción de tiempo», «relojes biológicos» y «cronometría» en inglés y castellano, encontrándose artículos desde el año 1983 hasta 2014.
DesarrolloDefinicionesAl introducirnos en conceptos teóricos, el tiempo objetivo, está definido por la física. Según la astronomía, el día solar dura en promedio 24 h 3 min y 56,55 s; un segundo se define como la duración de 9.192.631.770 oscilaciones de un átomo de cesio 1334.
El tiempo se vincula con el cuerpo humano de 2 formas distintas interrelacionadas entre sí, la cronometría y la cronobiología5. Esta última estudia los aspectos oscilatorios de la función biológica que requieren de periodicidad. El ritmo circadiano («circa»’, cerca de 24 h) del hombre dura aproximadamente 25 h6.
La cronometría mide en forma indirecta o directa segmentos de tiempo que incluyen el cronometraje automático y el controlado. El primero participa en la realización de movimientos complejos, como hablar, conducir o realizar algún deporten mientras que el segundo cuantifica segmentos de tiempos, por ejemplo, el tiempo transcurrido mientras se espera para ser atendido en un consultorio médico. Esa estimación temporal representa el tiempo subjetivo o psicológico7. Diaz lo explica como experiencias en una vivencia consciente, durante una sucesión de estados mentales, cuando calcula lapsos para actuar, recuerda eventos pasados que fija cronológicamente o planea sus actos en referencia prospectiva a un futuro probable4. Coull et al. dividen el tiempo subjetivo en tiempo explícito, cuando se trata de medir segmentos de tiempo, tal es el ejemplo mostrado anteriormente, y por otra parte describen el tiempo implícito, cuando se necesita hacer una predicción temporal sin ser el objetivo primario la medición, por ejemplo, al estar parado en la calle esperando para cruzarla, viene un auto que transita su carril a una determinada velocidad, me dará tiempo de cruzar o no8.
Teorías de los relojes biológicosDesde fines del siglo xix el tiempo comenzó a ser motivo de debate y discusión entre los filósofos, físicos y psicólogos9. Uno de los principales adelantos de la época fue la ley de Weber, también conocida como Weber-Frechner, en donde se relaciona la magnitud objetiva de un estímulo físico y la percepción cognitiva de dicho estímulo10. Ernst Heinrich Weber, psicólogo y anatomista alemán, fue el fundador de la psicofísica10. Aproximadamente en el año 1870 se empiezan a realizar experiencias relacionando un estímulo y una respuesta motora refleja, definiendo así los denominados tiempos de reacción4. Williams James François, en el año 1927, incorpora el concepto de medición de intervalos de tiempos y lo hizo en pacientes febriles10,11. Fue secundado por Hoagland, un psicólogo americano que en el año 1933 realizó observaciones al ver que su mujer supraestimaba el paso del tiempo en un contexto febril10,12. Esto hizo que considerase que el tiempo es medido por un reloj interno que puede ser influenciado, por ejemplo, al aumentar la temperatura corporal, y lo denominó «reloj químico»12.
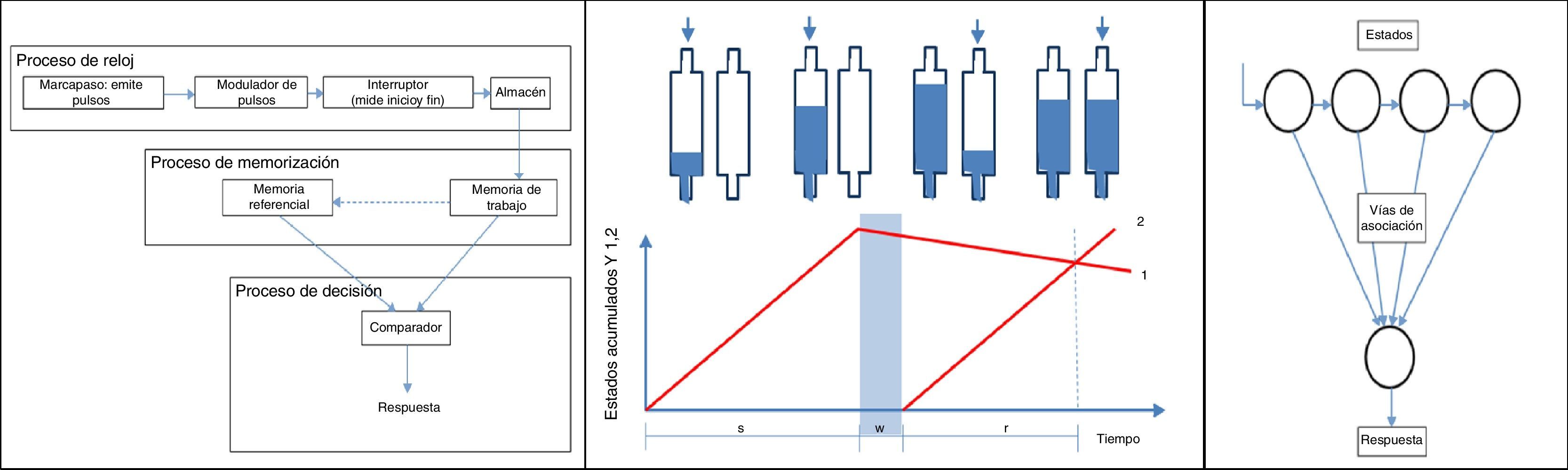
En 1963, Treisman toma las teorías desarrolladas hasta el momento y realiza un modelo denominado oscilador temporal interno. El modelo consta de 5 componentes: marcapasos, contador, almacén, comparador y mecanismo verbal selectivo. El marcapasos, a su vez, se compone del oscilador temporal, que emite una serie regular de pulsos con una frecuencia determinada. Los pulsos son transmitidos a la unidad de calibración, que controla la tasa final de pulsos que emite el marcapasos multiplicando la frecuencia inicial por un factor de calibración13.
Gibbon y Church en 1977 desarrollan la teoría de expectancia escalar, aplicando la ley de Weber, en donde la media y la desviación estándar de un tiempo a ser medido se incrementan linealmente con la duración que se estima, con un coeficiente de variación independiente del segmento a estimar. Posteriormente, desarrollan en 1984 el modelo de cronometraje escalar y las influencias que puede tener. Este modelo, basado en modelos experimentales animales, consta de 3 niveles: proceso de reloj, proceso de memoria y proceso de decisión. Según este, la medición comienza en el marcapasos, que produce pulsos a un ritmo determinado, el interruptor indica el comienzo y el fin del intervalo a medir, y envía su medición14-16.
La teoría conductual del tiempo (behavioral theory of timing) y Aprendiendo a medir (Learning to time) vinculan la percepción del tiempo con la conducta y postulan 3 elementos; estados, vías de asociación y respuesta. Básicamente, estipulan que hay una probabilidad constante para que un organismo cambie un estado de conducta17,18.
La teoría de resonancia adaptativa (adaptive resonance theory) incluye 3 subsistemas: atencional, de orientación y de comparación. La teoría incluye un componente espectral de temporización postulado en la región CA3 del hipocampo, que se envía como señal de salida a cerebelo19. Existen otros modelos, como la teoría del intervalo-frecuencia (1960), donde los segmentos son juzgados respecto de la media de todos los intervalos medidos en la secuencia, y de esta deriva la teoría temporal de intervalo-frecuencia20 al aplicar los principios de la primera puntualmente con sensopercepción del tiempo.
De acuerdo con investigaciones recientes, se postula una nueva teoría que complementa, al incorporar estructuras celulares y neurotransmisores, el modelo de Gibbon. Según esta, llamada teoría de la frecuencia rítmica estriatal, neuronas corticales y talámicas emiten pulsos oscilatorios periódicos, a distintas frecuencias, que llegan a neuronas del estriado; cuando se pide a un paciente que recuerde un segmento de tiempo, la dopamina liberada del área tegmental ventral resetea las oscilaciones corticales y la sustancia nigra pars compacta, libera también dopamina, la cual modula las conexiones sinápticas que llegan a las neuronas estriatales3. Estas tienen el papel de detectar patrones oscilatorios coincidentes con otros previamente incorporados. Finalmente, las neuronas estriatales envían información al tálamo y la corteza, a través de vías dopaminérgicas directas e indirectas, para modificar la velocidad del reloj3. Las neuronas corticales y talámicas serían el reloj de la teoría de expectancia escalar, las vías corticoestriatales representarían la memoria y las neuronas estriatales la fase de decisión3. Investigaciones posteriores demostraron la participación de dopamina, por medio de receptores D1, a nivel de corteza prefrontal en procesos de temporización en ratas21.
Teorías posteriores dividen los modelos de cronometraje en intrínsecos y dados (dedicated); este último se formula al considerar que estructuras cerebrales funcionan exclusivamente para medición de tiempo, mientras que el primero estipula que los procesos cognitivos y sensoriales que no están dedicados exclusivamente censan el paso del tiempo22,23.
Una teoría reciente basada en modelos intrínsecos estipula que la capacidad de medición de intervalos de tiempo se basa en procesos de flujo de entrada y salida, cuyos estados se comparan continuamente. Este modelo, llamado klepsydra (del griego, significa reloj de agua), constituye un modelo psicofísico que intenta fundamentar el acortamiento subjetivo del paso del tiempo23,24. Resumidamente, consiste en acumuladores, donde se almacenaría en tiempo en forma de agua, y que mientras se censa un segmento se van llenando a medida que también va perdiendo agua en forma constante (fuga). Los acumuladores son cilindros que miden el segmento de tiempo en relación con la altura a la cual llega el agua almacenada. Estos tienen una entrada de agua y una salida de menor calibre que produce la fuga. Al compararse 2 segmentos, se compara la altura del contenedor 1 con el 2, teniendo como premisa que el acumulador 1 se va acortando progresivamente (fuga) y puede tener menor altura al momento de llegada del acumulador 223-25 (fig. 1).
Estructuras cerebrales implicadas en el procesamiento de percepción temporalDistintas partes del sistema nervioso central fueron consideradas a través de la historia en el momento de seleccionar la «estructura reloj». Las funciones orgánicas, pertenecientes al campo de la cronobiología, presentan ritmicidad gracias a las oscilaciones generadas por el núcleo supraquiasmático del hipotálamo y la periodicidad anual es lograda gracias a la glándula pineal6. En cuanto al cronometraje, no existe un consenso ni evidencia tan clara para asignar las estructuras implicadas, pero lesiones en los ganglios de la base, la corteza motora suplementaria, el cerebelo y la corteza prefrontal dorsolateral y parietal derecha alteran la capacidad cognitiva de medir secuencias temporales3,26-30.
En el año 2011, mediante resonancia magnética funcional (RMF), indagaron el papel del cerebelo, estructura vinculada con la percepción del tiempo en los últimos 20 años31-34. Partiendo de la participación de estructuras diferentes dependiendo de la meta, es decir, medición de segmentos de tiempo o detección de ritmos periódicos34, los autores concluyen a través de RMF que el sistema olivocerebelar discrimina segmentos de tiempos y el sistema estriado-tálamo-cortical detecta secuencias rítmicas34; destacan la participación del putamen en forma bilateral35. Este último sistema se correlaciona con lo expuesto en la teoría de frecuencia rítmica estriatal3.
La oliva inferior (OI), estructura reconocida por su participación en secuenciación motora, desde hace tiempo es vinculada junto con el cerebelo en mediciones temporales36. Esta característica fue otorgada al poner de manifiesto su capacidad de generar potenciales de membrana oscilatorios en animales de experimentación37,38. Expertos en el tema consideran que en forma aislada no sería suficiente como para generar un reloj biológico, es por eso que la OI junto con las células de Purkinje y las células trepadoras sí podrían conformarlo37. Esta observación se ha realizado sobre la base de los potenciales de acción multifásicos de alto voltaje (espigas) periódicas que se han encontrado en estas células. Las conexiones sinápticas también favorecen dicha teoría; las células de Purkinje reciben inervación excitatoria por 2 vías, una de estas está constituida por las células trepadoras, las cuales provienen de la OI37,39,40.
El científico Craig descubrió, a través del uso de RMF, que la codificación de un intervalo de tiempo implica la participación insular (segmento posterior dorsal) y temporal superior en forma bilateral, mientras que al pedirle a los participantes que reproduzcan el tiempo mostrado y codificado anteriormente intervinieron ambas ínsulas, la región inferior y la corteza frontal inferior, donde se incluye al área motora suplementaria, en forma bilateral41.
Harrington postula que aquellas estructuras cerebrales que estén conectadas en forma recíproca con los ganglios de la base podrían estar implicadas en la capacidad de medir segmentos de tiempo; entre estas destaca áreas como la motora suplementaria, prefrontal dorsolateral, ocular frontal y parietal inferior. En sus trabajos sobre evaluar el papel de los hemisferios cerebrales en la percepción tiempo en pacientes con lesiones isquémicas encontró que el hemisferio derecho es esencial para la discriminación de tiempos y que daños en áreas como el giro medio y superior frontal se asocian a déficit en dicha capacidad26. Otros autores también han contribuido con esta hipótesis al evaluar dicha sintomatología tras afectarse el lóbulo parietal posterior derecho42-46.
Por último, lesiones hipocampales, en animales de experimentación, alteran la memoria episódica; la codificación y la recuperación de los eventos guardados podrían alterarse al no funcionar bien el hipocampo47. Lesiones en las vías que conectan el hipocampo interfieren con la memoria de trabajo, reduciendo el tiempo recordado y almacenado en la memoria de referencia48.
Mediadores químicosDiversos autores han reportado el vínculo que existe entre dopamina y percepción de tiempo. Entre otros, Merck, el cual sostiene que las manipulaciones dopaminérgicas afectan a la función de reloj, mientras que la acetilcolina modula la memoria para la duración49,50. La teoría de la frecuencia rítmica estriatal, mencionada previamente, justifica su funcionamiento gracias a la dopamina, que modula diferentes áreas del reloj biológico3. Mediante otras experiencias, compartidas por otros autores, estableció que los neurolépticos, bloqueantes de receptores D2, disminuyen la velocidad de reloj interno, mientras fármacos estimulantes, como la metanfetamina, que intervendría estimulando receptores D1 y D2, la aumentan28,29,49-53. La nicotina, como la cocaína, puede alterar la velocidad del reloj biológico; el alcohol también puede alterarlo y potenciar el efecto de la nicotina en cuanto a medición de tiempos54,55.
Las variaciones del ritmo circadiano pueden influir la medición de segmentos de tiempo y, si bien no es consensuado, la dopamina también sería la responsable de vincular ambos sistemas5.
Devin B. Terhune y su grupo de trabajo demostraron que errores en estimación de tiempo se correlacionaron con elevados niveles del neurotransmisor GABA en la corteza occipital. Puntualmente, los pacientes infraestimaron los segmentos de tiempo medidos56.
La serotonina también ha sido vinculada con la percepción temporal57,58.
Modelos psicofísicos de mediciónLas primeras evaluaciones que se vinculan con la percepción datan del año 1870 con el llamado tiempo de reacción; son utilizados actualmente para detectar alteraciones atencionales59, pero la relación entre tiempo objetivo y subjetivo no se correlaciona4.
La capacidad de percibir el paso del tiempo puede ser estimada en forma retrospectiva o prospectiva. La primera consiste en lograr que un sujeto recuerde un determinado segmento de tiempo sin previo aviso de que se evaluaría su estimación; posteriormente, se puede constatar su medición en forma verbal (p. ej., valor numérico que considera han pasado en segundos) o mediante un sistema de reproducción (presiona un botón para marcar inicio y fin)60.
El tiempo prospectivo puede ser evaluado por los 2 métodos nombrados anteriormente y también mediante producción de tiempo, es decir, el participante produce un segmento de tiempo y el examinador lo cuantifica. Un cuarto método consiste en comparar intervalos de tiempos; esto puede hacerse al solicitar a un participante que mida 2 segmentos de tiempos que se suceden y evaluar cuál es más largo y más corto (elección forzada). Otra forma de hacerlo es mediante la muestra de segmentos de tiempos, donde se da a conocer el segmento más corto y más largo de la serie, repetidas veces antes de iniciar la toma; posteriormente, se muestra un segmento de tiempo y se le pide al individuo que evalúe si este es más cercano al segmento más corto o más largo de los mostrados previamente (bisección temporal). Por último, mediante el test llamado temporización generaliza, se enseña al paciente un intervalo estándar (punto medio entre el más corto y largo de la serie de tiempos) y posteriormente se muestran segmentos de tiempo y el sujeto evaluado debe decir si es parecido o no al estándar3,36.
Existen modelos con mayor aplicación a la investigación con animales, dentro de estos se encuentra el programa de intervalo fijo; en este procedimiento se aplica un reforzador positivo, de acuerdo con los principios de Pavlov, en donde un estímulo se asocia a otro estimulo biológico como el alimento. El procedimiento pico consiste en 2 evaluaciones, una bajo el método intervalo fijo (con reforzador) y el otro con el modelo de ensayo pico (sin reforzador). Otros métodos son el procedimiento de pico con interrupciones y el reforzamiento diferencial de tasas bajas3,61.
Gibbon y Church reportaron, posteriormente, en forma objetiva que la media y la desviación estándar de un tiempo a ser medido se incrementan linealmente con la duración que se estima14. Otros autores postulan que la cronometría puede dividirse en subsistemas en donde mediciones inferiores a 200 ms son llevadas a cabo por determinadas estructuras y mayores a dicha medida por otras23.
Las mediciones dependen del método desarrollado para medirlas. En modelos donde un mismo segmento de tiempo se delimita con sonidos e imágenes, los intervalos sonoros son medidos por los individuos como mayores62,63. Estas diferencias también han sido identificadas en modelos intrínsecos64 y explicados por la teoría temporal intervalo-frecuencia65. Tanto la intensidad del estímulo, el tamaño, la forma, la complejidad, la familiaridad, como el orden mostrado de los segmentos a medir interfieren y modifican las distintas experiencias; si el intervalo se representa en forma gráfica como un segmento vacío o continuo, si es dinámico o estático, la velocidad y las emociones pueden también ser factores influyentes66.
Percepción temporal y psicología cognitivaConocemos el mundo por medio de nuestros sentidos, siendo posible únicamente gracias a distintos receptores que despiertan potenciales de acción al interaccionar con la energía portadora de un estímulo59.
No hay un órgano que permita recibir la información que requiere el cerebro para temporalizar y tampoco explicación alguna que indique cómo nuestro cerebro recibe la información necesaria para realizar la representación espacial de tiempo y cronometraje23,66,67.
La capacidad de percibir se considera un proceso cognitivo cortical que separa o segmenta información de una escena, guardar en memoria de trabajo flujos sensoriales y establece predicciones59.
La percepción del tiempo subjetivo tiene implicancias, como son los cambios en su velocidad. Diversos factores se ven implicados en su modulación, como el ritmo cardíaco, las emociones, la edad y los fármacos, como se mencionó anteriormente4,23,68. Especialmente las catecolaminas como la adrenalina y la noradrenalina, partícipes en el estrés y en respuestas emocionales, las cuales también aumentan el ritmo cardíaco; aumentan el ritmo del reloj estimando en forma más larga las duraciones4. La capacidad de percibir la rapidez del paso del tiempo está influida por la atención consciente puesta en dicho proceso; el ejemplo típico consiste al esperar para realizar un trámite, mientras la espera transcurre el tiempo fluye con lentitud, luego, al pensar en este, se lo considera más corto que lo vivido en ese momento4,69.
Según una revisión de Wittmann, habitualmente los individuos tienden a infraestimar el paso del tiempo cuando se miden segmentos mayores a 3 s23. Al evaluar pacientes con Parkinson, déficit atencional del adulto y controles, todos supraestimaron el paso del tiempo en sus valores medios, aunque los paciente con déficit atencional muchas veces se anticiparon2.
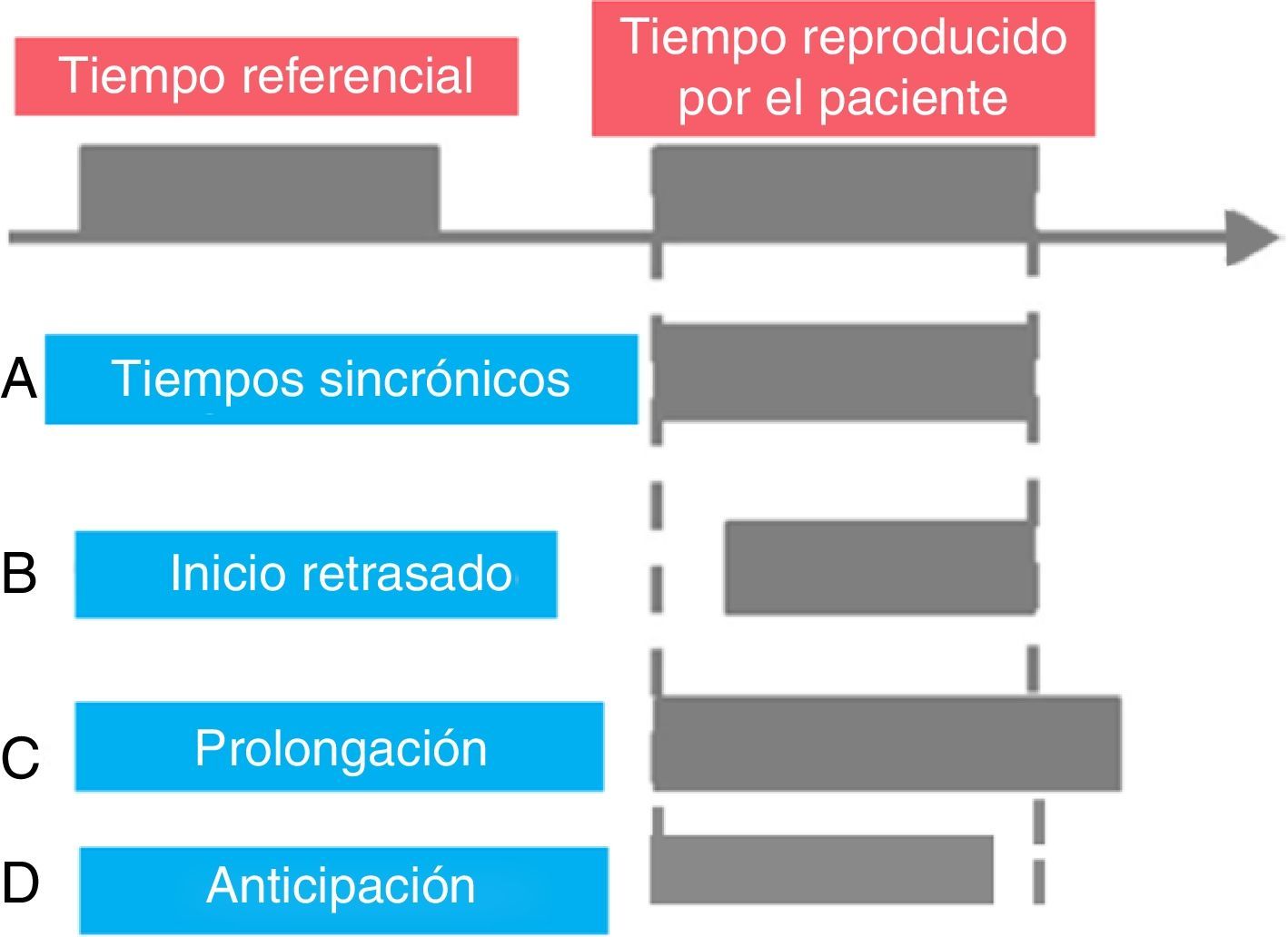
Patologías que alteran la percepción del tiempoDistintos trabajos han permitido mostrar alteraciones de la capacidad cognitiva de percibir el tiempo en patologías neurológicas y psiquiátricas. Una de las primeras estudiadas fue la enfermedad de Parkinson70, donde se ve una prolongación de los tiempos2,71-74 (fig. 2).
Esquema ilustrativo de los posibles resultados obtenidos mediante sistemas de reproducción de tiempos.
Tomado y modificado de Bueti y Walsh94.
Los pacientes con déficit atencional del adulto anticipan el paso del tiempo, es decir, acortan los segmentos reproducidos y, a la vez, presentan mucha variabilidad en las mediciones2,3,75. También dicha variación tiene un mecanismo relacionado con la dopamina; están descritas asimetrías e hipoperfusión de estructuras neoestriadas y frontales, y estos pacientes se benefician ampliamente al incorporar agonistas dopaminérgicos a su esquema terapéutico76,77.
Patologías psiquiátricas como la depresión, donde disfunciones en el sistema serotoninérgico fundamentan su fisiopatología, tienden a prolongar sus reproducciones78. La serotonina, asociada con el espectro autista, al igual que la dopamina, ha sido vinculada con la percepción del tiempo3,57,58. En el autismo se han hallado alteraciones funcionales en ganglios de la base, el cerebelo y la corteza prefrontal, como así también reportes de disfunción dopaminérgica; su percepción es debatida entre los que hallaron alteraciones, sobre todo anticipando79 contra los que argumentan no tener alteraciones80. Pacientes esquizofrénicos presentan alteraciones con mucha variabilidad estimativa y diferencias entre los test con audio o luces3,81.
Monge-Galindo puso de manifiesto episodios paroxísticos de sensación de aceleración del tiempo; la mayoría de los casos finalizaron con el diagnóstico de epilepsia del lóbulo temporal1. Monfort et al. reportaron un caso de un paciente epiléptico con lesión en la región insular anterior y la corteza frontal adyacente, el cual prolonga sus reproducciones temporales al compararlo con un grupo control, aunque con resultados controvertidos82. Benjamin et al. estudiaron las funciones del lóbulo temporal en pacientes con epilepsia del lóbulo temporal izquierdo. Los resultados demostraron que la epilepsia del lóbulo temporal izquierdo cambia el sustrato neurofuncional de procesamiento asociativo elemental de la información espacial y temporal83.
Pese a la escaza evidencia en pacientes migrañosos, una publicación china evidenció una tendencia a la prolongación de intervalos cortos de tiempo en los pacientes con migraña con y sin aura respecto de grupos control84, acordando con este estudio Vicario et al. constataron sobreestimación de tiempos en niños migrañosos85, que contrasta lo reportado en el año 2004 por Anagnostou y Mitsikostas, en donde se comunica la falta de compromiso entre estimación temporal y migrañas episódicas y migrañas con aura86.
Uno de los puntos que podría vincular la migraña con estimaciones temporales defectuosas podría ser el papel de la dopamina en dicha patología87-90; Gladstone realizó una revisión de los elementos que vinculan la dopamina con la migraña y describe 2 componentes, uno genético y otro vinculado al sistema trigeminal91; también la mejoría comprobada al medicar a dichos pacientes con antagonistas dopaminérgicos90,92,93. Entre el reporte de niños con sensaciones de aceleración del tiempo se encontró un caso de migraña con aura como única explicación posible1.
ComentarioConocer lo que implica percibir el tiempo puede ser de ayuda para comprender síntomas acompañantes en situaciones clínicas, como así también efectos adversos de psicofármacos. Muchos síntomas se buscan y constatan en un paciente por el solo hecho de saber que se presentan como acompañantes de determinadas patologías, como por ejemplo la hiposmia en la enfermedad de Parkinson. Hasta el momento, no hay datos en donde se reporte la evaluación del tiempo como indicador de la evolución de un desorden neurológico, pero puede llegar a ser una meta altamente alcanzable.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.