El coronavirus SARS-CoV-2 ha sido un reto para la salud pública, estableciendo la vacuna como la mejor herramienta para su prevención.
Caso clínicoSe presenta el caso de un paciente en quien se documenta un síndrome de Miller Fisher después de recibir su dosis de refuerzo con la vacuna de Oxford-AstraZeneca.
ConclusiónEn el momento no se puede establecer una relación causal entre la vacunación contra COVID-19 y el desarrollo de síndrome de Miller Fisher, pero el conocimiento de este potencial efecto adverso es relevante para un diagnóstico temprano y el tratamiento oportuno.
The SARS-CoV-2 coronavirus has been a challenge for public health, establishing the vaccine as the best tool for its prevention.
Clinical caseWe present the case of a patient in whom Miller Fisher syndrome was documented after receiving her booster dose with the Oxford-AstraZeneca vaccine.
ConclusionAt the moment, a causal relationship between vaccination against COVID-19 and the development of Miller Fisher syndrome cannot be established, but knowledge of this potential adverse effect is relevant for early diagnosis and timely treatment.
El coronavirus SARS-CoV-2 y sus variantes pertenecen a la familia Coronaviridae, siendo declarado como una emergencia de salud pública el 30/01/2020 por la Organización Mundial de la Salud (OMS)1. En medio de la pandemia, se han desarrollado vacunas contra el SARS-CoV-2 para la inmunización a gran escala, y a pesar de que se han cumplido los requisitos de seguridad y eficacia de estas vacunas, persisten los riesgos de reacciones adversas2,3.
El síndrome de Guillain-Barré (SGB) es reconocido como un grupo de trastornos heterogéneos pero relacionados del nervio periférico, con un inicio agudo y casi siempre con una evolución monofásica4,5. Su incidencia puede aumentar con los brotes de enfermedades infecciosas que desencadenan la enfermedad y sus variantes6. A medida que avanza la campaña de vacunación contra la COVID-19 en todo el mundo, se han notificado casos que sugieren una relación causal con la presentación de esta patología7. Reportamos el caso de un paciente con síndrome de Miller Fisher después de recibir su dosis de refuerzo con la vacuna de Oxford-AstraZeneca.
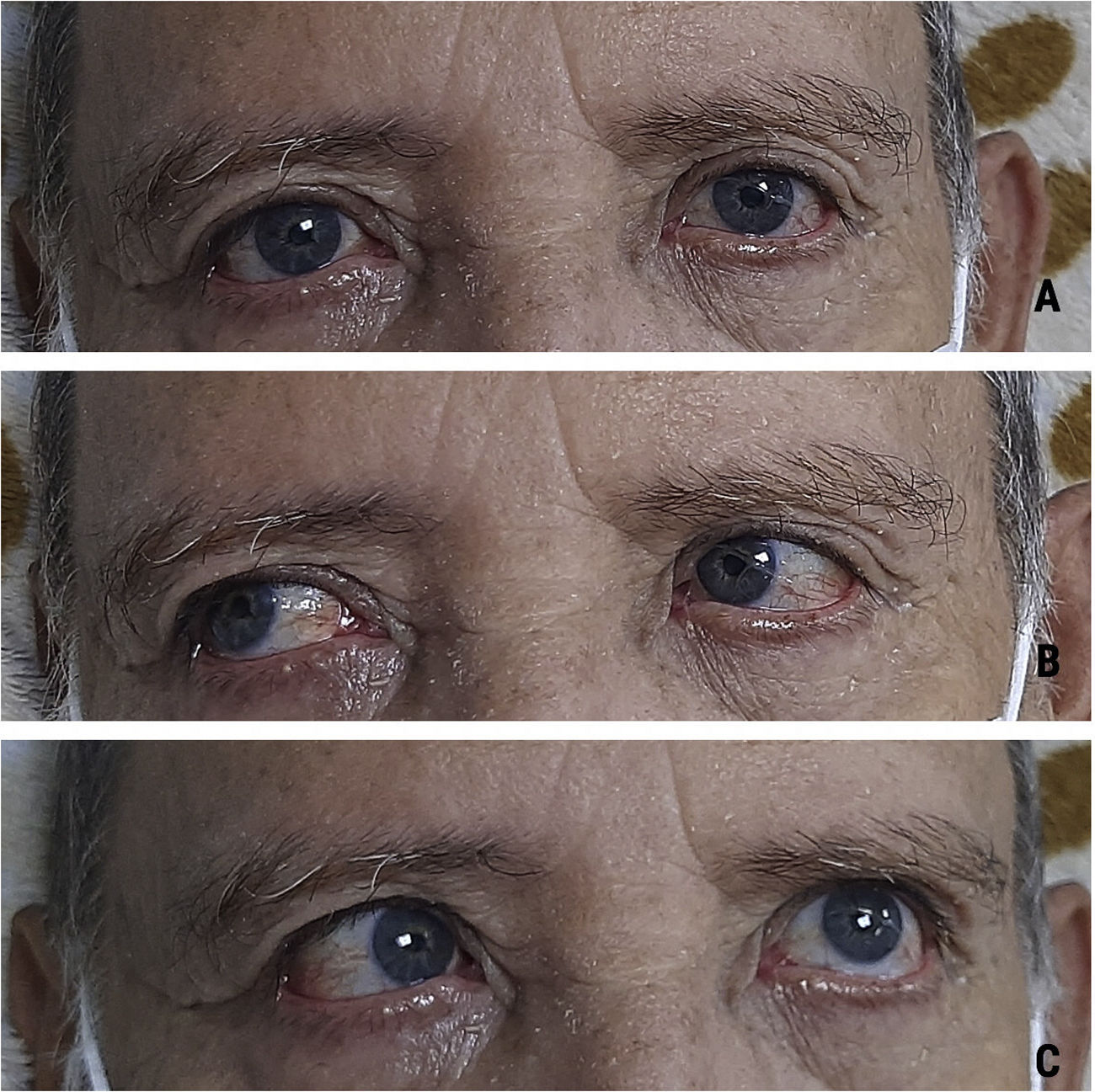
Caso clínicoHombre de 73 años de edad quien ingresa al servicio de urgencias por cuadro de 2días de evolución posterior a inmunización de refuerzo para COVID-19 con la vacuna de Oxford-AstraZeneca. El paciente presenta desviación de la comisura labial a la derecha con limitación para el cierre palpebral izquierdo y progresivamente desarrolla alteración para la marcha por aumento en la base de sustentación. Describe que 6días posterior a este cuadro presenta disminución de la fuerza muscular de los miembros inferiores con una distribución de distal a proximal. No tiene antecedente médico y no estaba bajo ninguna medicación reciente. Al examen neurológico se evidencia una parálisis facial periférica izquierda asociado a parálisis del músculo recto lateral ipsilateral (fig. 1C), dismetría apendicular en las 4 extremidades, disminución de la fuerza muscular 4/5 según la escala del Medical Research Council de predominio distal en miembros inferiores, hiporreflexia en miembros superiores (+/++ bicipital – tricipital – radial bilateral), arreflexia en miembros inferiores (0/++ rotuliano – aquiliano bilateral) y marcha atáxica.
Lo estudios iniciales de hemograma, ionograma, anticuerpos contra VIH (virus de la inmunodeficiencia humana), hemoglobina glicosilada, serología no treponémica, proteínaC reactiva y radiografía de tórax fueron normales. Se realizó una punción lumbar, que evidenció disociación albumino-citológica (tabla 1). Dadas las características clínicas y la evolución temporal se consideró un cuadro de SGB variante Miller Fisher. Se inició manejo con inmunoglobulina humana por 5días (2g/kg de peso), teniendo una evolución clínica satisfactoria con recuperación de la fuerza muscular de los miembros inferiores y resolución de la dismetría posterior a su tratamiento.
Estudio del líquido cefalorraquídeo
| Estudio | Valor |
|---|---|
| Color | Incoloro |
| Aspecto | Cristal de roca |
| PH líquido | 8 |
| Hematíes | 28 × mm3 |
| 95% frescos | |
| 5% crenados | |
| Leucocitos | 0 |
| Xantocromía | Negativo |
| Glucosa | 78 mg/dl |
| Proteínas | 255,3 mg/dl |
| Coloración gram | Negativo |
| Tinta china | Negativo |
| KOH | Negativo |
| Serología no treponémica | Negativo |
| Zielh-Nielsen | Negativo |
| Cultivo | Negativo a las 96 horas |
KOH: hidróxido de potasio; PH: potencial hidrógeno.
El síndrome de Miller Fisher hace parte de una de las variantes del SGB y se caracteriza por tener una tríada clínica que corresponde en oftalmoplejía, ataxia y arreflexia4. Describimos el caso de un paciente de 73años que desarrolló un cuadro que cumple criterios clínicos y de líquido cefalorraquídeo para un síndrome de Miller Fisher posterior a su inmunización de refuerzo con Oxford-AstraZeneca para COVID-19. El intervalo de tiempo de inicio de síntomas posterior a la vacunación se ha descrito en la literatura en un rango de los 4 a 30días, periodo que coincide con la respuesta inmune esperada para la vacuna contra la COVID-197; en el caso de nuestro paciente, presentó una progresión de sus síntomas entre 2-8días posterior a su dosis de refuerzo.
En Colombia, la prevalencia del SGB se ha descrito de 9casos por 100.000 habitantes según información administrativa aportada por el estudio ESENCIA8, pero sin una descripción para cada una de sus variantes. A pesar de que ya se han descrito casos de SGB secundarios a la vacunación para COVID-19, este el primer reporte de un paciente con una variante Miller Fisher en Colombia9,10. En varios reportes el SGB se ha relacionado con algunas vacunas, como la de la hepatitisA yB, la de la polio y la de la influenza11,12. Una de las vacunas que se ha relacionado con complicaciones neurológicas como meningoencefalitis, SGB y encefalomielitis diseminada aguda es la vacuna contra la fiebre amarilla13; se ha descrito una mayor prevalencia (no exclusiva) en pacientes menores de 6años y mayores de 60años, esto último generando una modificación en sus indicaciones de aplicación por edad14. En un estudio realizado por Nishiguchi et al.11 se documentó que, al igual que en nuestro paciente, la vacuna que más se ha relacionado con la presentación del síndrome de Miller Fisher es la de Oxford-AstraZeneca, y esto se debe posiblemente a que se trata de una vacuna basada en vectores que pueden desencadenar una reacción de mimetismo molecular15. Por esta razón, es importante identificar el antígeno diana encargado para entender fisiopatológicamente el desarrollo de la enfermedad, con el objetivo de poder desarrollar vacunas seguras y eficaces16.
El pronóstico del síndrome de Miller Fisher es usualmente bueno y se ha considerado autolimitado, teniendo una respuesta favorable al manejo con inmunoglobulina humana, del mismo modo que se describió en nuestro paciente. En la actualidad existe poca evidencia que permita establecer el riesgo de desarrollo de SGB relacionado con la vacunación; sin embargo, los Centros para Control y Prevención de enfermedades (CDC) publicaron una guía en 2010 recomendando que los pacientes que desarrollaron SGB dentro de las 6semanas de haber recibido la vacuna contra la influenza no deben volver a vacunarse contra la influenza si no corren un alto riesgo de sufrir complicaciones graves por la influenza17.
En el momento no se puede establecer una relación causal entre la vacunación contra COVID-19 y el desarrollo del SGB18,19, pero el conocimiento de este potencial efecto adverso es relevante para un diagnóstico temprano y el tratamiento oportuno. Se ha descrito en la literatura que esta complicación puede estar relacionada con la contaminación de proteínas y otros componentes de la vacuna que pueden provocar la producción de antigangliósidos20, y es por esta razón que procesos de purificación y de filtración de estos elementos disminuirán el riesgo de una reacción cruzada, pero sin eliminarlo por completo21. Finalmente, se debe estimular a la población a continuar su proceso de inmunización, dado que la relación riesgo-beneficio sigue siendo a favor del paciente, principalmente cuando lo comparamos con las graves complicaciones de la infección por SARS-CoV-2.
FinanciaciónNinguno de los autores recibió alguna remuneración o ayuda financiera para desarrollar el trabajo.
Conflicto de interesesNo existe ningún conflicto de intereses por parte de alguno de los autores.