Entre los desafíos asociados a la epilepsia resistente se encuentra el riesgo de presentar crisis agrupadas o prolongadas. Dado que la mayoría de estos episodios ocurren fuera del ámbito hospitalario, se requieren terapias no intravenosas que puedan ser fácilmente administradas en el hogar, en las escuelas o por el personal médico o paramédico de los servicios de emergencia.
Por esta razón es esencial contar con alternativas que permitan una administración no invasiva, rápida y segura, que pueda ser realizada por el propio paciente o su cuidador en cualquier entorno, y que facilite una rápida absorción del fármaco. Dentro de esta alternativa, la vía intranasal emerge como una opción ideal para la administración rápida de medicamentos en emergencias médicas, incluidas las crisis agrupadas o prolongadas.
ObjetivoEl objetivo de esta revisión es describir la anatomía y fisiología de la nariz para comprender por qué es una vía ideal para la administración de medicaciones de rescate, revisar las características que debe tener un fármaco para ser utilizado por esta vía, y finalmente analizar los datos sobre seguridad y eficacia del uso de diazepam intranasal.
ConclusiónEl diazepam intranasal ha demostrado ser efectivo como un tratamiento inmediato de rescate para crisis agrupadas o prolongadas, debido a su fácil administración, buena absorción, baja variabilidad entre pacientes y buena aceptación social; por lo cual, es una alternativa adecuada y eficaz para uso extrahospitalario.
Among the challenges associated with resistant epilepsy is the risk of presenting cluster seizures. Since most of these episodes occur outside the hospital setting, non-intravenous therapies are required that can be easily administered at home, in schools, or by medical or paramedical personnel in emergency services.
For this reason, it is essential to have alternatives that allow non-invasive, rapid and safe administration, which can be carried out by the patient themselves or their caregiver in any environment, and which facilitate rapid absorption of the drug. Within this alternative, the intranasal route emerges as an ideal option for the rapid administration of medications in medical emergencies, including grouped or prolonged crises.
ObjectiveThe objective of this review is to describe the anatomy and physiology of the nose to understand why it is an ideal route for the administration of rescue medications, review the characteristics that a drug must have to be used by this route, and finally analyze data on safety and efficacy of the use of intranasal diazepam.
ConclusionIntranasal diazepam has proven to be effective as an immediate rescue treatment for grouped or prolonged seizures, due to its easy administration, good absorption, low variability between patients and good social acceptance; Therefore, it is an appropriate and effective alternative for out-of-hospital use.
La epilepsia es una de las enfermedades neurológicas más comunes en el mundo, afectando todas las edades, las razas, las clases sociales y las localizaciones geográficas, con una incidencia de 111/100.000 habitantes por año y una prevalencia activa de 9,06 por 1.000 habitantes en la región de Latinoamérica1. Aproximadamente entre un 20 y un 30% de los individuos con epilepsia continuarán presentando crisis luego de haber utilizado al menos 2 medicaciones anticrisis epilépticas (MAC) solas o en combinación, bien elegidas, bien toleradas y con dosis óptimas, cumpliendo los criterios para la definición de epilepsia fármaco-resistente2. Entre las múltiples problemáticas asociadas a la epilepsia resistente al tratamiento se encuentra el riesgo de presentar las denominadas crisis agrupadas, o en clusters por su nombre en inglés. Si bien al momento actual no hay una acepción única para crisis agrupadas, una definición práctica incluye un cambio en la frecuencia previamente conocida en un tiempo determinado, aceptándose por lo general 2 o más crisis en 24h, con un patrón distinguible del habitual del paciente3. Están frecuentemente asociadas a epilepsias severas y pobremente controladas3, con una prevalencia estimada en adultos del 14,9% en EE. UU.4.
Estas crisis agrupadas, así como las denominadas crisis prolongadas, representan un continuum dentro de las emergencias médicas, cuyo estadio final es el estatus epiléptico, generando frecuentes consultas en salas de emergencia con alto impacto tanto en la calidad de vida de los pacientes y sus cuidadores, como en los gastos en salud.
Dado que la gran mayoría de los episodios de crisis agrupadas ocurren fuera del ámbito hospitalario, se requiere de terapias no intravenosas que puedan ser fácilmente administradas por el mismo paciente o sus familiares, en el hogar, en las escuelas o por el personal médico o paramédico de los servicios de emergencia. Tanto las vías de administración como las formulaciones deben idealmente garantizar rápida absorción, biodisponibilidad alta y consistente, buena potencia a pequeños volúmenes, rápido inicio de acción con suficiente duración de esta y un buen perfil de seguridad. Las benzodiazepinas (BZD) han desempeñado un papel crucial desde la década de 1960 en el manejo de la epilepsia. Entre ellas, el diazepam, lorazepam y midazolam han sido utilizados durante décadas con diversas vías de administración5,6 para tratar las crisis agrupadas, a menudo sin aprobación de los organismos reguladores. En 1997, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso del diazepam en gel intrarrectal para el manejo de crisis repetitivas7, tras revisar datos sustanciales de 2 estudios randomizados, doble ciego que demostraron que el diazepam en esta presentación es eficaz tanto para reducir la frecuencia de crisis repetitivas como en prolongar el tiempo hasta la recurrencia de las mismas luego del tratamiento inicial7,8. Este fue el primer fármaco en recibir aprobación específica para este propósito, la cual fue posteriormente aprobada por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) de Argentina en 1998.
Sin embargo, a pesar de su reconocida eficacia, esta vía es generalmente muy poco utilizada por pacientes adultos y niños mayores, quienes la encuentran inclusive más humillante que presentar una crisis en público y prefieren utilizarla solo en espacios privados9. Según una encuesta a padres de pacientes con epilepsia, el 19% indicó que en las escuelas se negaron a utilizar medicación vía rectal, principalmente por restricciones legales relacionadas con la privacidad de los niños y la falta de familiaridad con las dosis adecuadas10.
Dadas las limitaciones de la formulación intrarrectal para su uso fuera del entorno hospitalario, es importante contar con rutas alternativas que permitan una vía no invasiva, rápida y segura, que pueda ser administrada por el propio paciente o su cuidador en cualquier ámbito, y que facilite una absorción rápida del fármaco necesario, evitando el paso por el tracto gastrointestinal y el metabolismo de primer paso hepático11. La cavidad nasal, como veremos más adelante en detalle, emerge, así como una opción ideal para la administración rápida de medicamentos en emergencias médicas, incluidas las crisis repetitivas o prolongadas. En 2019, la FDA aprobó un espray nasal de midazolam para tratar episodios frecuentes y estereotipados de crisis en pacientes de 12 años o más con epilepsia12, mientras que en 2020 se aprobó un aerosol nasal de diazepam con la misma indicación para pacientes de 6 años o más, el cual está actualmente siendo evaluado en pacientes de 2-5 años13.
El objetivo de la presente revisión es describir brevemente la anatomía y fisiología de la nariz para comprender por qué es una vía ideal para la administración de medicaciones de rescate, revisar las características que debe tener un fármaco para poder ser utilizado por esta vía y finalmente analizar los datos sobre seguridad y eficacia real del uso de diazepam intranasal.
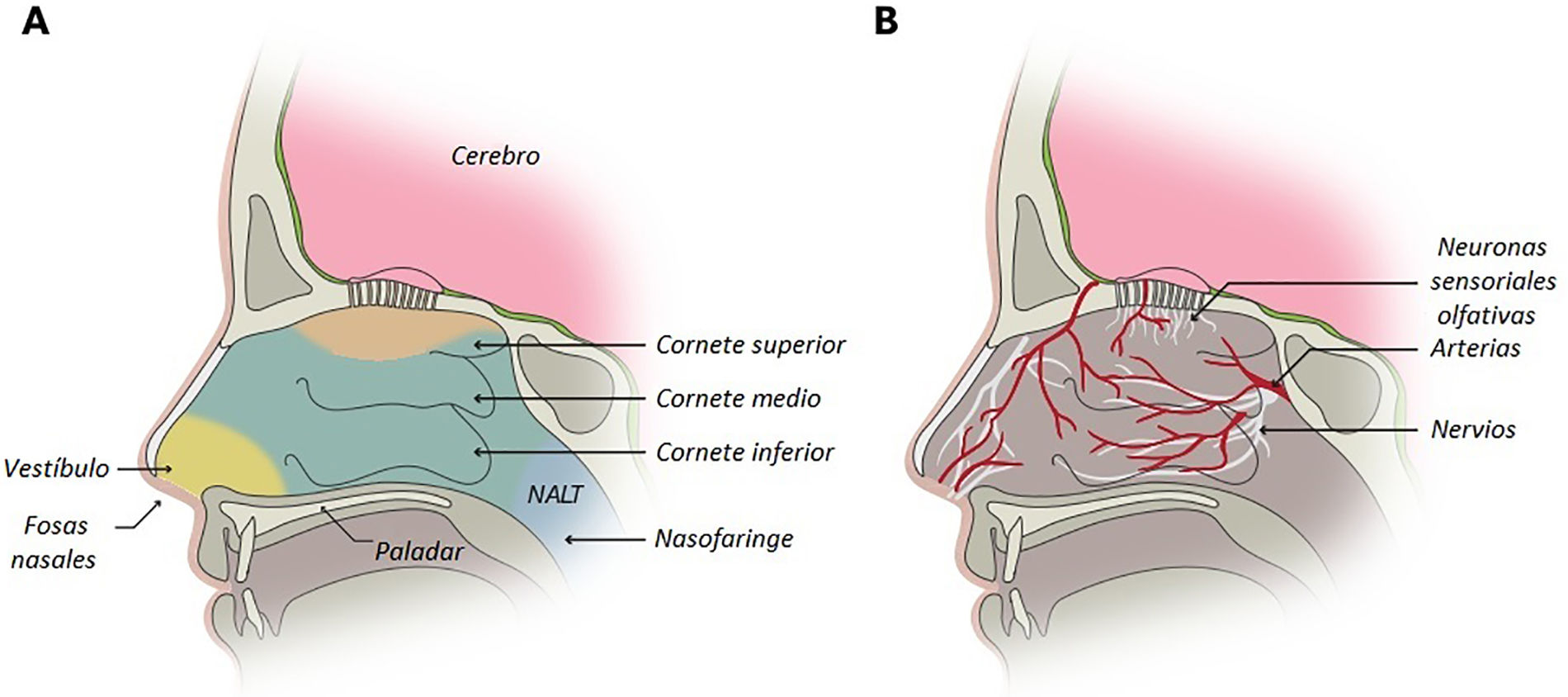
Anatomía y fisiología de la narizLa cavidad nasal desempeña 3 funciones principales: el olfato, el calentamiento y la humidificación del aire para la respiración, y la eliminación de partículas y polvo11. Se compone de 2 cavidades situadas entre el techo de la boca y la base del cráneo, separadas por el septum. En la pared externa, hay 3 estructuras llamadas cornetes, que aumentan la superficie total a aproximadamente 160cm214. Cada cavidad nasal está dividida en 3 áreas principales: el vestíbulo, la región central y el tejido nasofaríngeo, que desempeña una función linfática11 (fig. 1). La región central, a su vez, está cubierta por las mucosas respiratoria y olfatoria, siendo la zona crucial para la absorción de medicamentos administrados por vía intranasal. La mucosa respiratoria recubre los cornetes inferior y medio, así como la parte inferior del septum11, siendo la porción más grande de la cavidad nasal, ricamente vascularizada por un lecho de vasos conteniendo poros o fenestraciones en las paredes11,15, lo cual facilita el pasaje de fármacos a la circulación general. La mucosa olfatoria, por otro lado, constituye ≤10% de la superficie de la cavidad nasal y cubre la parte superior de la misma11,15, teniendo un volumen de 12,5cm311. En esta región se encuentran las neuronas sensoriales, únicas neuronas del sistema nervioso central (SNC) expuestas al exterior de la superficie corporal15, ofreciendo de esta forma el potencial para una vía directa de llegada de las medicaciones al cerebro, aunque su localización representa un obstáculo para el depósito eficiente de las mismas. La cavidad nasal se encuentra inervada por el nervio trigémino, el cual se encuentra por debajo de la mucosa nasal, pudiendo también tener un rol en el acceso directo al cerebro11,15.
A) La cavidad nasal presenta 4 áreas: el vestíbulo, la mucosa respiratoria y la olfatoria, las cuales cubren la porción central incluyendo los cornetes, y finalmente el tejido linfático nasofaríngeo. B) La mucosa respiratoria es la parte más vascularizada de la cavidad nasal, inervada por los nervios trigémino, palatino y maxilar. La mucosa olfatoria contiene las neuronas sensoriales olfatorias. Fuente: usado con permiso de Madden et al.14, 2023.
La irrigación sanguínea está aportada por una rama de la arteria esfenopalatina y por las ramas etmoidales de la arteria oftálmica15, mientras que la red venosa drena a las venas etmoidales, de allí al plexo oftálmico y, finalmente, al seno cavernoso16. La parte inferior del septum contiene una densa red vascular especialmente en la transición de epitelio escamoso a respiratorio. Este lecho vascular se extiende sobre los cornetes inferior y medio y está compuesto por vasos fenestrados y capilares que serían la fuente de fluido para la humidificación del aire durante la respiración.
La cavidad nasal tiene la posibilidad de capturar en forma efectiva las gotas producidas por los métodos utilizados para administrar medicaciones en aerosol, al tiempo que las microvellosidades del tejido nasal y su rica vasculatura favorecen la absorción. No obstante, ciertos factores pueden limitar el índice y extensión de esta, tales como el área de superficie total, el volumen de la cavidad, la renovación de la lámina mucosa, el mecanismo de limpieza mucociliar y el drenaje tanto anterior como posterior16.
El desafío más importante para la absorción de fármacos en la región respiratoria está representado por el pasaje a través del epitelio. Uno de los mecanismos utilizados es la difusión paracelular a través de las células columnares17, pero las uniones estrechas (zonula occludens) son hidrofílicas y generalmente impermeables a muchos fármacos. En su estado natural el epitelio permite el pasaje de moléculas de hasta 1.000Da, disminuyendo significativamente la absorción de las de mayor peso molecular18,19. Un segundo mecanismo es el transporte intracelular vía transcitosis19. Una vez que las moléculas atraviesan el epitelio, deben entrar a la lámina propia y desde allí pasar a la circulación sistémica 20. En la región olfatoria el transporte intracelular comienza con la internalización del compuesto en la neurona y su posterior transporte hacia el SNC donde se libera, existiendo además vías extracelulares que utilizan un mecanismo paracelular similar a los de la mucosa respiratoria21.
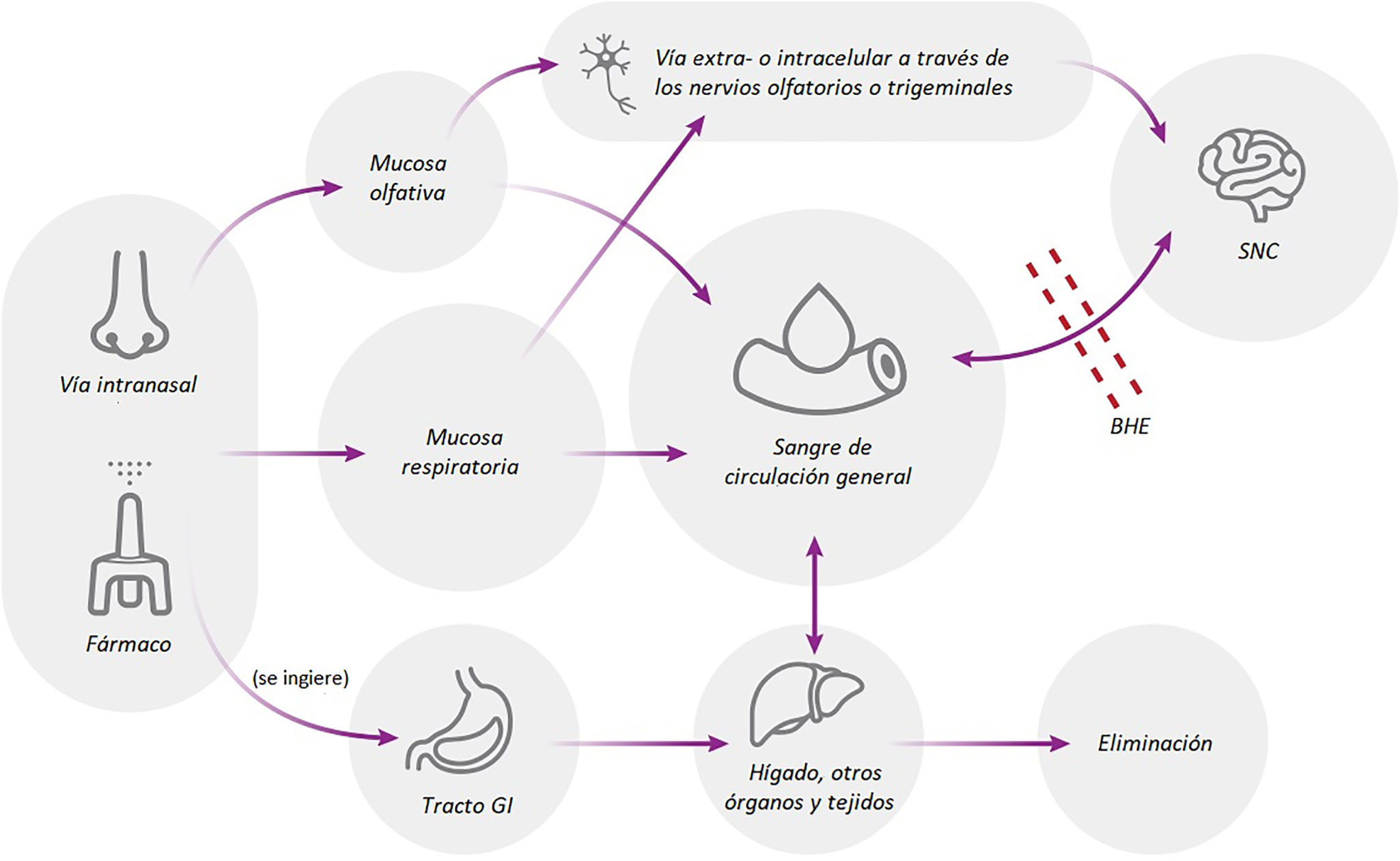
Una vez que los fármacos son absorbidas desde el epitelio nasal pueden utilizar diferentes vías para llegar al sitio de acción en áreas del SNC. Pueden utilizar la vía sanguínea para atravesar la barrera hematoencefálica, o la vía olfatoria y del nervio trigémino que ofrecen una vía más directa o el sistema linfático dada sus conexiones con los espacios perineurales y con el líquido cefalorraquídeo (LCR)14,22. La vía olfatoria involucra las neuronas sensoriales olfatorias como una ruta directa hacia el SNC, permitiendo el ingreso al cerebro por transporte intraneuronal o bien por pasaje al LCR por vía paraneuronal antes de ser transferidas a las neuronas. La ruta intraneuronal requiere de un tiempo prolongado, a veces de hasta 24h o más, por lo cual es poco probable que sea el mecanismo primario de ingreso11. Para el transporte paraneuronal los compuestos deben tener un primer pasaje a través de la mucosa olfatoria, luego moverse vía difusión extracelular a través de canales perineurales que existen entre las células olfatorias y los fibroblastos neurales, los cuales van desde el epitelio olfatorio hasta el bulbo olfatorio, creando una conexión más directa23 y rápida que va de 5min a 23h11. Las vías transcelulares pueden ser más utilizadas por los compuestos lipofílicos, mientras que los hidrofílicos pueden usar la difusión pasiva a lo largo de los canales llenos de fluido con una relación inversa al peso molecular del compuesto22. Se ha propuesto que el movimiento de la sangre durante la sístole a través de las arterias adyacentes al nervio olfatorio generaría un efecto de bomba perivascular que puede colaborar en el movimiento de los fluidos dentro del espacio perivascular hacia el cerebro24. Finalmente, el nervio trigémino ha sido menos estudiado como vía de llegada directa. Aunque sus terminaciones no están directamente expuestas en la cavidad nasal, se asume que los fármacos pasan a través del epitelio y desde allí son transportadas extra o intracelularmente al cerebro. Los tiempos de transporte son más largos, yendo de 17-56h11. Algunos estudios establecen que esta vía es utilizada en el transporte de factor de crecimiento similar a la insulina 1, lidocaína, e interferón β-1b11.
Es probable que los fármacos usen estas vías en grados variables dependiendo de diferentes factores tales como naturaleza molecular del fármaco, composición de la formulación, y el sistema de aplicación existiendo distintas estrategias para aumentar la permeabilidad del epitelio al disrumpir la barrera celular o aflojar las uniones estrechas (fig. 2).
Vías hacia el sistema nervioso central luego de la administración de medicación intranasal. El fármaco absorbido a través de la mucosa respiratoria puede ingresar a la circulación general y luego pasar a través de la barrera hematoencefálica para llegar al sitio de acción, o bien utilizar la vía del nervio trigémino como una ruta más directa de acceso. La absorción en la mucosa olfatoria puede utilizar una vía directa mediante el transporte por el nervio olfatorio. Finalmente, el exceso de fármaco administrado en la cavidad nasal puede ingresar al tubo gastrointestinal y absorbido desde allí en forma similar a la administración oral.Fuente: usado con permiso de Chung et al.11, 2023.
Tanto la permeabilidad de la membrana celular, como el eflujo y el metabolismo de las medicaciones impactan en la absorción6 al igual que el proceso fisiológico de limpieza mucociliar. El depósito de las gotas, por otro lado, va a depender del tamaño de estas, aquellas que superan los 10μl se retienen en la cavidad nasal pero las de menor tamaño se depositan a nivel pulmonar25.
Existen múltiples mecanismos que permiten incrementar la absorción incluyendo aumento de la solubilidad del fármaco, incremento de la permeabilidad de la membrana, e incremento del tiempo de estadía del fármaco en la mucosa nasal. El aumento de la absorción puede ser obtenido o bien realizando modificaciones al fármaco, o bien ajustando el pH de la solución, sumando excipientes o creando nuevos sistemas de administración. El agregado de potenciadores de la absorción mucosa puede incrementar la permeabilidad del epitelio hasta 30 veces el estado natural, permitiendo el pasaje de moléculas de hasta 30kDa26. Dado que las BZD tienen baja solubilidad en soluciones acuosas se ha requerido de diferentes técnicas potenciadoras para el desarrollo de los preparados de terapias de rescates intranasales6, así las formulaciones aprobadas de midazolam (NAYZILAM®, UCB Biopharma SPRL. ©2019 UCB, Inc., Smyrna, GA) contienen un cosolvente llamado polietilenglicol (PEG) 400, metil-eter PEG-6, propilenglicol y etanol6,12,27,28 mientras que la presentación de diazepam (Valtoco®, Neurelis, Inc., San Diego, CA, EE. UU.) contiene una fórmula basada en vitamina E para aumentar la solubilidad del diazepam evitando el uso de cosolventes orgánicos que pueden ser irritantes, y dodecil-beta-D-maltopiranosida (DDM), un surfactante alquiglucósido no iónico que incrementa la absorción por rutas paracelulares y transcelulares29. Es importante resaltar que estas formulaciones han sido específicamente diseñadas para optimizar la biodisponibilidad, efectividad y seguridad de la administración intranasal, lo cual es muy diferente a utilizar, por ejemplo, el preparado de midazolam endovenoso como espray, dado que se requiere de un mayor volumen generando una pérdida significativa desde la cavidad nasal, tiene una absorción variable y dado el bajo pH de la formulación, genera notoria irritación nasofaríngea11.
En cuanto al dispositivo utilizado para la administración intranasal, ambas formulaciones de BZD aprobados por la FDA utilizan un sistema de administración con dosis fijas12,13 lo cual permite obtener dosis consistentes, al tener un volumen pre-medido estable. Han sido diseñados para un uso simple e intuitivo, y no requieren de colocar la cabeza en una posición específica para su utilización12,30, favoreciendo la administración rápida y segura tanto por el mismo paciente como por el cuidador. El dispositivo utilizado específicamente por el diazepam intranasal (Unidose system, Aptar Pharma) además de proveer una dosis específica, favorece la dispersión uniforme de las gotas para mejorar la absorción31.
Diazepam intranasalFarmacocinética y farmacodinamiaEl diazepam intranasal es una fórmula rápida, no invasiva y con una vía de administración socialmente aceptada, aprobado por la FDA para el tratamiento agudo e intermitente de crisis agrupadas en pacientes de ≥6 años con epilepsia.
Las investigaciones iniciales se focalizaron en evaluar el potencial del diazepam para ser utilizado por vía intranasal, optimizando su absorción y determinando las características farmacocinéticas. En los primeros estudios con voluntarios sanos se utilizaron formulaciones basadas en polietileno y glicofurol, con buena biodisponibilidad, pero con una alta asociación con malestar nasal transitorio16. Ulteriormente se utilizó otro solvente orgánico basado en glicol, con resultados variables en cuanto a biodisponibilidad en comparación con el diazepam rectal. Tomados en conjunto, estos estudios sugirieron que la vía intranasal del diazepam podía ser viable siempre y cuando se mejorara la tolerancia16. El diseño de la formulación aprobada por FDA, que luego fue homologada en nuestro país, tuvo como objetivo alcanzar un índice de absorción similar o superior al del diazepam rectal, con menor variabilidad en su biodisponibilidad y con baja vinculación con irritación nasal o cambios en el gusto. Esta formulación incluye DDM, el cual mejora la absorción y biodisponibilidad mediante la permeabilización de la membrana de la mucosa nasal al producir una relajación transitoria de las uniones estrechas intercelulares14 y vitamina E usada como solvente no acuoso, no tóxico y no irritante13 evitando la inflamación mediada por fosfolípidos y el daño de la mucosa sino-nasal16. En uno de los primeros estudios de fase 1 se compararon 2 formulaciones diferentes, una solución y una suspensión, de 10mg de diazepam intranasal conteniendo DDM y vitamina E vs. diazepam intravenoso en 24 voluntarios sanos, evidenciándose que la biodisponibilidad absoluta de la solución era mayor, el 97% en comparación con el 67% de la suspensión.
La FDA aprobó en 1997 el gel rectal de diazepam (Diastat®) como tratamiento de rescate de crisis epilépticas. La administración rectal de diazepam produce una rápida absorción debido a la alta vascularización, con una biodisponibilidad de aproximadamente entre el 80-90%. En el año 2014, Henny H et al.32, desarrollaron una formulación intranasal de diazepam (Plumiaz®) que luego fue suspendido debido a que no se demostró una adecuada absorción en el revestimiento de la nariz en comparación con el diazepam rectal. Años posteriores se desarrolló otra formulación (Valtoco®) con distintos cosolventes (DDM, vitamina E) que incrementan la absorción por rutas paracelulares y transcelulares29 y, por lo tanto, fue posible optimizar la biodisponibilidad, efectividad y seguridad de la administración intranasal.
Los estudios de eficacia realizados por Diastat fueron aceptados por FDA para el desarrollo y aprobación de Valtoco®, habiendo sido necesario realizar estudios de largo plazo de seguridad y tolerancia33,34. Dicho estudio incluyó 163 pacientes y se evaluaron más de 4.300 eventos que requirieron la administración de Valtoco®, lo cual representa el mayor estudio por la cantidad de eventos colectados. De estos eventos, el 87,5% requirió solamente una dosis única de Valtoco®, mientras que el 12% requirió de una segunda dosis dentro de las 24h de la administración de la primera dosis33, sin aumentar los riesgos de efectos adversos por la segunda dosis recibida dentro de las próximas 4h35. Es importante destacar que todos los pacientes evaluados, independiente de las diferentes edades, 6-11, 12-17 o mayores de 18 años, todos respondieron de forma similar34.
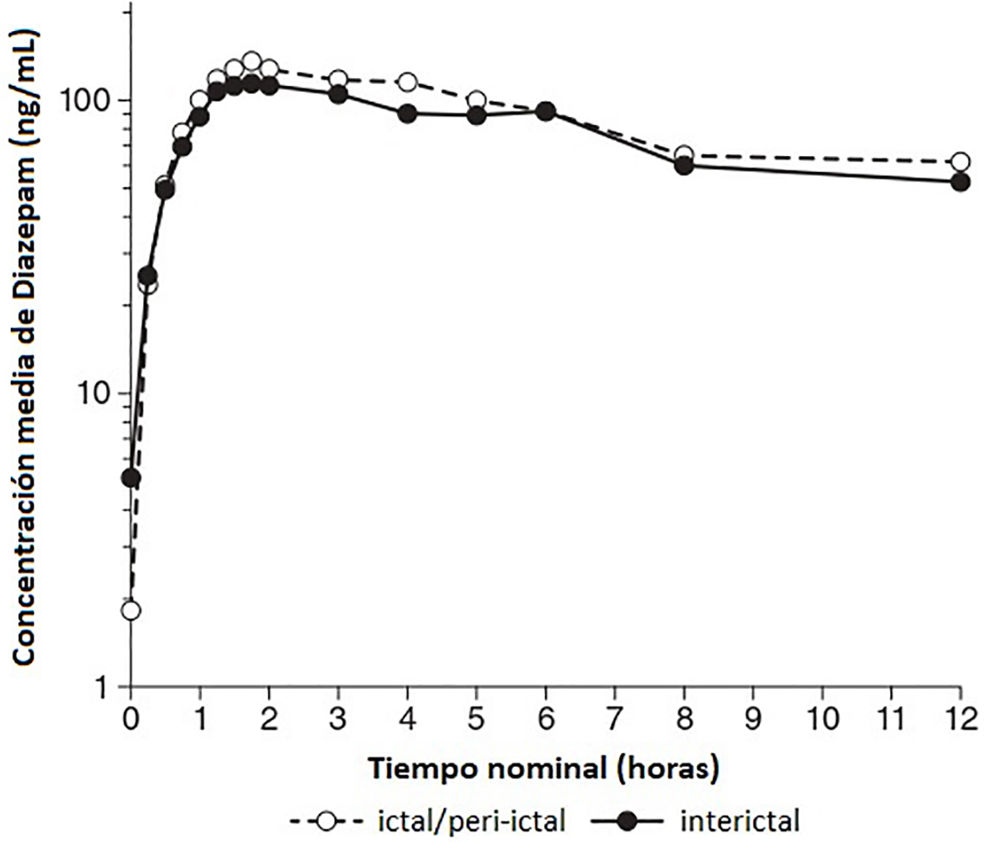
La farmacocinética del diazepam intranasal fue luego evaluada en 2 condiciones, la ictal/peri-ictal (definida como la administración realizada dentro de los 5min desde el inicio de la crisis) y la interictal (libre de crisis por al menos 12h)36, no habiéndose observado diferencias significativas en la Cmáx, siendo esta a su vez comparable con otras vías de administración, por lo cual se puede inferir que las crisis no modifican los parámetros de absorción. La variabilidad farmacocinética inter-paciente fue relativamente baja, demostrando un perfil sólido y más confiable que el diazepam rectal (fig. 3).
Concentración plasmática de diazepam vs. tiempo luego de la administración de diazepam intranasal en las condiciones ictal e interictal. Fuente: usado con permiso de Hogan et al.36, 2020.
La administración del diazepam intranasal como terapia de rescate logró el buen control de las crisis dentro de los 10min en la mayoría de los episodios. La mediana de duración de las crisis desde el inicio hasta el cese en el grupo tratado fue de 6min, con el 62% de los eventos finalizando dentro de los 10min. La mediana de tiempo desde la administración hasta la finalización de las crisis fue de 4min, con un rango de 1-1.151min37.
Seguridad y tolerabilidadEn un estudio abierto de fase 3 de 12 meses de duración, se evaluó la seguridad a largo plazo, en pacientes con crisis agrupadas de 6 a 65 años, sin excluir a pacientes con antecedentes de status epiléptico o con comorbilidades asociadas como, por ejemplo, rinitis estacional38. Se utilizaron dosis calculadas por peso corporal, con la posibilidad de una segunda administración entre las 4 y 12h de la inicial, y dejando pasar al menos 5 días antes de repetir el tratamiento y no más de 5 aplicaciones por mes13. De igual manera, el estudio dejó librado al investigador principal la posibilidad de administrar una segunda dosis cuando lo considerara necesario. De hecho, en el artículo publicado por Sperling et al., 152 dosis (un 4% del total de las dosis en el estudio) fueron dadas entre 0-4h sin observarse ningún problema desde el punto de vista de eficiencia o seguridad33. Por otro lado, es importante destacar que, al día de hoy, este es el estudio que registró el mayor número de crisis agrupadas.
Un subanálisis de este estudio incluyó 132 pacientes estratificados por el número promedio de dosis utilizadas por mes: frecuencia moderada (<2); frecuencia alta (2-5); y frecuencia muy alta (>5). Las proporciones de pacientes con efectos adversos que el investigador consideró posible o probablemente relacionados con el fármaco de estudio fueron del 11,6 y el 18,8% en los grupos de frecuencia moderada y alta, respectivamente, y del 33,3% en el grupo de frecuencia muy alta38. El malestar nasal ocurrió únicamente en pacientes que recibieron dosis de 15 y 20mg y, por lo general, fue leve y transitoria, sin asociar cambios significativos en el olfato. Además, ningún efecto adverso serio fue considerado por el investigador como posiblemente relacionado con el uso de diazepam intranasal38. Por lo tanto, estos resultados respaldan la utilidad, el perfil de seguridad y la eficacia del diazepam intranasal en crisis agrupadas con distintas frecuencias de crisis epilépticas.
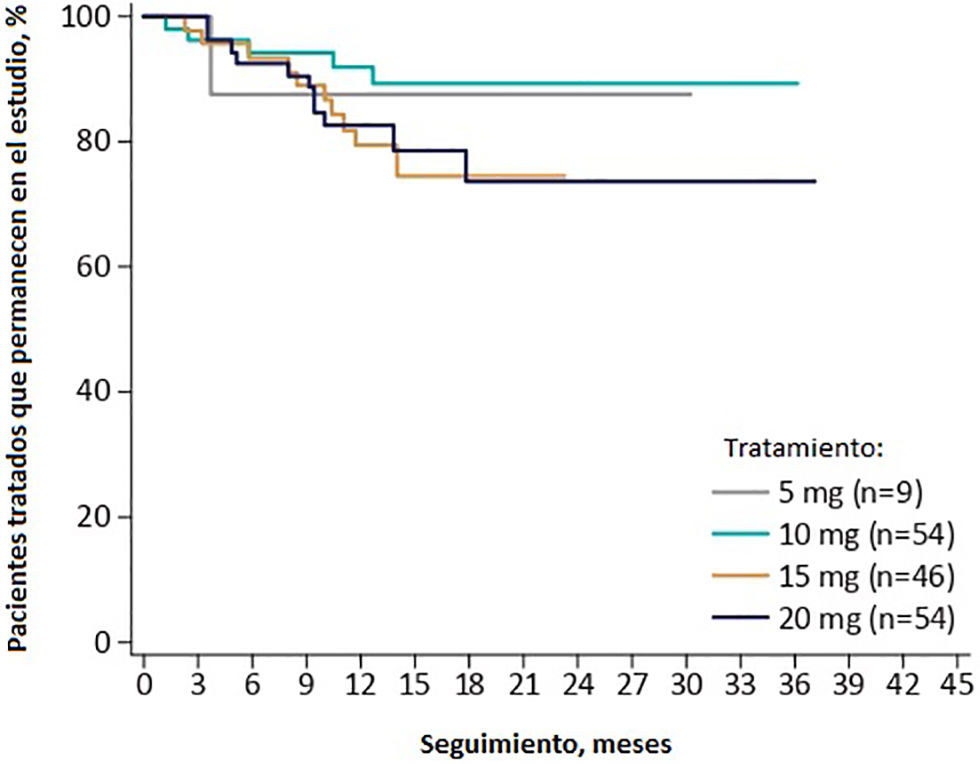
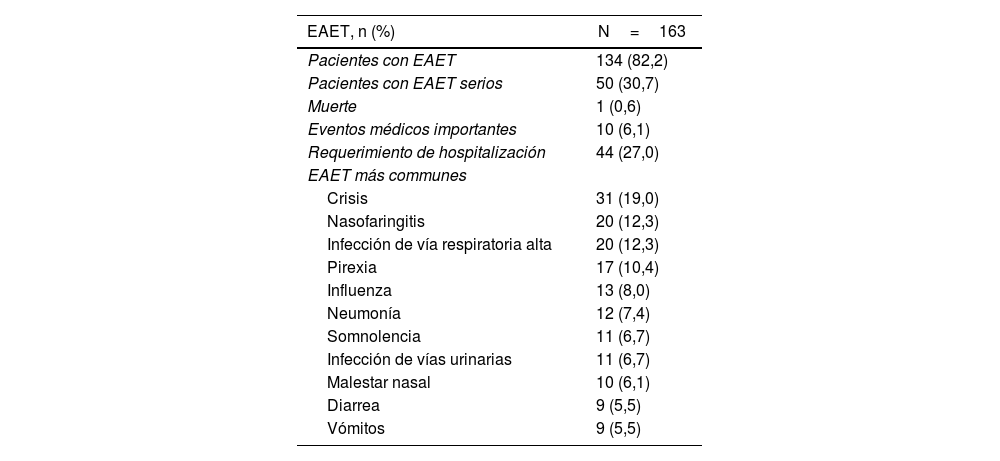
En el año 2021 el mismo grupo de trabajo publicó los resultados finales de dicha investigación sobre 163 pacientes que recibieron al menos una dosis del de diazepam intranasal34. El perfil de seguridad fue similar al observado en los estudios previos, con una exposición ≥1 año en el 81,6% de los pacientes. Un 18,4% de los pacientes manifestaron haber tenido algún efecto adverso que el investigador consideró relacionado al tratamiento. El más común fue el malestar nasal (6,1%); seguido por cefalea (2,5%); luego disgeusia, epistaxis y somnolencia (1,8% cada una)34 (tabla 1). La prueba de irritación nasal, evaluada por un observador capacitado, mostró que la mayoría de los pacientes no experimentaron signos de irritación nasal; los pocos casos de irritación fueron transitorios. Además, no hubo cambios olfativos significativos según lo medido por la prueba de identificación de olores NIH Toolbox34,38. La tasa de retención de pacientes fue alta, con el 71,8% de los pacientes permaneciendo durante una exposición media de 17,4 meses en el estudio al momento del análisis, sin discontinuaciones por efectos adversos34, lo que respalda eficacia del diazepam intranasal en esta población de pacientes (fig. 4).
Eventos adversos emergentes durante el tratamiento ocurriendo en ≥5% de la población
| EAET, n (%) | N=163 |
|---|---|
| Pacientes con EAET | 134 (82,2) |
| Pacientes con EAET serios | 50 (30,7) |
| Muerte | 1 (0,6) |
| Eventos médicos importantes | 10 (6,1) |
| Requerimiento de hospitalización | 44 (27,0) |
| EAET más communes | |
| Crisis | 31 (19,0) |
| Nasofaringitis | 20 (12,3) |
| Infección de vía respiratoria alta | 20 (12,3) |
| Pirexia | 17 (10,4) |
| Influenza | 13 (8,0) |
| Neumonía | 12 (7,4) |
| Somnolencia | 11 (6,7) |
| Infección de vías urinarias | 11 (6,7) |
| Malestar nasal | 10 (6,1) |
| Diarrea | 9 (5,5) |
| Vómitos | 9 (5,5) |
EAET: eventos adversos emergentes durante el tratamiento.
Pacientes permaneciendo en el estudio a lo largo del tiempo. Fuente: usado con permiso de Wheless et al.34, 2021.
Otro subanálisis realizado en el estudio de Wheless J. et al fue la seguridad y tolerancia en la población de pacientes que utilizaron benzodiacepinas de forma concomitante4. Este estudio fue abierto y no apto para obtener datos de eficacia teórica, pero permitió un análisis de eficacia real y de análisis de tolerancia al fármaco. Para tales fines se analizó la proporción de crisis agrupadas durante las cuales se requirió el uso de una segunda dosis dentro de las 24h en pacientes con y sin BZD concomitantes, como así también la necesidad de una segunda dosis en aquellos con una tasa de uso más elevada. Clobazam y clonazepam fueron las BZD más frecuentemente usadas en forma crónica, mientras que diazepam, lorazepam y clonazepam fueron las más utilizadas en forma intermitente. Solo el 12,6% de los eventos requirieron de una segunda dosis, sin diferencias clínicas significativas en relación con la tasa de uso mensual ni al uso asociado de BZD en forma regular, sugiriendo que el desarrollo de tolerancia no parece ser un tema preocupante en esta subpoblación. Si bien el porcentaje de efectos adversos serios fue mayor en el grupo con uso crónico de BZD (35 vs. 23%), en ningún grupo se observó depresión cardiorrespiratoria o sedación, y ningún efecto adverso grave estuvo relacionado con el fármaco en estudio33. Por lo tanto, el diazepam intranasal es seguro y eficaz en pacientes mayores de 6 años independientemente del uso concomitante o no de BZD (incluso clobazam)33.
Otra población a tener en cuenta son aquellos pacientes con rinitis alérgica. Vasquez et al. analizaron si las alergias estacionales alteraban el control de crisis al comparar el uso de una segunda dosis de rescate en pacientes con y sin antecedente de rinitis alérgica. Los resultados de este análisis mostraron que las alergias estacionales no aumentaron la tasa de uso de una segunda dosis; lo cual sugiere que no hay un cambio significativo en el patrón de uso de la medicación39. Se plantea que esto puede ser, entre otras cosas, debido a que la formulación del diazepam intranasal incluye DDM (Intravail®) y vitamina E que facilita su absorción. En este estudio también se demostró que el perfil de seguridad y tolerabilidad es similar en pacientes con y sin antecedentes de rinitis estacional39. El perfil de seguridad del diazepam intranasal fue consistente en todos los subgrupos, independientemente de la edad, la frecuencia de uso, el tratamiento concomitante con BZD o la presencia de alergia/rinitis estacional.
Actualmente la eficacia de las terapias de rescate intermitente para las crisis agrupadas no está bien establecida en la literatura, por lo cual Misra S. et al. realizaron un análisis novedoso en el cual evaluaron si el tiempo entre crisis agrupadas (SEIVAL=intervalo entre crisis agrupadas) cambia con la administración de diazepam intranasal como terapia de rescate intermitente40. Este grupo encontró en una cohorte de 76 pacientes, un patrón consistente y estadísticamente significativo en el aumento del SEIVAL a lo largo del tiempo en todas las poblaciones analizadas. Se demostró una duplicación del SEIVAL entre los pacientes que recibieron terapia de rescate entre 1-90 días (periodo 1) con una media de SEIVAL de 12,2 y los pacientes del período 4 (271-360 días) con una media de SEIVAL 25.7, demostrando así que mientras mayor sea el período de uso de diazepam intranasal como rescate, mayor será el SEIVAL de estos pacientes. Sin embargo, esta es una hipótesis que se debe confirmar con futuras investigaciones.
Por último, es relevante mencionar que, mediante una encuesta realizada al finalizar el estudio fase 3 de seguridad41, tanto los pacientes como los cuidadores se mostraron conformes con su uso y cómodos de utilizarlo en espacios públicos, prefiriéndolo sobre la vía rectal. El 93,8% de los cuidadores calificó el dispositivo como fácil o muy fácil de utilizar, y el 40,3% de los encuestados se lo había autoadministrado al notar el primer síntoma de sus crisis, incluyendo un niño de 11 años. El 59% de los pacientes fueron capaces de retomar sus actividades diarias dentro de la hora de utilización41.
ConclusiónEn la búsqueda de métodos alternativos de administración de fármacos que tengan mayor aceptación social, la vía intranasal cumple con los requisitos para poder ser utilizada en forma efectiva, surgiendo así las formulaciones intranasales. El diazepam intranasal ha demostrado tener una buena absorción, baja variabilidad entre pacientes, de fácil administración y con buena aceptación social para ser utilizada en el ámbito extrahospitalario. Es importante remarcar que el diazepam intranasal representa una excelente alternativa de uso inmediato para el tratamiento de crisis agrupadas, mitigando los riesgos de crisis prolongadas y eventualmente SE.
FinanciaciónM.C.G., M.C.B.D. y Y.L.G.F. han recibido compensación para realizar material de difusión de Celnova.
Conflicto de interesE.C. y A.L.R. son empleados y reciben compensación de Neurelis.