La leucoencefalopatía multifocal progresiva (LMP) es una enfermedad desmielinizante producto de la reactivación del virus John Cunningham (JC) en el sistema nervioso central (SNC) en pacientes que presentan diversos grados de inmunocompromiso. Sus manifestaciones clínicas e imagenológicas están bien descriptas, pero es necesaria una alta sospecha de la enfermedad para arribar al diagnóstico.
ObjetivosRealizar una descripción clínica y de estudios complementarios en pacientes con LMP confirmada.
Pacientes y métodosEstudio multicéntrico retrospectivo descriptivo de pacientes con LMP confirmada, obteniendo datos demográficos, clínicos, imagenológicos, de laboratorio y biopsias a partir de historias clínicas.
ResultadosDoce pacientes con diagnóstico definitivo de LMP: 10 con VIH/sida (virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida), 1 con linfoma no Hodgkin (LNH) y tratamiento con rituximab y 1 con VIH/sida, LNH y rituximab. En RM de cráneo todas las lesiones se mostraron hiperintensas en FLAIR y T2 e hipointensas en T1, en 7 bilaterales y en 4 realzaron con contraste EV. Los sitios más afectados fueron el lóbulo frontal, el parietal y el tronco encefálico, que se correlacionan con las sintomatologías más frecuentes (trastornos motores e incoordinación). El líquido cefalorraquídeo (LCR) no mostró alteraciones significativas. Los dos pacientes con sobrevida mayor a 1año fueron aquellos que presentaron PCR negativa para JC en LCR.
ConclusionesLa LMP es una enfermedad que requiere de alta sospecha para su estudio y diagnóstico. Destacamos el considerable compromiso de sustancia gris tanto profunda como cortical evidenciado en este estudio. Es importante señalar el hallazgo de mayor sobrevida en aquellos en los que la PCR para JC fue negativa en LCR.
Progressive multifocal leukoencephalopathy (PML) is a demyelinating disease caused by the reactivation of the John Cunningham virus (JCV) in the central nervous system (CNS) in patients with several degrees of immunocompromised status. Its clinical and imaging manifestations are well described, but a high index of suspicion for the disease is necessary to arrive at a diagnosis.
ObjectivesTo provide a clinical description and complementary studies in patients with confirmed PML.
Patients and methodsA retrospective descriptive multicentre study of patients with confirmed PML, obtaining demographic, clinical, imaging, laboratory, and biopsy data from medical records.
ResultsTwelve patients with a definitive diagnosis of PML: 10 with HIV/AIDS (human immunodeficiency virus/acquired immunodeficiency syndrome), 1 with non-Hodgkin lymphoma (NHL) and treatment with rituximab and 1 with HIV/AIDS, NHL and rituximab. In cranial MRI, all lesions appeared hyperintense on FLAIR and T2 and hypointense on T1, with 7 being bilateral, and 4 enhancing with EV contrast. The most affected sites were the frontal lobe, parietal lobe, and brainstem, correlating with the most frequent symptoms (motor disorders and incoordination). CSF showed no significant alterations. The two patients with survival greater than 1year were those with negative JC PCR in CSF.
ConclusionsPML is a disease that requires high suspicion to be studied and diagnosed. We highlight the considerable involvement of both deep and cortical gray matter evidenced in this study. It is important to note the observation of increased survival in those with negative JC PCR in CSF.
La leucoencefalopatía multifocal progresiva (LMP) representa una enfermedad desmielinizante que conlleva el riesgo de ser potencialmente fatal o dejar secuelas neurológicas graves, siendo desencadenada por la reactivación del poliomavirus John Cunningham (JC)1,2. La infección primaria con el virus JC generalmente se produce durante la infancia, quedando latente en diversos tejidos2. Es relevante destacar que un porcentaje significativo de la población mundial ha estado expuesto al virus JC en algún momento de su vida, estimándose entre un 40% y un 80%. No obstante, la reactivación posterior de la infección, dando lugar a la LMP, se manifiesta con mayor frecuencia en individuos con inmunocompromiso grave3-5.
La resonancia magnética (RM) desempeña un papel crucial en la identificación y caracterización de las lesiones cerebrales vinculadas a esta patología1. En las etapas iniciales de la enfermedad las lesiones son de tamaño reducido y naturaleza unifocal. Estas suelen localizarse en áreas subcorticales o yuxtacorticales, afectando particularmente las fibrasU, mientras que la afectación cortical se describe como excepcional. Los lóbulos frontal, parietal y occipital, junto con el cuerpo calloso, emergen como sitios prominentes de afectación en la carga de la enfermedad3,4.
Las primeras descripciones de la enfermedad fueron realizadas en pacientes afectados por leucemia linfática crónica y linfoma de Hodgkin. Una extensa revisión llevada a cabo por Brooks y Walker6,7 analizó 230 casos de LMP ocurridos entre 1958 y 1984; las causas subyacentes fueron enfermedades linfoproliferativas (62,2%), enfermedades mieloproliferativas (6,5%), carcinoma (2,2%), tuberculosis y sarcoidosis (7,4%), y otras deficiencias inmunitarias (16,1%). El sida estaba categorizado dentro de esta clasificación, pero solo representaba el 2,1% de los casos. Con la expansión epidémica de la infección por VIH y el aumento de casos de sida, la incidencia de LMP experimentó un notable aumento, siendo así que un análisis de 156 casos de LMP en Florida, abarcando el periodo de 1980 a 1994, reveló que el 98,7% de ellos estaban asociados con el VIH/sida8,9. Según el boletín nacional n.° 39 «Respuesta al VIH y las ITS en la Argentina»10, se estima que 140.800 personas viven con VIH en nuestro país: el 13% desconocen su diagnóstico, y en el 30,1% se realiza en forma tardía.
Es llamativa la falta de estudios y reportes de esta enfermedad en países Latinoamericanos y en Argentina, por lo que es de particular interés analizar y publicar esta serie de casos.
ObjetivosEl presente estudio multicéntrico se propone explorar de manera exhaustiva los perfiles clínicos, radiológicos y virológicos de pacientes con diagnóstico de LMP.
Pacientes y métodosSe llevó a cabo un estudio retrospectivo descriptivo de 12 pacientes con LMP diagnosticados en el período 2010-2023, con revisión de historias clínicas, laboratorio, imágenes y biopsias en tres centros de tercer nivel de atención de la Ciudad de Rosario. Se contó con la aprobación del Comité de Ética de los respectivos centros. Se incluyeron pacientes mayores de 18años, con diagnóstico confirmado de LMP (PCR para JC positiva en LCR o en biopsia de SNC). Los datos obtenidos fueron volcados en una planilla de Microsoft Excel, para su posterior análisis con el software IBM SPSS Statistics. Se utilizaron gráficos y tablas para la presentación de resultados; las variables cuantitativas se expresaron como media y rango, y las cualitativas, con frecuencias absolutas y relativas.
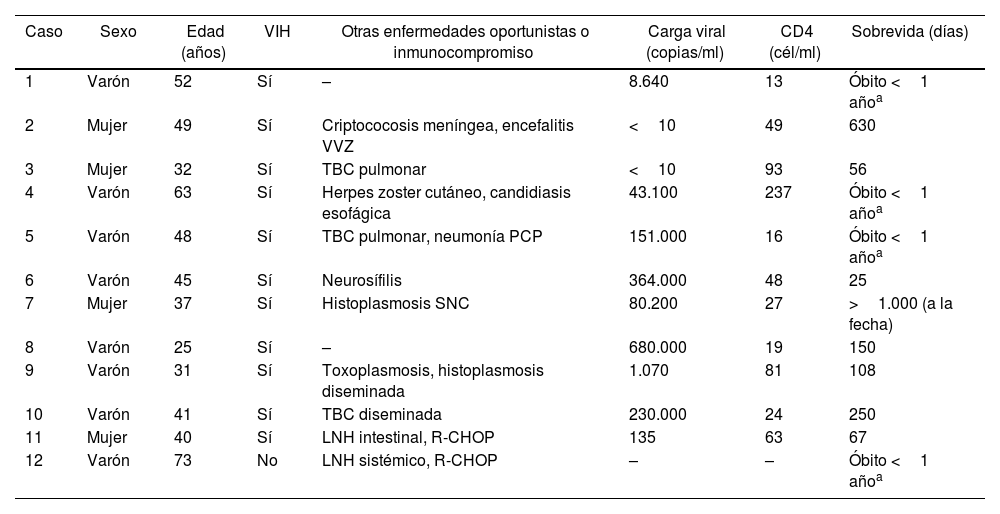
ResultadosSe evaluó un total de 12 pacientes, de los cuales 8 fueron hombres y 4 mujeres, con un promedio de edad de 44,6años (con un rango de 32 a 73años). Los datos individuales de cada paciente se encuentran resumidos en la tabla 1. En los pacientes con VIH, la media del recuento de CD4 fue de 73,58células/ml y la carga viral, 173.127copias/ml.
Datos demográficos y antecedentes de relevancia
| Caso | Sexo | Edad (años) | VIH | Otras enfermedades oportunistas o inmunocompromiso | Carga viral (copias/ml) | CD4 (cél/ml) | Sobrevida (días) |
|---|---|---|---|---|---|---|---|
| 1 | Varón | 52 | Sí | – | 8.640 | 13 | Óbito <1 añoa |
| 2 | Mujer | 49 | Sí | Criptococosis meníngea, encefalitis VVZ | <10 | 49 | 630 |
| 3 | Mujer | 32 | Sí | TBC pulmonar | <10 | 93 | 56 |
| 4 | Varón | 63 | Sí | Herpes zoster cutáneo, candidiasis esofágica | 43.100 | 237 | Óbito <1 añoa |
| 5 | Varón | 48 | Sí | TBC pulmonar, neumonía PCP | 151.000 | 16 | Óbito <1 añoa |
| 6 | Varón | 45 | Sí | Neurosífilis | 364.000 | 48 | 25 |
| 7 | Mujer | 37 | Sí | Histoplasmosis SNC | 80.200 | 27 | >1.000 (a la fecha) |
| 8 | Varón | 25 | Sí | – | 680.000 | 19 | 150 |
| 9 | Varón | 31 | Sí | Toxoplasmosis, histoplasmosis diseminada | 1.070 | 81 | 108 |
| 10 | Varón | 41 | Sí | TBC diseminada | 230.000 | 24 | 250 |
| 11 | Mujer | 40 | Sí | LNH intestinal, R-CHOP | 135 | 63 | 67 |
| 12 | Varón | 73 | No | LNH sistémico, R-CHOP | – | – | Óbito <1 añoa |
LNH: linfoma no Hodgkin; PCP: Pneumocystis jirovecii; R-CHOP: rituximab, ciclofosfamida, clorhidrato de doxorubicina, sulfato de vincristina y prednisona (esquema terapéutico para tratamiento de LNH); TBC: tuberculosis; VIH: virus de la inmunodeficiencia humana; VVZ: virus varicela zóster.
a Se desconoce la cantidad exacta de días.
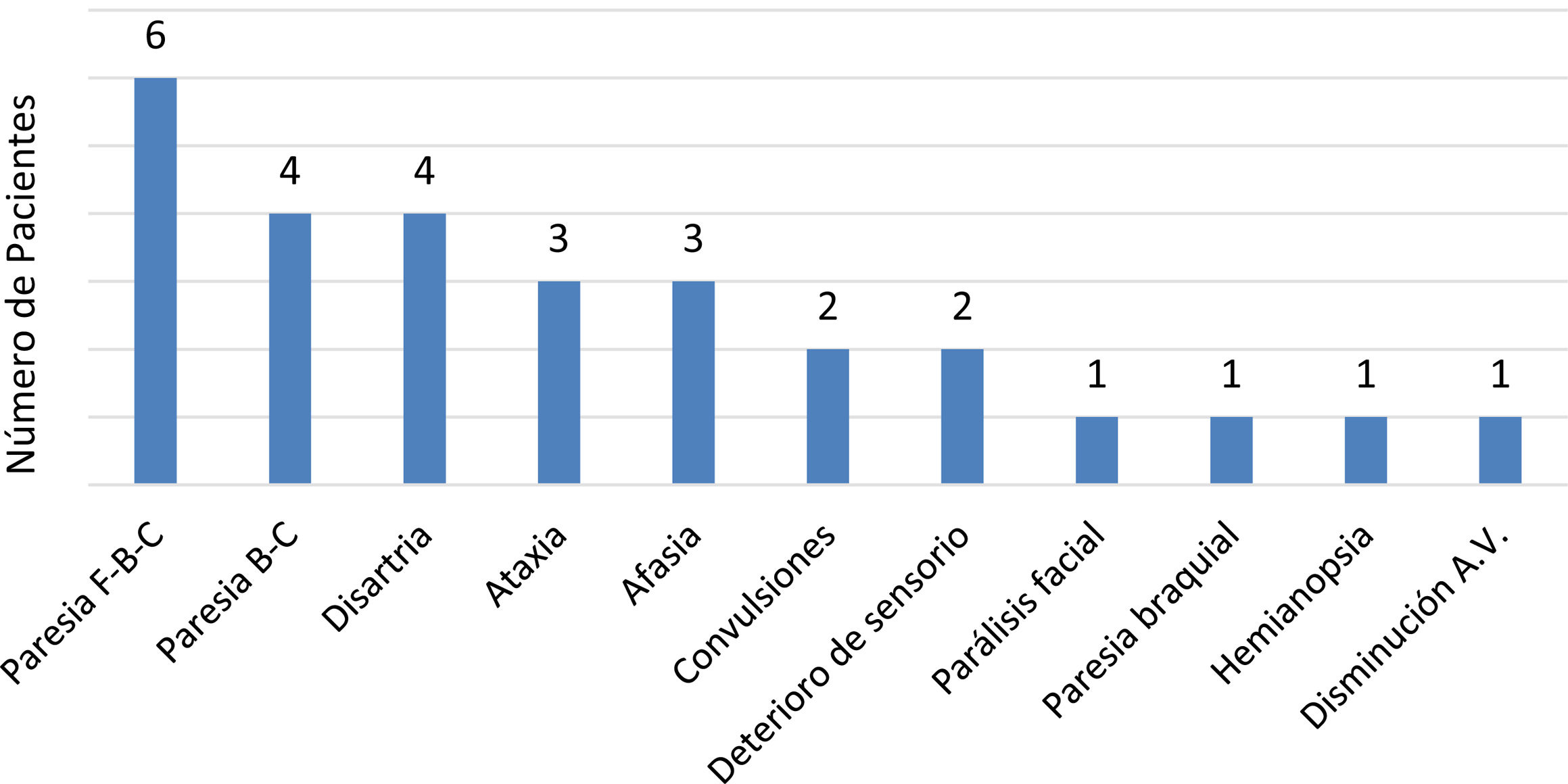
Evaluando las presentaciones clínicas de los casos, todos manifestaron síndromes focales o multifocales motores, sumado o no a otros signos y síntomas (fig. 1 y tabla 2).
Manifestaciones clínicas agrupadas por paciente
| Caso | Signo-Sintomatología |
|---|---|
| 1 | Paresia F-B-C, afasia, hemianopsia homónima |
| 2 | Paresia B-C, confusión |
| 3 | Paresia B-C, disminución agudeza visual bilateral |
| 4 | Paresia F-B-C |
| 5 | Paresia B-C, ataxia |
| 6 | Paresia F-B-C, convulsión |
| 7 | Paresia F-B-C, disartria |
| 8 | Disartria, afasia |
| 9 | Paresia F-B-C, disartria, afasia, convulsión |
| 10 | Paresia B-C, ataxia |
| 11 | Paresia F-B-C, ataxia |
| 12 | Deterioro del sensorio |
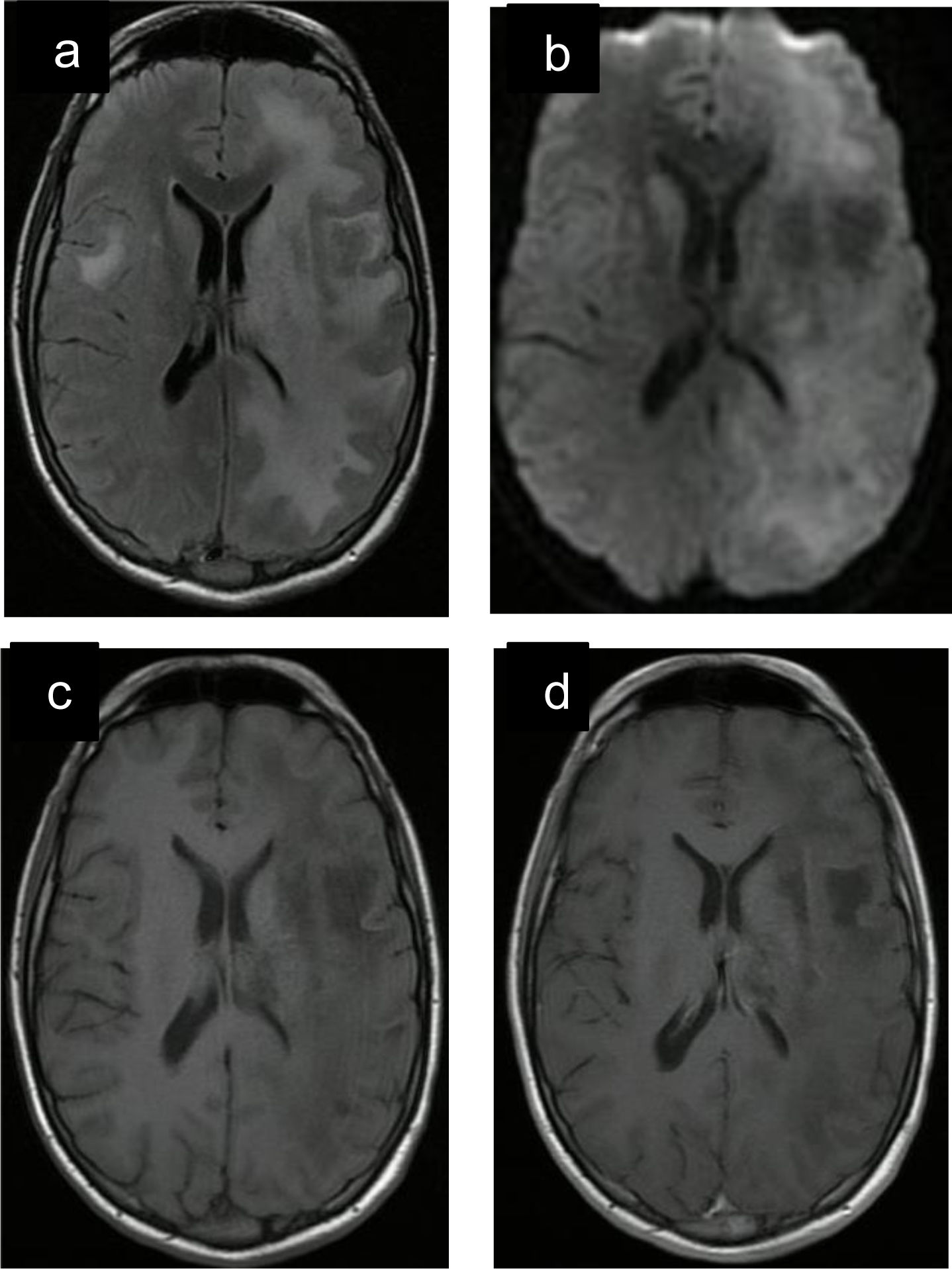
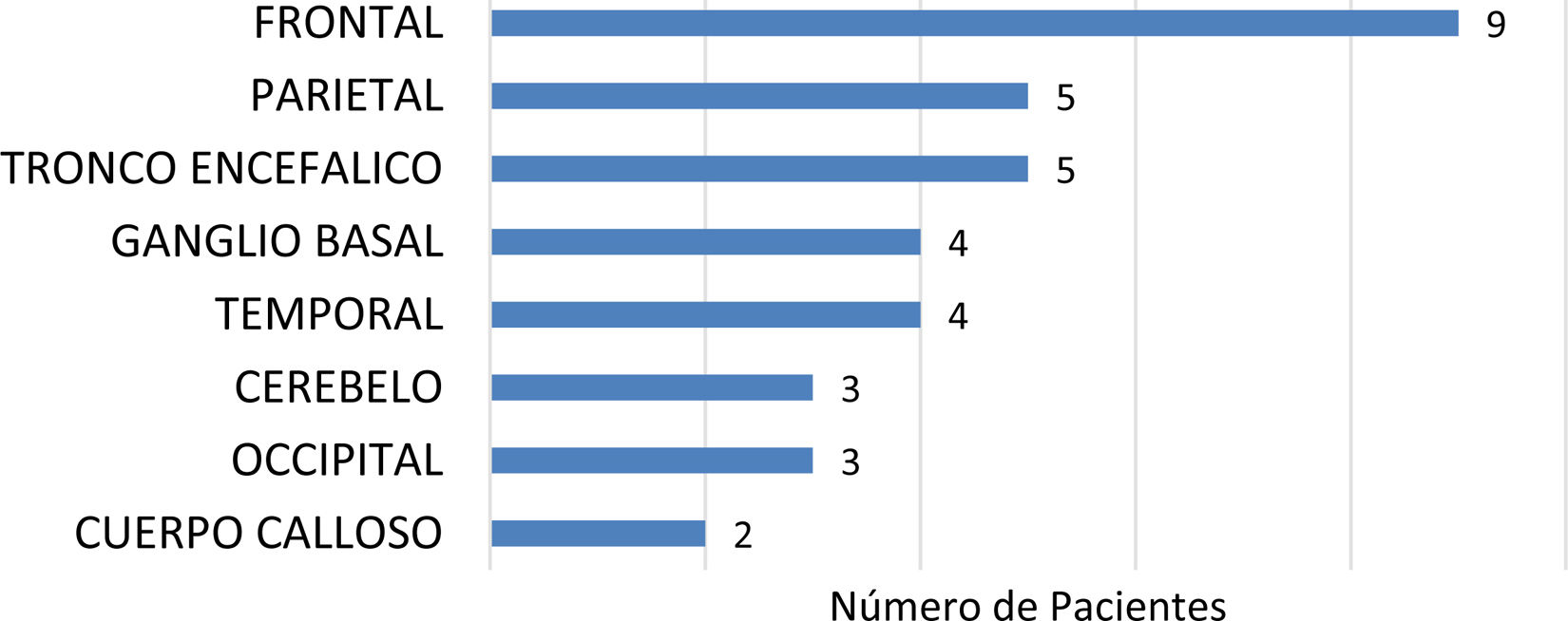
Todos los pacientes contaron con angio-RM de cráneo con contraste en resonador magnético de 1,5 tesla al momento del diagnóstico de la enfermedad. El total de las lesiones descritas se presentaron hiperintensas en secuencias FLAIR y T2 e hipointensas en T1 (fig. 2). En 7 pacientes las lesiones fueron bilaterales, en 4 presentaron realce con contraste EV y en 5 exhibieron compromiso de áreas corticales. En la figura 3 se representan las localizaciones según el orden de frecuencia.
Resonancia magnética nuclear de cráneo (caso clínico n.° 8). Lesión subcortical y yuxtacortical frontal derecha y fronto-parieto-occipital, cápsula interna, tálamo y núcleo lenticular izquierdo hiperintensa FLAIR (a), tenue restricción de señal en DWI (b), hipointensa en T1 (c), sin realce con contraste EV (d).
El análisis del líquido cefalorraquídeo (LCR) arrojó como resultados que 10 pacientes tenían un recuento de elementos de 3/mm3 o menor, y los 2 restantes tuvieron 7/mm3 y 9/mm3. Todos tuvieron proteinorraquia por debajo de 1g/l, con una media de 0,46g/l (mínimo 0,31g/l y máximo 0,89g/l). Ningún paciente presentó disminución de glucorraquia con respecto a la glucemia capilar.
La PCR para virus JC en LCR fue detectable en 10 de los pacientes, y en los 2 restantes el diagnóstico llegó por PCR realizada en tejido de biopsia cerebral. Diez del total de pacientes presentaron una sobrevida menor a un año (óbito entre 25 y 250días desde el inicio de los síntomas), y 2 con una sobrevida mayor a un año (630 y >1.000días). Es de destacar que estos últimos dos casos fueron aquellos en los que la PCR para JC en LCR fue no detectable.
DiscusiónEn el presente análisis de 12 casos de LMP confirmada, los pacientes presentaron como antecedentes enfermedad por VIH, linfoma no Hodgkin o tratamiento inmunosupresor con rituximab, todos ellos factores de riesgo conocidos para desarrollar esta enfermedad por reactivación del virus JC9,11,12. En los pacientes con VIH, la media del recuento de CD4 y de la carga viral evidencian que tanto un valor elevado de esta última, así como un bajo recuento de CD4, son factores predisponentes para presentar la enfermedad, reflejando diversos grados de inmunosupresión. Hubo un paciente con un recuento de CD4>200células/ml, valor mayor al esperado para desarrollar esta patología. En los últimos años, además del recuento total de CD4, se está considerando la relación CD4/CD8. En este aspecto, una relación menor a1, a pesar de tener recuento de CD4 normales, es el reflejo de un desequilibrio en dichas poblaciones y puede explicar por qué un paciente puede presentar enfermedades marcadoras y no marcadoras de sida. En este caso no disponemos de dichos datos, pero podría ser la causa de por qué, a pesar de sus valores altos de CD4, presentó una reactivación del virus JC13.
Al evaluar las manifestaciones clínicas encontramos que lo más frecuente fueron los signos focales motores, seguidos por alteraciones de la coordinación. De manera llamativa encontramos signos de afectación cortical, tales como afasia, hemianopsia y convulsiones. Todas estas manifestaciones se correlacionan con las lesiones evidenciadas en RM de cráneo, donde los sitios mayormente afectados fueron los lóbulos frontal y parietal y el tronco encefálico. Estos resultados son similares a los descritos en la literatura3,4, así como los encontrados por Camporro et al.1 un análisis de 15 casos de LMP realizado en un centro neurológico de Argentina. Si bien es una enfermedad que característicamente afecta la sustancia blanca, en nuestro análisis encontramos que, en un considerable número de casos, hubo compromiso de sustancia gris tanto profunda como cortical. Esto último explicaría la presencia de síntomas como afasia y convulsiones, ya que todos los pacientes con estas manifestaciones clínicas demostraron compromiso de sustancia gris cortical. En la literatura se describen estos hallazgos como aislados, y por lo general sujetos a cuadros de reconstitución inmune9,14.
El análisis del LCR no muestra hallazgos de jerarquía que permitan una alta sospecha de la enfermedad, si bien puede afirmarse que las alteraciones presentes en el mismo son leves, con ligero incremento en el valor de celularidad y proteinorraquia, sin alteraciones en la glucorraquia. Del mismo modo, tanto a nivel mundial como en el estudio mencionado previamente1 se encontraron valores similares en dichas determinaciones, por lo que podría ser prudente mencionar que deben considerarse diagnósticos alternativos ante la presencia de mayores alteraciones en los respectivos valores del LCR.
El pronóstico de la enfermedad es sombrío, con una sobrevida variable pero reportada en meses, dependiendo de la causa primaria de la inmunosupresión, del acceso al TARV en pacientes que viven con VIH/sida y en el cese de la exposición a fármacos inmunosupresores en los casos que corresponda4,15. En nuestro análisis queda demostrada una baja supervivencia de los pacientes, dado que la mayoría fallecieron antes del año desde el inicio de los síntomas.
Es llamativo que los dos pacientes con mayor sobrevida fueron aquellos que presentaron PCR para JC en LCR no reactiva. Si bien estos datos no son concluyentes, nos llevan a postular que la presencia de PCR negativa es un reflejo de baja carga viral de JC en dicho líquido y que podría estar relacionado con un mejor pronóstico evolutivo, aunque esta conclusión va más allá de nuestros objetivos y requiere futuros estudios16.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con el contenido de este manuscrito.