A pesar de la efectividad de los tratamientos inyectables para la esclerosis múltiple (EM), las reacciones adversas y el dolor pueden implicar problemas de satisfacción y adherencia. Se presenta la validación de la versión española del Multiple Sclerosis Treatment Concerns Questionnaire (MSTCQ)©, que evalúa la satisfacción con el dispositivo de autoinyección (DA), 4 dimensiones: sistema de inyección (A), efectos secundarios (B) (síntomas pseudogripales, reacciones, satisfacción), experiencia con el tratamiento (C) y beneficios (D).
MétodosDos fases de estudio: 1) Adaptación cultural con expertos (n=6) y pacientes (n=27). 2) Estudio observacional, transversal y multicéntrico de validación. Se evaluaron 143 pacientes adultos con EM que utilizaban el DA Extaviject™30G. Cuestionarios: MSTCQ©; Patient-Reported Indices for Multiple Sclerosis (PRIMUS©), y Treatment Satisfaction Questionnaire for Medication (TSQM©). Propiedades psicométricas: factibilidad (% casos válidos y distribución de puntuaciones); fiabilidad (α-Cronbach) y test-retest (n=41, coeficiente correlación intraclase [CCI]), y validez de constructo (análisis factorial A y B, [AF]) y convergente (Spearman-rho MSTCQ© versus TSQM©).
ResultadosEdad media (DT) 41,94 (10,47) años, 63% mujeres, 88,11% con EM remitente-recurrente, media (DT) EDSS 2,68 (1,82) puntos. Alta cumplimentación del MSTCQ© (perdidos 0-2,80%). Alta consistencia interna: puntuación total (A+B) α=0,89, por dimensiones (A, B y C) α=0,76, 0,89 y 0,92, respectivamente. Excelente concordancia test-retest en las puntuación total (CCI=0,98), por dimensiones (A, B y C) CCI=0,82, 0,97 y 0,89, respectivamente. El AF corroboró la estructura interna del cuestionario original. Correlación moderada (Rho=0,42-0,74) y significativa (p<0,05 y p<0,01) entre las puntuación total y por dimensiones del MSTCQ© y el TSQM©.
ConclusionesSe constatan adecuadas propiedades psicométricas de la versión española del MSTCQ©.
Although subcutaneous treatments for multiple sclerosis (MS) have been shown to be effective, adverse reactions and pain may adversely affect treatment satisfaction and adherence. This study presents an adapted and validated Spanish version of the Multiple Sclerosis Treatment Concerns Questionnaire© (MSTCQ), which evaluates satisfaction with the injection device (ID) across 4 domains: injection system (A), side effects (B) (flu-like symptoms, reactions, and satisfaction), experience with treatment (C) and benefits (D).
MethodsTwo study phases: 1) Cultural adaptation process with input from experts (n=6) and patients (n=30). 2) Validation obtained by means of an observational, cross-sectional, multi-centre study evaluating 143 adult MS patients using an ID. Tools employed: MSTCQ©, Patient-Reported Indices for Multiple Sclerosis (PRIMUS©), and Treatment Satisfaction Questionnaire for Medication (TSQM©). Psychometric properties: Feasibility (percentage of valid cases and floor/ceiling effects); Reliability (Cronbach α) and test-retest correlation (n=41, intraclass correlation coefficient, ICC); and construct validity (factor analysis of domains A and B) and convergent validity (Spearman rank-order correlation for MSTCQ© vs TSQM©).
ResultsMean age (SD) was 41.94 (10.47) years, 63% of the group were women, and 88.11% presented relapsing-remitting MS. Mean (SD) EDSS score was 2.68 (1.82) points. MSTCQ© completion was high (0%-2.80% missing data). Internal consistency was high at α=0.89 for the total score (A+B) and α=0.76, 0.89, and 0.92 for domains A, B, and C, respectively. The version demonstrated excellent test-retest reliability for the total (ICC=0.98) and for domains A, B, and C: ICC=0.82, 0.97, and 0.89, respectively. Factor analysis corroborated the internal structure of the original questionnaire. The association between total and domain scores on both the MSTCQ© and the TSQM© was moderately strong (Rho=0.42-0.74) and significant (P<.05 and P<.01).
ConclusionThe Spanish version of MSTCQ© demonstrates appropriate psychometric properties.
La esclerosis múltiple (EM) es una enfermedad neurológica crónica, desmielinizante e inmunomediada que afecta al sistema nervioso central (SNC)1,2 en la que se diferencian principalmente 3 subtipos clínicos3: la forma remitente-recurrente (EMRR), caracterizada por episodios agudos recurrentes de síntomas neurológicos (brotes) seguidos de una remisión completa o parcial de los síntomas y sin progresión entre episodios; la forma secundaria progresiva (EMSP), evolución de la forma RR en la que hay progresión sin relación con los brotes, y la forma primaria progresiva (EMPP), que se caracteriza por la progresión desde el inicio con algunas estabilizaciones transitorias. Se denomina síndrome clínico aislado (CIS) al primer episodio de síntomas neurológicos causados por inflamación o desmielinización del SNC4.
Los objetivos terapéuticos principales en EM son el tratamiento de los brotes y la reducción de la frecuencia de estos y de la progresión de la discapacidad con terapias modificadoras del curso de la enfermedad (TME) de primera línea (interferón beta o acetato de glatirámero) y de segunda línea (fingolimod o natalizumab)4. El IFN beta-1b (IFNβ-1b) (Betaferon®/Extavia®) ha demostrado ser eficaz y seguro en la reducción del número y de la gravedad de las exacerbaciones clínicas5-7, con demostrada eficacia frente al IFNβ-1a8. Está indicado para el tratamiento de pacientes con CIS, EMRR y EMSP con brotes. Sin embargo, el método de administración del fármaco por vía subcutánea y a días alternos produce reacciones en el lugar de inyección (RLI) y dolor9 que, junto con los efectos secundarios (AE) de tipo pseudogripal, pueden causar problemas de satisfacción y falta de adherencia al tratamiento10,11.
En general, los pacientes satisfechos con un determinado tratamiento pautado por su médico demuestran mayor adherencia al mismo12. En el caso de la EM tratada con IFNβ-1b la adherencia al tratamiento mejora con el uso de autoinyecciones con agujas finas, pues se ha demostrado clínicamente que producen menos RLI13; esto ha conducido al desarrollo de dispositivos autoinyectores (DA) más seguros que producen menos temor a los pacientes que las agujas convencionales. Se ha desarrollado el ExtaviJect™30G, DA para la administración subcutánea de IFNβ-1b, que presenta como ventajas el pequeño diámetro de la aguja, que es de 0,31mm, y la posibilidad de ajustar la profundidad de la región subcutánea óptima (8, 10 o 12mm bajo la superficie de la piel)14.
Para medir la satisfacción del paciente con EM con el DA del tratamiento con IFNβ-1a se diseñó y validó, en lengua inglesa, el Multiple Sclerosis Treatment Concerns Questionnaire (MSTCQ©)15. El instrumento demostró mediante α de Cronbach una adecuada consistencia interna, es decir, todos los ítems de cada dimensión miden el mismo constructo, y además, mediante el coeficiente de correlación intraclase (CCI), la versión original demostró alta estabilidad temporal de las puntuaciones y adecuada validez de constructo (correlación significativa de las puntuaciones con la escala visual analógica de dolor y con el McGill Pain Questionnaire en su forma corta).
El MSTCQ© está compuesto por 9 ítems que miden: satisfacción con el «sistema de inyección» (dimensión A), α=0,70, CCI=0,68, y por 11 ítems que miden cuestiones sobre los «efectos secundarios» (AE) más habituales en los pacientes tratados con IFNβ-1a (dimensión B). La dimensión B se compone de 3 subescalas: AE pseudogripales, α=0,82, CCI=0,86; reacciones en el lugar de inyección (RLI), α=0,68, CCI=0,73, y satisfacción global, α=0,75, CCI=0,77. Todas las respuestas son en escala Likert de 5 alternativas. La puntuación del cuestionario es la suma de A y B (20 ítems).
Además, el cuestionario consta (en su versión follow-up para seguimientos) de la dimensión «experiencia con el tratamiento» (C), de 10 ítems relativos al cambio en la experiencia con el tratamiento desde que el paciente ha empezado a usar un nuevo dispositivo de inyección respecto del que utilizaba anteriormente, y un ítem 11 en el que los pacientes hacen una valoración general del cambio de DA, en una escala visual analógica (VAS) de 11 puntos (de −5 a 5 puntos). Y finalmente consta de una dimensión de «preferencias» (D) en la que los pacientes han de ordenar en importancia 4 de 5 beneficios del dispositivo.
Con el objetivo de que los especialistas en neurología de nuestro país puedan disponer en la práctica clínica del MSTCQ© como medida de satisfacción del paciente EM en tratamiento con IFNβ-1b mediante el dispositivo ExtaviJect™30G se diseñó este estudio, que consistió en la adaptación cultural y validación de las versión en español de este cuestionario. Además, como objetivo secundario se evaluó la satisfacción, la aceptación, la tolerabilidad, el cumplimento terapéutico y la calidad de vida relacionada con la salud (CVRS) de los pacientes que utilizan el autoinyector ExtaviJect™30G.
Pacientes y métodosEl presente estudio se diseñó en dos etapas: En primer lugar se realizó la adaptación cultural al contexto español del MSTCQ©15; y en segundo lugar, se evaluaron las propiedades psicométricas factibilidad, fiabilidad, y validez (de constructo y convergente):
Adaptación culturalEntre marzo y julio de 2011, 2 traductores independientes expertos, uno originario de España y otro del Reino Unido, realizaron una traducción del inglés al español del cuestionario MSTCQ© original15, así como una retro-traducción del español al inglés. Mediante un panel de traducción compuesto por los 2 traductores de la fase anterior y 2 psicólogos con amplia formación en el desarrollo y adaptación cultural de cuestionarios en el ámbito de la salud, se determinó la redacción en español del cuestionario.
Utilizando un formulario ad hoc, un panel de expertos neurólogos y profesionales de enfermería con actividad asistencial a pacientes con EM (n=6) y pacientes mayores de edad, diagnosticados de EM, seleccionados de manera consecutiva al acudir a consulta (n=27), evaluaron la pertinencia y la comprensibilidad de cada uno de los ítems de la versión traducida al español del MSTCQ© en una escala de 0 a 4 (0 indicaría nada y 4 totalmente). Además, los participantes en el panel pudieron ofrecer redacciones alternativas y comentarios sobre los ítems en un campo abierto del formulario.
Las puntuaciones promedio, en importancia y en comprensibilidad, fueron altas tanto desde el punto de vista de los expertos como del de los pacientes. En el análisis cualitativo de las respuestas abiertas se concluyó que los ítems de la versión evaluada del cuestionario se consideraron adecuados, aprobándose así la versión en español del MSTCQ©.
Evaluación de las propiedades psicométricasSe llevó a cabo un estudio observacional, transversal y multicéntrico, aprobado por el CEIC del Parc de Salut Mar (Barcelona). Entre los meses de octubre de 2011 y julio de 2012 (9meses) se recogieron datos de 143 pacientes en 15 consultas de Neurología de centros hospitalarios públicos del territorio español.
Para su participación en el estudio, los pacientes prestaron su consentimiento informado por escrito. Entraron a estudio pacientes con una edad mayor o igual a 18años, diagnosticados de CIS, EMRR o EMSP con brotes, en tratamiento con IFNβ-1b y empleando el autoinyector ExtaviJect™30G desde al menos 3meses antes del inicio del estudio.
Los pacientes fueron evaluados en visita única en 2 momentos (test y retest). En el test, los neurólogos recogieron datos sociodemográficos y clínicos básicos (tabla 1), los profesionales de enfermería cumplimentaron el cuestionario ad hoc Trainer User Trial Questionnaire y los pacientes los cuestionarios autoadministrados: MS Treatment Concerns Questionnaire (MSTCQ©)15; Patient-Reported Indices for Multiple Sclerosis instrument (PRIMUS©)16, Treatment Satisfaction Questionnaire for Medication (TSQM©)17; Patient/Trainer User Trial Questionnaire; Patient Injection Site Reaction and Injection Site Pain (ISR&ISP)13, y el cuestionario de cumplimento terapéutico Morisky-Green (M-G). En el retest, para el cálculo de la estabilidad de las puntuaciones de la versión adaptada del MSTCQ©, 41 pacientes del total de la muestra procedentes de 6 hospitales participantes volvieron a dar respuesta a este instrumento transcurridos 7±2días desde la primera cumplimentación. Además, los especialistas aplicaron la escala de impresión clínica global de mejoría (CGI-GI) con el fin de contrastar si se habían producido cambios clínicamente significativos desde la primera visita (test).
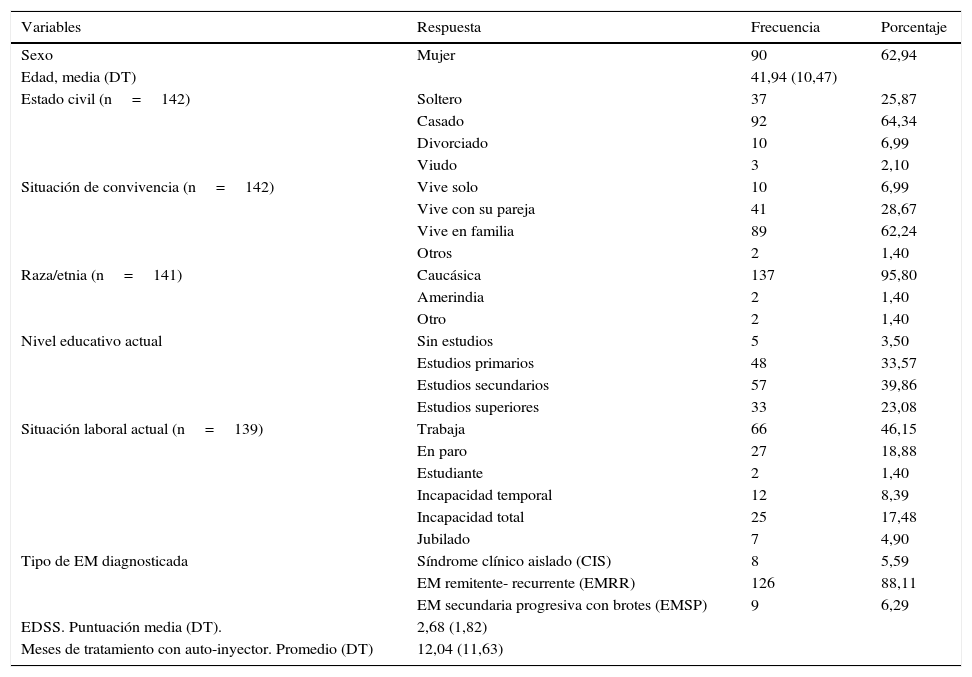
Variables sociodemográficas y clínicas recogidas (n=143)
| Variables | Respuesta | Frecuencia | Porcentaje |
|---|---|---|---|
| Sexo | Mujer | 90 | 62,94 |
| Edad, media (DT) | 41,94 (10,47) | ||
| Estado civil (n=142) | Soltero | 37 | 25,87 |
| Casado | 92 | 64,34 | |
| Divorciado | 10 | 6,99 | |
| Viudo | 3 | 2,10 | |
| Situación de convivencia (n=142) | Vive solo | 10 | 6,99 |
| Vive con su pareja | 41 | 28,67 | |
| Vive en familia | 89 | 62,24 | |
| Otros | 2 | 1,40 | |
| Raza/etnia (n=141) | Caucásica | 137 | 95,80 |
| Amerindia | 2 | 1,40 | |
| Otro | 2 | 1,40 | |
| Nivel educativo actual | Sin estudios | 5 | 3,50 |
| Estudios primarios | 48 | 33,57 | |
| Estudios secundarios | 57 | 39,86 | |
| Estudios superiores | 33 | 23,08 | |
| Situación laboral actual (n=139) | Trabaja | 66 | 46,15 |
| En paro | 27 | 18,88 | |
| Estudiante | 2 | 1,40 | |
| Incapacidad temporal | 12 | 8,39 | |
| Incapacidad total | 25 | 17,48 | |
| Jubilado | 7 | 4,90 | |
| Tipo de EM diagnosticada | Síndrome clínico aislado (CIS) | 8 | 5,59 |
| EM remitente- recurrente (EMRR) | 126 | 88,11 | |
| EM secundaria progresiva con brotes (EMSP) | 9 | 6,29 | |
| EDSS. Puntuación media (DT). | 2,68 (1,82) | ||
| Meses de tratamiento con auto-inyector. Promedio (DT) | 12,04 (11,63) |
DT: desviación típica; EM: esclerosis múltiple.
Además de las 4 dimensiones (A, B, C y D) de la versión en español del cuestionario MSTCQ© y con el objetivo de dar respuesta a todos los objetivos del estudio, los pacientes cumplimentaron:
- •
El cuestionario PRIMUS©16, que mide la calidad de vida y la actividad en pacientes con EM. Consta de 3 escalas que evalúan por separado: síntomas, 22 ítems dicotómicos (sí/no); actividades, 15 ítems de 3 alternativas en escala Likert, y calidad de vida, 22 ítems dicotómicos (V/F). La puntuación del cuestionario proporcionará una evaluación de la CVRS en relación a la EM expresada por el paciente.
- •
El cuestionario TSQM© (vs.1.4)17, versión en español, es una medida genérica de la satisfacción con la medicación prescrita que consta de 14 ítems de respuesta Likert de 7 o 5 alternativas, que evalúan de forma independiente: eficacia (3 ítems), AE (4 ítems), conveniencia del tratamiento (3 ítems) y satisfacción global (3 ítems). Las puntuaciones del TSQM© se utilizarán para el análisis de la validez convergente del cuestionario a examen.
- •
El ISR&ISP13 es una herramienta ad hoc de 5 ítems que describen el estado en la zona corporal en la que se administra el tratamiento (eritema, enrojecimiento, aparición de hematomas, inflamación y dolor); con este cuestionario el paciente evalúa la tolerabilidad al dispositivo de autoinyección.
- •
Los cuestionarios ad hoc Patient/TrainerUser Trial Questionnaire, de 8 y 9 ítems, respectivamente, cumplimentados con el objetivo de evaluar la aceptación del uso del autoinyector (facilidad de uso y dosificación, comodidad…) desde el punto de vista de los pacientes y del profesional de enfermería.
- •
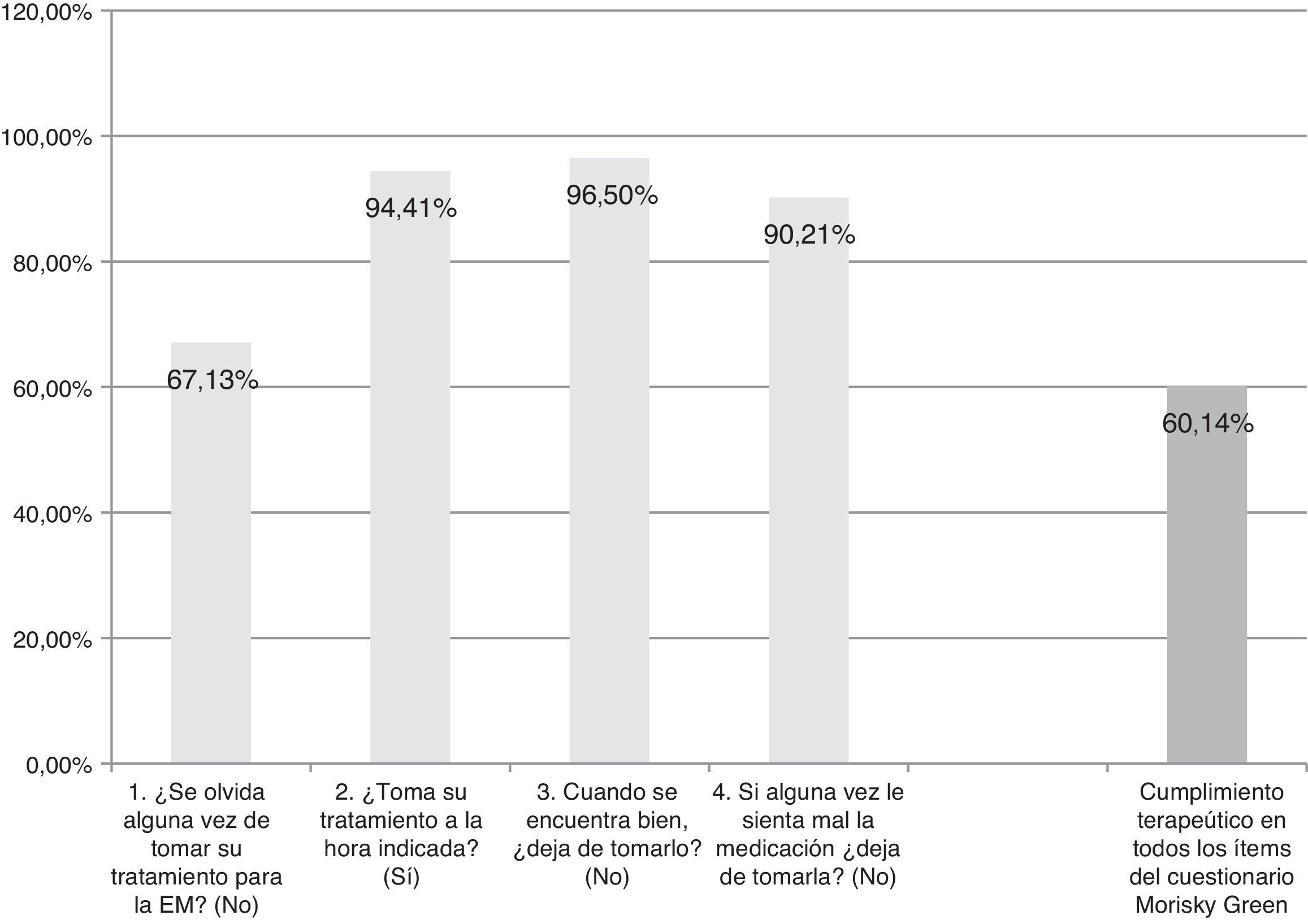
La adaptación del cuestionario M-G, que evalúa el cumplimiento terapéutico que refiere el paciente; se considera al paciente cumplidor si responde correctamente a los 4 ítems dicotómicos (sí/no) del cuestionario (fig. 1).
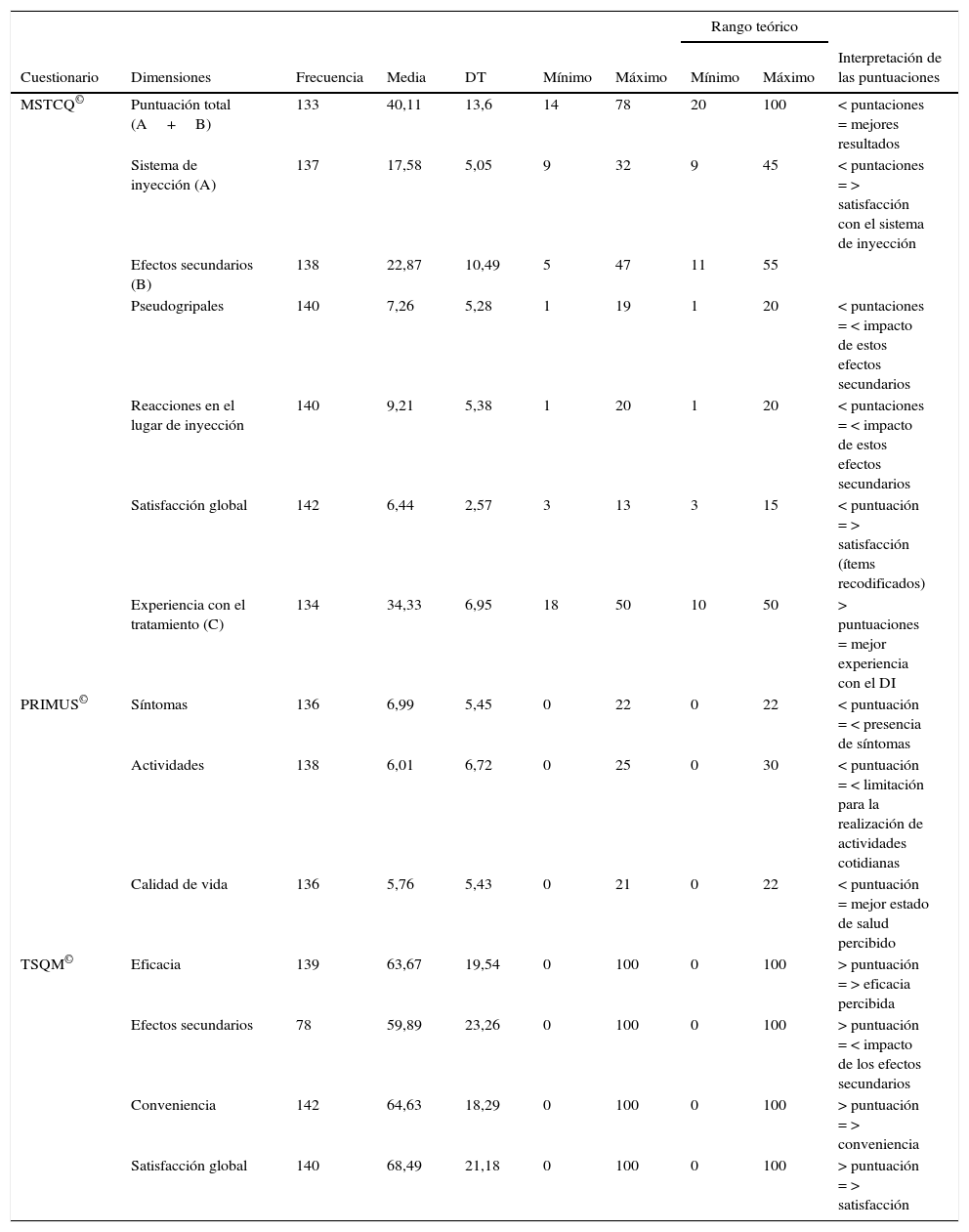
Descriptivos puntuación cuestionarios y rangos teóricos MSTQ©, PRIMUS© y TSQM© (n=143)
| Rango teórico | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cuestionario | Dimensiones | Frecuencia | Media | DT | Mínimo | Máximo | Mínimo | Máximo | Interpretación de las puntuaciones |
| MSTCQ© | Puntuación total (A+B) | 133 | 40,11 | 13,6 | 14 | 78 | 20 | 100 | < puntaciones = mejores resultados |
| Sistema de inyección (A) | 137 | 17,58 | 5,05 | 9 | 32 | 9 | 45 | < puntaciones = > satisfacción con el sistema de inyección | |
| Efectos secundarios (B) | 138 | 22,87 | 10,49 | 5 | 47 | 11 | 55 | ||
| Pseudogripales | 140 | 7,26 | 5,28 | 1 | 19 | 1 | 20 | < puntaciones = < impacto de estos efectos secundarios | |
| Reacciones en el lugar de inyección | 140 | 9,21 | 5,38 | 1 | 20 | 1 | 20 | < puntaciones = < impacto de estos efectos secundarios | |
| Satisfacción global | 142 | 6,44 | 2,57 | 3 | 13 | 3 | 15 | < puntuación = > satisfacción (ítems recodificados) | |
| Experiencia con el tratamiento (C) | 134 | 34,33 | 6,95 | 18 | 50 | 10 | 50 | > puntuaciones = mejor experiencia con el DI | |
| PRIMUS© | Síntomas | 136 | 6,99 | 5,45 | 0 | 22 | 0 | 22 | < puntuación = < presencia de síntomas |
| Actividades | 138 | 6,01 | 6,72 | 0 | 25 | 0 | 30 | < puntuación = < limitación para la realización de actividades cotidianas | |
| Calidad de vida | 136 | 5,76 | 5,43 | 0 | 21 | 0 | 22 | < puntuación = mejor estado de salud percibido | |
| TSQM© | Eficacia | 139 | 63,67 | 19,54 | 0 | 100 | 0 | 100 | > puntuación = > eficacia percibida |
| Efectos secundarios | 78 | 59,89 | 23,26 | 0 | 100 | 0 | 100 | > puntuación = < impacto de los efectos secundarios | |
| Conveniencia | 142 | 64,63 | 18,29 | 0 | 100 | 0 | 100 | > puntuación = > conveniencia | |
| Satisfacción global | 140 | 68,49 | 21,18 | 0 | 100 | 0 | 100 | > puntuación = > satisfacción | |
DT: desviación típica.
En primer lugar y utilizando el software estadístico SPPS v. 21, se realizó un análisis descriptivo de todas las variables sociodemográficas, clínicas (tabla 1) y de las puntuaciones de los cuestionarios (tabla 2), que consistió en medidas de tendencia central y de dispersión en las variables cuantitativas, y un análisis de frecuencias en las cualitativas.
A continuación se procedió a la evaluación de las propiedades psicométricas del cuestionario MSTCQ©. La factibilidad se analizó mediante el cálculo del porcentaje de no respuesta en cada ítem, se comprobó la distribución normalizada de las puntuaciones y se analizó para cada ítem el efecto techo (porcentaje de pacientes con puntuación máxima) y el efecto suelo (porcentaje de pacientes con puntuación mínima). Siguiendo los análisis realizados en la versión original (15) y con el objetivo de comprobar que la consistencia interna y la fiabilidad test-retest de la versión en español igualaran o superaran a la original (α=0,70; CCI=0,68), la fiabilidad se evaluó mediante el α de Cronbach (consistencia interna), y la fiabilidad test-retest, una vez comprobado que no se habían producido cambios clínicamente significativos mediante la CGI-GI, se aplicó la prueba paramétrica CCI entre las respuestas al cuestionario de los 41 pacientes que realizaron test-retest.
Respecto a la validez de constructo, una vez comprobada la adecuación muestral (KMO y prueba de esfericidad de Barlett) y con el objetivo de asegurar que la estructura factorial original se mantuviera en la versión española, se realizó un análisis factorial (AF) exploratorio y análisis de componentes principales (ACP) con rotación Varimax. La validez convergente se estudió mediante el análisis de la correlación (Rho de Spearman) entre las puntuaciones de las dimensiones y la puntuación total del cuestionario MSTCQ© con las puntuaciones de las dimensiones del cuestionario TSQM©, esperando una correlación significativa.
El total de pacientes incluidos en el estudio permitió contar con un número de pacientes suficiente (n=143) para el contraste de los estadísticos en los análisis descritos (entre 5-10 pacientes por ítem)18,19.
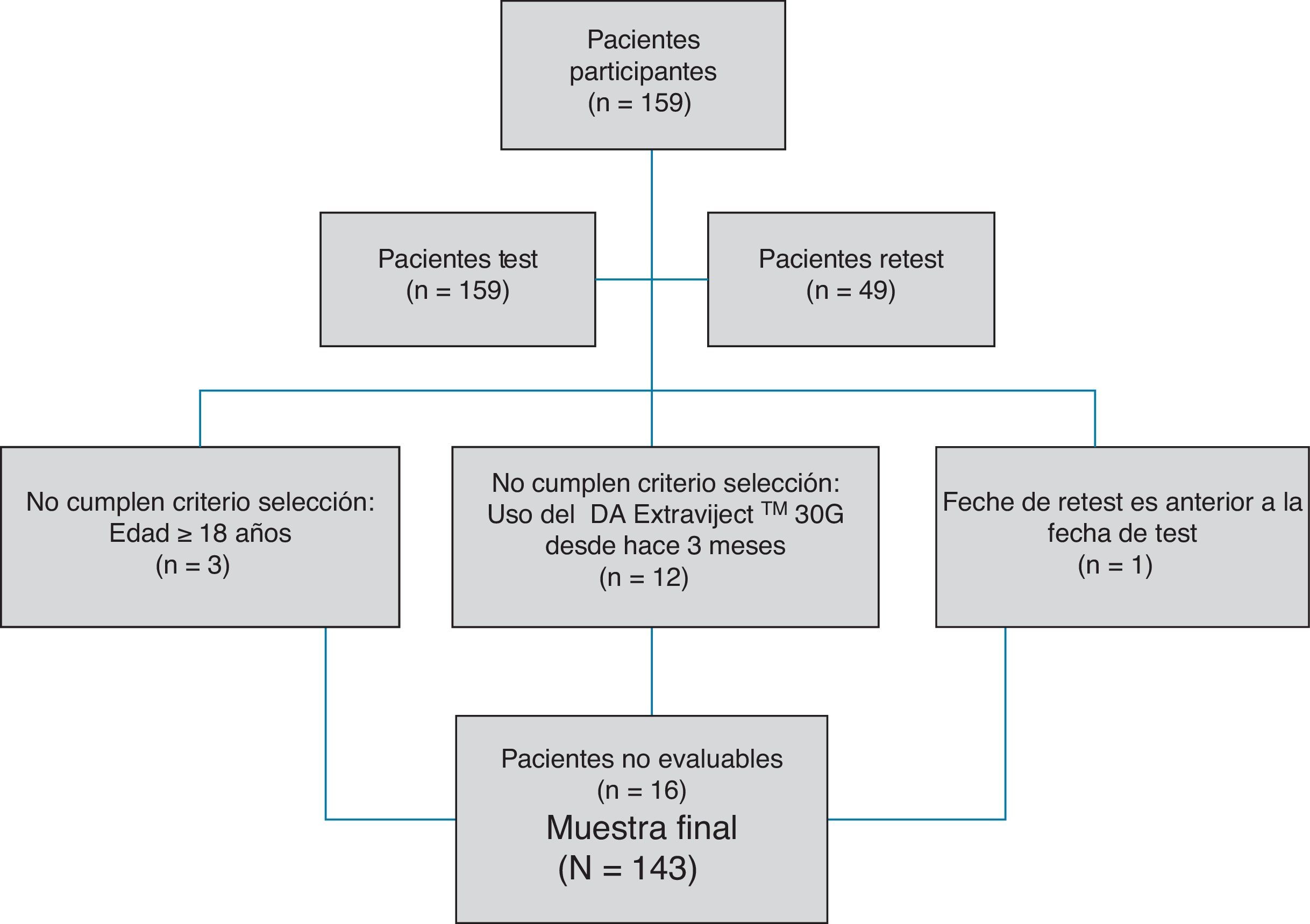
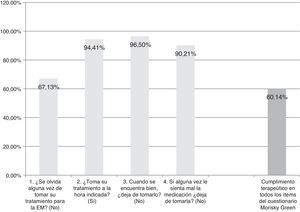
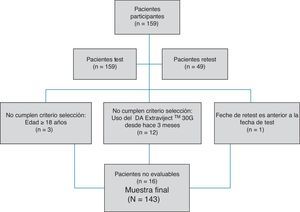
ResultadosAunque se recogieron datos de un total de 159 pacientes, 16 casos tuvieron que ser descartados por no cumplir los criterios de selección (fig. 2). Así, se contó con una muestra a estudio de 143 pacientes. La edad media de dichos pacientes (desviación típica [DT]) fue 41,94 (10,47) años; el 62,94% fueron mujeres, y el porcentaje de pacientes con diagnóstico de EMRR fue del 88,11%. La descripción de las variables sociodemográficas y clínicas se muestra en la (tabla 1). Según la prueba de adherencia M-G, se clasificaron como cumplidores con el tratamiento el 87,50% de los pacientes con CIS, el 58,75% de los pacientes con EMRR y el 55,55% de los pacientes con EMSP. Los resultados de cumplimento terapéutico de toda la muestra se presentan en la figura 1.
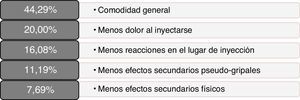
Los pacientes reportaron buenos resultados en las medidas autocumplimentadas de satisfacción y calidad de vida; las puntuaciones totales y por dimensiones obtenidas en los cuestionarios MSTCQ©, PRIMUS© y TSQM© se presentan en la tabla 2. En la figura 3 se presenta el orden de elección de los beneficios evaluados como más importantes en relación al sistema de inyección (dimensión D del MSTCQ©).
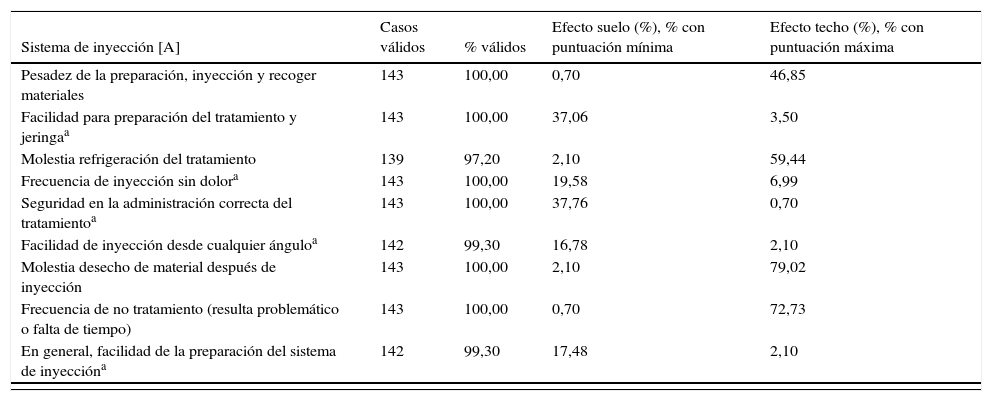
Respecto a la factibilidad, el porcentaje de cumplimentación del MSTCQ© osciló entre el 97,20 y el 100%. Los resultados de análisis del efecto suelo y techo de las dimensiones A y B (puntación total) se presentan en la tabla 3, donde queda reflejada la variabilidad de las respuestas al instrumento.
Factibilidad. Análisis efecto suelo y techo MSTCQ©
| Sistema de inyección [A] | Casos válidos | % válidos | Efecto suelo (%), % con puntuación mínima | Efecto techo (%), % con puntuación máxima |
|---|---|---|---|---|
| Pesadez de la preparación, inyección y recoger materiales | 143 | 100,00 | 0,70 | 46,85 |
| Facilidad para preparación del tratamiento y jeringaa | 143 | 100,00 | 37,06 | 3,50 |
| Molestia refrigeración del tratamiento | 139 | 97,20 | 2,10 | 59,44 |
| Frecuencia de inyección sin dolora | 143 | 100,00 | 19,58 | 6,99 |
| Seguridad en la administración correcta del tratamientoa | 143 | 100,00 | 37,76 | 0,70 |
| Facilidad de inyección desde cualquier ánguloa | 142 | 99,30 | 16,78 | 2,10 |
| Molestia desecho de material después de inyección | 143 | 100,00 | 2,10 | 79,02 |
| Frecuencia de no tratamiento (resulta problemático o falta de tiempo) | 143 | 100,00 | 0,70 | 72,73 |
| En general, facilidad de la preparación del sistema de inyeccióna | 142 | 99,30 | 17,48 | 2,10 |
| Efectos secundarios (AE) [B] | Casos válidos | % válidos | Efecto suelo (%), mejores resultados | Efecto techo (%), peores resultados |
|---|---|---|---|---|
| Síntomas pseudogripales: frecuencia | 142 | 99,30 | 33,57 | 8,39 |
| Síntomas pseudogripales: duraciónb | 140 | 97,90 | 9,09 | 6,99 |
| Síntomas pseudogripales: molestiab | 141 | 98,60 | 5,59 | 1,40 |
| Síntomas pseudogripales: interferencia trabajo y actividadesb | 141 | 98,60 | 17,48 | 0,70 |
| Reacción en el lugar de inyección: frecuencia | 141 | 98,60 | 22,38 | 13,99 |
| Reacción en el lugar de inyección: duraciónc | 141 | 98,60 | 6,29 | 40,56 |
| Reacción en el lugar de inyección: molestia3 | 142 | 99,30 | 9,79 | 4,20 |
| Reacción en el lugar de inyección: interferencia trabajo y actividadesc | 141 | 98,60 | 40,56 | 2,10 |
| En general: satisfacción con el tratamiento actuala | 142 | 99,30 | 24,48 | 2,10 |
| En general: beneficios vs molestiasa | 142 | 99,30 | 39,16 | 1,40 |
| En general: cómo sobrelleva las molestias y efectos secundariosa | 142 | 99,30 | 29,37 | 1,40 |
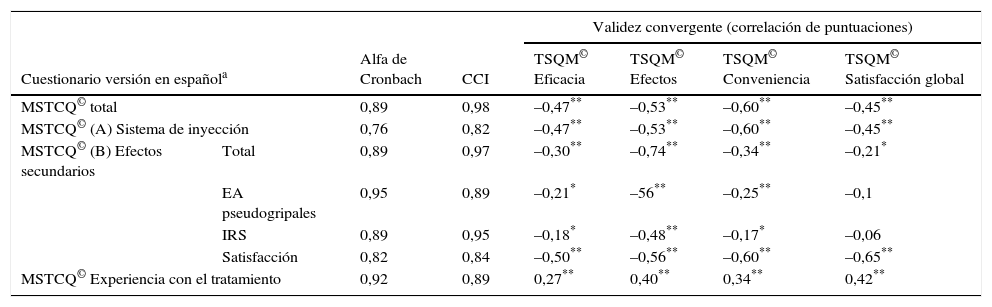
Los resultados de los cálculos de fiabilidad del instrumento, tanto en sus valores de α como en el test-retest (CCI), demuestran, por un lado, alta consistencia interna en la puntuación total (α=0,89) y por dimensiones (dimensión A α=0,76; B (total) α=0,89 y C α=0,92), y por el otro, una alta concordancia entre las puntuaciones obtenidas en el test y re-test de la versión en español del MSTCQ© (tabla 4). Para evaluar la validez de constructo del MSTCQ© una vez comprobado que la muestra era adecuada para este análisis (KMO=0,86 y prueba de esfericidad de Bartlett, p<0,05), se realizó un análisis de componentes principales (ACP) que corroboró la estructura interna del cuestionario original. Los pesos factoriales de los ítems resultantes del ACP se presentan en la tabla 5. En la dimensión A se observa la existencia de un factor que engloba el 36,91% de la varianza explicada de las puntuaciones, y respecto a la dimensión B, se encuentran 3 factores que engloban el 82,39% de la varianza total explicada de las puntuaciones del MSTCQ© (factor 1 [33,64%], factor 2 [28,79%] y factor 3 [19,96%]).
Análisis de fiabilidad MSTCQ© versión en español [Cronbach y CCI] y Validez Convergente (correlación entre puntuaciones MSTCQ© versión en español y TSQM© vr.1.4. (n=143)
| Validez convergente (correlación de puntuaciones) | |||||||
|---|---|---|---|---|---|---|---|
| Cuestionario versión en española | Alfa de Cronbach | CCI | TSQM© Eficacia | TSQM© Efectos | TSQM© Conveniencia | TSQM© Satisfacción global | |
| MSTCQ© total | 0,89 | 0,98 | –0,47** | –0,53** | –0,60** | –0,45** | |
| MSTCQ© (A) Sistema de inyección | 0,76 | 0,82 | –0,47** | –0,53** | –0,60** | –0,45** | |
| MSTCQ© (B) Efectos secundarios | Total | 0,89 | 0,97 | –0,30** | –0,74** | –0,34** | –0,21* |
| EA pseudogripales | 0,95 | 0,89 | –0,21* | –56** | –0,25** | –0,1 | |
| IRS | 0,89 | 0,95 | –0,18* | –0,48** | –0,17* | –0,06 | |
| Satisfacción | 0,82 | 0,84 | –0,50** | –0,56** | –0,60** | –0,65** | |
| MSTCQ© Experiencia con el tratamiento | 0,92 | 0,89 | 0,27** | 0,40** | 0,34** | 0,42** | |
CCI: coeficiente de correlación intraclase.
Análisis de componentes principales. MSTCQ© (n=143)
| Dimensión(A): Satisfacción con el sistema de inyeccióna | Componente 1 |
|---|---|
| Pesadez de la preparación, inyección y recoger materiales | 0,68 |
| Facilidad para preparación del tratamiento y jeringa | 0,73 |
| Molestia refrigeración del tratamiento | 0,41 |
| Frecuencia de inyección sin dolor | 0,45 |
| Seguridad en la administración correcta del tratamiento | 0,73 |
| Facilidad de inyección desde cualquier ángulo | 0,75 |
| Molestia desecho de material después de inyección | 0,30 |
| Frecuencia de no tratamiento | 0,23 |
| En general, facilidad de la preparación del sistema de inyección | 0,85 |
| Componente 1 | Componente 2 | Componente 3 | |
|---|---|---|---|
| Dimensión (B): Efectos secundariosb | Pseudogripales | Reacciones en el lugar de inyección | Satisfacción |
| Síntomas pseudogripales: molestia | 0,9 | ||
| Síntomas pseudogripales: frecuencia | 0,89 | ||
| Síntomas pseudogripales: duración | 0,92 | ||
| Síntomas pseudogripales: interferencia trabajo y actividades | 0,88 | ||
| Reacción en el lugar de inyección: frecuencia | 0,92 | ||
| Reacción en el lugar de inyección: duración | 0,88 | ||
| Reacción en el lugar de inyección: molestia | 0,87 | ||
| Reacción en el lugar de inyección: interferencia trabajo y actividades | 0,68 | ||
| En general: beneficios vs molestias | 0,87 | ||
| En general: satisfacción | 0,87 | ||
| En general: cómo sobrelleva las molestias y efectos secundarios | 0,75 |
La evaluación de la validez convergente (tabla 4) del cuestionario demostró correlaciones estadísticamente significativas y negativas (p<0,05 y p<0,01, bilateral) entre las puntuaciones del cuestionario MSTCQ© y las puntuaciones de las dimensiones del cuestionario TSQM©, a excepción de las correspondientes a las subescalas AE pseudogripales (p=0,253) y RLI (p=0,508) de la dimensión B del cuestionario MSTCQ© con la escala satisfacción global del cuestionario TSQM©.
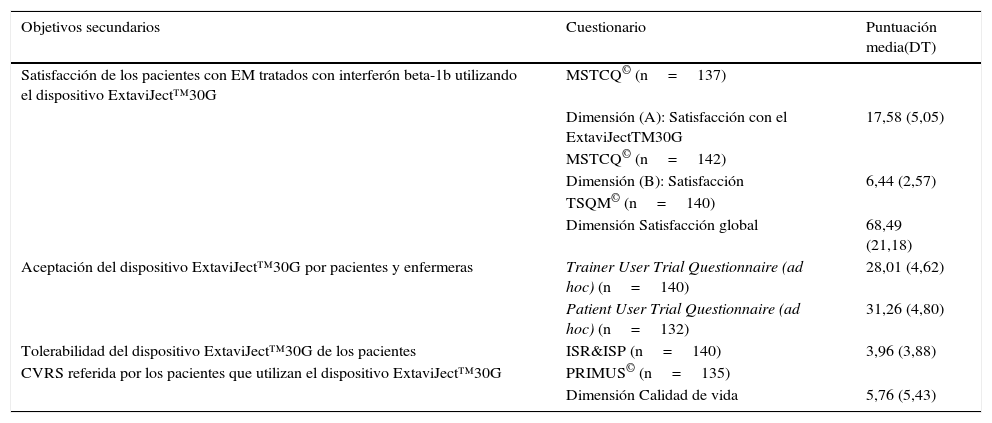
Satisfacción, aceptación, tolerabilidad, cumplimento terapéutico y CVRS (tabla 6)La satisfacción de los pacientes con el autoinyector ExtaviJect™30G se encuentra por encima de la media teórica de las dimensiones relacionadas con satisfacción en los cuestionarios MSTCQ© y TSQM©. Además, los participantes (pacientes y el personal de enfermería) muestran una alta aceptación del dispositivo para la inyección del IFNβ-1b (Trainer/Patient User Trial Questionnaires), y una alta tolerabilidad a las RLI del tratamiento (puntaciones ISR&ISP). Por último, la CVRS se percibe como alta o muy alta en la muestra participante (dimensión calidad de vida, PRIMUS©). Los resultados cumplimiento terapéutico (M-G) indican que un alto porcentaje de pacientes (60,14%) se autoconsideran cumplidores con el tratamiento, en los 4 ítems del cuestionario M-G.
Objetivos secundarios: satisfacción, aceptación, tolerabilidad, cumplimento terapéutico y CVRS con el dispositivo ExtaviJect™30G
| Objetivos secundarios | Cuestionario | Puntuación media(DT) |
|---|---|---|
| Satisfacción de los pacientes con EM tratados con interferón beta-1b utilizando el dispositivo ExtaviJect™30G | MSTCQ© (n=137) | |
| Dimensión (A): Satisfacción con el ExtaviJectTM30G | 17,58 (5,05) | |
| MSTCQ© (n=142) | ||
| Dimensión (B): Satisfacción | 6,44 (2,57) | |
| TSQM© (n=140) | ||
| Dimensión Satisfacción global | 68,49 (21,18) | |
| Aceptación del dispositivo ExtaviJect™30G por pacientes y enfermeras | Trainer User Trial Questionnaire (ad hoc) (n=140) | 28,01 (4,62) |
| Patient User Trial Questionnaire (ad hoc) (n=132) | 31,26 (4,80) | |
| Tolerabilidad del dispositivo ExtaviJect™30G de los pacientes | ISR&ISP (n=140) | 3,96 (3,88) |
| CVRS referida por los pacientes que utilizan el dispositivo ExtaviJect™30G | PRIMUS© (n=135) | |
| Dimensión Calidad de vida | 5,76 (5,43) |
Los resultados presentados demuestran que la versión en español de cuestionario MSTCQ© es un cuestionario factible, fiable y válido para su uso en la práctica clínica con pacientes tratados con IFN-b1 mediante el autoinyector ExtaviJect™30G. El instrumento evalúa la percepción de los pacientes en diversos aspectos asociados con el uso de un dispositivo de inyección: facilidad de uso; molestias; AE pseudogripales, RLI y satisfacción global.
El análisis de la fiabilidad demuestra que el porcentaje de datos perdidos en la cumplimentación del cuestionario fue muy bajo (entre un 0 y un 2,80%). Además, se presentan en distribución normal y con una variabilidad de respuesta muy alta, es decir, valores mínimos y máximos de las puntuaciones comprenden todas las alternativas de respuesta.
Los resultados sobre la fiabilidad (α de Cronbach) fueron muy altos, similares a los obtenidos en cuestionario TSQM©17 y similares a los que presentan otras medidas de evaluación de la satisfacción general con el tratamiento de pacientes crónicos como el SAT-Q (α=0,80)20 y el SATMED-Q (α=0,87)21. Respecto a la fiabilidad test-retest, se observó elevada concordancia22 entre las puntuaciones, resultados superiores a los presentados en la validación de la versión original15 y similares a los de otros instrumentos de evaluación de la satisfacción del paciente, como el cuestionario SATMED-Q (CCI=0,94)21.
El análisis factorial implementado mostró que la estructura factorial del original se mantiene en esta versión, y los pesos factoriales en nuestro país son muy similares a los originales15 (tabla 5). Respecto a la asociación con otros instrumentos, el coeficiente de correlación mostró una asociación estadísticamente significativa moderada-alta entre las puntuaciones del MSTCQ© y las del TSQM©. Esta asociación fue negativa, debido a la dirección opuesta de la respuesta de los ítems en cada instrumento (p<0,05 y p<0,01, bilateral). No se encontró asociación entre las subescalas «AE pseudogripales» e «RLI» del MSTCQ© con la escala «satisfacción global» del cuestionario TSQM©. Esto podría justificarse por el contenido de los ítems: no correlacionan datos de satisfacción global con el tratamiento con datos del impacto de los AE pseudogripales o de RLI del mismo tratamiento.
Las puntuaciones en el MSTCQ© respecto a satisfacción del paciente con el DA ExtaviJect™30G, tanto en la dimensión A (sistema de inyección) como en la subescala satisfacción global de la dimensión B, al igual que los resultados en la escala de la medida genérica de satisfacción con el tratamiento prescrito TSQM©17, indican alta satisfacción con el método de administración del fármaco. Como es habitual en las escalas de evaluación de la satisfacción20,21, en el análisis del efecto techo-suelo de la subescala de la B del MSTCQ©, satisfacción global, en la que bajas puntuaciones indican mayor satisfacción, se encontró un efecto suelo relevante (24,38-39,16%).
Aunque el impacto de AE pseudogripales y el de las RLI estuvieron asociados significativamente al tratamiento con Extavia© en pacientes EMRR y EMSP (94,40% de la muestra), las puntuaciones del MSTCQ© indican que el impacto de los AE pseudogripales es ligeramente menor que el impacto de las RLI. Es cierto que las RLI son los AE más señalados en la literatura9,23, pero estos datos se han de tomar con precaución, pues no se dispone de ninguna variable que indique si la muestra está o no en tratamiento profiláctico para los síntomas gripales (ibuprofeno, corticoides en dosis bajas…). Además, las bajas puntuaciones en el cuestionario ISR&ISP indican alta tolerabilidad al ExtaviJect 30G. Las RLI más frecuentes según dicho cuestionario son enrojecimiento y dolor, escozor y/o quemazón. Las puntuaciones en la escala de calidad de vida del cuestionario PRIMUS© reflejaron que los pacientes perciben tener una muy alta CVRS, a pesar de las molestias de los AE referidas.
Los ítems del MSTCQ© relacionados con facilidad de uso del dispositivo tanto en la dimensión A, como en la C, al igual que en la evaluación de la aceptación del paciente al ExtaviJect 30G mediante los cuestionarios ad hoc de la evaluación del uso del DA por parte del paciente (Patient/TrainerUser Trial Questionnaire), presentaron buenos resultados, siendo la característica del autoinyector con mayor puntuación la facilidad en la preparación de la dosificación24.
Los resultados del cumplimiento terapéutico indicaron por su parte que podría ser un aspecto a mejorar: un 60,14% de pacientes muestran cumplimiento terapéutico en todos los ítems de M-G. La causa de este porcentaje de cumplimento terapéutico podría deberse al tiempo previo que lleva el paciente en tratamiento para su enfermedad. En la literatura se recoge que a mayor tiempo de tratamiento la adherencia al tratamiento disminuye10, y puesto que no se ha recogido en el diseño del estudio información relacionada con el tiempo de tratamiento previo, no podemos realizar ninguna conclusión al respecto. Por otro lado, y de acuerdo con lo presentado anteriormente y relacionado con los pacientes con TME inyectada10,11, el ítem de M-G que muestra menor adherencia al tratamiento es el relacionado con los olvidos en la toma del medicamento (67,13% del total de la muestra). Finalmente, los resultados de este estudio apoyan el uso en nuestro país del MSTCQ© para la evaluación de la satisfacción, AE pseudogripales del tratamiento, reacciones en el lugar de inyección y experiencia global con el tratamiento del paciente que utiliza el ExtaviJect 30G como dispositivo de inyección del tratamiento con IFNβ-1b. Pero dado que este estudio no se ha diseñado para comparar el ExtaviJect 30G con ningún método de inyección previo, imprescindible en lo que concierne a preferencias, consideramos necesario el diseño de un estudio retrospectivo como continuación y complemento a este para la evaluación de la sensibilidad al cambio de la versión española de MSTCQ©.
Además, futuras investigaciones encaminadas a aplicar esta versión del cuestionario MSTCQ©, con el objetivo de obtener mayor representatividad de los contrastes estadísticos y resultados presentados, se llevarán a cabo con muestras de mayor tamaño.
FinanciaciónEl estudio ha sido financiado por Novartis Farmacéutica S.A.
Conflicto de interesesLos autores Elvira Munteis, José Meca-Lallana, Antonio Pato y Ángel Pérez-Sempere declaran conflicto de intereses. El resto de autores declaran que no existe conflicto de intereses.
El presente estudio ha sido presentado como póster en la LXV Reunión Anual de la Sociedad Española de Neurología (SEN), Barcelona 2013; en el International Society for Pharmacoeconomics and Outcomes Research (ISPOR) 16th Annual European Congress, Dublín 2013, y en el American Academy of Neurology (AAN) 2014 Annual Meeting.