La malformación de Chiari tipo I (MC-I) se caracteriza por la existencia de una ectopia de las amígdalas del cerebelo que se sitúan por debajo del foramen mágnum, lo que puede asociarse a fenómenos compresivos del tronco del encéfalo, de la médula espinal alta y de los pares craneales. Las manifestaciones clínicas más frecuentes suelen ser las cefaleas occípito-nucales y los mareos, aunque el cortejo sintomático puede ser muy extenso. Sin embargo, un aspecto menos conocido es la repercusión de la malformación sobre las alteraciones respiratorias nocturnas y los trastornos del sueño.
FuentesMEDLINE e información de pacientes con MC-I valorados en los servicios de neurocirugía y neurofisiología del Hospital Universitario Vall d’Hebron.
DesarrolloArtículo de revisión realizado a partir del análisis de todos los estudios publicados en MEDLINE a partir del año 1966, localizados a través del motor de búsqueda PubMed, utilizando combinaciones de las palabras clave: «Chiari malformation» o «Arnold-Chiari malformation» y «sleep apnea» o «sleep disorders».
ConclusionesLos pacientes con una MC-I presentan una mayor prevalencia de trastornos del sueño que la población general. En algunos estudios el 50% de los pacientes con MC-I presentan un síndrome de apnea-hipopnea del sueño (SAHS), habiéndose descrito incluso casos de muerte súbita probablemente relacionados con estos fenómenos. Estos resultados recomiendan incluir el análisis de los parámetros respiratorios nocturnos en el estudio de los pacientes con MC-I. Identificar la presencia de un SAHS contribuye a optimizar el tratamiento de estos pacientes, mejorando la calidad de vida y su pronóstico.
Chiari type I malformation (CM-I) is characterised by caudal ectopia of the cerebellar tonsils through the foramen magnum. This is associated with brain stem, high spinal cord, and cranial nerve compression phenomena. The most frequent symptoms are occipital headaches and dizziness. Less well-known symptoms are sleep disorders and nocturnal respiratory abnormalities.
SourcesMEDLINE and information from patients evaluated at the Neurosurgery and Clinical Neurophysiology Departments at Hospital Universitario Vall d’Hebron.
DevelopmentReview article based on data obtained from MEDLINE articles since 1966, using combinations of the following keywords: «Chiari malformation» or «Arnold-Chiari malformation» and «sleep apnea» or «sleep disorders».
ConclusionsCM-I patients show a higher prevalence of sleep disorders than that observed in the general population. Some studies report a 50% prevalence of sleep apnea-hypopnea syndrome (SAHS), probably associated with sudden death in some cases. These results support analysing sleep respiratory parameters in theses patients. Identifying SAHS symptoms may help optimise treatment, thereby improving quality of life and prognosis.
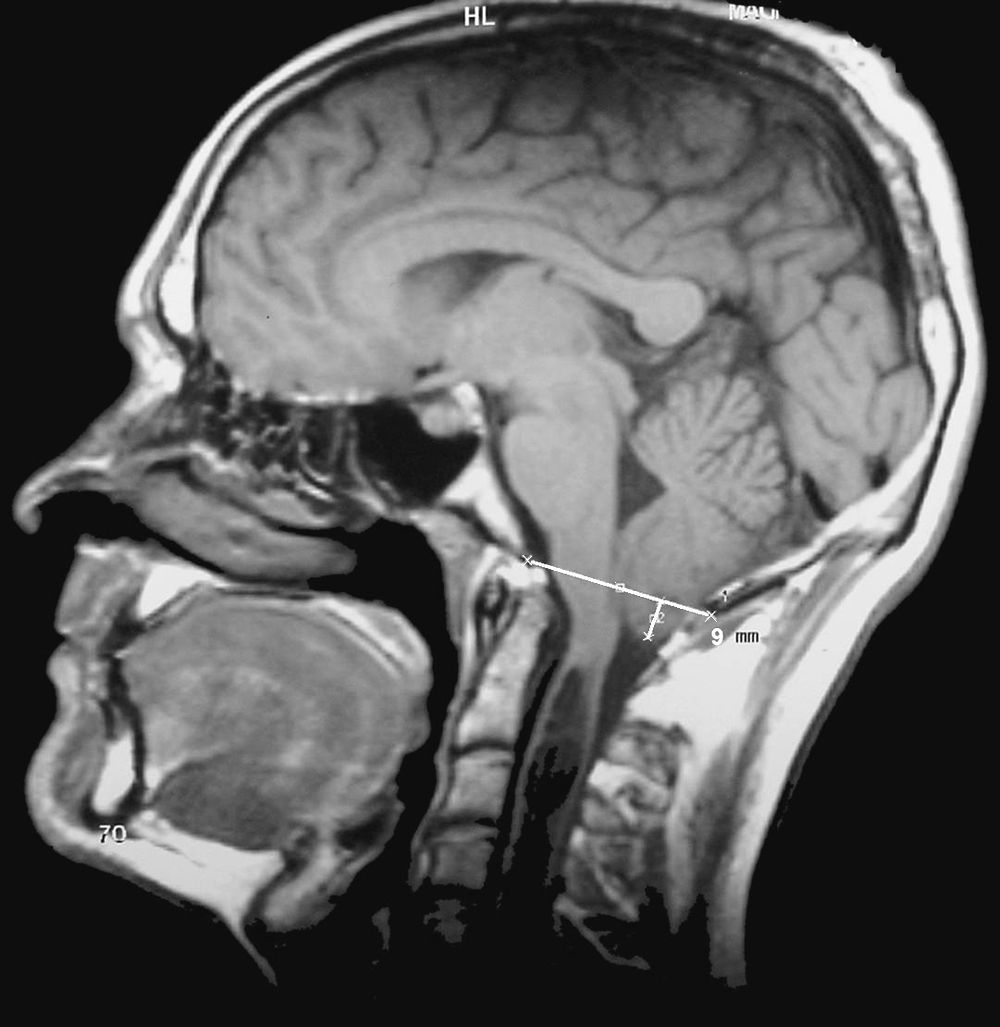
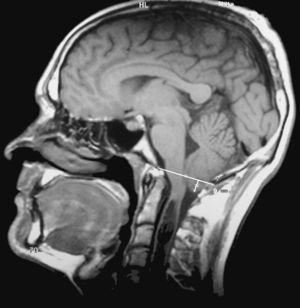
Los epónimos malformación de Chiari y Arnold-Chiari han sido utilizados como sinónimos para definir a una serie de malformaciones que se caracterizan por la existencia de una ectopia de las amígdalas del cerebelo que se sitúan por debajo del foramen mágnum. De una forma casi generalizada, y por un sentido de justicia histórica, el epónimo malformación de Arnold-Chiari ha sido sustituido por el de malformación de Chiari. Clásicamente se han diferenciado cuatro tipos de malformaciones de Chiari, en función de las anomalías asociadas, aunque la más frecuente es la malformación de Chiari tipo I (MC-I), para la que se exige que las amígdalas del cerebelo se sitúen al menos 3mm por debajo del foramen mágnum (fig. 1)1. Sin embargo, en el momento actual existen todavía importantes controversias clínicas, etiopatogénicas y terapéuticas relacionadas con esta malformación.
En los pacientes con una MC-I, la ectopia de las amígdalas del cerebelo causa un bloqueo más o menos importante a nivel de la unión cráneo-cervical, lo que dificulta la libre circulación del líquido cefalorraquídeo (LCR) y explica el desarrollo, en algunos enfermos, de siringomielia o hidrocefalia asociadas2. Esta malformación también puede asociarse a otras anomalías óseas de la charnela cráneo-cervical, a aracnoiditis de la fosa posterior, escoliosis y aumentos de la presión intracraneal3. También se ha descrito la asociación de la MC-I con una capacidad volumétrica menor en la fosa posterior cuando se compara con individuos normales4–6. Estas anomalías estructurales pueden comprometer el correcto funcionamiento del segmento superior de la médula espinal y del tronco del encéfalo, por lo que puede alterar el funcionamiento de las estructuras del sueño, de los pares craneales bajos y de los centros cardiorrespiratorios.
Las manifestaciones clínicas de los pacientes afectados de una MC-I son muy variables y dependen del complejo malformativo asociado y de la existencia o no de cavidades siringomiélicas e hidrocefalia en el momento del diagnóstico. La cefalea, las cervicalgias y los mareos son los síntomas más frecuentes. Las cefaleas tienen características inespecíficas, aunque se localizan en la región occípito-cervical y suelen aumentar cuando se realizan maniobras de Valsalva. Las sensaciones de «mareo» que presentan estos pacientes son, a menudo, vértigos, que suelen desencadenarse por los movimientos de rotación cefálica. Estos pacientes también pueden presentar disfagia, ataxia, dolor radicular cervical, alteraciones sensitivas y/o motoras, entre otros síntomas. En los últimos años diversos autores han hecho énfasis en un aspecto menos conocido de esta patología como son las alteraciones del sueño y los trastornos respiratorios nocturnos que presentan muchos de estos pacientes y que pueden llegar a conducir a un fallo respiratorio7–15 o incluso a la muerte súbita16–22.
En la actualidad, la nueva clasificación de la sociedad americana de medicina del sueño (ICSD-2)23 define más de 91 trastornos relacionados con el sueño, que han sido agrupados en: insomnio, trastornos respiratorios durante el sueño, hipersomnia, alteraciones del ritmo circadiano, parasomnias y trastornos de movimiento durante el sueño. A pesar de que diversos autores han objetivado diferentes tipos de apneas e hipopneas en los pacientes con MC-I, no existen estudios que analicen la calidad de sueño ni las alteraciones del ritmo circadiano relacionados con esta malformación. Esta revisión pretende actualizar los trastornos del sueño que pueden presentar los pacientes con una MC-I.
Tipos de trastornos respiratorios durante el sueñoLos trastornos respiratorios durante el sueño son una enfermedad crónica muy prevalente y están asociados a una fragmentación del sueño y una hipoxemia intermitente. La ICSD-223 clasifica los síndromes respiratorios en: a) alteraciones respiratorias centrales durante el sueño (SAHCS); b) alteraciones respiratorias obstructivas durante el sueño (SAHOS), y c) síndrome de hipoventilación-hipoxemia durante el sueño (SHS).
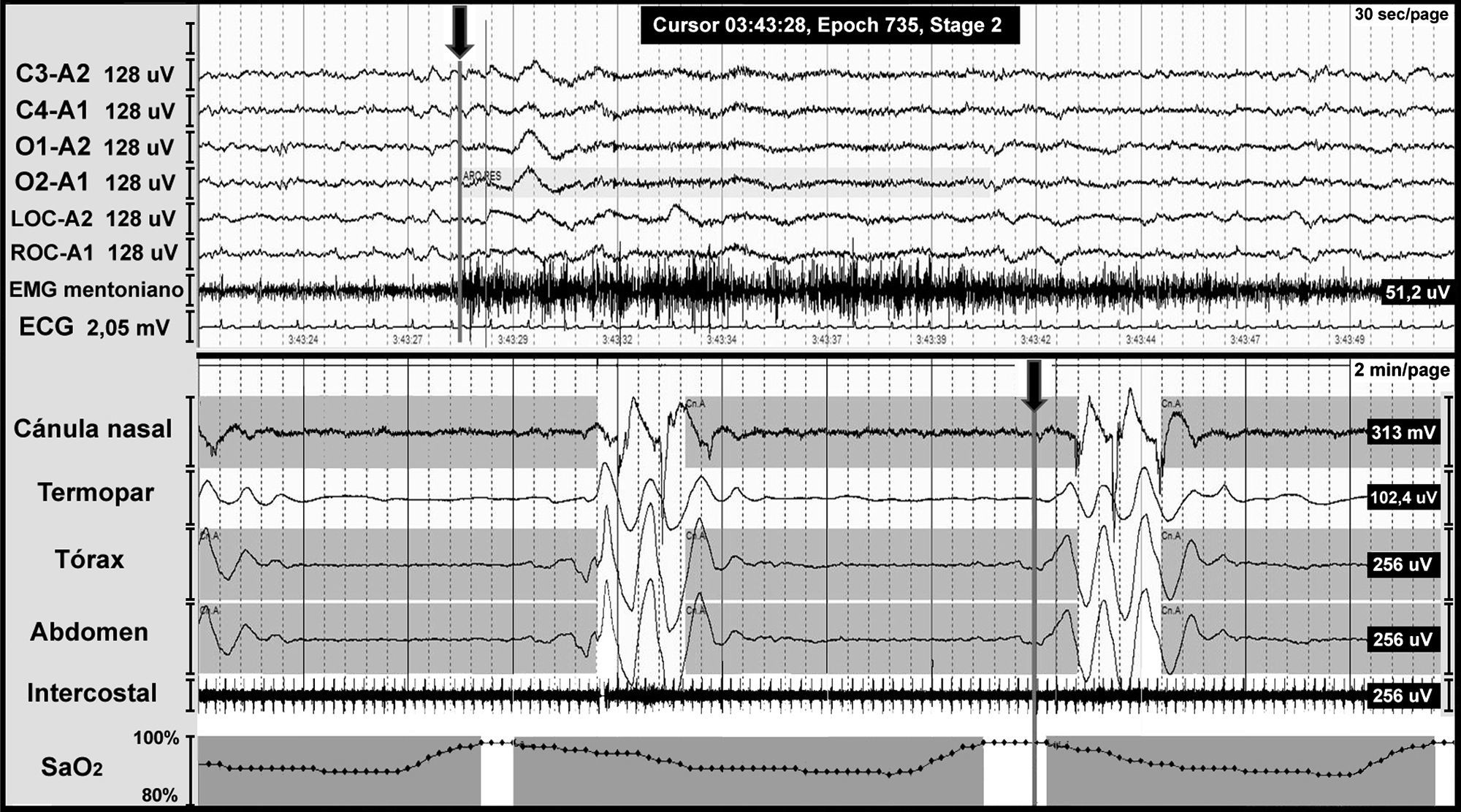
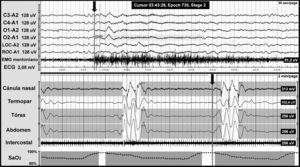
El SAHCS se caracteriza por un cese o disminución del esfuerzo transitorio de la respiración que puede originarse en el sistema nervioso central, o bien ser secundario a una disfunción muscular, y se define como la presencia en la polisomnografía (PSG) de 5 o más eventos respiratorios con la ausencia de esfuerzo respiratorio de más de 10s de duración, asociados a microdespertar y/o desaturación de oxígeno (fig. 2).
Apneas centrales en un paciente con malformación de Chiari tipo I. Registro polisomnográfico nocturno con presencia de apneas centrales (incluidas en las franjas grises). La línea gris al final del evento respiratorio (flecha) indica el inicio del microdespertar cortical, que se visualiza en los canales de electroencefalografía con una escala de tiempo diferente. La parte inferior de la figura muestra el descenso de la saturación de oxígeno secundario a la apnea.
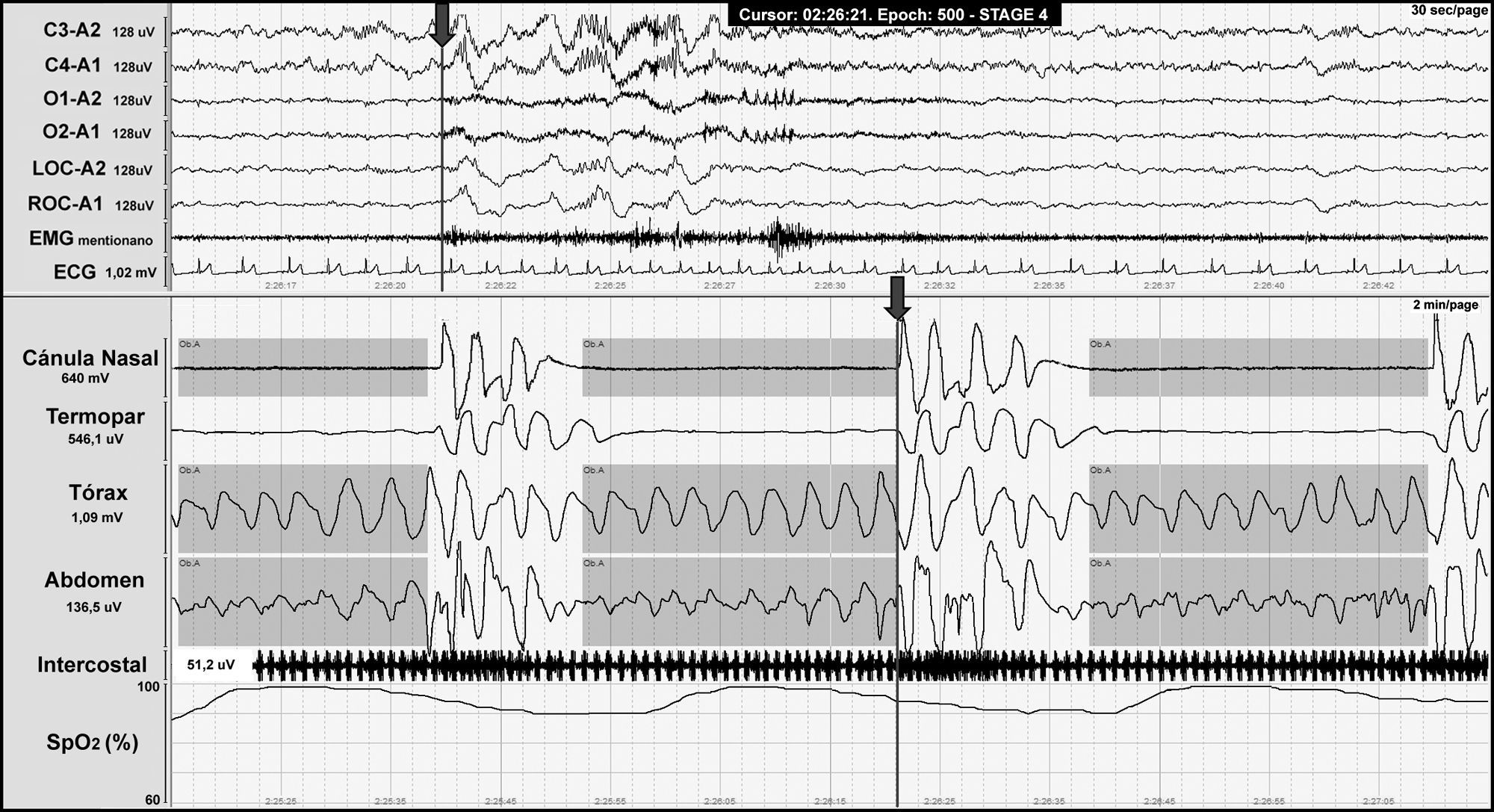
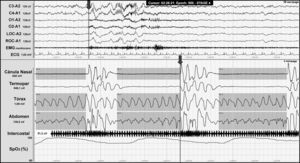
El SAHOS se caracteriza por una obstrucción total o parcial de la vía aérea superior y se define como la presencia en la PSG de 5 o más eventos respiratorios con la presencia de esfuerzo respiratorio de más de 10s de duración asociados a microdespertar y/o desaturación de oxígeno (fig. 3).
Registro polisomnográfico nocturno que muestra apneas obstructivas (incluidas en las franjas grises) en un paciente con malformación de Chiari tipo I. La línea gris al final del evento respiratorio (flecha) indica el inicio del microdespertar cortical, que se visualiza en los canales de electroencefalografía y el descenso de la saturación de oxígeno.
El SHS se caracteriza por una saturación de oxígeno menor del 90% durante más de 5min con un nadir del 85%, o bien una saturación de oxígeno menor del 90% durante el 30% del registro o una presión arterial de CO2 (PaCO2) > 45% durante el periodo diurno.
Centros y vías relacionados con el control respiratorioLa respiración puede tener un control automático o bien voluntario. La respiración automática, indispensable durante el sueño, está controlada por una red neuronal situada en el nivel inferior del tronco cerebral, que coordina la activación de las neuronas inspiratorias, post-inspiratorias y las espiratorias, que a su vez están reguladas por el sistema de arousabilidad, los quimiorreceptores centrales y/o periféricos sensibles a la PaCO2 y/u O2 y los mecanorreceptores respiratorios. La coordinación de la respiración no sólo es necesaria para el control de la respiración, sino también para la vocalización, la deglución y el vómito24.
La respiración automática a nivel de tronco cerebral está controlada por tres grupos de neuronas interconectadas: el grupo respiratorio pontino (GRP), el grupo respiratorio ventral (GRV) y el grupo respiratorio dorsal (GRD)25,26.
El GRP incluye el complejo parabraquial/Kölliker-Fuse, localizado a nivel rostro-dorsal de la protuberancia. Tiene la función de controlar la respiración, incluida la coordinación de la fase respiratoria y de la integración de los reflejos de los mecanorreceptores pulmonares. El núcleo parabraquial además transmite información desde las neuronas respiratorias medulares hacia la amígdala, el hipotálamo y otras estructuras suprapontinas27.
El GRV consiste en una columna neuronal longitudinal y bilateral localizada en la región ventrolateral del bulbo y que se extiende desde inmediatamente debajo del núcleo facial hasta cordón medular cervical (C1). La porción más rostral del GRV incluye el complejo de Bötzinger, que contiene las neuronas espiratorias que inhiben a las inspiratorias del GRV y proyectan a la médula espinal. El complejo pre-Bötzinger consiste en neuronas propriobulbares, que tienen un papel crucial en la generación del ritmo respiratorio24. Caudalmente al complejo pre-Bötzinger se encuentra la parte rostral del GRV, localizado centralmente al núcleo ambiguo y contiene las neuronas bulboespinales inspiratorias. La parte más caudal del GRV se corresponde con el núcleo retroambigualis, se extiende hasta la raíz C1 y contiene las neuronas espiratorias bulboespinales, que proyectan a las neuronas motoras intercostales y abdominales.
El GRD, localizado en el tracto del núcleo solitario, es el primer relevo central de los quimiorreceptores, los barorreceptores y los mecanorreceptores periféricos, por lo que constituye la primera estación del proceso e integración de los reflejos respiratorios y cardiovasculares28.
El control automático de la respiración se realiza a partir de una monitorización constante por los sensores aferentes y los quimiorreceptores centrales. También influyen en este proceso el pH plasmático, la presión arterial de oxígeno (PaO2) y la PaCO2. Cuando se producen alteraciones gasométricas y del equilibrio ácido-base plasmático, los centros respiratorios se activan, aumentando y disminuyendo la frecuencia respiratoria, con el objeto de corregir estos cambios29. Los quimiorreceptores de la carótida proporcionan una activación tónica de las neuronas respiratorias del tronco cerebral a través del tracto solitario y se activan con la hipoxia. Los quimiorreceptores localizados en la superficie ventrolateral del bulbo son muy sensibles a los cambios locales del CO2. Pequeños descensos de los niveles de CO2 originan una disminución de la frecuencia respiratoria y viceversa.
Es importante recordar que los centros respiratorios están situados, a su vez, próximos a los núcleos de los pares craneales bajos (VII, IX, X, XI, XII), encargados, en su mayoría, de inervar la musculatura de la vía aérea superior. Esto explicaría por qué ciertas alteraciones estructurales a nivel inferior del tronco cerebral o nivel superior de la médula espinal, además de afectar a los centros respiratorios, también pueden influir mediante la alteración de la circulación y la función periférica de los quimiorreceptores o la función motora de estos nervios30.
Control de la respiración durante el sueñoDurante el sueño, el control de la respiración depende única y exclusivamente de la respiración automática. Fisiológicamente, durante el sueño existe una respuesta disminuida a los estímulos de hipoxia e hipercapnia, además de un discreto incremento de la resistencia de la vía aérea superior, secundaria a una hipotonía de la musculatura dilatadora. Estos fenómenos explican por qué al dormir disminuyen el volumen corriente y la frecuencia respiratoria y, por lo tanto, existe una discreta hipoventilación, con un incremento de 2-7mmHg de la PaCO2 y un descenso de la PaO2.
El patrón respiratorio durante el sueño suele ser periódico en los estadios iniciales 1 y 2, mucho más regular en los estadios 3 y 4 e irregular durante el sueño REM. Durante el REM el patrón respiratorio presenta cambios bruscos en los que la respiración varía tanto en amplitud como en frecuencia, especialmente cuando aparecen los movimientos oculares rápidos. En el sueño REM el diafragma es el único músculo respiratorio funcionante, por lo que alteraciones en esta musculatura pueden proporcionar una hipoventilación profunda durante esta fase de sueño.
Trastornos respiratorios nocturnos en los pacientes con malformación de Chiari tipo IExisten numerosos estudios sobre los trastornos respiratorios durante el sueño en pacientes con MC-I31. La mayor parte de estos estudios han objetivado alteraciones respiratorias de características centrales32–43, pero también se han descrito alteraciones obstructivas44–50 y mixtas (figs. 2 y 3)18,48,51–58. Duvilliers et al56 objetivaron que el SHS podía estar presente en un bajo porcentaje de pacientes. Sin embargo, otros estudios presentan como primer y único síntoma un síndrome de hipoventilación y/o fallo respiratorio agudo en un paciente con MC-I14,39.
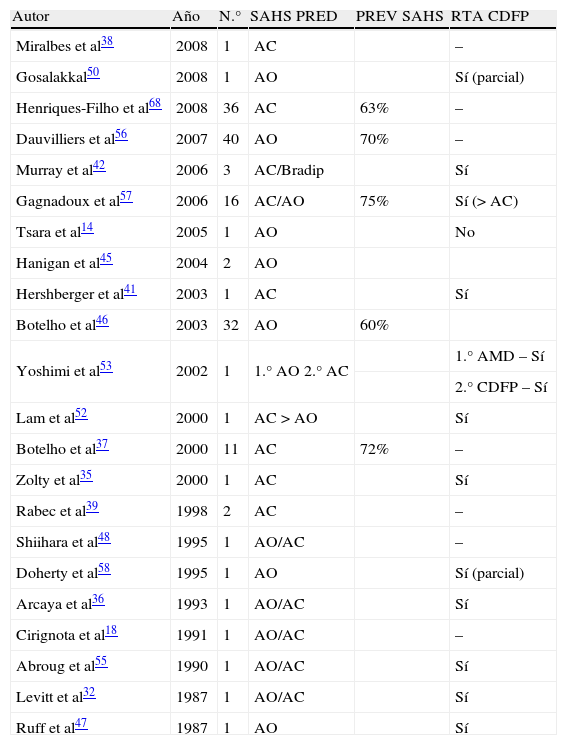
Sólo cuatro artículos analizan los trastornos respiratorios durante el sueño en un grupo amplio de pacientes con MC-I, observándose que la prevalencia de estas alteraciones puede situarse en un 60-72% de los pacientes estudiados, con un predominio de los eventos respiratorios de características obstructivas31,37,56,57.
Si se analizan los artículos publicados hasta el momento actual en los que se estudian los trastornos respiratorios en pacientes con MC tipo I (tabla 1), observamos que inicialmente muchos de ellos presentan casos aislados de pacientes, en los que se observa una tendencia a los eventos respiratorios de características centrales y/o mixtas. Sin embargo, a medida que ha ido aumentando el tamaño de las series de pacientes con MC-I estudiados, esta tendencia de alteraciones respiratorias centrales se ha ido transformando en un predominio de los eventos obstructivos. Sin embargo, los pacientes con MC-I que presentan siringomielia o invaginación basilar continúan teniendo un mayor número de alteraciones respiratorias de tipo central37.
Estudios publicados en los que se objetiva la prevalencia de síndrome de apnea-hipopnea del sueño (SAHS), tipo de apneas y respuesta a la cirugía en pacientes con malformación de Chiari tipo I
| Autor | Año | N.° | SAHS PRED | PREV SAHS | RTA CDFP |
| Miralbes et al38 | 2008 | 1 | AC | – | |
| Gosalakkal50 | 2008 | 1 | AO | Sí (parcial) | |
| Henriques-Filho et al68 | 2008 | 36 | AC | 63% | – |
| Dauvilliers et al56 | 2007 | 40 | AO | 70% | – |
| Murray et al42 | 2006 | 3 | AC/Bradip | Sí | |
| Gagnadoux et al57 | 2006 | 16 | AC/AO | 75% | Sí (> AC) |
| Tsara et al14 | 2005 | 1 | AO | No | |
| Hanigan et al45 | 2004 | 2 | AO | ||
| Hershberger et al41 | 2003 | 1 | AC | Sí | |
| Botelho et al46 | 2003 | 32 | AO | 60% | |
| Yoshimi et al53 | 2002 | 1 | 1.° AO 2.° AC | 1.° AMD – Sí | |
| 2.° CDFP – Sí | |||||
| Lam et al52 | 2000 | 1 | AC>AO | Sí | |
| Botelho et al37 | 2000 | 11 | AC | 72% | – |
| Zolty et al35 | 2000 | 1 | AC | Sí | |
| Rabec et al39 | 1998 | 2 | AC | – | |
| Shiihara et al48 | 1995 | 1 | AO/AC | – | |
| Doherty et al58 | 1995 | 1 | AO | Sí (parcial) | |
| Arcaya et al36 | 1993 | 1 | AO/AC | Sí | |
| Cirignota et al18 | 1991 | 1 | AO/AC | – | |
| Abroug et al55 | 1990 | 1 | AO/AC | Sí | |
| Levitt et al32 | 1987 | 1 | AO/AC | Sí | |
| Ruff et al47 | 1987 | 1 | AO | Sí |
AC: apnea central; AMD: amigdalectomía; año: año de publicación; AO: apnea obstructiva; CDFP: cirugía descompresiva de fosa posterior; N.°: número de pacientes incluidos en el estudio; PREV SAHS: prevalencia del síndrome de apnea-hipopnea (central y obstructiva); RTA CDFP: respuesta a la cirugía descompresiva de fosa posterior; SAHS PRED: tipo de síndrome de apnea-hipopnea predominante.
Aunque habitualmente los trastornos respiratorios se asocian a otras alteraciones neurológicas tales como: siringomielia, parálisis de pares craneales, ataxia, signos de vías largas, parálisis diafragmática y disfunciones autonómicas, algunos autores hacen hincapié en que las alteraciones respiratorias durante el sueño pueden ser el primer y único síntoma de la MC-I, tanto en la edad adulta como en la edad pediátrica, siendo en esta última en la que aparecen alteraciones respiratorias predominantemente de tipo central35,38,39,42,48,52. Por este motivo, algunos autores recomiendan la realización de una resonancia magnética craneal en aquel paciente que inicie con un SAHCS50.
También es importante remarcar que en los pacientes con MC-I las alteraciones respiratorias se han relacionado con un empeoramiento de la siringomielia59 y de la hipertensión intracraneal60,61.
Origen de los trastornos respiratorios nocturnos en la malformación de Chiari tipo IEl mecanismo fisiopatológico de los trastornos respiratorios en los pacientes con MC-I todavía no es bien conocido, aunque se podría explicar a través de una disfunción troncoencefálica. Diversos estudios han objetivado que el tamaño y el volumen de la fosa posterior están disminuidos en los pacientes con una MC-I4,6,62. En estos pacientes, la falta de espacio y el potencial efecto compresivo subsiguiente podrían alterar el funcionamiento de estructuras neuronales a este nivel, ocasionado alteraciones respiratorias principalmente durante el sueño.
En los eventos respiratorios centrales se supone que hay una disfunción por compresión de los centros respiratorios centrales, una compresión de los pares craneales IX y X y/o una alteración de los nervios aferentes causada por la expansión de la siringomielia63.
Las alteraciones respiratorias obstructivas podrían aparecer en relación con una disfunción o hipofunción por compresión de los pares craneales (IX, X, XI y XII) que facilitan el colapso de la vía aérea superior. No obstante, no hay que olvidar que los pacientes con MC-I también tienen factores anatómicos que pueden facilitar la aparición de eventos obstructivos como son la macroglosia, aumento del perímetro cervical y la retrognatia64.
Se ha descrito que en la siringomielia, frecuentemente asociada a MC-I, se puede alterar la función del tracto solitario y del núcleo ambiguo, y que dicha lesión puede cursar con disfagia y disfonía, lo que podría favorecer la presencia de apneas obstructivas30.
Un mecanismo adicional que también podría explicar la existencia de trastornos respiratorios durante el sueño es la hipercapnia. Incluso en los sujetos normales, durante el sueño existe un incremento de la PaCO2 de 2-4mmHg. La hipercapnia es un potente vasodilatador, por lo que un incremento del CO2 sanguíneo durante el sueño puede aumentar de forma significativa la presión intracraneal y así exacerbar la compresión sobre de las estructuras neurales ubicadas en la fosa posterior y charnela cráneo-cervical62.
Reversibilidad de los trastornos respiratorios después del tratamientoDado que la MC-I constituye un problema estructural, anatómico, su tratamiento requiere una corrección quirúrgica. Los objetivos del tratamiento quirúrgico en este tipo de pacientes son los siguientes: a) conseguir un incremento volumétrico de la fosa posterior; b) mejorar o anular el gradiente de presiones cráneo-espinal existente a nivel del foramen magnum; c) restaurar la anatomía normal de los espacios subaracnoideos; d) eliminar la cavidad siringomiélica, en los casos en que esta coexista con la MC-I, y e) aliviar la compresión sobre el tronco del encéfalo. Con estos objetivos, el tratamiento quirúrgico generalmente aceptado para la MC-I es la cirugía de descompresiva de la fosa posterior (CDFP) o del foramen mágnum.
La CDFP ha demostrado ser efectiva en el tratamiento de los síntomas neurológicos de la MC-I, pero existen algunos estudios que han demostrado que tras la realización de la intervención quirúrgica también se obtiene una mejoría de los parámetros respiratorios (tabla 1)4,9–11,14,32,35,36,42,43,52–55,65. La intervención descompresiva sobre la fosa posterior contribuye fundamentalmente a mejorar los parámetros respiratorios centrales, mientras que en los obstructivos se han encontrado resultados diversos (sin cambios después de la cirugía, mejoría parcial o reversión completa de las alteraciones prequirúrgicas) (tabla 1).
Dos estudios, uno de Doherty et al58 y otro de Ely et al51, exponen sendos casos de recurrencia de un SAHOS después de 2 y 5 años de la cirugía descompresiva respectivamente, por lo que los autores recomiendan controles evolutivos de estos pacientes. La recurrencia tras la intervención puede ser un indicador precoz de la recurrencia de la ectopia amigdalar57. Sin embargo, se ha descrito que hasta un 14% de casos el síndrome de apneas del sueño puede aparecer de forma inmediata a la intervención de la MC-I (dentro de los 5 primeros días post-intervención), pudiendo en algunos pacientes llegar a producir la muerte54,57. Este fenómeno se ha relacionado a la formación de edema posquirúrgico en la fosa posterior54,57.
Otros trastornos del sueño en los pacientes con malformación de Chiari tipo IHipersomniaDiversos autores han objetivado que los pacientes con MC-I presentan una mayor prevalencia de somnolencia diurna que la población normal. Sin embargo, esta somnolencia sólo se ha cuantificado en tres estudios mediante la escala de Epworth. Gagnadoux et al57 objetivan una prevalencia de somnolencia diurna, definida con una puntuación > 8 en la escala de Epworth, en el 83% de los pacientes, mientras que en más del 50% la puntuación supera los 10 puntos. Dauvilliers et al56 encuentran somnolencia (Epworth > 10) en un 26% de los pacientes con malformación de Chiari, aunque este porcentaje sube al 48% cuando sólo se considera la población adulta (> 18 años). Bothelo et al46 describen somnolencia diurna, expresada en la escala de Epworth con una puntuación > 9, en el 72% de los pacientes con MC-I. En los tres estudios la somnolencia podría explicarse por la elevada prevalencia de trastornos respiratorios registrados durante el sueño de los pacientes.
Alteraciones en la arquitectura de sueñoExisten pocos estudios dirigidos a analizar las alteraciones en la estructura del sueño de los pacientes con una MC-I. Por otra parte, todos estos estudios incluyen series muy cortas de pacientes, lo que no permite extrapolar los hallazgos a la población global de pacientes con MC-I. Estos estudios sólo muestran discretas alteraciones de la arquitectura de sueño. Dauvilliers et al56 objetivan que, especialmente en los pacientes de más de 18 años, existe una disminución del tiempo total de sueño, con una eficiencia del 74 al 76%, así como un descenso del sueño lento profundo y del sueño REM. Bothelo et al37 constatan una mayor fragmentación del sueño, con una eficiencia del sueño < 90% en el 81% de los pacientes, reducción del sueño REM en el 63% y del sueño lento profundo en el 36%. Las alteraciones observadas en ambos estudios podrían explicarse o estar asociadas a las alteraciones respiratorias que presentan estos pacientes.
Parasomnias en pacientes con malformación de Chiari tipo IDe las diversas parasomnias que se definen en la ICSD-2, en los pacientes con MC-I únicamente se han objetivado casos de trastornos de la conducta en sueño REM, sin que se hayan descrito casos de parasomnias NREM ni de otras parasomnias durante el REM.
El trastorno de la conducta en sueño REM (TCSR) es una parasomnia caracterizada por la pérdida de la atonía muscular durante el sueño REM, con una desinhibición motora concomitante a nivel mesencefálico, lo que origina una hiperactivación motora con movimientos y vocalizaciones durante el sueño REM. Esta conducta motora coincide con sueños vívidos con un contenido usualmente agresivo y violento. El TCSR se ha relacionado con enfermedades neurodegenerativas (enfermedad de Parkinson), narcolepsia, agripnia excitata, esclerosis múltiple, accidente vascular cerebral y tumores cerebelo-pontinos66.
Sólo existen dos artículos en los que se relaciona el TCSR con la MC-I. El primero corresponde a Lapierr et al67 y en él se define que el TCSR puede aparecer en malformaciones cráneo-vertebrales, siendo eventualmente el primer signo de una MC-I no diagnosticada. El segundo estudio corresponde a Henriques-Filho et al68, quienes diagnostican un TCSR en un 19% de los pacientes con MC-I, de los cuales el 28% presentaba un síndrome de apnea-hipopnea del sueño asociado. Estos autores proponen un mecanismo fisiopatológico de disgenesia troncoencefálica, debido a microtraumatismos crónicos de las estructuras neurales sobre los elementos óseos de la charnela craneocervical. En este estudio los autores hacen énfasis sobre un paciente en el que se le realizó una cirugía descompresiva de la fosa posterior y después del tratamiento quirúrgico mejoró tanto de las apneas como del TCSR. Estos hallazgos podrían justificar el mecanismo fisiopatológico propuesto por los autores, pero no permiten descartar la existencia de un «seudo-TCSR», descrito por Iranzo et al69. De acuerdo con este autor, el seudo-TCSR consiste en una actividad motora exagerada, incluso con vocalizaciones, que puede presentarse durante el despertar de los eventos respiratorios en lugar de durante el sueño REM69.
Trastornos de movimiento asociados al sueñoDe los diferentes trastornos de movimiento que se encuentran descritos en la literatura, en la MC-I sólo se han publicado dos artículos referidos a estos fenómenos. Ambos estudios se centran sobre el síndrome de movimiento periódico de las piernas durante el sueño (MPP).
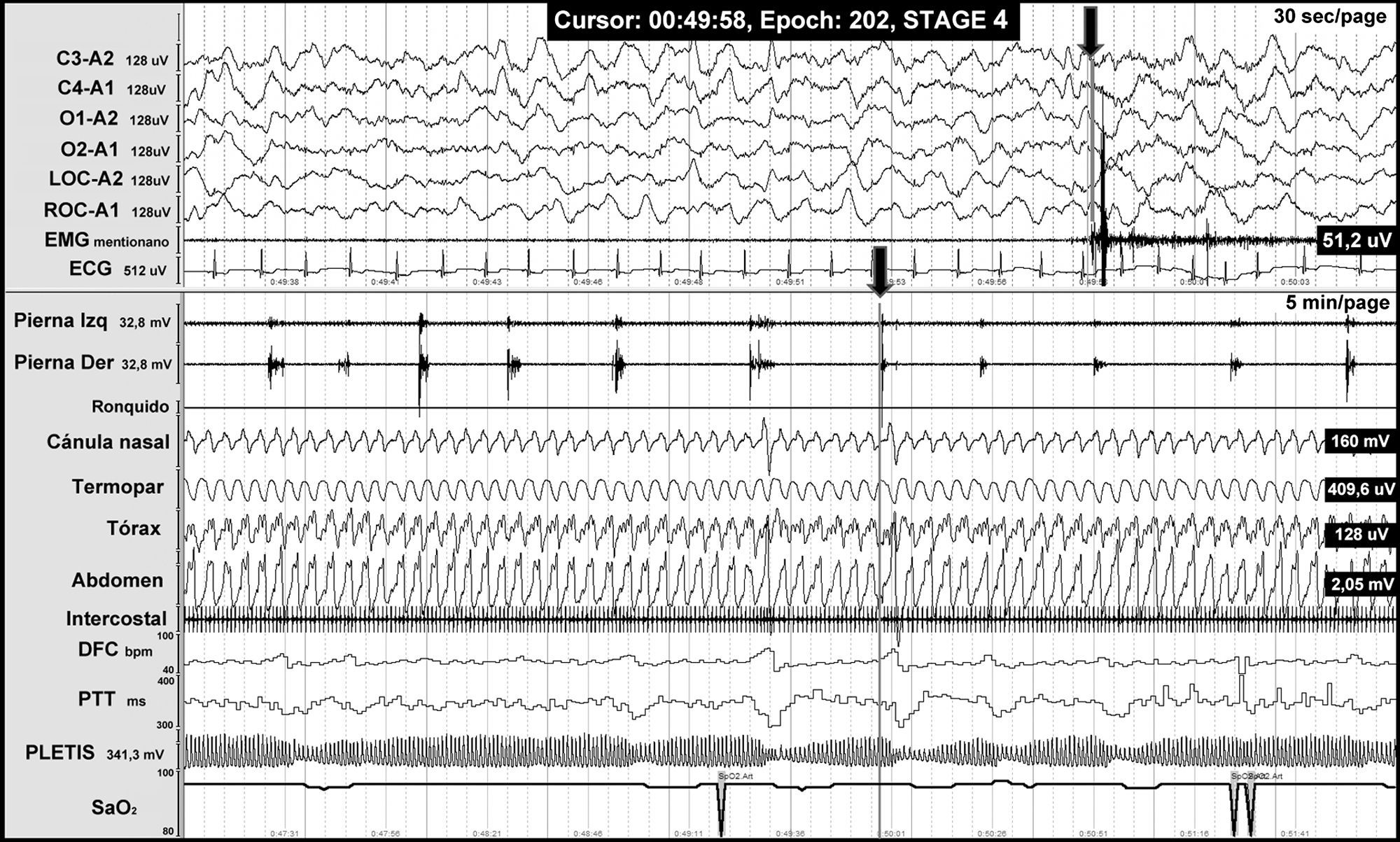
El síndrome de MPP se caracteriza por un movimiento repetitivo y estereotipado de dorsiflexión del dedo gordo del pie, acompañado de una flexión del tobillo, rodilla y cadera a intervalos de 5-90s, con una duración de 0,5 a 5s, que recurren con una periodicidad en sueño lento superficial y menos frecuentemente durante la vigilia (fig. 4). Los MPP se han relacionado con varios trastornos de origen espinal, tales como esclerosis múltiple, síndrome de Isaac, enfermedad de motoneurona, espondilosis cervical, lesiones medulares, tumores y anestesia espinal.
Registro polisomnográfico nocturno de un paciente con malformación de Chiari tipo I en el que se objetivan movimientos periódicos de las piernas. La línea gris al final de uno de los movimientos de piernas (flecha) se asocia a activación simpática (objetivada en los canales de frecuencia cardiaca [DFC], transición de la onda de pulso [PTT] y la amplitud de la onda de pulso [PLETIS]) y a un microdespertar cortical visible en los canales de electroencefalografía.
Sólo hemos encontrado dos referencias en las que se demuestre un aumento significativo de MPP en pacientes con MC-I, que están presentes hasta en el 62% de los pacientes, porcentaje muy superior al de la prevalencia de este problema en la población normal (5%)55,70. Cabe destacar que todos los pacientes incluidos en estos estudios presentaban una siringomielia asociada55,70.
Existe un único estudio en el que se relaciona la MC-I con el síndrome de piernas inquietas (SPI)71. Además de la MC-I, estos pacientes no presentaban ningún otro proceso potencialmente causante del SPI y todos ellos eran resistentes al tratamiento farmacológico habitual (agonistas dopaminérgicos). En este estudio, los pacientes presentaban un índice de MPP muy elevado en la PSG, confirmando el diagnóstico de SPI. A pesar de estos hallazgos, no puede concluirse que el SPI es secundario a MC-I71.
InsomnioDe acuerdo con los criterios de la ICDS-2, el insomnio se define como una dificultad repetida en conciliar el sueño, mantener el sueño y/o despertar precoz, que se asocian a una sensación de sueño poco reparador y de mala calidad, condicionando una o más de las siguientes manifestaciones diurnas.
En la literatura se han escrito pocos casos de insomnio y ansiedad asociados a MC-I17,72,73. En estos estudios se sugiere que la MC- I puede ser una causa precipitante y perpetuante de ansiedad, y es de difícil control y con mala respuesta al tratamiento. Sin embargo, después de la cirugía de fosa posterior, aunque los síntomas no llegan a remitir, los autores refieren una discreta mejoría y una mejor respuesta terapéutica de la ansiedad72,73. Estos autores proponen como fundamentos fisiopatológicos de esta asociación dos teorías: a) la compresión del tronco del encéfalo condicionaría un compromiso de la vía serotoninérgica del núcleo dorsal y medio del rafe, regulador de los estados de ansiedad agudos y crónicos, y del núcleo coeruleus, responsable del aporte noradrenérgico del córtex y, por tanto, un importante regulador de la ansiedad, y b) la ansiedad vendría generada por la presencia de la sintomatología propia de la malformación de Chiari73.
Otro aspecto que se debe considerar es que los trastornos respiratorios durante el sueño también pueden debutar clínicamente en forma de insomnio y ansiedad, debido a la fragmentación y la deuda crónica de sueño que producen los eventos respiratorios. Por ello, se recomienda que en pacientes con presentaciones psiquiátricas atípicas se descarte siempre patología neurológica.
Recomendaciones para la valoración de pacientes con malformación de Chiari tipo IDebido a la elevada prevalencia de trastornos respiratorios que presentan los pacientes con una MC-I, y hasta que se definan criterios más específicos, el estudio de esta patología debería incluir un cribado clínico de estos trastornos, ya que pueden estar presentes sin que existan otras anomalías neurológicas asociadas. Un aspecto relevante en el manejo de los pacientes con una MC-I es la importancia de realizar un diagnóstico y tratamiento precoz de las alteraciones respiratorias, con el objeto de minimizar la potencial morbimortalidad asociada a estos trastornos. Por ello, en los pacientes con MC-I que presenten una sospecha clínica de alteraciones respiratorias nocturnas o cuando se requiere establecer una indicación quirúrgica debería practicarse un estudio polisomnográfico.
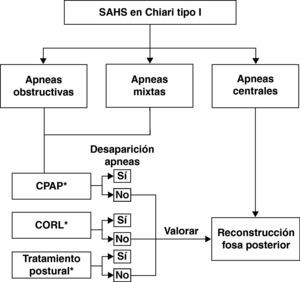
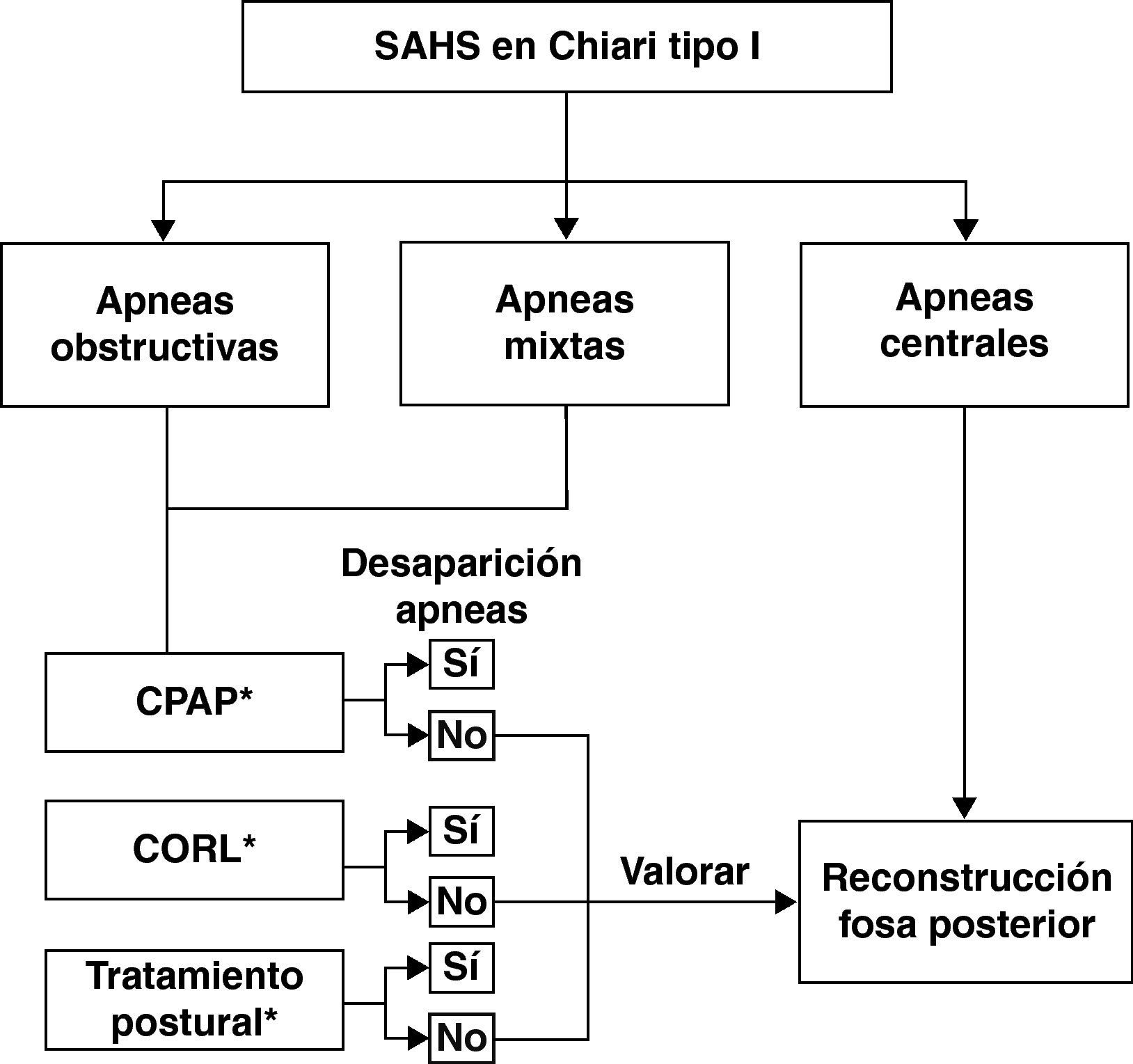
Dentro de las alteraciones respiratorias que pueden presentar estos pacientes es importante identificar y diferenciar fenómenos obstructivos, centrales y/o mixtos, con el objeto de dirigir adecuadamente el tratamiento del paciente. Siguiendo un esquema simplista, la estrategia terapéutica de los trastornos respiratorios de estos pacientes se debería dirigir a: a) cirugía descompresiva de la fosa posterior, en los casos en los que existan eventos centrales; b) presión positiva continua en la vía respiratoria; c) cirugía otorrinolaringológica, si se diagnostica una causa obstructiva periférica; d) tratamiento postural en aquellos casos que presenten un SAHOS postural, o e) una combinación de las distintas maniobras terapéuticas53,74,75. Es importante recordar que se han descrito casos de pacientes con MC-I con apneas o hipopneas obstructivas o mixtas en los que, en ausencia de problemas obstructivos orofaríngeos, la cirugía descompresiva de fosa posterior ha mejorado o normalizado la sintomatología respiratoria. La figura 5 muestra un posible algoritmo terapéutico que se debe seguir en función de los hallazgos respiratorios nocturnos de estos pacientes.
Algoritmo terapéutico que debe seguirse en los pacientes con malformación de Chiari tipo I y alteraciones respiratorias nocturnas. CORL: cirugía otorrinolaringológica; CPAP: tratamiento con presión positiva de aire continua; tratamiento postural: consiste en un sistema que colocado en la espalda impide adoptar la posición supina.
Los pacientes con una MC-I pueden presentar diversos trastornos del sueño, de los cuales los más estudiados han sido los trastornos respiratorios, debido a su alta prevalencia e importantes repercusiones clínicas. Sin embargo, estos pacientes también pueden presentar hipersomnia, insomnio, trastornos de la conducta en sueño REM, síndrome de MPP y SIP. Por ello, la anamnesis de estos pacientes debe dirigirse a descartar estos fenómenos, ya que muchos de ellos pueden pasar desapercibidos, tanto para el paciente como para los clínicos. Detectarlos de forma precoz va a permitir aplicar un tratamiento adecuado y mejorar la calidad de sueño, la calidad de vida y disminuir la morbimortalidad asociada a la malformación de Chiari tipo I.
FinanciaciónEsta revisión ha sido parcialmente financiada por la beca FIS PI07/0681 del Fondo de Investigación Sanitaria concedida a M.A. Poca.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos a todos los compañeros de trabajo, tanto de la unidad de sueño, como de neurocirugía, que me apoyan y estimulan para seguir trabajando en proyectos de investigación.





![Registro polisomnográfico nocturno de un paciente con malformación de Chiari tipo I en el que se objetivan movimientos periódicos de las piernas. La línea gris al final de uno de los movimientos de piernas (flecha) se asocia a activación simpática (objetivada en los canales de frecuencia cardiaca [DFC], transición de la onda de pulso [PTT] y la amplitud de la onda de pulso [PLETIS]) y a un microdespertar cortical visible en los canales de electroencefalografía. Registro polisomnográfico nocturno de un paciente con malformación de Chiari tipo I en el que se objetivan movimientos periódicos de las piernas. La línea gris al final de uno de los movimientos de piernas (flecha) se asocia a activación simpática (objetivada en los canales de frecuencia cardiaca [DFC], transición de la onda de pulso [PTT] y la amplitud de la onda de pulso [PLETIS]) y a un microdespertar cortical visible en los canales de electroencefalografía.](https://static.elsevier.es/multimedia/02134853/0000002900000005/v1_201406010057/S0213485311000144/v1_201406010057/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)