La infección intrauterina por citomegalovirus es la más frecuente de las viriasis/parasitosis intrauterinas que afectan al sistema nervioso central y causan lesiones permanentes tanto en el córtex como en la sustancia blanca subcortical. Son escasos los estudios de resonancia magnética (RM) cerebral.
Material y métodosSeis pacientes (4M y 2V) fueron estudiados desde los primeros meses de vida para hacer el diagnóstico de citomegalia congénita e identificar la presencia de lesiones corticales y subcorticales, utilizando las necesarias secuencias de RM.
ResultadosLos 6 pacientes mostraban malformaciones del desarrollo cortical (MDC) (esquisencefalia, polimicrogiria o lisencefalia-paquigiria) desde la época neonatal y alteraciones difusas de la sustancia blanca, que se mantuvieron con pocos cambios durante los dos primeros años y después se iban reduciendo de tamaño en forma de zonas de hiperseñal en T2, circunscritas a determinadas áreas y permanecían con pocos cambios durante algunos años más.
ConclusiónLa infección intrauterina por citomegalovirus causa lesiones en sustancia gris cortical, que consisten en MDC y en sustancia blanca subcortical. Estas últimas muestran aspecto cambiante, ya que aparecen como áreas difusas y amplias de hiperseñal, que se suelen interpretar como retraso en la mielinización, pero que también pueden ser causadas directamente por el virus de la citomegalia. Estas alteraciones de la sustancia blanca sufren cambios morfológicos a lo largo de los primeros años de vida, dejando atrofia cerebral. Las secuelas neurológicas que dejan estas alteraciones son severas y crónicas.
Intrauterine infection due to cytomegalovirus is the most common of the intrauterine viral/parasitic infections that affect the central nervous system and cause permanent lesions in the cortex as well as the subcortical white matter. Studies using brain magnetic resonance imaging (MRI) are limited.
Material and methodsSix patients (4 females and 2 males) were studied in the first months of life in order to make a diagnosis of congenital cytomegalovirus, and identify the cortical and subcortical lesions using the necessary MRI sequences.
ResultsThe six patients showed malformations of cortical development (MDC) (schizencephaly, polymicrogyria or lissencephaly-pachygyria) from the neonatal period, and diffuse changes of the white matter, which remained with few changes during the first two years. They then began reducing in size in the form of high signal areas in T2, restricted to certain areas, and were evident for a few years more with little change.
ConclusionIntrauterine infection due to cytomegalovirus causes changes in the cortical grey matter, which consists of MDC, and in the subcortical white matter. The latter show a changing aspect as they appear as diffuse and wide areas of high signal intensity, which is usually due to delay in myelinisation, but could also be caused directly by the cytomegalovirus. These changes in the white matter are subjected to morphological changes throughout the first years of life, leading to brain atrophy. The neurological sequelae of these lesions left by these alterations are severe and chronic.
Las malformaciones del desarrollo cortical (MDC) forman parte del gran grupo de alteraciones de la migración neuronal y de la organización cortical, siendo las entidades más conocidas la esquisencefalia, la lisencefalia-paquigiria, la polimicrogiria, las displasias corticales y las heterotopias1. El interés de estos cuadros radica en la asociación de cada una de estas entidades con problemas neurológicos, principalmente con crisis epilépticas, retraso psíquico y alteraciones motoras o sensoriales. Las MDC tienen su base en las alteraciones en el orden histológico neuronal por perturbación del normal proceso de diferenciación de neuronas y células gliales en las matrices germinales ependimarias de los ventrículos laterales, en la migración neuronal y en la organización cortical2,3. A continuación de este proceso formativo tiene lugar el de diferenciación, migración y correcto emplazamiento de las células cerebrales, ordenadamente dirigido por genes específicos4,5, unos más importantes que otros, apareciendo como gen director el reelin4. Pero la etiología de varios tipos de MDC no siempre puede ser identificada y, menos aún, puede achacarse su origen a un gen determinado. En opinión de algunos autores, lesiones exógenas tempranas —tales como hipoxia, infecciones durante la gestación o traumas perinatales— pueden desempeñar un papel en el origen de algunos tipos de MDC6–9. Experimentalmente, también se ha inducido displasia cortical en ratas a las que se alteró la morfología neuronal y la corticogénesis por irradiación10.
La citomegalia es la infección por citomegalovirus. Es la causa más común de infección viral intrauterina y perinatal en el mundo, provocando más de 40.000 casos de niños afectados cada año en Estados Unidos11,12. Pese a que ya transcurrieron muchos años desde que la constelación TORCH (toxoplasmosis, rubéola, citomegalia y herpes) se manejaba frecuentemente entre las posibles infecciones intrauterinas y perinatales, y se imponía un diagnóstico diferencial, especialmente a través de marcadores analíticos, prioritariamente de tipo hematológico, inmunológico o bioquímico, todavía sigue siendo popular este término entre los pediatras, especialmente entre los neonatólogos. Si bien las posibilidades diagnósticas han avanzado con los nuevos métodos de imagen, con utilización intrauterina muy temprana, como son la ecografía de técnica muy avanzada, la tomografía computarizada (TC) y la resonancia magnética (RM)11–14, todavía siguen naciendo muchos niños afectados por citomegalia intrauterina y sintomatología clínica manifestada por ictericia, trombocitopenia, hepatomegalia, petequias, púrpura y esplenomegalia, presentando casi la mitad de los casos complicaciones en el sistema nervioso central (SNC), tales como microcefalia, coriorretinitis, pérdida auditiva sensorial, calcificaciones intracraneales, retraso en el desarrollo psicomotor y crisis15. Parece que el avance experimentado en el tratamiento ha sido menor, ya que la vacuna, en la que ya hace más de 30 años se tenían muchas esperanzas, aunque ha avanzado en sus resultados y se utiliza en la prevención de la transmisión viral madre-hijo16, puede considerarse todavía como un tratamiento de resultados controvertidos17.
Nosotros hemos estudiado 6 pacientes cuyo padecimiento materno de citomegalia durante la gestación causó MDC (esquisencefalia, lisencefalia-paquigiria y polimicrogiria), además de cambios de señal en la sustancia blanca, acompañado de cuadro neurológico severo por cuya causa consultaron posnatalmente y fueron estudiados neurológica y radiológicamente, y posteriormente tratados.
Material y métodosSon 6 pacientes, 4 mujeres y 2 varones, que consultaron en el Servicio de Neurología Pediátrica del Hospital Universitario La Paz cuando tenían edades que estaban entre recién nacidos (RN) y 9 meses (promedio 3 meses) por crisis convulsivas, microcefalia, espasticidad, retraso en la evolución psicomotriz y sordera. Las madres, primíparas o secundíparas, habían presentado durante el embarazo fiebre, dolor abdominal o velocidad de sedimentación sanguínea elevada en más del 50% de ellas. Los partos habían sido normales y a término, con un Apgar al minuto de 9/10 y un peso entre 2.700 y 2.850g, y un perímetro cefálico entre 32 y 33cm. Uno de los pacientes presentaba infección auditiva bilateral, que precisó drenaje hasta su curación al cabo de unos meses. Aparte del estudio analítico encaminado a buscar la relación del trastorno con la infección por virus citomegálico, se realizó un estudio posnatal por RM en 5 pacientes, manejando diversas secuencias y reconstrucción cortical dada la preferencia de las lesiones causadas por este virus por la polimicrogiria, la paquigiria y la esquisencefalia. En un niño, el estudio de imagen consistió solo en tomografía computarizada (TC).
En el estudio de RM realizado a las madres de dos de los pacientes no se observó ningún tipo de alteración.
ResultadosEl crecimiento del perímetro cefálico ha ido evolucionando con percentiles por debajo del p<–2 DE y así se ha mantenido hasta la edad del último control (entre los 8 y los 12 años) en los 3 pacientes que siguen visitándose periódicamente, que son los tres que no presentan esquisencefalia, el retraso en la evolución psicomotriz era muy severo y su control fue perdido por abandono de su seguimiento por parte de la familia a lo largo del primer año de la vida sin haber iniciado el contacto consciente con el entorno y, obviamente, tampoco el lenguaje ni la sedestación. El retraso en todas las actitudes psicomotrices también era muy importante en los tres pacientes sin esquisencefalia, iniciando muy tarde la marcha y el lenguaje, ambas cosas conseguidas en 2 pacientes a nivel muy primario, la primera tras un tratamiento fisioterápico, ayudado con aplicación intramuscular de toxina botulínica debido al gran componente espástico y, la segunda con la ayuda de educación logopédica. Uno todavía no ha conseguido la marcha sin ayuda debido a la espasticidad, que ha causado problemas de subluxación de cadera (caso 4).
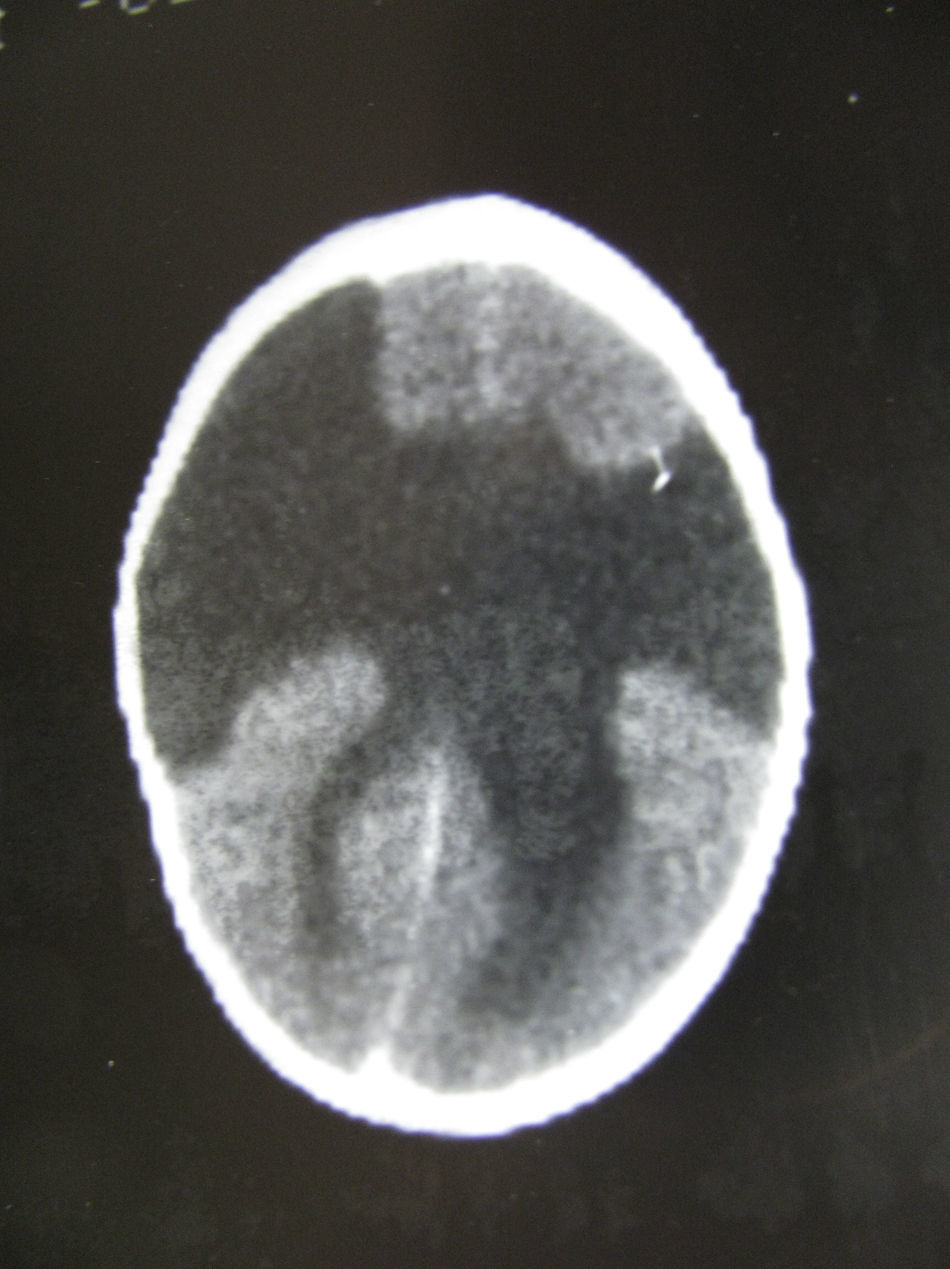
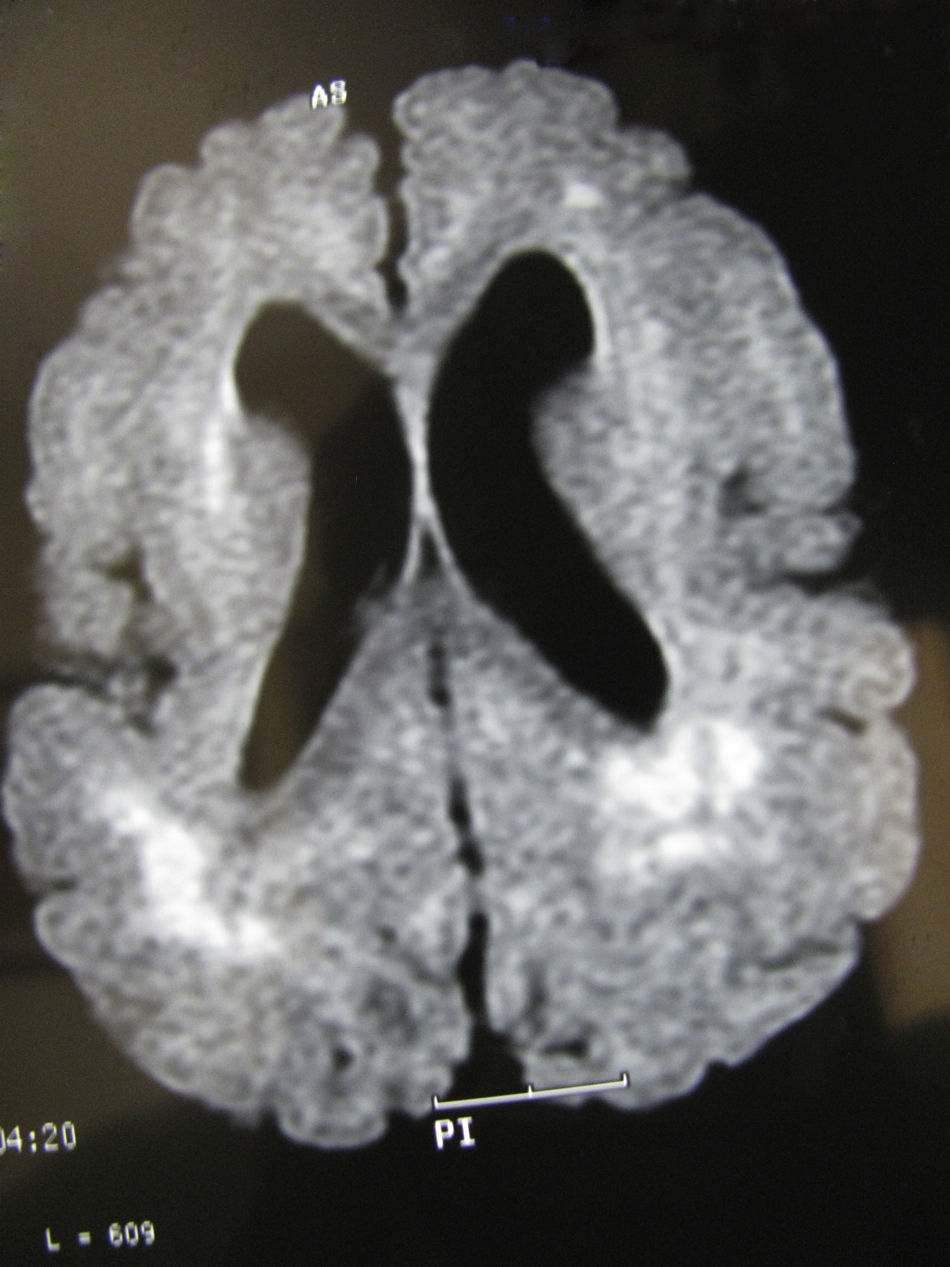
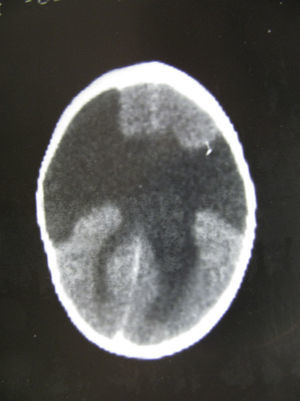
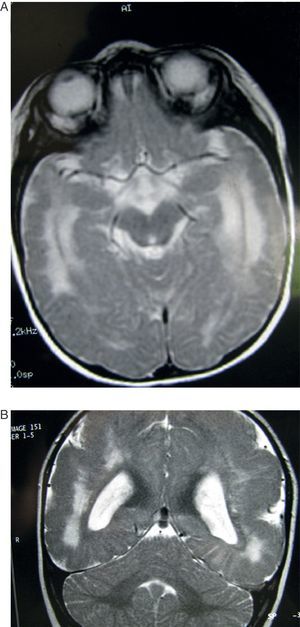
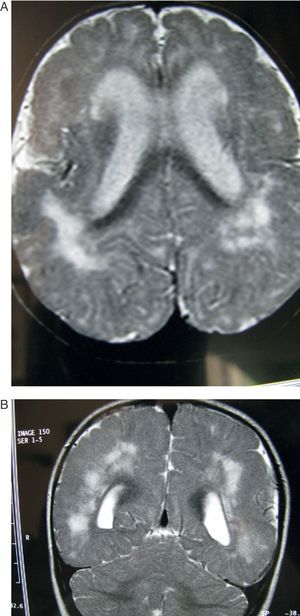
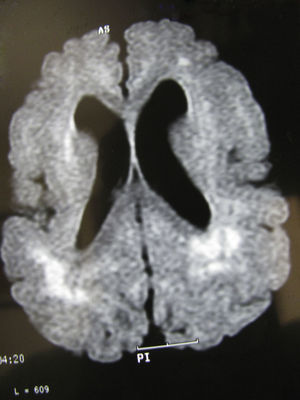
Tanto la TC en el único caso en que se practicó esta prueba (fig. 1) como los estudios completos de RM mostraron alteraciones importantes en la sustancia blanca subcortical como en la sustancia gris cortical. La esquisencefalia de labios abiertos bilaterales (LABL) estaba presente en los casos 1 y 2, mientras que se presentaba unilateralmente en el caso 3. En los casos 4,5 y 6 existía polimicrogiria alternando con áreas de paquigiria en ambos hemisferios. Estas alteraciones se observaban en todas las proyecciones o cortes (axiales, coronales y sagitales) (fig. 2) de todas las secuencias practicadas en los casos 4, 5 y 6, no existiendo diferencias entre las alteraciones recogidas durante el primer año de edad y a los 6-10 años. Este tipo de estabilización de las lesiones corticales no ocurrió en las lesiones de la sustancia blanca, cuyas imágenes de hiperseñal de la RM en T2 evolucionaron a lo largo de los años, al menos en los primeros, y llegaron a los años posteriores con algún tipo de alteración y sin normalizar del todo la señal (figs. 3–5). Estas zonas de hiperseñal en T2 siguieron apareciendo, aunque más circunscritas, durante algunos años. Estas zonas, que eran interpretadas como posible retraso en la mielinización, no puede descartarse que correspondan a reacción inflamatoria crónica ante el ataque del virus de la citomegalia, ya que se acompaña de posteriores secuelas neurológicas que afectan a la casi totalidad de las funciones del SNC.
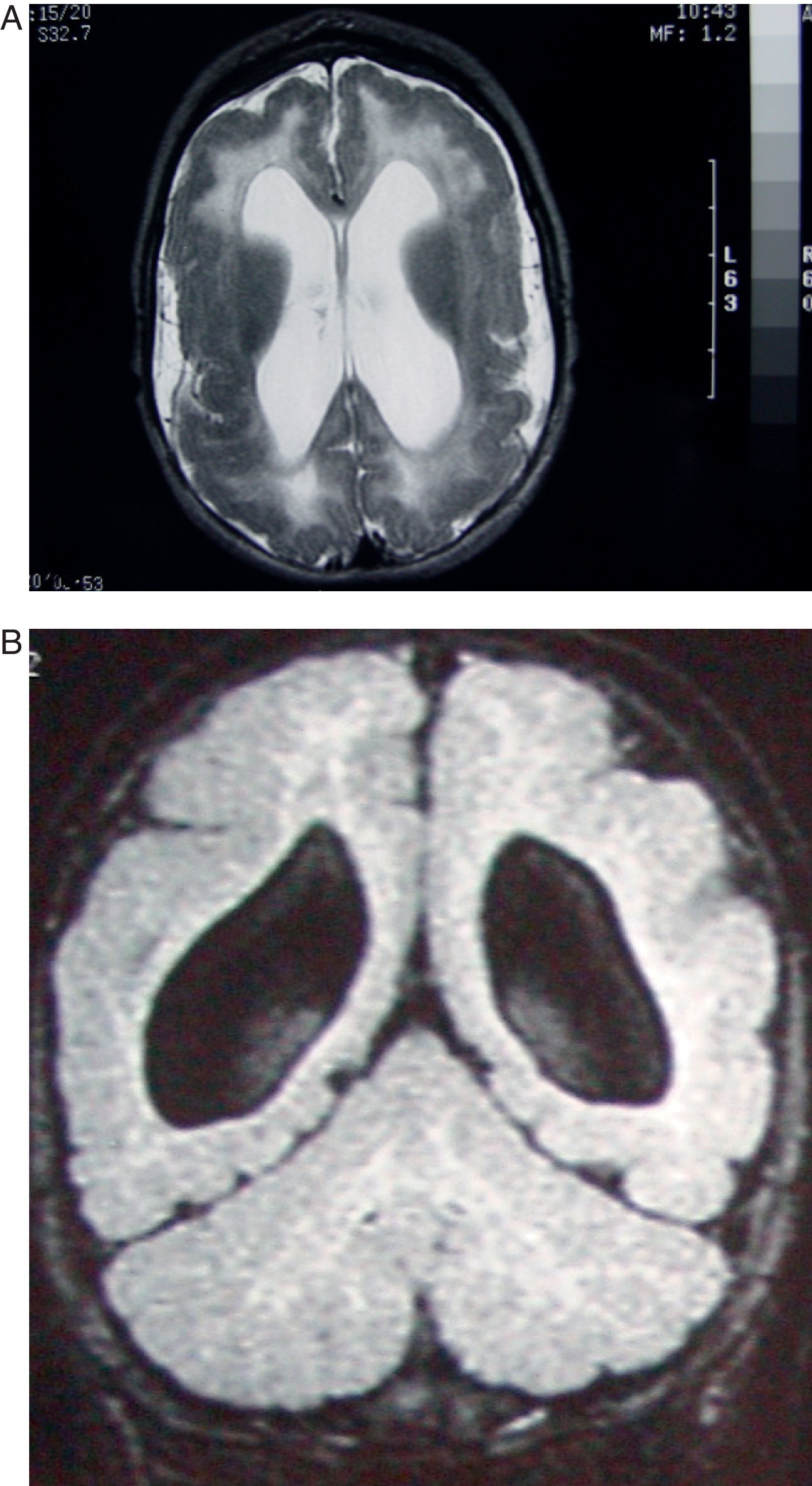
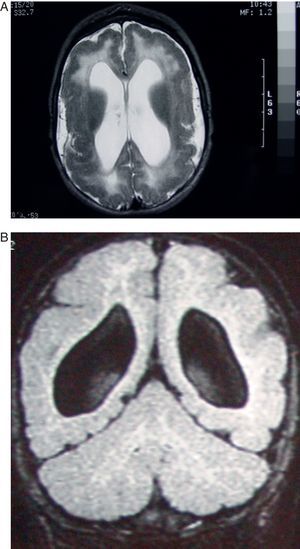
Caso 4. Paciente de 5 meses con citomegalia intrauterina. Estudio de RM. A) El corte axial en T2 muestra alteraciones corticales tipos paquigiria y polimicrogiria, dilatación de los ventrículos laterales e imagen difusa de hiperseñal en la sustancia blanca de ambos hemisferios. B) Corte coronal del mismo estudio en T1 mostrando la pobreza de circunvoluciones, la gran anchura de la sustancia gris cortical (polimicrogiria) y la gran dilatación pasiva con aspecto redondeado de los ventrículos laterales.
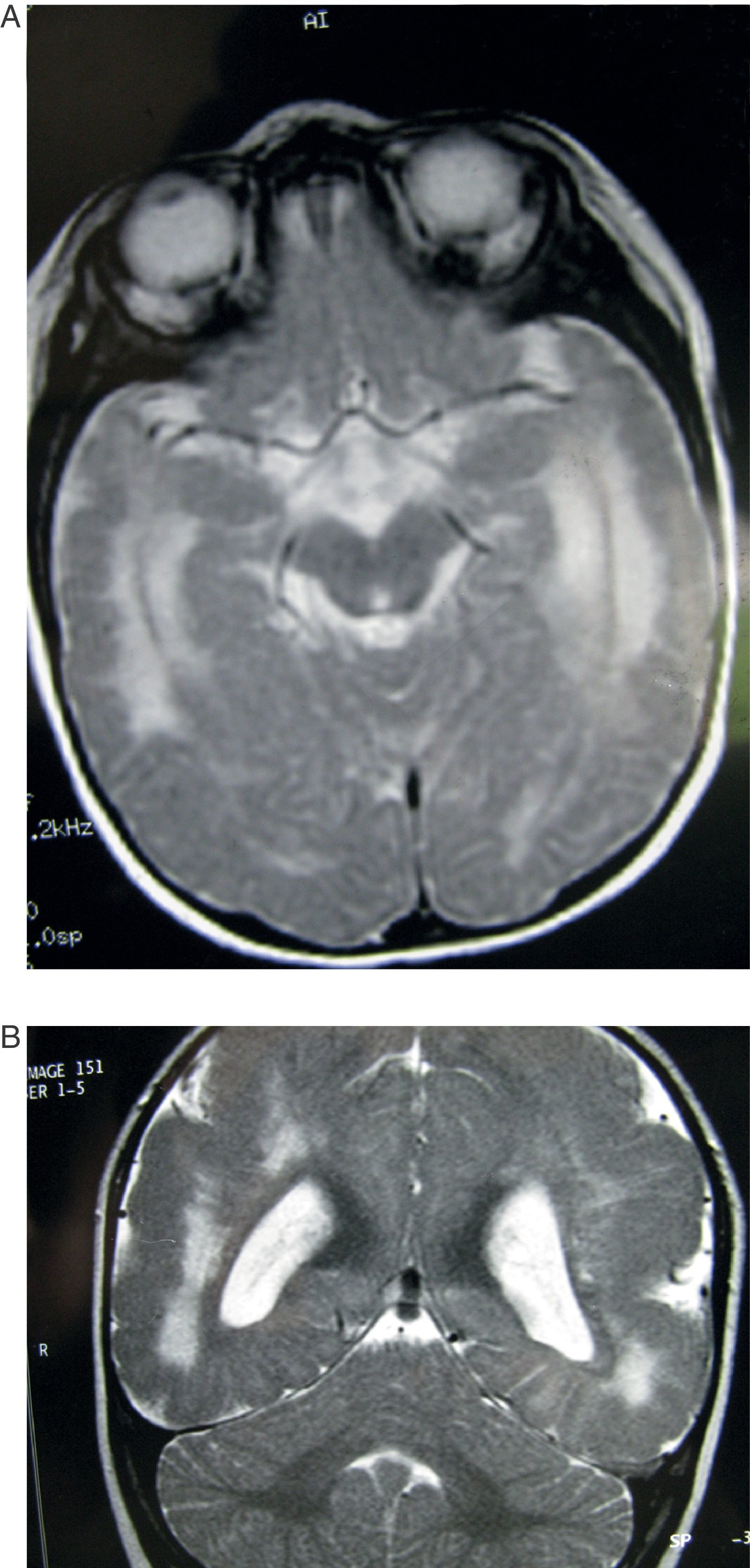
Caso 5. Paciente de 6 meses. A) Corte axial de la RM a la altura de la base cerebral mostrando amplia zona de hiperseñal en sustancia blanca de ambos hemisferios. B) Corte coronal del mismo estudio en T2. Se observan alteraciones corticales e hiperseñalización difusa de la sustancia blanca, con predominio en zonas posteriores y anteriores del cerebro.
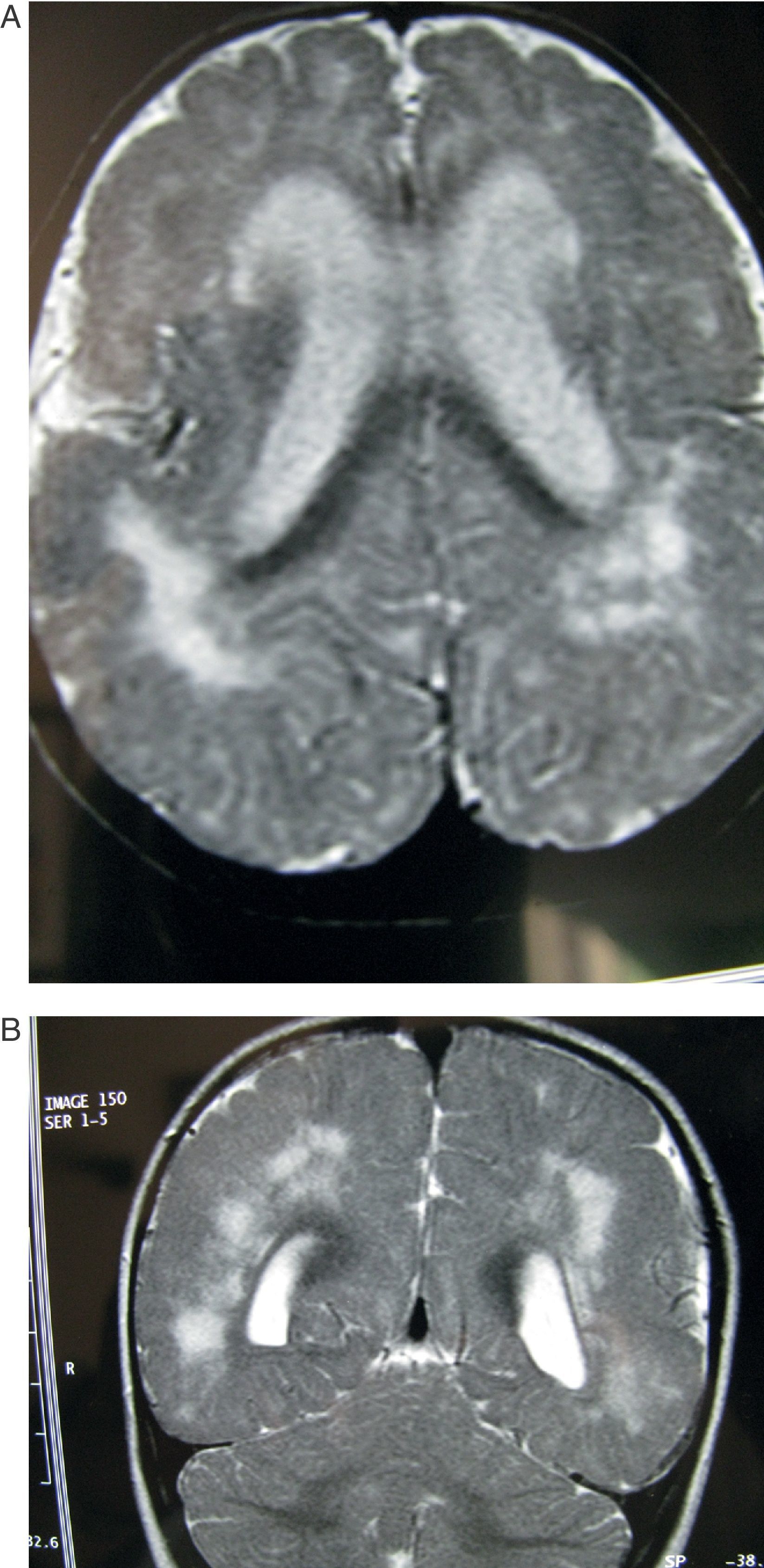
Mismo paciente de la figura 3 al año de edad. A) El corte axial muestra las mismas alteraciones corticales y subcorticales que a los 6 meses, pero las lesiones de la sustancia blanca presentan mayor grado de hiperseñal. B) El corte coronal también muestra alteraciones en la sustancia blanca similares a las de los 6 meses.
Las imágenes de los ventrículos eran muy diferentes en los estudios de los pacientes con esquisencefalia, que aparecían muy dilatados, con las aperturas esquisencefálicas hemisféricas de LABL (casos 1 y 2) o de LC unilaterales (caso 3) y con ausencia de septum pellucidum y de cuerpo calloso en los 3 casos. Los bordes polimicrogíricos de los labios esquisencefálicos no aparecían muy nítidos en ninguno de estos pacientes debido a que en uno de ellos solo se practicó estudio con TC y, en los otros dos, la RM no era tridimensional y dicha anormalidad precisa imagen de buena definición. En los 3 pacientes con lisencefalia-paquigiria o polimicrogiria, los ventrículos laterales aparecían dilatados y redondeados, probablemente por atrofia de la sustancia blanca.
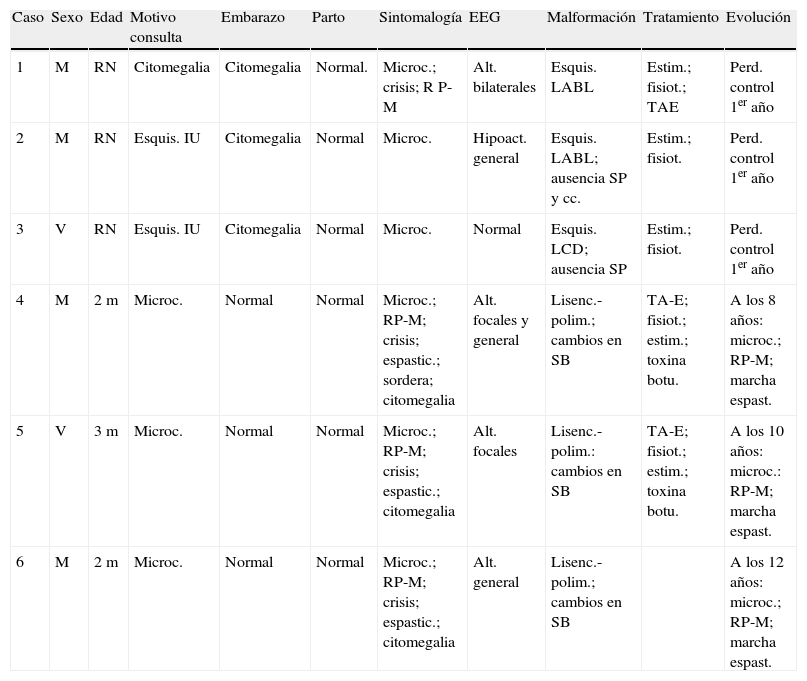
El EEG siempre mostró algún tipo de alteración focal, de aparición no constante (dependía del momento de control continuado o no de las crisis). El tratamiento farmacológico permitió el control de las crisis en los tres pacientes (casos 4,5 y 6) que fueron seguidos a lo largo de varios años. Los hallazgos clínicos, de EEG y de imagen más destacados aparecen en la tabla 1.
Citomegalia intrauterina. Secuelas
| Caso | Sexo | Edad | Motivo consulta | Embarazo | Parto | Sintomalogía | EEG | Malformación | Tratamiento | Evolución |
| 1 | M | RN | Citomegalia | Citomegalia | Normal. | Microc.; crisis; R P-M | Alt. bilaterales | Esquis. LABL | Estim.; fisiot.; TAE | Perd. control 1er año |
| 2 | M | RN | Esquis. IU | Citomegalia | Normal | Microc. | Hipoact. general | Esquis. LABL; ausencia SP y cc. | Estim.; fisiot. | Perd. control 1er año |
| 3 | V | RN | Esquis. IU | Citomegalia | Normal | Microc. | Normal | Esquis. LCD; ausencia SP | Estim.; fisiot. | Perd. control 1er año |
| 4 | M | 2m | Microc. | Normal | Normal | Microc.; RP-M; crisis; espastic.; sordera; citomegalia | Alt. focales y general | Lisenc.-polim.; cambios en SB | TA-E; fisiot.; estim.; toxina botu. | A los 8 años: microc.; RP-M; marcha espast. |
| 5 | V | 3m | Microc. | Normal | Normal | Microc.; RP-M; crisis; espastic.; citomegalia | Alt. focales | Lisenc.-polim.: cambios en SB | TA-E; fisiot.; estim.; toxina botu. | A los 10 años: microc.: RP-M; marcha espast. |
| 6 | M | 2m | Microc. | Normal | Normal | Microc.; RP-M; crisis; espastic.; citomegalia | Alt. general | Lisenc.-polim.; cambios en SB | A los 12 años: microc.; RP-M; marcha espast. |
alt.: alteraciones; cc.: cuerpo calloso; espast.: espástico; espastic.: espasticidad; esquis.: esquisencefalia; estim.: estimulación; fisiot.: fisioterapia; general.: generalizada; hipoact.: hipoactividad; IU: intrauterino; LABL: labios abiertos bilaterales; LCD: labios cerrados en lado derecho; lisenc.-polim.: lisencefalia-polimicrogiria; luxac. cad.: luxación de cadera; m: meses; M: mujer; microc.: microcefalia; perd.: pérdida; RN: recién nacido; RP-M: retraso psicomotor; SB: sustancia blanca; SP: septum pellucidum; TAE: tratamiento antiepiléptico; toxina botu.: tratamiento de la espasticidad con toxina botulínica; V: varón.
La infección intrauterina por virus citomegálico es posiblemente la más frecuente entre las que son capaces de causar malformaciones en el feto11. Tanto la madre como el niño afectado durante el embarazo y en la época de recién nacido presentan los signos propios de la infección. Entre estos destacan la hepatoesplenomegalia, la microcefalia, las dificultades de audición, la coriorretinitis, las petequias, el retraso en la evolución psicomotriz y las crisis15–19. Hasta la llegada de los estudios por RM, capaces de diagnosticar directamente, las principales alteraciones cefálicas causadas en el feto por el virus citomegálico eran la radiología simple y la neumoencefalografía— mostrando las calcificaciones periventriculares y la microcefalia— los métodos de imagen que permitían su diagnóstico.
Al contrario de la toxoplasmosis, otro componente (en este caso parasitario) de la constelación TORCH, que crea inmunidad, el virus de la citomegalia no se elimina después de la primera infección en la mayoría de los casos, queda latente y puede reactivarse posteriormente, especialmente en sujetos con problemas de inmunidad o durante el embarazo. Ello ocurre en las tres cuartas partes de los casos20.
La infección por virus citomegálico ocurre en el 0,6-0,7% de todos los RN y es la alteración neurológica congénita de causa infecciosa de mayor prevalencia en España21 y también en Suecia, donde alcanza del 0,2 al 0,5%. Las alteraciones más severas son las malformaciones corticales cerebrales19,22.
Los niños que muestran alguna sintomatología en la época neonatal tiene muchos riesgos de presentar después secuelas neurológicas y muchos de los que aparentan normales al nacer también evolucionan con diversas alteraciones principalmente neurológicas y de otros tipos, especialmente auditivas, asociadas frecuentemente a lesiones en la sustancia blanca, que pueden ser extensas y de aparición temprana23, hecho constatado también en los casos 4,5 y 6 de nuestra serie.
Uno de los tests más fiables para detectar la infección primaria es la presencia de las inmunoglobulinas IgG e IgM. Desde hace pocos años, el diagnóstico retrospectivo de la infección por citomegalia congénita ha sido posible mediante el uso de la reacción de la cadena de polimerasa en el ADN sanguíneo almacenado usando los filtros de papel o cartas de Guthrie23–25. La detección intrauterina no es difícil pero el tratamiento proporciona todavía resultados modestos y, en este momento, parece que la combinación de antibióticos y esteroides a la madre es el más prometedor26. La ausencia de signos abdominales durante la gestación garantiza la supervivencia de los niños afectados y la presencia de signos abdominales o cerebrales va asociada a un pronóstico pobre que sugiere la posibilidad de aplicar a estos fetos un tratamiento intrauterino para la infección por citomegalovirus27.
La presencia de un niño recién nacido con microcefalia y lesiones oculares típicas o, en edades posteriores, con retraso en la evolución psicomotriz, hiperactividad, incoordinación motriz, disminución auditiva y signos de afectación cerebelosa, indica el padecimiento intrauterino tardío de citomegalia28. Los estudios por RM ponen en evidencia las lesiones cerebrales que, además de reducción de la masa cerebral y de la dilatación ventricular generalizada, consisten fundamentalmente en alteraciones de la sustancia gris y de la sustancia blanca. En la sustancia gris cortical destacan los cambios en el perfil de los surcos y circunvoluciones, con la presencia de esquisencefalia, lisencefalia, polimicrogiria, paquigiria y displasia cortical19,22,25,28–30. Estos tipos de alteración cortical dependen del periodo gestante en el que fue afectado el feto por el virus de la citomegalia31. Estas alteraciones raras veces van solas y se acompañan de lesiones de gravedad similar en el cerebelo, como son la hipoplasia global, afectando a vermis y a hemisferios.
El mecanismo de afectación del parénquima cerebral por el virus de la citomegalia es bastante controvertido, barajándose como teorías prevalentes la afinidad del virus por las células de la matriz germinal y la afectación vascular causada por el mismo virus sobre el feto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.