Natalizumab es un tratamiento que ha demostrado ser muy eficaz en los ensayos clínicos y muy efectivo en la práctica clínica en los pacientes con esclerosis múltiple recurrente-remitente, en cuanto a la reducción del número de brotes, enlentecimiento de la progresión de la enfermedad y variables de resonancia magnética. Sin embargo, el fármaco se ha asociado con el riesgo de desarrollar leucoencefalopatía multifocal progresiva (LMP). Los nuevos datos aparecidos sobre la monitorización de los pacientes en tratamiento, el diagnóstico, y manejo de la LMP y otros temas de interés como la actuación ante la suspensión del natalizumab se han incorporado en esta actualización del primer consenso sobre el uso del natalizumab publicado en el 2011.
Material y métodosEn esta actualización se procedió con la misma metodología que la del primer consenso. Un grupo de expertos españoles en esclerosis múltiple (los autores de esta actualización) revisaron toda la bibliografía disponible sobre natalizumab hasta la fecha, y basándose en su experiencia clínica definieron los temas relevantes a actualizar. Un primer borrador se sometió a ciclos de revisión hasta llegar a la versión final.
Resultados y conclusionesLos estudios de práctica clínica han demostrado que el cambio a natalizumab es más efectivo que el cambio entre inmunomoduladores, y apoyan una mayor conveniencia del tratamiento temprano con natalizumab frente a una utilización más tardía como terapia de rescate. A pesar de ser un fármaco muy eficaz, se deben tener en cuenta los posibles efectos adversos y, en particular, la probabilidad de desarrollar LMP. El neurólogo debe explicar al paciente en detalle los riesgos y beneficios del tratamiento frente al riesgo de la esclerosis múltiple usando términos comprensibles. Antes de empezar el tratamiento, deben estar disponibles las pruebas de laboratorio y las imágenes de resonancia magnética que permitan hacer un seguimiento adecuado. El riesgo de LMP debe estratificarse en alto, medio y bajo de acuerdo con la presencia o ausencia de anticuerpos frente al virus JC, antecedente de tratamiento inmunosupresor y duración del tratamiento. La presencia de anticuerpos antivirus JC, aunque significativa, no se puede tomar como una contraindicación absoluta para el natalizumab. La presente actualización establece unas recomendaciones generales, pero los neurólogos deben aplicar su experiencia clínica para hacer un seguimiento individualizado de los pacientes.
Natalizumab treatment has been shown to be very efficacious in clinical trials and very effective in clinical practice in patients with relapsing-remitting multiple sclerosis, by reducing relapses, slowing disease progression, and improving magnetic resonance imaging patterns. However, the drug has also been associated with a risk of progressive multifocal leukoencephalopathy (PML). The first consensus statement on natalizumab use, published in 2011, has been updated to include new data on diagnostic procedures, monitoring for patients undergoing treatment, PML management, and other topics of interest including the management of patients discontinuing natalizumab.
Material and methodsThis updated version followed the method used in the first consensus. A group of Spanish experts in multiple sclerosis (the authors of the present document) reviewed all currently available literature on natalizumab and identified the relevant topics would need updating based on their clinical experience. The initial draft passed through review cycles until the final version was completed.
Results and conclusionsStudies in clinical practice have demonstrated that changing to natalizumab is more effective than switching between immunomodulators. They favour early treatment with natalizumab rather than using natalizumab in a later stage as a rescue therapy. Although the drug is very effective, its potential adverse effects need to be considered, with particular attention to the patient's likelihood of developing PML. The neurologist should carefully explain the risks and benefits of the treatment, comparing them to the risks of multiple sclerosis in terms the patient can understand. Before treatment is started, laboratory tests and magnetic resonance images should be available to permit proper follow-up. The risk of PML should be stratified as high, medium, or low according to presence or absence of anti-JC virus antibodies, history of immunosuppressive therapy, and treatment duration. Although the presence of anti-JC virus antibodies is a significant finding, it should not be considered an absolute contraindication for natalizumab. This update provides general recommendations, but neurologists must use their clinical expertise to provide personalised follow-up for each patient.
En el 2011 se publicó el primer consenso español1 sobre la utilización del natalizumab (Tysabri®), un tratamiento modificador de la enfermedad para la esclerosis múltiple remitente-recidivante (EMRR). El natalizumab es un anticuerpo monoclonal recombinante humanizado anti-alfa-4-integrina, que inhibe selectivamente la interacción de la integrina alfa-4-beta-1 de los leucocitos mononucleares con su receptor análogo, la molécula de adhesión de células vasculares 1 presente en el endotelio de la barrera hematoencefálica (BHE)2.
En la esclerosis múltiple (EM), se cree que las lesiones ocurren cuando los linfocitos T activados atraviesan la BHE. La migración de leucocitos a través de la BHE supone una interacción entre moléculas de adhesión de las células inflamatorias y de las células endoteliales de la pared vascular. La interacción entre la integrina alfa-4-beta-1 de los leucocitos mononucleares y sus dianas representa un mecanismo patogénico importante para la inflamación patológica del encéfalo2. La inhibición de dicha interacción mediante el natalizumab ha demostrado ser muy eficaz en pacientes con EMRR.
Natalizumab está aprobado por la Agencia Europea del Medicamento (EMA) desde el 2006 para el tratamiento de pacientes con EMRR, cuando se trata de pacientes adultos de 18 años de edad o mayores con elevada actividad de la enfermedad a pesar del tratamiento con un interferón beta o con acetato de glatirámero (este último supuesto ha sido recientemente aprobado por la EMA); y en el caso de pacientes adultos de 18 años de edad o mayores con EMRR grave de evolución rápida (indicación en pacientes «de novo»)2.
El natalizumab, como consecuencia del mecanismo de acción arriba descrito, ha demostrado una gran eficacia clínica y radiológica, dando lugar al objetivo terapéutico «ausencia de actividad de la enfermedad» (definida como ausencia de actividad clínica como brotes o progresión de la discapacidad y de actividad radiológica), que fue logrado en un 37% de los pacientes tratados con natalizumab durante los 2 años de tratamiento en el ensayo AFFIRM, frente a un 7% registrado en el grupo de tratamiento con placebo3. Posteriormente, en la práctica clínica habitual, la posibilidad de lograr este objetivo terapéutico para un porcentaje significativo de pacientes en tratamiento con natalizumab se ha confirmado en diversos estudios4–6.
El uso del natalizumab se asocia a un incremento de la probabilidad de desarrollar leucoencefalopatía multifocal progresiva (LMP)7. Desde las primeras notificaciones de LMP, nuestros conocimientos de los beneficios y de los riesgos se han visto incrementados, y siguen mejorando gracias al esfuerzo para entenderlos por parte de todas las partes implicadas. Así, actualmente se dispone de una numerosa y prolongada experiencia con el fármaco, y de información relevante y de gran utilidad para ayudar al paciente y al neurólogo en la toma de decisiones.
Desde el 2011, se han publicado nuevos resultados de eficacia del natalizumab mantenida a largo plazo8, la posibilidad de mantener a los pacientes sin actividad de la enfermedad, y la identificación de variables que predicen un mayor éxito en el resultado del tratamiento5. Asimismo, la utilidad de StratifyJCV (un ensayo inmunoenzimático de 2 pasos que detecta los anticuerpos antivirus JC [vJC]) para la caracterización serológica del paciente frente al virus JC2,9, así como la identificación de otros factores de riesgo2, se consolidan como herramientas de monitorización personalizada que han supuesto un gran avance en el manejo del natalizumab en la práctica clínica. Por último, desde la publicación del consenso español sobre el natalizumab en 2011, la ficha técnica del fármaco vigente en España ha sido actualizada varias veces.
Por todo ello, entendemos que es necesaria una actualización del consenso publicado en el 2011 para incorporar las novedades acontecidas desde entonces. En el presente documento de actualización del anterior consenso repasamos los avances y las nuevas evidencias publicadas desde entonces, y presentamos consejos prácticos a seguir por el neurólogo clínico en el inicio, durante el seguimiento y en la interrupción del tratamiento, si fuera preciso, con natalizumab.
MétodosLos métodos para redactar el primer consenso español publicado en 2011 han sido descritos en detalle anteriormente1. Para la actualización del mismo, se procedió con la misma metodología. Un grupo de expertos españoles en EM (los autores de este consenso) revisaron toda la bibliografía disponible sobre el natalizumab hasta la fecha, y basándose en su experiencia clínica definieron los temas relevantes a actualizar de cara a la realización de un nuevo consenso sobre su utilización. Un coordinador (O.F.) redactó un primer borrador que se sometió a ciclos de revisión hasta llegar a la versión final. El grupo de expertos mantuvo discusiones sobre los nuevos datos y evidencias aparecidos desde el primer consenso. Los más relevantes de cara al manejo clínico del natalizumab se incorporaron al borrador que se revisó de nuevo entre todos los autores hasta llegar al documento final.
Eficacia y efectividad del natalizumabLa eficacia del natalizumab como monoterapia para la EMRR fue demostrada en el ensayo fundamental AFFIRM controlado con placebo10. En los 2 años del estudio, el natalizumab redujo significativamente la tasa anualizada de brotes (TAB) en un 68%, así como también redujo la probabilidad de progresión de la discapacidad, confirmada a los 3 meses, en un 42%, y del 54% con la progresión de la discapacidad confirmada a los 6 meses. El natalizumab también tuvo un efecto significativo, reduciendo la progresión de la enfermedad medida por resonancia magnética (RM) (reducción del número de lesiones nuevas o aumentadas en T2 del 83%, del número de lesiones captantes de gadolinio del 92% y de lesiones ponderadas en T1 del 76%)11. El natalizumab produjo un efecto significativo en el resto de las variables medidas en el estudio (atrofia cerebral durante el segundo año de tratamiento11, número de hospitalizaciones12, uso de corticosteroides12, progresión del deterioro cognitivo12 y calidad de vida13). Estos resultados de eficacia promovieron un análisis post hoc con nuevos objetivos de eficacia, «proporción de pacientes sin actividad de la enfermedad (ni clínica ni radiológica)»3 y «probabilidad de mejoría mantenida de la escala ampliada del estado de discapacidad (EDSS)»14, demostrándose también un efecto positivo significativo del tratamiento con natalizumab con respecto al placebo.
El natalizumab fue estudiado en el ensayo AFFIRM en una población de pacientes sin tratamiento previo (el tratamiento durante más de 6 meses con interferón beta o acetato de glatirámero fue criterio de exclusión) para la EMRR10. Sin embargo, el fármaco tiene indicaciones de uso en una población de pacientes previamente tratados en caso de respuesta inadecuada, así como en pacientes «de novo» con enfermedad grave de evolución rápida2. Este hecho hace que los estudios de la efectividad del fármaco en la práctica clínica incluyan a pacientes con características basales de mayor gravedad. Aun así, los resultados de efectividad derivados de estos estudios confirman con creces la eficacia observada en los ensayos fundamentales.
Un ejemplo de ello son los resultados obtenidos del estudio de la efectividad del natalizumab en la práctica clínica española (estudio GEXNE)4. En él se analiza de manera retrospectiva el efecto del tratamiento con natalizumab durante un año en 825 pacientes. La reducción de la TAB (mediana) resulta en un 88% con respecto a la prenatalizumab; la puntuación mediana en la EDSS disminuye de 3,5 a 3,0 y el 63% de los pacientes permanecen sin actividad de la enfermedad. Además hay un 23% de pacientes que mejoran clínicamente. Asimismo, en otro estudio nacional sobre 112 pacientes se observó una reducción al año del 99% en el número de lesiones captantes de gadolinio15. Estos resultados coinciden con los obtenidos en el estudio de otras cohortes de otros países6,16,17. También se ha observado una mejoría de algunos síntomas frecuentes en la enfermedad como fatiga, depresión y somnolencia18.
Otro ejemplo es el estudio recientemente publicado5, que tenía como objetivo no solo describir la efectividad del fármaco en la práctica clínica italiana, sino también describir el perfil de paciente que con mayor probabilidad va a obtener la máxima eficacia del fármaco (esto es, quedar sin actividad de la enfermedad). Este estudio confirma también una gran efectividad del natalizumab, siendo esta mayor cuando el tratamiento se inicia tempranamente. El estudio concluye que la subpoblación de pacientes que tuvo menos de 2 brotes en el año previo al tratamiento y una EDSS menor de 3,0 al inicio tienen una probabilidad 3 veces mayor de no tener ninguna actividad durante el tratamiento con natalizumab. Así, en esta subpoblación de pacientes (n=70) el 77% tuvieron una respuesta completa al tratamiento, frente a un 57 y un 44% en pacientes con EDSS mayores (de 3,0 a 4,5 y por encima de 5,0, respectivamente).
Los hallazgos encontrados al respecto con natalizumab por este grupo5 son corroborados en un análisis intermedio (n=4.434 pacientes) del estudio observacional Tysabri Observational Program de práctica clínica habitual, presentado recientemente en el Congreso de la ENS 2013. En él, se observa que el natalizumab tuvo un efecto mayor sobre la reducción de la TAB en aquellos pacientes que iniciaron el tratamiento con una EDSS basal<3,0 (p<0,0001)8. Igualmente se observa una reducción significativamente mayor de la TAB para aquellos pacientes con un número de brotes≤1 en el año previo a natalizumab (TAB=0,23), frente a los que tuvieron un número de brotes mayor (TAB=0,28; p<0,0001)8. En la misma línea, en este estudio se ha visto que el natalizumab es más efectivo en la reducción de la TAB en pacientes «de novo» que en pacientes que recibieron tratamiento previo con uno o más tratamientos modificadores de la enfermedad8.
Estos estudios, así como otros que han demostrado que el cambio a natalizumab es más efectivo que el cambio entre inmunomoduladores19–21, apoyan una mayor conveniencia del tratamiento temprano con natalizumab, frente a una utilización más tardía como terapia de rescate.
El paciente idóneo para natalizumabEl natalizumab (Tysabri®) está indicado por la EMA y la Agencia Española del Medicamento y Productos Sanitarios para el tratamiento de la EMRR en 2 grupos de pacientes2:
- •
Pacientes adultos de 18 años de edad o mayores con elevada actividad de la enfermedad a pesar del tratamiento con un interferón beta o con acetato de glatirámero.
Estos pacientes pueden definirse como los que no han respondido a un curso completo y adecuado (normalmente un año de tratamiento por lo menos) de un interferón beta o del acetato de glatirámero. Los pacientes deben haber tenido al menos una recidiva durante el año anterior mientras recibían la terapia, y tener al menos 9 lesiones hiperintensas en T2 en la RM cerebral o al menos una lesión realzada con gadolinio. Los pacientes «no respondedores» pueden definirse también como los que presentan una tasa de recidiva igual o mayor, o recidivas graves activas, en comparación con el año anterior.
O bien
- •
Pacientes adultos de 18 años de edad o mayores con EMRR grave de evolución rápida definida por 2 o más recidivas incapacitantes en un año, y con una o más lesiones realzadas con gadolinio en la RM cerebral o un incremento significativo de la carga lesional en T2 en comparación con una RM anterior reciente.
Estudios de historia natural de la enfermedad22,23 atribuyen al brote un efecto en el desarrollo de discapacidad. Otro estudio23 muestra la existencia de diferencias significativas en la velocidad de progresión de la discapacidad cuando los pacientes tienen un brote en los 2 primeros años de enfermedad (mejor pronóstico) que cuando tienen más de un brote (peor pronóstico); en este último caso, los pacientes llegan a una EDSS de 3,0 en casi la mitad de tiempo que los primeros.
Igualmente, en el contexto del beneficio aportado por el natalizumab no podemos dejar de lado la implicación que esto tiene para el sistema sociosanitario en términos de coste-efectividad, ya que, en la EM, los costes asociados a los brotes y a la discapacidad asociada son significativos. Para poder establecer de manera objetiva la efectividad de un fármaco frente a otros, uno de los parámetros utilizados es el número necesario para tratar (NNT), es decir, el número necesario de pacientes a tratar para obtener el beneficio deseado en un paciente adicional, por ejemplo, evitar un brote. A mayor eficacia del tratamiento, menor NNT. Tal como se explicaba en el primer consenso del año 2011, el NNT del natalizumab, durante el primer año, para evitar un brote es 2, lo que significa que con el natalizumab solo se precisa tratar a 2 pacientes para evitar un brote, un NNT menor que el resto de los tratamientos actuales para la EMRR. El natalizumab ha demostrado ser la opción más eficiente para el tratamiento de la EMRR24–27.
El beneficio que aporta el natalizumab debe balancearse frente al riesgo de aparición de efectos adversos, para cuyo manejo disponemos cada vez de más herramientas, y también frente al riesgo de discapacidad que la propia enfermedad conlleva. Como se ha mencionado anteriormente, en la evaluación del beneficio de un tratamiento, un NNT bajo indica una buena respuesta terapéutica (se necesita tratar pocos pacientes para obtener una buena respuesta terapéutica). Para la evaluación de los riesgos asociados a un tratamiento se utiliza el número necesario para dañar, y se calcula teniendo en consideración los efectos adversos concomitantes graves, las alteraciones de laboratorio significativas, los abandonos de tratamiento y la probabilidad de efectos adversos futuros desconocidos. El natalizumab es un fármaco bien tolerado y seguro, pero en algunos pacientes se asocia a un incremento del riesgo de LMP. Por lo tanto, en la evaluación del beneficio/riesgo del natalizumab, el número necesario para dañar se refiere a la probabilidad de desarrollar LMP, la cual es variable y cuantificable para cada caso individual, como se detalla más adelante.
Es necesario trasmitir la información sobre riesgo de forma comprensible para cada paciente, en su caso, utilizando ejemplos concretos de la realidad más próxima. Por lo general, el paciente está más dispuesto a asumir riesgos que el neurólogo28. Está documentado que los pacientes dan más importancia al tiempo hasta la progresión de la discapacidad que a la probabilidad de desarrollar LMP29, y el natalizumab actualmente es una buena opción de tratamiento que ha demostrado excelentes datos de eficacia en los estudios pivotales4–6.
Por último, en la valoración de la razón beneficio/riesgo de un tratamiento para la EMRR, también debe tenerse en cuenta el riesgo que implica la propia enfermedad en términos presentes (control de la actividad de la enfermedad) y futuros (el riesgo de progresión de la discapacidad y disminución de la esperanza de vida). El riesgo de discapacidad por la enfermedad para cada paciente puede valorarse de acuerdo a la existencia o no de factores de mal pronóstico, siendo de gran relevancia, entre ellos, la discapacidad residual después del brote22,23, el espacio temporal entre brotes (tiempo interbrote), y por último, la presencia de bandas oligoclonales IgM lípido-específicas en el líquido cefalorraquídeo (LCR)30, que se han asociado con un mal pronóstico a largo plazo31. Es responsabilidad del neurólogo transmitir al paciente la realidad de la gravedad de su enfermedad, con el fin de que este pueda evaluar el perfil beneficio/riesgo que tiene el tratamiento en su caso particular.
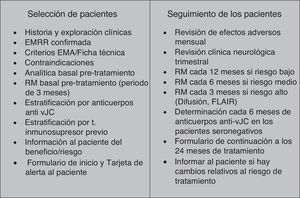
Inicio del tratamiento con natalizumabUna vez definido el paciente idóneo para el inicio del tratamiento con natalizumab, describimos en este apartado los requisitos necesarios que hacen factible la selección de pacientes y el inicio del tratamiento (fig. 1):
- •
Historia y exploración clínica, con confirmación de EMRR.
- •
Valoración de los criterios de la EMA/ficha técnica.
- •
Constatar que no se dan contraindicaciones para el tratamiento, especificadas en la ficha técnica. Entre ellas cabe resaltar la necesidad de confirmar que el paciente no está inmunodeprimido en el momento de inicio del tratamiento, mediante prueba analítica para el recuento leucocitario.
- •
Estudio analítico con hemograma y bioquímica básica. Si las enzimas hepáticas se encuentran alteradas de manera asintomática antes del inicio del tratamiento se recomienda un estudio adecuado del paciente destinado a clarificar el origen de dicha alteración. Si se decide iniciar el tratamiento, se debe monitorizar al paciente en esta función durante el mismo.
- •
Realizar una prueba de RM dentro de los 3 meses previos al inicio del tratamiento2. Esta resonancia sirve como referencia basal en caso de necesitar compararla con otra prueba de resonancia durante el tratamiento con natalizumab, tanto para valorar la efectividad del natalizumab a nivel radiológico como para poder contrastar en caso de sospecha de LMP.
- •
Estratificación por anticuerpos anti-vJC. Determinación de anticuerpos frente al vJC: se realiza con el test StratifyJCV (ensayo ELISA de 2 pasos), validado con este fin para pacientes con EM. El test original disponible en España en 2011 se perfeccionó en lo que se conoce como ensayo de segunda generación9, vigente desde el mes de marzo del año 2012. Con la segunda generación del ensayo se ha conseguido incrementar la sensibilidad de la técnica, lo que se traduce en un mayor valor predictivo negativo del test.
Si el paciente no tiene anticuerpos anti-vJC (el paciente es seronegativo), es improbable que el paciente tenga el virus y, por lo tanto, la probabilidad de desarrollar LMP en estos pacientes es mínima (≤1/10.000)1,32. Pero es preciso decir que «los pacientes con anticuerpos anti-vJC negativos pueden aún estar en riesgo de LMP por motivos tales como una nueva infección por vJC, un estado de anticuerpos fluctuante o un resultado falso negativo en las pruebas». Este párrafo se ha incorporado recientemente a la ficha técnica. La probabilidad es mínima, y no nula, en un paciente seronegativo por los siguientes supuestos: i) que el resultado del test sea un falso negativo (la tasa de falsos negativos, estimada del análisis de 1.319 pacientes, es de un 2,2%9); ii) que el paciente seronegativo entre en contacto con el vJC por primera vez y cambie a un estado seropositivo (seroconversión) o que el paciente seronegativo presente anticuerpos en niveles fluctuantes en torno al valor que separa el resultado negativo del positivo, pudiendo dar un resultado positivo en un test posterior (positivo intermitente) (de los pacientes basalmente seronegativos del estudio STRATIFY-1 [n=328] seguidos longitudinalmente durante un periodo de 12 meses, un 10,7% cambiaron el estatus serológico de negativo a positivo)33,34.
Si el paciente sí tiene anticuerpos anti-vJC (el paciente es seropositivo), el paciente ha tenido contacto con el vJC32 y la probabilidad que tiene de desarrollar LMP varía entre baja, media o alta en función de los otros 2 factores de riesgo (inmunosupresión previa y tiempo en tratamiento)1.
- •
Estratificación por tratamiento inmunosupresor previo. Haber estado previamente tratado con un agente inmunosupresor: el tratamiento previo del paciente con algún agente inmunosupresor aumenta de 2 a 3 veces la probabilidad de desarrollar LMP2.
- •
Informar debidamente al paciente del beneficio y riesgo del tratamiento.
- •
Se recomienda constatar este hecho con la firma del «formulario de inicio del tratamiento con Tysabri®» sugerido por la EMA en el manual de Información para el médico y directrices para el manejo de pacientes con EM en tratamiento con Tysabri®. Asimismo, se debe hacer entrega de la «tarjeta de alerta al paciente»2.
Selección y seguimiento de pacientes en el tratamiento de la esclerosis múltiple con natalizumab. EMA: Agencia Europea del Medicamento; EMRR: esclerosis múltiple recurrente-remitente; FLAIR: recuperación de inversión por atenuación de fluido; RM: resonancia magnética; t: tratamiento; vJC: virus JC.
Tras el inicio del tratamiento debe hacerse un cuidado seguimiento para evitar complicaciones, en particular la aparición de la LMP (fig. 1).
- a)
Identificación en el paciente de posibles factores que aumentan la probabilidad de desarrollar LMP para su correcta monitorización durante el tratamiento2:
- 1.
Presencia/ausencia de anticuerpos anti-vJC.
- 2.
Presencia/ausencia antecedente de inmunosupresión previa.
- 3.
Tiempo que lleva el paciente en tratamiento con natalizumab: la probabilidad de LMP en un paciente seropositivo es baja si lleva menos de 2 años en tratamiento, y es mayor si lleva más de 2 años en tratamiento.
Aunque el desarrollo de anticuerpos anti-vJC es, sin duda, uno de los principales factores que afectan a la evaluación de la proporción beneficio/riesgo del tratamiento, no tiene que ser el único motivo de no iniciar o de suspender el tratamiento con natalizumab.
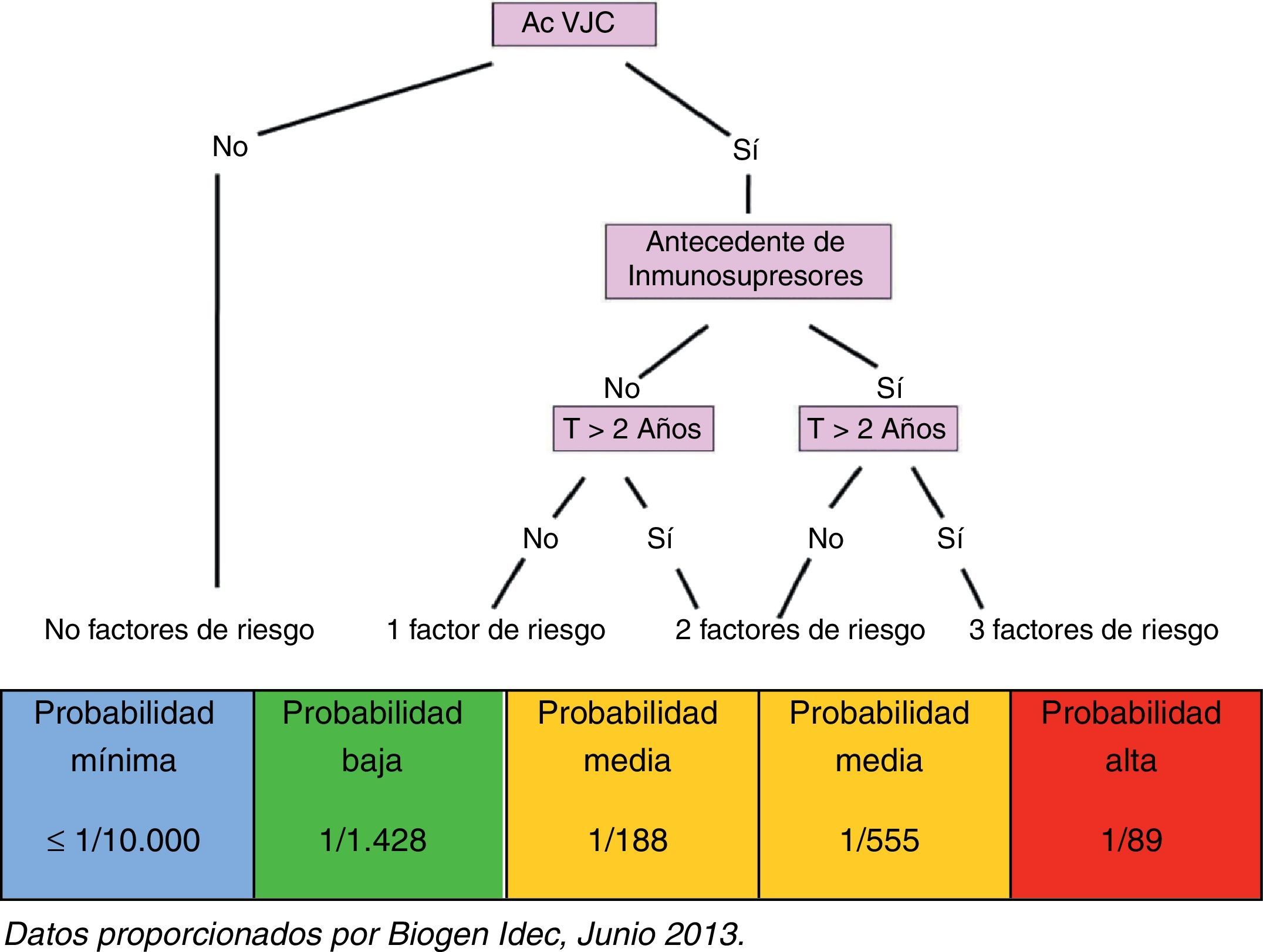
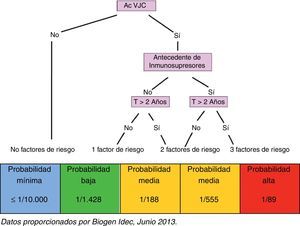
En función de la identificación de todos los factores arriba mencionados, y sin perder de vista el propio riesgo que conlleva la enfermedad en cada caso, el paciente es clasificado en uno de los grupos de riesgo que se indican a continuación (fig. 2):
- •
Paciente sin factores de riesgo: paciente seronegativo, probabilidad de desarrollar LMP mínima (≤1/10.000)
- •
Paciente con un factor de riesgo: paciente seropositivo, probabilidad de desarrollar LMP baja (1/1.428)
- •
Paciente con 2 factores de riesgo: paciente seropositivo con antecedentes de tratamiento inmunosupresor, probabilidad de desarrollar LMP media (1/555)
- •
Paciente con 2 factores de riesgo: paciente seropositivo que lleva más de 2 años en tratamiento con natalizumab, probabilidad de desarrollar LMP media (1/188)
- •
Paciente con 3 factores de riesgo: paciente seropositivo, con antecedentes de tratamiento inmunosupresor y que lleva más de 2 años en tratamiento con natalizumab, probabilidad de desarrollar LMP alta (1/89)
La clasificación del paciente tratado con natalizumab en función de la probabilidad que tendría de desarrollar una LMP es fundamental para su adecuada monitorización durante el tratamiento:
- 1.
- b)
Monitorización del paciente en tratamiento con natalizumab.
- 1.
Reacciones de hipersensibilidad: un 4% de los pacientes pueden presentar hipersensibilidad al fármaco, la cual se manifiesta con mayor probabilidad en la segunda dosis2. Personal de enfermería y/o médico debe monitorizar en cada perfusión la posible aparición de reacciones a la perfusión (cansancio, mareo, cefalea, astenia, náuseas, etc.), distinguiéndolas de las reacciones alérgicas o de hipersensibilidad (urticaria con o sin repercusión sistémica).
- 2.
Desarrollo de anticuerpos neutralizantes persistentes al natalizumab: un 6% de los pacientes pueden desarrollarlos y, cuando se desarrollan, suele tener lugar en los 6 primeros meses de tratamiento. En caso de observarse una falta de eficacia del fármaco o acontecimientos relacionados con la perfusión, se recomienda realizar la determinación de anticuerpos neutralizantes. Si el resultado es positivo, se debe repetir dicho análisis al cabo de 4 semanas. Si el resultado fuera de nuevo positivo (anticuerpos persistentes), se recomienda la suspensión del tratamiento, por cuanto su presencia se relaciona con pérdida de la eficacia clínica del natalizumab y un aumento de la incidencia de reacciones de hipersensibilidad2,35.
- 3.
Monitorización de la función hepática: para el paciente que comienza el tratamiento con alteración hepática asintomática el control debería ser mensual durante los 3 primeros meses y posteriormente trimestrales si se aprecia estabilización de los valores. Tras el inicio del tratamiento la aparición de alteraciones hepáticas es infrecuente. Si se observara un aumento de la cifra de transaminasas, si este es sintomático se sugiere suspender transitoriamente el fármaco e investigar la causa. Si la transaminasemia es asintomática se recomienda el seguimiento clínico y analítico, excepto si esta supera 3 veces o más el valor normal, en cuyo caso se aconseja la suspensión temporal del fármaco, investigar otras causas y no reiniciar el tratamiento hasta la normalización de la analítica.
- 4.
Monitorización de la serología para el vJC: para monitorizar el posible cambio del paciente seronegativo al estado seropositivo está indicado repetir la determinación de anticuerpos anti-vJC cada 6 meses a los pacientes seronegativos2.
- 5.
Renovación de la información al paciente sobre el beneficio/riesgo del tratamiento cuando haya llegado a los 2 años de tratamiento con natalizumab2: se recomienda la firma del «formulario de continuación del tratamiento con Tysabri®», sugerido por la EMA en el manual de Información para el médico y directrices para el manejo de pacientes con EM en tratamiento con Tysabri®, y firma de consentimiento informado (este último es opcional). Esta información debe renovarse a partir de aquí anualmente y cada vez que se produzca algún conocimiento nuevo relativo a los riesgos del tratamiento.
- 6.
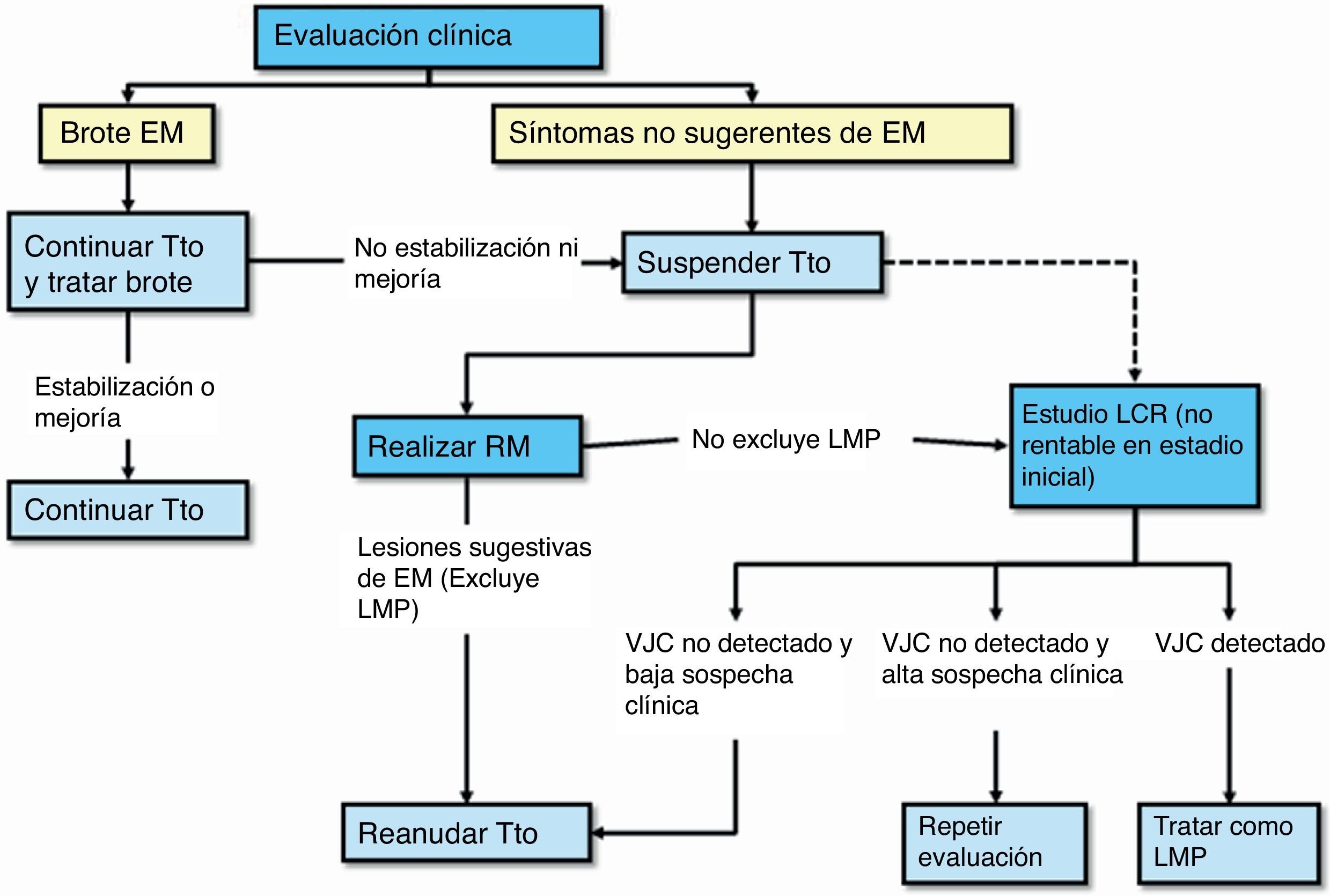
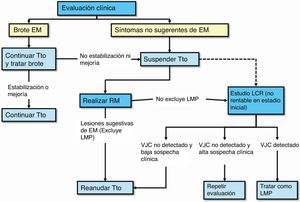
Monitorización clínica: se debe monitorizar en cada perfusión (cada 4 semanas) por personal de enfermería y/o médico la posible aparición de actividad clínica o complicaciones relacionadas con la medicación, en particular la LMP. La monitorización clínica con exploración neurológica incluida se debe realizar de forma preferentemente trimestral y en el caso de aparición de nuevos síntomas, con el fin de determinar si los síntomas son compatibles con un brote de la enfermedad o indicativos de LMP (fig. 1)2. Además, la monitorización clínica se debe continuar al menos durante los 6 meses después de haber suspendido el tratamiento, pues se han descrito casos de LMP en pacientes que no tenían hallazgos sugerentes de LMP en el momento de la suspensión2.
- 7.
Monitorización radiológica: se debe realizar una prueba anual de RM cerebral completa (secuencias ponderadas en T2, en T1 y con contraste) a todo paciente en tratamiento, para el control de la aparición de nuevas lesiones de EM. Esta RM anual también sirve para la vigilancia radiológica frente a la LMP en los pacientes con probabilidad baja1. Adicionalmente, si es un paciente con probabilidad media o alta, debe realizarse RM de control cada al menos 6 meses (3-4 meses en pacientes con un riesgo alto), para facilitar un diagnóstico precoz. En el caso de tener acceso limitado a RM completa con esta frecuencia, podría ser útil realizar los controles con secuencias de difusión o FLAIR para una mejor discriminación de las lesiones de LMP. Se ha observado que los pacientes pueden tener un pronóstico mejor si la LMP se detecta de manera precoz36. Por último, se debería realizar una RM cerebral de forma preferente ante cualquier síntoma o signo neurológico que nos haga sospechar o dudar entre un brote o sintomatología relacionada con la aparición de LMP.
- 8.
Protocolo de actuación en caso de sospecha de LMP (fig. 3): la sospecha diagnóstica se basa en datos clínicos y de RM, y la confirmación pasa por la detección del vJC en el LCR. En la tabla 1 se describen las características radiológicas que nos pueden ayudar a realizar un diagnóstico de sospecha de LMP37. En caso de sospecha, esta se debe comunicar de inmediato al departamento de farmacovigilancia de Biogen Idec España (compañía responsable de la comercialización del fármaco) para activar lo antes posible el proceso para la confirmación o descarte de la LMP; esto es, el análisis de una muestra de LCR para la detección específica de ADN del vJC, en el laboratorio centralizado y validado para ello. El resultado positivo de esta prueba confirma el diagnóstico de LMP. La propia compañía ofrece también una evaluación de la RM de sospecha como segunda opinión para una mejor caracterización y confirmación del caso. Ante la sospecha, aún sin confirmar, se debe realizar de inmediato la retirada del fármaco del organismo mediante plasmaféresis o inmunoadsorción, tal y como se indica en el manual de Información para el médico y directrices para el manejo de pacientes con EM en tratamiento con Tysabri®, revisado y actualizado por la EMA recientemente.
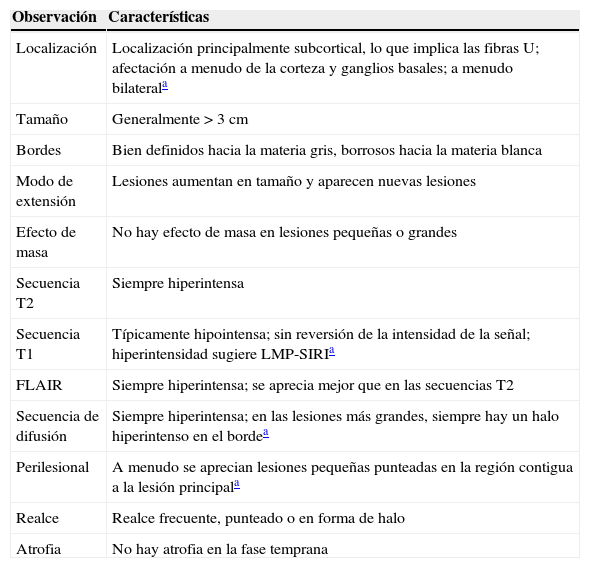
Tabla 1.Recomendaciones para el diagnóstico temprano de la leucoencefalopatía multifocal progresiva en pacientes de esclerosis múltiple tratados con natalizumab
Observación Características Localización Localización principalmente subcortical, lo que implica las fibras U; afectación a menudo de la corteza y ganglios basales; a menudo bilaterala Tamaño Generalmente>3cm Bordes Bien definidos hacia la materia gris, borrosos hacia la materia blanca Modo de extensión Lesiones aumentan en tamaño y aparecen nuevas lesiones Efecto de masa No hay efecto de masa en lesiones pequeñas o grandes Secuencia T2 Siempre hiperintensa Secuencia T1 Típicamente hipointensa; sin reversión de la intensidad de la señal; hiperintensidad sugiere LMP-SIRIa FLAIR Siempre hiperintensa; se aprecia mejor que en las secuencias T2 Secuencia de difusión Siempre hiperintensa; en las lesiones más grandes, siempre hay un halo hiperintenso en el bordea Perilesional A menudo se aprecian lesiones pequeñas punteadas en la región contigua a la lesión principala Realce Realce frecuente, punteado o en forma de halo Atrofia No hay atrofia en la fase temprana Fuente: Yousry et al.37
FLAIR: recuperación de inversión por atenuación de fluido; LMP: leucoencefalopatía multifocal progresiva; SIRI: síndrome inflamatorio de reconstitución inmunológica.
- 1.
La necesidad de interrumpir el tratamiento con natalizumab por diversos motivos (por ejemplo, reacciones de hipersensibilidad, el desarrollo de anticuerpos antinatalizumab persistentes, la falta de eficacia o aparición de una relación beneficio/riesgo negativa) plantea incertidumbres a algunos neurólogos por diversos motivos, y más específicamente por el temor a una exacerbación de la actividad de la enfermedad.
La revisión de diversos estudios publicados desde 1999 hasta la actualidad indica que la actividad de la enfermedad que reaparece tras el cese del natalizumab es variable, pero de manera general no supera la actividad basal que tenía el paciente antes del tratamiento con dicho fármaco, una situación semejante a la que se produce por la maternidad.
El mayor estudio realizado al respecto es un análisis retrospectivo de los pacientes procedentes de los ensayos AFFIRM, SENTINEL y GLANCE (n=1.866), con un seguimiento de 8 meses tras la interrupción del tratamiento38. Del estudio se concluye que la mayoría de los pacientes experimentan un retorno de la actividad basal. Sin embargo, el subanálisis de los pacientes que tenían alta actividad, definidos como los que tenían≥2 brotes en el año previo a la administración del natalizumab y una lesión Gd+, muestra que en estos pacientes el retorno de la actividad fue más rápido y más grave. Un estudio recientemente presentado (n=105) describe la existencia de una exacerbación grave de la enfermedad en un 10% de los pacientes, y la correlaciona con una mayor TAB y actividad en RM (Gd+) en el año anterior39.
La exacerbación grave de la enfermedad, conocida como «efecto rebote», se entiende como un aumento importante de la actividad clinicorradiológica tras el cese del tratamiento, que es superior a la actividad basal del paciente. El rebote podría explicarse porque en la sangre hay un aumento de linfocitos activados y citocinas proinflamatorias que al retirar el natalizumab pasarían la BHE40. La actividad basal del paciente debe ser la actividad que tenía en ausencia de tratamiento, que es la situación en la que en muchos casos está el paciente cuando se interrumpe el tratamiento con natalizumab. Es común aludir a la actividad prenatalizumab, pero en ese momento el paciente probablemente esté bajo los efectos de un tratamiento previo (inmunomodulador) que enmascara la actividad basal real, siendo la actividad prenatalizumab menor que la actividad posnatalizumab, sin tratamiento alguno.
Aun así, la práctica clínica diaria es testigo de un porcentaje de pacientes que experimentan esta exacerbación de la enfermedad, no solo tras el cese del natalizumab (también hay casos reportados tras el cese del fingolimod41–43), haciéndose necesarios estudios que caractericen el perfil de paciente más susceptible a ello, así como una estrategia de tratamiento que funcione para controlarla. En este sentido, no se ha demostrado que ningún tratamiento de los empleados garantice el control de la actividad en estos casos. El último tratamiento comercializado para la EMRR, el fingolimod, tampoco resulta ser del todo efectivo en estos casos, según 4 estudios publicados al respecto44–47. En 2 de estos estudios comparan el efecto del fingolimod frente a no tratar en uno de ellos46 y frente a un tratamiento inmunomodulador en el otro47; y concluyen, como es de esperar, que es mejor tratar que no tratar, que el fingolimod puede ser más efectivo que el inmunomodulador, y que puede ser beneficioso adelantar el inicio del fingolimod a los 3 meses de lavado que requiere el natalizumab, aunque ello supondría durante un tiempo la exposición concomitante a los 2 fármacos. En este sentido, la ficha técnica del fingolimod contempla este «adelanto» al estimar entre 2-3 meses la exposición concomitante si el fingolimod fuera iniciado inmediatamente después de suspender el natalizumab, pero se recomienda hacerlo «con precaución».
Actualmente, la ficha técnica del natalizumab indica un periodo de lavado de 3 meses antes de comenzar con otro tratamiento, una actitud que se justifica por la duración del efecto biológico del natalizumab. No obstante, hay una tendencia cada vez mayor a empezar el siguiente tratamiento antes de este tiempo, en un intento de controlar la reaparición de la actividad de la enfermedad y de permitir, en beneficio del paciente, que el nuevo fármaco ejerza su efecto terapéutico. En el caso del uso de inmunomoduladores, interferones o acetato de glatirámero, cada vez hay un mayor consenso para iniciar el tratamiento cuanto antes, e incluso de inmediato (siempre que no hayan fracasado previamente). Dicha actuación no está del todo respaldada por lo indicado en ficha técnica al respecto (dice textualmente «Para el caso de interferón beta o acetato de glatirámero, la exposición concomitante no se asoció a riesgos de seguridad en los ensayos clínicos. El uso de fármacos inmunodepresores poco después de la retirada de natalizumab puede dar lugar a un efecto inmunodepresor adicional. Esto debe analizarse detenidamente caso por caso y puede ser adecuado un periodo de lavado de natalizumab»), por lo que debe ser consentida por escrito por parte del paciente.
Manejo de la leucoencefalopatía multifocal progresivaLa aparición de LMP es una grave complicación, puesto que implica un riesgo de mortalidad (20%) y morbilidad. Se ha observado que edades más jóvenes y EDSS pre-LMP menores se asocian a mayor probabilidad de supervivencia de la LMP44.
El mejor tratamiento de la LMP es el diagnóstico temprano de la misma. Por ello, se recomienda un alto grado de vigilancia y actuar según las recomendaciones actualmente disponibles y hacer las RM que sean necesarias1,48–50.
La LMP asociada al tratamiento con natalizumab es etiológica y clínicamente distinta a la LMP asociada a pacientes con VIH. Se explica por el bloqueo que ejerce el natalizumab sobre el acceso de células linfoides al interior del sistema nervioso central que hace que en el caso de una infección del encéfalo por el vJC, este se encuentre inmunológicamente desprotegido. Por ello, el primer paso para el tratamiento de la LMP asociada al natalizumab consiste en lograr la eliminación rápida del fármaco en sangre para restituir el acceso del sistema inmune al sistema nervioso central para combatir la infección del vJC. Para ello, se utilizan la plasmaféresis o la inmunoadsorción en diversas pautas2,51.
Adicionalmente, para el tratamiento de la LMP se han ensayado y utilizado diversos medicamentos antivirales (cidofovir), antagonistas del receptor 5HT2a (mirtazapina), o el antipalúdico mefloquina; sin embargo, no se tienen resultados concluyentes de su eficacia.
El síndrome inflamatorio de reconstitución inmunológica se da en la gran mayoría de los casos de LMP y aparece entre unos días y varias semanas después de la plasmaféresis o de la inmunoadsorción. Se caracteriza por la aparición de un deterioro neurológico junto a signos inflamatorios evidentes en la neuroimagen y, si no se maneja adecuadamente, puede causar daño neurológico muy grave o la muerte. Aunque no hay consenso sobre la prevención y el tratamiento del síndrome inflamatorio de reconstitución inmunológica, hay abundantes evidencias clínicas, fundamentalmente derivadas de la experiencia de pacientes con VIH, que sugieren la utilidad del uso de corticosteroides a altas dosis por vía intravenosa en ambas situaciones.
Últimas novedades en la identificación de marcadores para el tratamiento personalizado con natalizumab- a)
Índice de anticuerpos anti-vJC: recientemente, se han publicado datos que sugieren que el título de anticuerpos anti-vJC podría tener relevancia a la hora de determinar la probabilidad de desarrollar LMP. En dichos estudios los niveles de anticuerpos anti-vJC eran más altos en pacientes que desarrollaron LMP que en los que no lo hicieron52,53. En función de estos hallazgos, se ha iniciado un estudio54 para comprobar la hipótesis de que los niveles de anticuerpos anti-vJC podrían servir para afinar más la probabilidad de desarrollar LMP en los pacientes seropositivos; es decir, de todos aquellos pacientes que han estado en contacto con el vJC en algún momento de su vida, cuáles serían aquellos con probabilidad de desarrollar LMP. Resultados preliminares de dicho estudio han sido presentados en congresos internacionales y muestran que, en la población de pacientes que no ha recibido inmunosupresión previa, el índice de anticuerpos (valor del índice obtenido como resultado del ensayo de segunda generación) fue significativamente más alto en aquellos pacientes que desarrollaron LMP (n=51) que en los pacientes que no lo hicieron (n=2.242). En función de estos primeros resultados, estas diferencias no se observaron en los pacientes que sí han recibido inmunosupresión previa.
En referencia a la población del estudio sin inmunosupresión previa, de los 51 casos de LMP, uno tenía un índice≤0,9; 6 tenían un índice<1,5; y el resto (n=44) tenía un índice≥1,5. Así, según este estudio, la estimación de la probabilidad de desarrollar LMP que tiene un paciente seropositivo sin inmunosupresión previa con 5-6 años de tratamiento va de 0,4 a 1,3/1.000 (IC del 95% [0,01-2,15] a [0,41-2,96]) pacientes, para índices que van de ≤0,9 a ≤1,5, respectivamente, frente a una probabilidad de 8,5/1.000 (IC del 95% 6,22-11,38) pacientes en el caso de un índice>1,5. En la población del estudio el 42,9% de los pacientes seropositivos que no desarrollaron LMP presentaba un índice≤1,5.
En el caso de validarse esta hipótesis en estudio, el dato de índice de anticuerpos anti-vJC ayudaría a entender mejor la naturaleza del cambio de estatus serológico negativo a positivo, ayudando a diferenciar entre cambios de estatus serológico por seroconversión (índice alto) o por anticuerpos fluctuantes (índice bajo). Además, podría ayudar a diferenciar mejor el riesgo entre estos 2 tipos de pacientes. Este estudio sobre la validez del índice de anticuerpos anti-vJC como herramienta para estratificara los pacientes anti-vJC (+) sigue en marcha con el objetivo de confirmar los resultados en una muestra de casos mayor.
De confirmarse, el índice de anticuerpos en un paciente seropositivo sería un dato clave que haría que el factor «tiempo de tratamiento mayor de 2 años» dejaría de suponer mayor riesgo para los pacientes seropositivos con índice bajo. Asimismo los pacientes anti-vJC (+) con índice bajo precisarían de una determinación periódica del índice de anticuerpos para confirmar que mantienen esta condición.
- b)
Presencia de bandas oligoclonales IgM (BOC-IgM) lípido-específicas en LCR: recientemente, la presencia de inmunoglobulina M (IgM) en LCR ha generado interés como un factor a tener en cuenta a la hora de estimar la probabilidad de desarrollar LMP. La presencia de BOC-IgM ya se había descrito como un marcador de mal pronóstico de la enfermedad, siendo en particular importantes las BOC-IgM específicas de antígenos de naturaleza lipídica55. Los mismos autores han investigado si la presencia de IgM lípido-específica en el LCR del paciente podría ser de utilidad para estimar la probabilidad de desarrollar LMP. Datos aún no publicados, pero presentados a congresos nacionales56 e internacionales, sugieren que los pacientes seropositivos para anticuerpos anti-vJC que desarrollaron LMP no tenían BOC-IgM lípido-específicas en el LCR. Si este hallazgo se confirma en otras cohortes y se valida clínicamente, la determinación de BOC-IgM en LCR podría ser en un futuro otro factor a tener en cuenta en la estimación de la probabilidad de desarrollar LMP.
- c)
Otro posible biomarcador de riesgo de PML, que precisa validación, es el porcentaje de células CD4+ que expresan L-selectina, que se ha apreciado significativamente bajo (9 veces más bajo) en los pacientes que posteriormente desarrollaron LMP57.
Atendiendo a todo lo expuesto anteriormente, la presencia de anticuerpos anti-vJC no debe excluir el tratamiento con natalizumab. Es esperanzador el hecho de que se siga investigando para que cada vez más pacientes puedan beneficiarse con mayor seguridad de los beneficios que aporta el natalizumab, acotándose con mayor exactitud las características del paciente que puede tener probabilidad de desarrollar LMP. Ante un paciente tratado con natalizumab, sin actividad de la enfermedad, que desarrolla anticuerpos anti-vJC, se recomienda mantener un estrecho diálogo con el paciente y valorar siempre, y en primer lugar, la gravedad de la enfermedad. Debe quedar claro que la retirada del natalizumab debe estar justificada y que el riesgo del tratamiento debe superar al riesgo de la enfermedad.
A fecha de 31 de marzo de 2013 son aproximadamente 118.100 pacientes en el mundo los que han sido expuestos a tratamiento con natalizumab desde que se comercializó en EE. UU. en 2004 (datos proporcionados por Biogen Idec).
El estudio multinacional Tysabri Observational Program, en el que participan 13 centros de España, tiene como objetivo recoger datos de seguridad y efectividad del tratamiento a largo plazo y en el ámbito de la práctica clínica habitual. Los resultados de análisis intermedios son actualizados y comunicados anualmente en congresos internacionales. A 1 de diciembre de 2012 había 4.821 pacientes incluidos en el estudio. La TAB media disminuyó de 1,99 a 0,30 (0,28–0,32) en el primer año y permaneció baja (0,24) después de 5 años de tratamiento. En la población total, la EDSS (mediana) permaneció estable tras 4 años de tratamiento. De 2.224 pacientes seguidos durante al menos 2 años, 1.247 (56%) no tuvieron actividad clínica de la enfermedad, tampoco lo hicieron 530 pacientes de 1.000 (53%) durante 3 años, ni 174 pacientes de 355 (49%) seguidos durante 4 años8.
El estudio Safety of Tysabri® Re-dosing and Treatment también evalúa la seguridad y la eficacia del natalizumab a largo plazo, en este caso en pacientes procedentes de ensayos fase 3 del fármaco, que reiniciaron el tratamiento tras un periodo de interrupción del mismo coincidente con la retirada voluntaria del fármaco por parte del laboratorio que lo comercializa tras la aparición de los primeros casos de LMP (febrero 2005-marzo 2006). La exposición al tratamiento acumulada en estos pacientes durante el periodo poscomercialización alcanza un periodo de casi 7 años58. El perfil de seguridad del fármaco es acorde con lo ya conocido de la práctica general con el medicamento durante la poscomercialización. La TAB resultante es acorde con las tasas observadas en el ensayo AFFIRM y se mantiene baja durante 5 años de tratamiento. Asimismo, la puntuación EDSS se mantuvo estable o mejoró. De nuevo, la observación de una menor TAB y una mejoría de la EDSS preferentemente en los pacientes aleatorizados originalmente al brazo de natalizumab, comparativamente con los que empezaron en brazo placebo, pone de manifiesto la ventaja del tratamiento temprano frente al retraso del mismo.
ConclusionesAl igual que en el momento de publicación del primer consenso, el natalizumab sigue siendo el fármaco más eficaz para los pacientes con EMRR, a pesar de que entre ambos consensos se han autorizado nuevos tratamientos. De acuerdo con la ficha técnica, debe ser considerado no solo como una primera opción ante el fracaso terapéutico con un inmunomodulador convencional, sino también en casos que comienzan con una EMRR grave de evolución rápida desde el inicio. El beneficio del tratamiento debe ser valorado frente a los riesgos, principalmente el riesgo inherente a la progresión de la enfermedad y a la probabilidad de desarrollar LMP. Nos encontramos en un momento alentador, en el que mientras se reafirma la alta efectividad del natalizumab en la práctica clínica a corto, medio y largo plazo, se entienden mejor los riegos asociados (tanto los de tratar, como los de retrasar el tratamiento), y se avanza hacia una caracterización cada vez más precisa de la relación beneficio/riesgo individualizada para cada paciente.
Conflicto de interesesOscar Fernández ha recibido honorarios como asesor en comités, como moderador o ponente en congresos y reuniones científicas, ha participado en ensayos clínicos y en otros proyectos de investigación promovidos por Biogen Idec, Bayer-Schering; Merck-Serono, Teva y Novartis.
Xavier Montalbán ha recibido honorarios como ponente y gastos de viaje a reuniones científicas, ha sido miembro de comités directivos de ensayos clínicos y ha participado en comités como asesor de ensayos clínicos en los últimos años con Bayer Schering Pharma, Biogen Idec, EMD Merck Serono, Genentech, Genzyme, Novartis, Sanofi-Aventis, Teva Pharmaceuticals y Almirall.
El resto de los autores declaran no tener ningún conflicto de intereses.
Al Dr. Greg Morley por su inestimable ayuda editorial.