En los mamíferos, el complejo pre-Bötzinger (preBötC) es una red neuronal bilateral y simétrica localizada en el tallo cerebral, la cual es indispensable para la generación y modulación del ritmo respiratorio. En humanos existen pocos estudios acerca del preBötC y su relación con enfermedades neurológicas no ha sido descrita. Sin embargo, la importancia del preBötC en el control neural del ritmo respiratorio y su posible participación en enfermedades neurológicas en humanos ha sido mostrada gracias a la manipulación farmacológica y de lesiones del preBötC realizadas en modelos animales in vivo e in vitro.
MétodoEn esta revisión describimos los efectos de algunos fármacos sobre la actividad inspiratoria in vitro en el modelo de rebanada transversal del tallo cerebral que contiene el preBötC, y algunos experimentos in vivo. La farmacología fue clasificada de acuerdo con los principales sistemas de neurotransmisión y con la importancia de los fármacos como estimuladores o inhibidores de la actividad del preBötC y, por tanto, de la generación del ritmo respiratorio.
ConclusionesEl neurólogo clínico encontrará esta información relevante para entender cómo el sistema nervioso central genera el ritmo respiratorio y, además, podrá relacionarla con las observaciones hechas durante su práctica.
In mammals, the preBötzinger complex (preBötC) is a bilateral and symmetrical neural network located in the brainstem which is essential for the generation and modulation of respiratory rhythm. There are few human studies about the preBötC and, its relationship with neurological diseases has not been described. However, the importance of the preBötC in neural control of breathing and its potential participation in neurological diseases in humans, has been suggested based on pharmacological manipulation and lesion of the preBötC in animal models, both in vivo and in vitro.
MethodIn this review, we describe the effects of some drugs on the inspiratory activity in vitro in a transverse slice that contains the preBötC, as well as some in vivo experiments. Drugs were classified according to their effects on the main neurotransmitter systems and their importance as stimulators or inhibitors of preBötC activity and therefore for the generation of the respiratory rhythm.
ConclusionClinical neurologists will find this information relevant to understanding how the central nervous system generates the respiratory rhythm and may also relate this information to the findings made in daily practice.
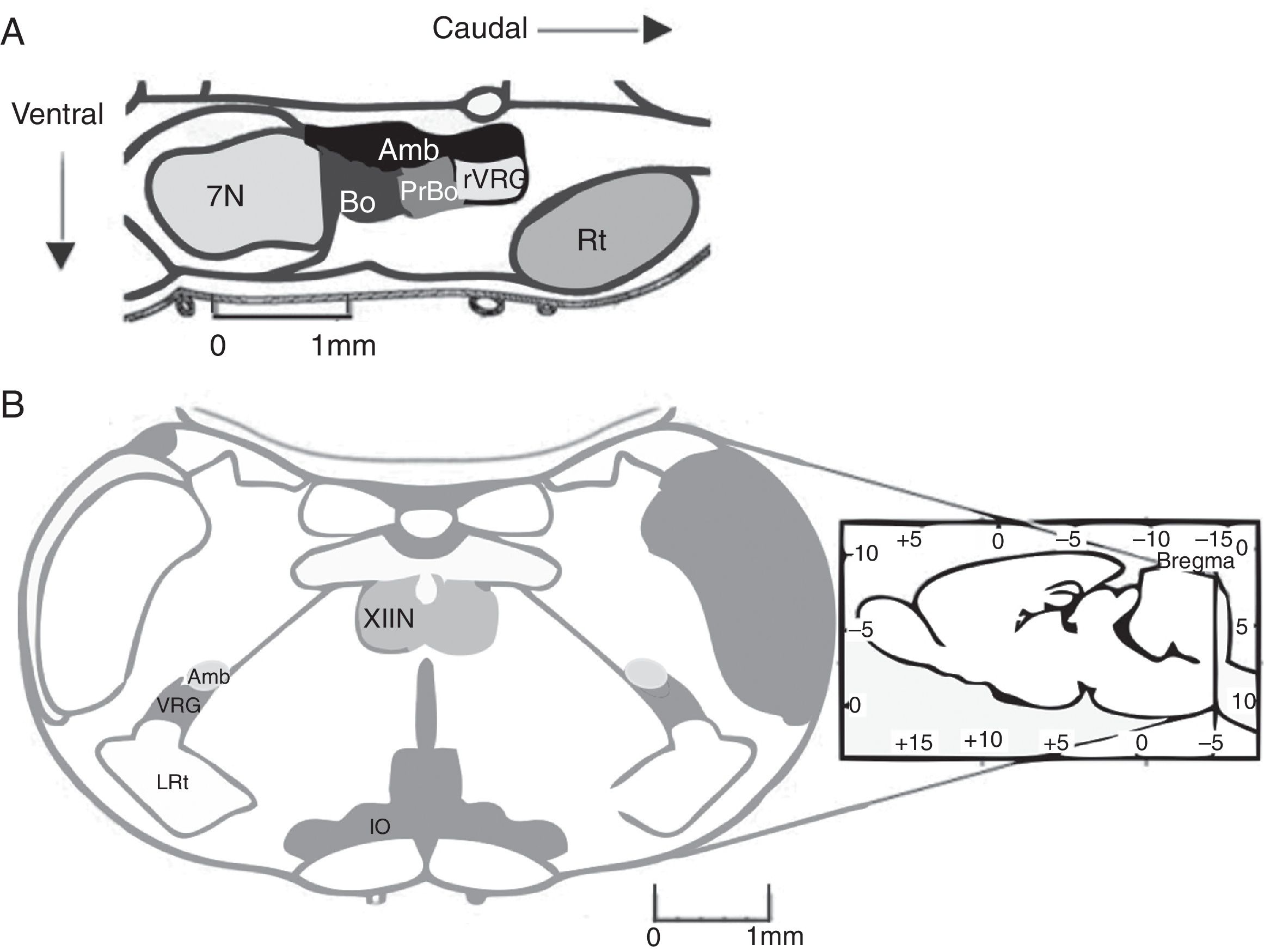
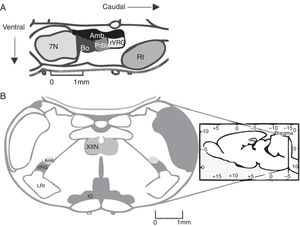
El complejo pre-Bötzinger (preBötC) es una red neuronal cuya actividad genera la fase inspiratoria de la respiración. En 1991, el preBötC fue descrito como una región de la médula oblongata ventral que contiene la red neuronal necesaria y suficiente para generar el ritmo respiratorio en preparaciones de rebanadas medulares de roedores neonatos1. El preBötC es una región limitada, bilateral y simétrica de la columna respiratoria ventral. Se encuentra caudal al núcleo facial y al complejo Bötzinger (BötC), rostral al núcleo reticular lateral y ventral al núcleo ambiguus1 (fig. 1A). En el humano, el preBötC se encuentra ventral a la división semicompacta y caudal a la división compacta del núcleo ambiguus2.
A) Representación de la ubicación del complejo pre-Bötzinger en el cerebro de roedor en corte sagital (fuente: modificada de Paxinos y Watson58). En mamíferos, el complejo pre-Bötzinger está en el bulbo ventrolateral, al nivel del óbex, caudal al núcleo facial, rostral al núcleo reticular lateral y ventral al núcleo ambiguus. B) Corte coronal que presenta las marcas anatómicas para localizar el complejo pre-Bötzinger.
Amb: núcleo ambiguus; IO oliva inferior; VRG grupo respiratorio ventral; XIIN: núcleo hipogloso.
En la rata adulta, el preBötC se extiende 300-400μm en el plano rostro-caudal1. Cada preBötC muestra actividad rítmica independiente, sin embargo, se comunican bidireccionalmente con conexiones sinápticas que sincronizan la actividad de ambos lados3. En estudios in vivo se ha mostrado que las neuronas del preBötC envían proyecciones: contralaterales al preBötC, ipsolaterales y contralaterales al BötC, al grupo respiratorio ventral caudal, al grupo respiratorio parafacial/núcleo retrotrapezoide (pFRG/RTN), al núcleo parahipogloso, al núcleo del tracto solitario, al núcleo parabraquial/núcleo de Kölliker-Fuse y a la sustancia gris periacueductal4.
Además de su papel en la generación del ritmo respiratorio, el preBötC es fundamental para la formación del patrón respiratorio5. La modulación peptidérgica sobre el preBötC proveniente de núcleos quimiosensibles como el pFRG/RTN, y posiblemente del núcleo del tracto solitario, es fundamental para la generación de suspiros6.
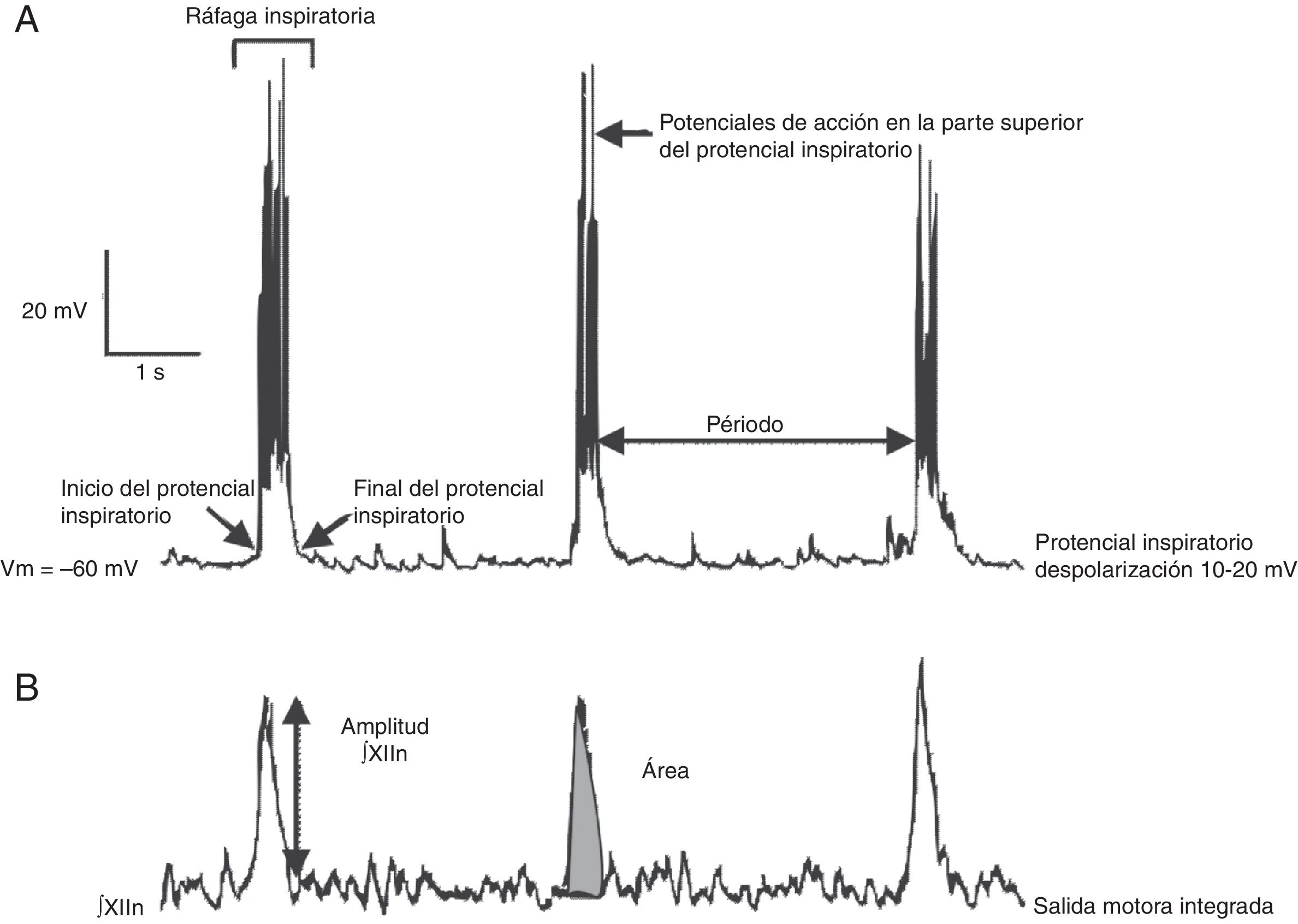
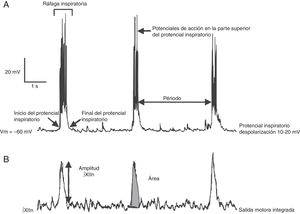
La generación del ritmo respiratorio: de la preparación in vitro al registro electrofisiológicoLa generación del ritmo respiratorio en mamíferos ha sido estudiada in vivo en distintos modelos animales como gato, cabra, rata y ratón1,7–9. Los modelos más utilizados para el estudio del ritmo respiratorio in vitro son: la preparación tallo cerebral-médula espinal conocida como en bloc y la rebanada transversal rítmica, ambas de rata y ratón neonatos9. La rebanada transversal rítmica descrita en 1991 por Smith et al.1 contiene el preBötC, el núcleo y nervios hipoglosos (XIIN y XIIn, respectivamente) en los cuales se registra e integra la actividad motora rítmica relacionada con la respiración. Dicha actividad está en fase con las neuronas del generador central de patrones, el preBötC. En la preparación en bloc, la actividad rítmica del nervio frénico está en fase con la actividad del preBötC.
Las ventajas y limitaciones de estudiar el ritmo respiratorio in vitro, así como una metodología para obtener rebanadas rítmicas de manera reproducible, ha sido revisada por otros10. Brevemente: bajo el microscopio el tallo cerebral es seccionado en serie en el plano transversal usando un vibratomo hasta que aparecen marcas anatómicas como el núcleo ambiguus y la oliva inferior (fig. 1B). En seguida se corta una rebanada transversal (500-600μm). En esta preparación se pueden registrar: a) directamente mediante registro de fijación de parche en célula única, la actividad rítmica de las neuronas del preBötC, que resulta de la interacción sináptica de la red neuronal y, b) indirectamente, la actividad rítmica del preBötC a partir del registro de las raíces del XIIn, que transmiten la señal de las motoneuronas del XIIN excitadas por las neuronas del preBötC (fig. 2). La actividad rítmica del XIIn es generalmente integrada (∫XIIn). Una vez establecida la actividad basal, la aplicación de fármacos puede ser realizada en el baño de la rebanada o inyectando el fármaco cerca de la neurona registrada.
Tipos neuronales en el complejo pre-BötzingerEl preBötC es una red de interneuronas heterogénea11. En las ratas, contiene una población de ∼1.000 neuronas por lado12, de las que ∼600 en total expresan el receptor neuroquinina-1 (rNK1), cuyo ligando es la sustancia P (SP)13. Algunas neuronas expresan somatostatina, un neuropéptido con acción moduladora en la respiración. La inmunorreactividad a rNK1 o a somatostatina es utilizada como marcador de neuronas del preBötC14–16. En estudios post mortem de cerebros de humanos con atrofia multisistémica, demencia con cuerpos de Lewy o síndrome de Perry, se ha observado una disminución significativa de neuronas inmunorreactivas a rNK1 en la región correspondiente al preBötC, con respecto al número de células inmunorreactivas encontradas en la misma área en cerebros de humanos fallecidos por otras causas. Estos hallazgos indican que los trastornos respiratorios asociados a estas enfermedades probablemente se deban a la pérdida de neuronas que regulan la generación del ritmo respiratorio17–20.
Se han identificado subpoblaciones neuronales glutamatérgicas, glicinérgicas, GABAérgicas, y con coexpresión de glicina-GABA16,21. Como resultado de las interacciones sinápticas entre las neuronas del preBötC, cada neurona produce actividad rítmica inspiratoria en forma de una despolarización sincrónica de 10-20mV, con duración de 0.3-0.8 s y con potenciales de acción encima, llamada potencial inspiratorio en fase con toda la red22 (fig. 2). Aunque rítmicas, no se considera a la mayoría de las neuronas del preBötC como neuronas marcapasos23, ya que en ausencia de conectividad sináptica la actividad rítmica cesa. Por último, el preBötC contiene neuronas silenciosas, que no disparan potenciales de acción aun cuando se encuentran en la misma área neuroanatómica. El preBötC no contiene neuronas espiratorias. Durante la ventilación pulmonar, la fase inspiratoria es la fase activa que involucra la contracción de músculos, mientras que la fase espiratoria es pasiva24. La espiración se vuelve activa en procesos como toser, estornudar o durante el ejercicio forzado. Se ha propuesto que la espiración activa está controlada por el pFRG/RTN25,26.
Farmacología de los receptores del glutamatoEl glutamato es el principal neurotransmisor excitatorio en el preBötC21,27. Las neuronas del preBötC expresan receptores ionotrópicos de glutamato de los tipos N-metil-D-aspartato (NMDAR), α-amino-3-hidroxil-5-metil-4-isoxazol-propionato (AMPAR) y kainato, así como metabotrópicos, mGluR28–30.
La activación y modulación de los AMPAR es crucial para la generación del ritmo respiratorio. La aplicación del agonista AMPA en el preBötC incrementa la frecuencia del ritmo, ya que despolariza las neuronas ritmogénicas29,31, en tanto la aplicación del antagonista 2,3-dihidroxi-6-nitro-7-sulfamoyl-benzo(f)quinoxalina (NBQX) elimina completamente la actividad respiratoria28. No obstante, en condiciones en las que se elimina el Mg2+ extracelular para quitar el bloqueo dependiente de voltaje de los NMDAR, el ritmo respiratorio se mantiene aún en altas concentraciones de NBQX, ya que la corriente postsináptica generada por los NMDAR sustituye a la corriente de los AMPAR28.
A pesar de estar presentes en las neuronas del preBötC, los NMDAR no son esenciales para la generación del ritmo respiratorio ni para la conducción de la transmisión sináptica en el neonato, pues la aplicación del bloqueador del poro del canal maleato de dizolcipina (MK-801) en preparaciones de rata no tiene efecto alguno sobre el ritmo respiratorio28. Además, preparaciones de ratones carentes de la subunidad NMDAR1 del receptor NMDA (NMDAR1−/−), necesaria para formar NMDAR funcionales, tienen ritmo respiratorio semejante al control32.
Se ha propuesto que los receptores metabotrópicos de glutamato del grupo i contribuyen a la generación del potencial inspiratorio. El mGluR1 regula una conductabilidad de K+ y mGluR5 utiliza Ca2+ intracelular como segundo mensajero y opera vía el receptor dependiente de inositol 1,4,5 trifosfato (IP3Rs)30,33. Los antagonistas selectivos de mGluR1 LY36738 y mGluR5 6-metil-2-(feniletinil) piridina (MPEP) reducen significativamente la amplitud y área del potencial inspiratorio, sin generar efectos sobre la actividad de la salida motora33. El antagonista general del grupo ii de mGluRs 1-amino-5-fosfonoindan-1-ácido carboxílico (APICA) reduce la frecuencia en la salida motora del XIIn sin un cambio en la amplitud33.
La capsaicina, el compuesto activo del chile, evoca liberación de glutamato y SP. La capsaicina actúa agotando y previniendo la reacumulación de SP en las neuronas sensoriales periféricas34. El tratamiento con capsaicina en la rebanada transversal disminuye la frecuencia de la actividad rítmica respiratoria medida en el ∫XIIn de manera dependiente de la concentración y el tiempo. El ritmo respiratorio cesa presuntamente porque la capsaicina evoca liberación de glutamato y SP de las fibras de las neuronas del preBötC27.
Farmacología de los receptores de GABALas neuronas inspiratorias pueden ser inhibidas o estimuladas vía receptores a GABA tipo A (GABAAR) por el anestésico sevoflurano. La aplicación de bajas concentraciones (0,23 y 0,47mM) estimula la actividad del preBötC, mientras que concentraciones desde 0,75mM deprimen su actividad35. La microinyección bilateral en el preBötC de muscimol, un agonista de los GABAAR, detiene el ritmo medido en el XIIn, pero la aplicación unilateral no cesa el ritmo36. En ratas, existe un periodo de transición del desarrollo del control motor respiratorio entre los días P10 y P15, cuando se ha indicado que hay un incremento de la inhibición neuronal GABAérgica. Esto se hace evidente al probar la sensibilidad a pentobarbital en el preBötC, la cual incrementa en P14, mientras que la sensibilidad a pentobarbital en motoneuronas del XIIN disminuye entre los días P11-P15, y es más baja en P14. Estos cambios en la sensibilidad a pentobarbital indican una variación en la expresión de subunidades que conforman al GABAAR37. Esta expresión diferencial podría ser clave para compensar o evitar un posible aumento de la inhibición GABAérgica y, por consiguiente, la depresión respiratoria durante el desarrollo. Por otra parte, la bicuculina, antagonista de los receptores GABAB, no genera cambios en la actividad respiratoria en neonatos38.
La información acumulada muestra que la participación del sistema GABAérgico en la generación del ritmo respiratorio podría ser dependiente de la edad, pues mientras a edades tempranas GABA parece no desempeñar un papel relevante en la ritmogénesis del preBötC, en edades posteriores a P10 podría estar participando en la modulación de la depresión respiratoria.
Farmacología de los receptores de la glicinaLos receptores de glicina (GlyR) son canales iónicos de Cl− activados por ligando que median la neurotransmisión inhibitoria rápida en la médula espinal y el tronco cerebral39. El antagonista de los GlyR, estricnina, ha sido utilizada para abolir la contribución de corrientes espontáneas mediadas por dichos receptores y como diana molecular para los anestésicos volátiles35,38. Por ejemplo, la aplicación de estricnina previa a sevoflurano antagoniza el efecto depresor de este en la actividad de las neuronas preinspiratorias, en tanto su coaplicación con sevoflurano (0,47mM) causa un incremento significativo en el ritmo de las ráfagas pre-IS35. Sin embargo, hasta ahora no se ha demostrado que su participación sea crítica en la generación del ritmo respiratorio.
Farmacología de los receptores de la acetilcolinaLas perturbaciones de la neurotransmisión colinérgica en el tronco cerebral afectan el patrón motor respiratorio tanto in vivo como in vitro40. Las neuronas del preBötC responden a la aplicación local de la acetilcolina (ACh), carbacol o a la aplicación en el baño de muscarina. La muscarina incrementa la frecuencia, amplitud y duración de las ráfagas motoras del XIIn. Además, induce actividad de tipo convulsivo durante el periodo interráfaga. Los efectos son bloqueados por la atropina40. La ACh y la nicotina modulan los patrones respiratorios activando los receptores nicotínicos (nAChR) en el preBötC41. La nicotina, mediante la activación de la subunidad α4 de los nAChR, facilita la entrada glutamatérgica excitatoria a las neuronas inspiratorias del preBötC y las despolariza. Por otra parte, el inhibidor de la acetilcolinesterasa neostigmina eleva los niveles de ACh, excita las neuronas inspiratorias, incrementa la frecuencia respiratoria y la amplitud, induciendo actividad tónica en el XIIn42.
La microinyección unilateral del inhibidor de la acetilcolinesterasa sulfato de fisostigmina (physo) en el preBötC incrementa la frecuencia de la actividad rítmica del ∫XIIn, en tanto que inyectado ipsolateralmente induce actividad tónica y un incremento de la amplitud y duración de las ráfagas del ∫XIIn; además, disminuye el periodo del ciclo respiratorio y su variabilidad43. Por otro lado, el 4-difenilacetoxi-N-metilpiperidina (4-DAMP), antagonista selectivo de los receptores muscarínicos de ACh M3, bloquea las corrientes inducidas por carbacol, además de aumentar la resistencia membranal de entrada y bloquear todos los efectos de physo, excepto el incremento de la frecuencia respiratoria40,43. En presencia tanto de dihidro-β-eritroidina como de 4-DAMP, physo induce efectos opuestos, lo que indica que la transmisión colinérgica en el preBötC regula la frecuencia respiratoria en tanto que, en el XIIn, regula la actividad tónica, amplitud y duración de las ráfagas inspiratorias del ∫XIIn en ratas neonatas43.
Farmacología de los receptores de la serotoninaLa serotonina (5-hidroxitriptamina, 5-HT) desempeña un papel clave en la modulación del patrón de la respiración actuando sobre diferentes subtipos de receptores. La aplicación sistémica del agonista 8-hidroxi-2-dipropilamino tetralin hidrobromuro (8-OH-DPAT) en perros reduce en ∼40% la duración inspiratoria y espiratoria, pero no produce cambios en la amplitud de la descarga del nervio frénico44. Este estudio in vivo señala que 8-OH-DPAT modula la fase del ritmo respiratorio por la activación de receptores de 5-HT en regiones diferentes al preBötC y, en general, fuera de la columna respiratoria, apuntando a la participación de estructuras cercanas como el núcleo rafé, RTN, complejo parabraquial-Kölliker–Fuse y el núcleo del tracto solitario44.
In vitro, la aplicación de 5-HT en el baño o directamente en el preBötC aumenta la frecuencia del ritmo respiratorio45,46. El efecto de la 5-HT sobre la actividad rítmica es mimetizado por el agonista R(-)2-(2,5-dimetoxi-4-iodofenil) aminoetano hidrocloruro (DOI) y bloqueado por el antagonista de receptores 5-HT2A ketanserina45,47.
Farmacología de los receptores adrenérgicosLa norepinefrina pertenece al grupo de las catecolaminas y actúa como regulador de la actividad respiratoria48. La pérdida de inervación noradrenérgica está relacionada con la enfermedad de Alzheimer49. La aplicación de norepinefrina a rebanadas de ratones después de exposición a hipoxia intermitente aguda (AIH) hace que la actividad respiratoria sea irregular, presumiblemente por un aumento de la inhibición sináptica dentro del preBötC48. Esta irregularidad puede ser prevenida mediante el bloqueo de la inhibición sináptica únicamente de forma previa a la AIH, ya que si se trata de bloquear la inhibición sináptica después de AIH, la respiración no se puede restablecer. Esto indica cambios sutiles en la transmisión sináptica de la red generadora del ritmo respiratorio, como la liberación endógena de neuromoduladores.
Farmacología de los receptores purinérgicosDistintas funciones de la red respiratoria neural se mantienen en condiciones homeostáticas mediante la señalización de adenosina a través de su unión a receptores purinérgicos P1 (P1R), y de ATP que se une a receptores purinérgicos P2 (P2R)50. La señalización de los P2R tiene un papel muy importante en la respuesta ventilatoria central a la hipoxia51. Las redes generadoras del ritmo inspiratorio en el preBötC son excitadas por activación de P2R del subtipo P2Y52.
La aplicación de adenosina en preparaciones de ratón reduce la frecuencia inspiratoria, que permanece significativamente por debajo del control. En preparaciones de rata no tiene efecto sobre la frecuencia basal inspiratoria50. La aplicación local de ATP en preparaciones de rata produce un aumento en la frecuencia inspiratoria de inicio rápido y corta duración, en tanto que en preparaciones de ratón no tiene efecto significativo50,53.
Los efectos moduladores de los receptores P2Y1 (P2Y1R) sobre la actividad eléctrica de la salida motora del nervio frénico (C4) y del XIIn se han estudiado en presencia del agonista MRS2365, el cual potencia la amplitud de la ráfaga inspiratoria del XIIn, y a concentraciones 10veces mayores, la amplitud de las ráfagas de C4 es potenciada52. La aplicación de MRS2365 en el preBötC en preparaciones de ratones durante 10 s aumenta la frecuencia y duración de ∫XIIn por encima de la frecuencia basal50,53. Registros de célula completa muestran que las motoneuronas del XIIN son más sensibles a la modulación de los P2Y1R que las motoneuronas del nervio frénico52.
El antagonista del receptor pirodoxal-fosfato-6-azofenil-2′,4′-disulfonato tetrasodio (PPADS) reduce la magnitud de corriente inducida por ATP51. La evidencia indica que la señalización a ATP modula el preBötC de forma indirecta, ejerciendo sus efectos sobre la frecuencia respiratoria.
Farmacología de los receptores de opioidesAgonistas del receptor μ-opioide (μOR) afectan el ritmo respiratorio cuando son inyectados directamente en el preBötC. Neuronas con propiedades ritmogénicas denominadas de tipo 1 que expresan rNK1 y μOR han sido propuestas como relevantes para la generación del ritmo respiratorio, ya que modulan la frecuencia respiratoria14.
La aplicación del agonista de μOR [D-Ala2,N-Me-Phe4,Gly5-ol] encefalin acetato (DAMGO) en el baño de la rebanada disminuye la frecuencia respiratoria medida en el XIIn54. La inyección de DAMGO directamente en el preBötC activa una conductabilidad de K+ que induce la hiperpolarización de las neuronas14. Estos datos son de relevancia clínica, ya que la morfina, que activa los μOR, es comúnmente utilizada como analgésico postoperatorio de larga duración al ser inyectada de manera epidural o intratecal. Sin embargo, esta droga puede provocar depresión respiratoria. Una explicación plausible a este efecto secundario es que el líquido cefalorraquídeo que contiene la morfina active los μOR de las neuronas del preBötC y deprima su actividad y, por lo tanto, la generación del ritmo respiratorio.
Fármacos misceláneosExisten compuestos que no actúan en un receptor conocido específico y, sin embargo, afectan al ritmo respiratorio. Tal es el caso de la creatina, un compuesto endógeno sintetizado de arginina y glicina que es almacenado en su mayoría en el músculo esquelético; su suplementación está asociada a la prevención de enfermedades neurodegenerativas y su deficiencia en el sistema nervioso central, con desórdenes intelectuales55,56.
El efecto de la creatina en hipoxia en la amplitud y duración de la ráfaga inspiratoria y en los niveles de ATP en condiciones de anoxia fue evaluado en neuronas del preBötC mediante el registro de fijación de parche en célula completa y en la salida motora del XIIn en rebanadas hipóxicas de ratón a diferentes etapas posnatales (P0-5 y P6-13) tratados mediante nutrición normal (controles), alimentados con creatina (2g/kg/día; grupo suplementado), o rebanadas incubadas 3 h en creatina (200μM)57. En rebanadas de ratones P0-P13 en condiciones de anoxia (30min), la amplitud y duración de la ráfaga inspiratoria aumenta tanto en rebanadas de ratones control como en las de ratones suplementados con creatina en comparación con los valores preanóxicos57. Los niveles de ATP se mantienen constantes en rebanadas pretratadas con creatina en comparación con una disminución en rebanadas control. Estos datos señalan que la creatina puede contrarrestar la insuficiencia de energía por hipoxia57.
ConclusiónSe han realizado múltiples manipulaciones farmacológicas para estudiar la generación del ritmo respiratorio a nivel central, sin embargo, aún existe una gran interrogante respecto a cuáles son los receptores y las vías de señalización endógenas indispensables y suficientes para que el ritmo emerja. Es de gran relevancia para el estudio de la ritmogénesis respiratoria hacer una clara distinción entre los mecanismos de generación vs. los de modulación del ritmo. Aunque se conocen los distintos tipos neuronales que forman el preBötC, las interacciones entre ellos para que emerja la fase inspiratoria del ritmo respiratorio aún no son claras. La farmacología ha sido de gran ayuda para formar una imagen de la organización del preBötC. Sin embargo, ningún fármaco está exento de efectos indeseables ya que, aun utilizados a concentraciones adecuadas, pueden afectar a sistemas distintos de los que se pretende estudiar, por lo que estudios futuros deben contemplar la especificidad del fármaco elegido y sus posibles interacciones con receptores distintos del blanco. Como se mostró en esta revisión, se siguen utilizando fármacos no selectivos que, si bien generan una respuesta observable y medible, dificultan conocer los mecanismos moleculares específicos participantes. El uso de las concentraciones farmacológicas idóneas utilizadas en los experimentos muestra una enorme discrepancia con las propuestas por organizaciones como la International Union of Basic and Clinical Pharmacology Committee on Receptor Nomenclature and Drug Classification (IUPHAR) para activar los receptores de interés. Los estudios futuros deberán hacer un análisis exhaustivo sobre los resultados que se pudieran obtener como respuesta a una interacción entre diversos sistemas de receptores y no de un solo sistema.
Finalmente, los estudios para conocer el funcionamiento del preBötC en humanos y primates no humanos son escasos. Sin embargo, es claro que, aun con la poca información con la que se cuenta, existe una correlación directa entre la muerte asociada a una falla respiratoria en pacientes con enfermedades neurodegenerativas en etapas avanzadas y la cantidad de neuronas del núcleo preBötC.
FinanciaciónFinanciamiento CONACYT-128392, CONACYT-153627 y beca doctoral CONACyT-515158.
Conflictos de interesesNo se presentaron conflictos de intereses para la realización de esta revisión.