La enfermedad por coronavirus 2019 (COVID-19) ha sido asociada con un amplio espectro de alteraciones neurológicas. El SARS-CoV-2 induce en muchos casos una respuesta inmunológica inadecuada, ocasionando una reacción hiperinflamatoria multisistémica. Se han descrito casos de enfermedades disinmunes desencadenadas por la COVID-191-4, entre ellos, varios casos de encefalitis por anticuerpos contra el receptor anti-N-metilo-d-aspartato (anti-NMDA-R)5-9. Presentamos un caso de encefalitis anti-NMDA-R de posible causa postinfecciosa tras COVID-19.
Mujer de 22 años diagnosticada de epilepsia focal frontal derecha no lesional desde los 20 años, libre de crisis más de un año, en monoterapia, sin otros antecedentes. En enero del 2022 contrajo la COVID-19, con sintomatología catarral leve. Cinco días tras el inicio de estos síntomas presentó 4crisis focales secundariamente generalizadas, tras lo cual se inició un segundo antiepiléptico. Tras esto, presentó una importante ansiedad, ánimo disfórico e insomnio, y los días posteriores comenzó con bloqueos del lenguaje, que evolucionaron progresivamente a una afasia motora, que persistía a pesar de los ajustes de antiepilépticos. Tras 2semanas, tuvo 3 crisis focales secundariamente generalizadas en pocas horas, con empeoramiento neurológico posterior, añadiendo a los síntomas previos bradipsiquia y trastorno delirante, con alucinaciones visuales y agitación psicomotriz, por lo que requirió ingreso hospitalario. No asoció fiebre, afectación sistémica, cambios del nivel de alerta ni trastornos del movimiento. Los EEG mostraron ondas delta intermitentes de gran voltaje en regiones frontales (FIRDA), sin otras alteraciones (fig. 1). La RM cerebral y analítica completa fueron normales. La sospecha clínica inicial fue una descompensación de su epilepsia previa por infección por SARS-CoV-2, seguida de una psicosis postictal. Comenzó tratamiento con benzodiacepinas y neurolépticos. La clínica psiquiátrica mejoró, no recurrieron nuevas crisis, pero mantuvo la disfasia y bradipsiquia. Se realizó punción lumbar (cuarta semana tras el inicio del cuadro): 7 células, proteinorraquia y glucorraquia normales, citología y estudio microbiológico (serología, cultivos y PCR) negativos. Los anti-NMDA-R fueron positivos en LCR y suero. Se pautó metilprednisolona (1g/día) durante 5 días, con mejoría clínica parcial. Continuó tratamiento con inmunoglobulinas intravenosas (0,4g/kg al día durante 5 días), con mejora gradual hasta su situación basal. El estudio ginecológico, body-TC y body-PET-FDG descartó neoplasia oculta; sin embargo, la PET-FDG demostró un hipometabolismo difuso del córtex cerebral (fig. 2). Se decidió tratamiento con rituximab (2 infusiones de 1g separadas 15 días).
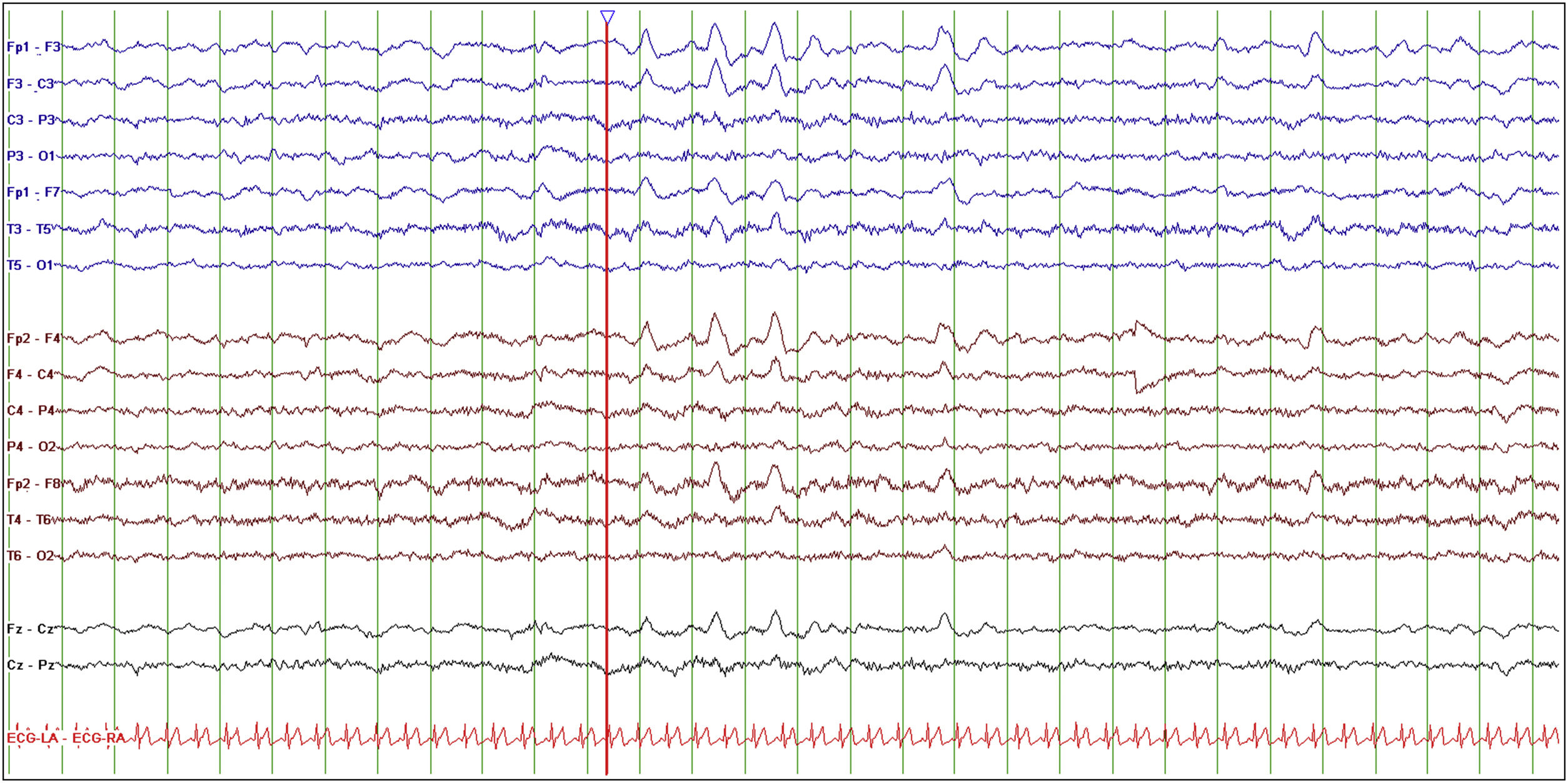
EEG basal con presencia de ondas delta intermitentes frontales (FIRDA).
Electroencefalograma basal, vigilia tranquila con ojos cerrados. Montaje longitudinal bipolar, LFF 0,5Hz, HFF 30Hz, sensibilidad 10 uV/mm, tiempo de base 15mm/s. Sobre una actividad de base dentro de límites normales, destaca la presencia de ondas delta de gran voltaje en derivaciones frontales bilaterales de aparición intermitente (FIRDA) tanto aisladas como en trenes de pocos segundos (línea roja).
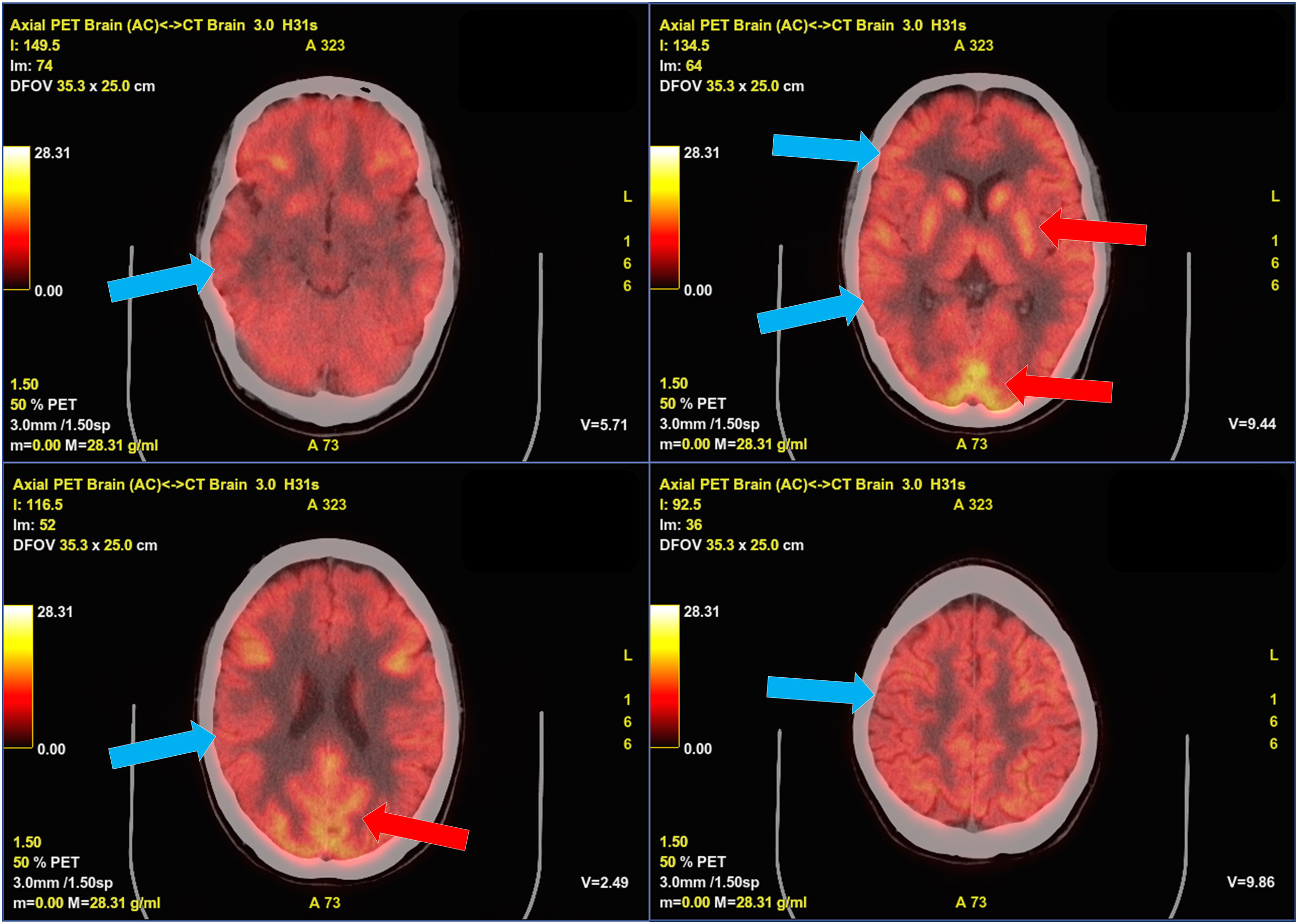
F18-FDG PET-TC cerebral con presencia de hipometabolismo cortical generalizado.
Tomografía por emisión de positrones con F18-fluordesoxiglucosa fusionado con TC cerebral. Se aprecia un hipometabolismo generalizado difuso en la corteza cerebral (flechas azules), con mayor captación de trazador en los ganglios de la base que en la corteza, así como algunos focos corticales occipitales con captación normal del trazador (flechas rojas).
Las encefalitis autoinmunes pueden deberse a fenómenos de inmunorreactividad cruzada. La exposición del sistema inmune a un epítopo que mimetiza un antígeno presente en el sistema nervioso daría lugar a la aparición de anticuerpos antineuronales. Además de varios casos recientes de SARS-CoV-25-9, múltiples virus se han asociado con el desarrollo de anticuerpos anti-NMDA-R, si bien la mayoría ocurrieron tras encefalitis por virus del herpes simple10. No obstante, también se ha descrito su asociación con infecciones bacterianas o parasitarias11,12. En el caso de la COVID-19, la similitud estructural entre la subunidad GluN1 del receptor NMDA y la proteína no estructural 8 del SARS-CoV-2 podría explicar su asociación con la encefalitis anti-NMDA-R13. Sin embargo, en varios de los casos de encefalitis anti-NMDA-R en el contexto de COVID-19 publicados hasta la fecha, la cronología de esta asociación parece cuestionable, ya que los síntomas de encefalitis comenzaron semanas antes que los síntomas o la confirmación diagnóstica de COVID-196-9, lo que pone en duda que el SARS-CoV-2 fuera el desencadenante del fenómeno disinmune. No obstante, conviene recordar que la latencia en la generación de los anticuerpos durante un proceso disinmune postinfeccioso no está bien definida en la actualidad. Por otro lado, en uno de los casos se diagnosticó un teratoma ovárico5 y en varios no hay información del estudio de neoplasia oculta, por lo que su asociación con la infección COVID-19 podría ser casual, en lugar de causal.
La encefalitis por anticuerpos anti-NMDA-R es la encefalitis autoinmune más frecuente14. Afecta habitualmente a mujeres (4:1) jóvenes (mediana 21 años)14,15. En más de la mitad de los casos no se demuestra ningún desencadenante, aunque en mujeres jóvenes suele asociarse con teratomas ováricos (58%)14. Se ha asociado una posible predisposición a desarrollar encefalitis anti-NMDA-R con la presencia de ciertos haplotipos HLA (human leukocyte antigen), como HLA-DRB1*16:02 o HLA-B*07:0216. La clínica típica comienza con síntomas psiquiátricos: delirios, alucinaciones, agitación, insomnio y catatonía. Suelen asociar bradipsiquia, trastorno del lenguaje, convulsiones, disautonomía, hipoventilación y trastornos del movimiento.
En nuestra paciente, la presentación clínica fue leve, aunque característica. Los casos no paraneoplásicos suelen cursar de manera más leve que los asociados a tumor15. La RM cerebral es normal en el 70% de casos; en cambio, el EEG, PET cerebral y la punción lumbar suelen mostrar alteraciones en la mayoría de los pacientes14,15. El abordaje terapéutico incluye inmunoterapia con corticoides, inmunoglobulinas o plasmaféresis, además de la resección del tumor, cuando existe. En casos refractarios se recomiendan rituximab o ciclofosfamida14. Se han descrito recurrencias en aproximadamente el 12% de casos; el riesgo es mayor en casos no paraneoplásicos y en los no tratados con inmunoterapia15.
En conclusión, la posibilidad de una encefalitis anti-NMDA-R post-COVID-19 debe tenerse en cuenta en un contexto clínico apropiado. La descripción de varios casos y de otros síndromes neurológicos inmunomediados tras COVID-19 plantean una posible relación entre ambas entidades.
Conflicto de interesesLos autores no declaran conflictos de interés.
FinanciaciónNo se ha recibido financiación de ningún tipo.