La encefalomielitis aguda diseminada (ADEM) es una enfermedad desmielinizante propia de la edad pediátrica y de etiología disinmune que afecta de manera multifocal a la sustancia blanca del sistema nervioso central. Suele ser monofásica, aunque el 1-20% de los pacientes pueden presentar recurrencias. En el 50-75% se identifica un proceso infeccioso previo, tanto viral (sarampión, parotiditis, influenza, hepatitis, herpes) como bacteriano (Chlamydia, Legionella, Campylobacter), siendo el Mycoplasma pneumoniae la bacteria implicada con mayor frecuencia1. Se han descrito casos también en relación con infecciones por SARS-CoV-22. La etiopatogenia es desconocida, se asume una respuesta autoinmune frente a agentes infecciosos similares a los péptidos de la mielina, provocando lesiones desmielinizantes3. El cuadro clínico es heterogéneo. Suele iniciarse con síntomas sistémicos seguidos de síntomas neurológicos multifocales que cursan de manera aguda y rápidamente progresiva4–7. El diagnóstico es clínico y radiológico, sin que exista un marcador biológico identificable, ni unos criterios diagnósticos en edad adulta, a diferencia de en población pediátrica8. El curso clínico suele ser más agresivo en los adultos, con peor pronóstico funcional y vital (mortalidad del 10-30%)5.
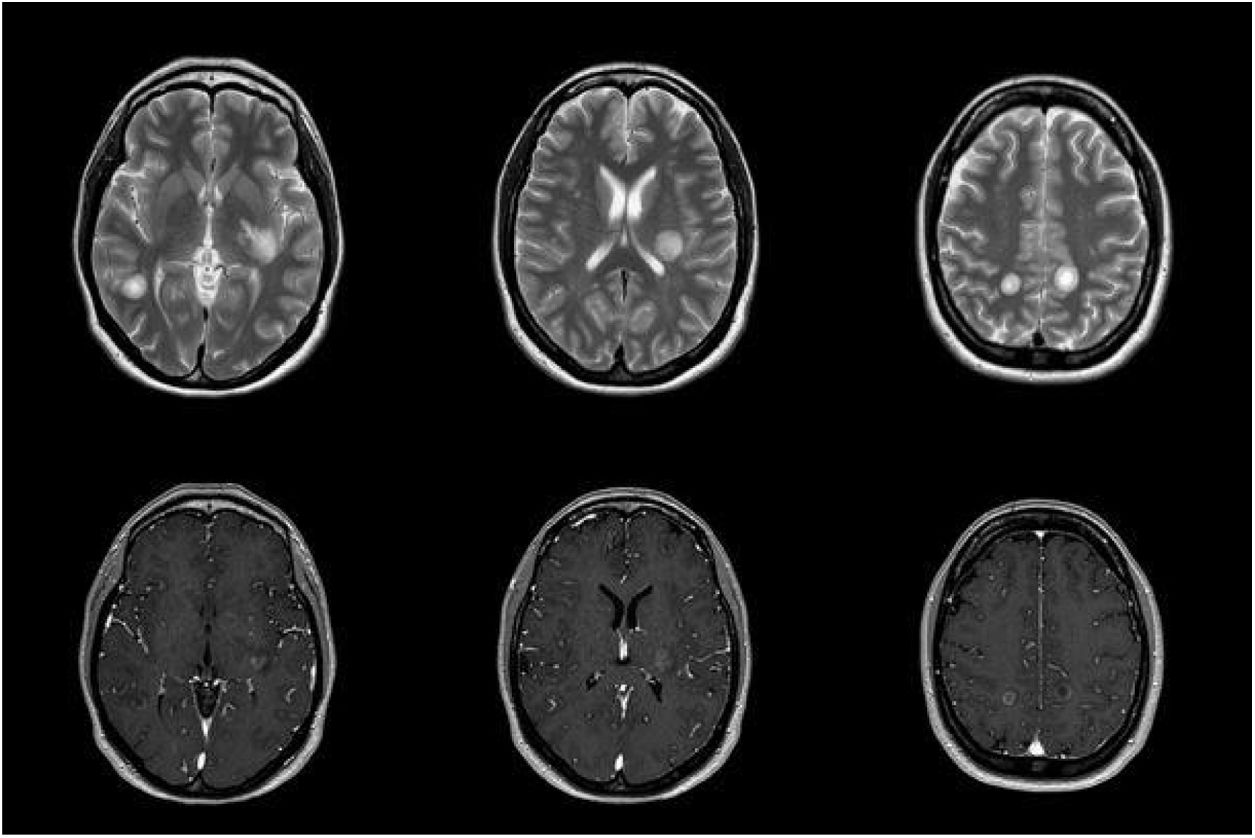
Presentamos el caso de una mujer de 38 años que presentó, 3 semanas antes, una neumonía tratada con amoxicilina-clavulánico, en un contexto epidémico laboral. Consultó por visión borrosa en ojo izquierdo de una semana de evolución y parestesias facio-braquiales derechas. En la exploración neurológica se objetivó: disminución de agudeza visual bilateral asimétrica, con fondo de ojo normal, hemiparesia atáxica derecha, hipoestesia en hemicara derecha, hiperreflexia generalizada y marcha con aumento de base de sustentación y tándem imposible. Teniendo en cuenta la situación epidemiológica actual, se solicitaron PCR y serologías de SARS-CoV-2 que fueron negativas. Durante los primeros días progresó la focalidad neurológica descrita asociándose afasia sensitivo-motora. En la resonancia magnética (RM) craneoencefálica inicial se observaron, en sustancia blanca y ganglios basales, lesiones multifocales ovaladas de gran tamaño hiperintensas en T2 y FLAIR sin efecto de masa, con realce periférico tras la administración de contraste (fig. 1). El estudio de líquido cefalorraquídeo (LCR) mostró una hiperproteinorraquia de 0,59g/L (0,35-0,45g/L) sin células, siendo el resto de determinaciones analíticas (autoinmunidad, estudio de micobacterias y PCR de N. meningitidis, S. pneumoniae, S. agalactiae, H. influenzae, L. monocytogenes y virus neurotropos) negativas. Las serologías en sangre mostraron positividad para IgM e IgG contra M. pneumoniae 15 días después tras el inicio de la clínica neurológica. El resto de serologías en suero (VIH, VEB, CMV, Legionella, Chlamydia, C. burnetti) y el estudio de autoinmunidad fueron negativos. La tomografía computarizada toracoabdominopélvica y el ecocardiograma transtorácico no mostraron alteraciones. Se inició tratamiento con metilprednisolona en bolos de 1g intravenoso que se suspendió al tercer día por empeoramiento clínico. Tampoco respondió al tratamiento con inmunoglobulinas intravenosas, por lo que se inició plasmaféresis con buena respuesta. Queremos destacar la discordancia clínico-radiológica (fig. 2), con empeoramiento radiológico a pesar de mejoría clínica.
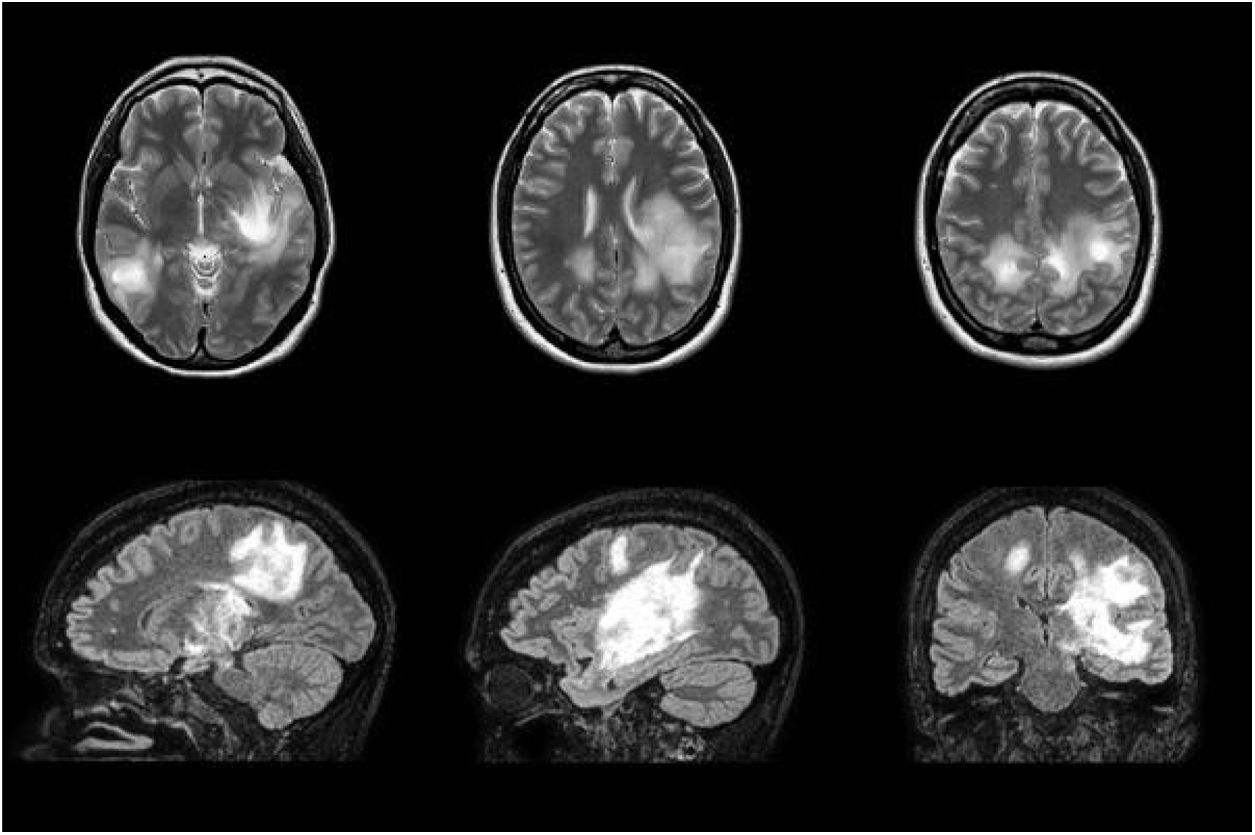
Resonancia magnética cerebral realizada durante el tratamiento con inmunoglobulinas intravenosas. Se observa un empeoramiento radiológico a pesar de la evolución favorable de la paciente. Se visualizan múltiples lesiones hiperintensas en T2 y FLAIR que restringen en la difusión, las de mayor tamaño en ganglios de la base izquierdos y corticosubcorticales bilaterales.
La clínica cobra especial importancia en esta entidad. En la población adulta es poco frecuente la presencia de fiebre, cefalea y signos meníngeos. La encefalopatía como síntoma inicial puede ser un dato clave para establecer el diagnóstico diferencial con otras enfermedades desmielinizantes5. En nuestra paciente, la ausencia de los síntomas citados y los hallazgos en la RM nos obligaron a ampliar el diagnóstico diferencial con enfermedades del espectro de neuromielitis óptica (NMOSD) y las encefalitis autoinmunes3,7. Tanto los anticuerpos anti-acuaporina 4 (AQP4) como las bandas oligoclonales (BOC) en LCR fueron negativas. Se recomienda la determinación de los anticuerpos contra la glicoproteína de la mielina del oligodendrocito (anti-MOG) por sus implicaciones en el tratamiento, pronóstico y riesgo de recurrencia y de anticuerpos anti-AQP4 para realizar el diagnóstico diferencial con NMOSD3. La presencia de BOC en LCR es poco frecuente pero su determinación puede ser útil para predecir en qué pacientes el diagnóstico de ADEM puede cambiar durante el seguimiento hacia esclerosis múltiple (EM), más frecuente en pacientes con desmielinización recurrente y anti-MOG negativos3. La prueba de imagen de elección es la RM, que muestra habitualmente lesiones hiperintensas en T2 y FLAIR. A diferencia de la EM, es característica la afectación del tálamo y la ausencia de "agujeros negros"6,9. La terapia de primera línea en el manejo agudo de la ADEM son los corticoides a altas dosis, usualmente metilprednisolona (máximo 1.000mg/día) durante 3-5 días. Con este tratamiento, entre un 50-80% de los pacientes consiguen una recuperación completa. En casos refractarios como el nuestro, se recomienda plasmaféresis o inmunoglobulinas intravenosas7,10. Nuestra paciente, a pesar de presentar signos de mal pronóstico, como el inicio hiperagudo, el curso agresivo, la focalidad neurológica grave y la ausencia de respuesta a corticoterapia, evolucionó favorablemente y tras revaloración en consulta 6 meses después se encuentra oligosintomática10.
En conclusión, la variabilidad en la presentación clínica y la ausencia de un marcador biológico identificable y de unos criterios diagnósticos de consenso de ADEM en la edad adulta convierten esta entidad en un reto diagnóstico, como el caso presentado. Es esencial su identificación y tratamiento precoz para mejorar el pronóstico funcional y vital.
Conflicto de interesesLos autores no declaran ningún conflicto de interés.