Las lesiones desmielinizantes focales seudotumorales se definen como lesiones solitarias, desmielinizantes, con diámetro superior de 2 cm. Estas pueden imitar mediante el estudio imagenológica una neoplasia o absceso cerebral, lo que lleva a medidas diagnósticas y terapéuticas invasivas en algunos casos, incrementando la morbilidad. Nuestro objetivo fue analizar y caracterizar estas lesiones clínica, radiológica y patológicamente, lo que, sumado a la revisión de la literatura, aportará al entendimiento de este tipo de trastornos.
MétodosEn este estudio descriptivo, se reportan 5 casos con diagnóstico patológico. Mediante la revisión de informes relacionados, clínicos, radiológicos y patológicos, se resumen las características de los sujetos.
ResultadosLa edad de los pacientes osciló entre los 12 y los 60 años, 3 pacientes fueron de género femenino. La latencia de los síntomas hasta admisión hospitalaria fue entre 3 y 120 días, las manifestaciones clínicas fueron diversas y dependientes de la localización de la lesión, en el 80% de los pacientes se encontraron signos piramidales y no se encontraron clínica o imagenológicamente lesiones de la médula espinal; el seguimiento de los pacientes abarca desde un año hasta 15 años.
ConclusiónLa biopsia cerebral es el estándar de oro para el diagnóstico de las lesiones desmielinizantes seudotumorales; no obstante, las características clínicas, junto con varias características de la resonancia magnética, tales como el realce en anillo abierto, el realce venular y la presencia de glutamato en la espectroscopia, entre otras, pueden ser satisfactorias en la diferenciación de las lesiones desmielinizantes focales seudotumorales de lesiones neoplásicas.
Focal tumour-like demyelinating lesions are defined as solitary demyelinating lesions with a diameter greater than 2cm. In imaging studies, these lesions may mimic a neoplasm or brain abscess; as a result, invasive diagnostic and therapeutic measures may be performed that will in some cases increase morbidity. Our aim was to analyse and characterise these lesions according to their clinical, radiological, and pathological characteristics, and this data in addition to our literature review will contribute to a better understanding of these lesions.
MethodsThis descriptive study includes 5 cases with pathological diagnoses. We provide subject characteristics gathered through reviewing their clinical, radiology, and pathology reports.
ResultsPatients’ ages ranged from 12 to 60 years; 3 patients were female. The time delay between symptom onset and hospital admission was 3 to 120 days. Clinical manifestations were diverse and dependent on the location of the lesion, pyramidal signs were found in 80% of patients, there were no clinical or radiological signs of spinal cord involvement, and follow-up times ranged from 1 to 15 years.
ConclusionBrain biopsy is the gold standard for the diagnosis of demyelinating tumour-like lesions; however, their clinical features, along with several magnetic resonance imaging features such as open ring enhancement, venular enhancement, the presence of glutamate in spectroscopy, and others, may be sufficient to differentiate neoplastic lesions from focal tumour-like demyelinating lesions.
Las principales enfermedades desmielinizantes del sistema nervioso central (SNC) abarcan una serie de entidades, tales como la encefalomielitis aguda diseminada (EMAD), leucoencefalopatía hemorrágica aguda, la neuromielitis óptica (enfermedad de Devic) y diversos tipos de esclerosis múltiple (EM). Esta última entidad incluye el tipo crónica (Charcot), tipo agudo (Marburg), esclerosis mielinoclástica difusa (Schilder) y la esclerosis concéntrica (Baló), de los cuales la tipo Charcot (EM clásica) es la más común y mejor conocida; esta última, si bien tienen una baja prevalencia en el trópico1,2, viene en aumento. Sin embargo, existe una enfermedad desmielinizante poco frecuente que se presenta como una zona focal de desmielinización de gran tamaño (> 2cm) asociada a efecto de masa y que puede imitar, mediante el estudio imagenológica, una neoplasia o absceso cerebral. En la literatura, esta enfermedad ha sido llamada «seudotumores desmielinizantes», «lesiones desmielinizantes seudotumorales», «tumor-like demyelinating lesions» y «lesiones desmielinizantes tumefactas».
La resonancia magnética (RM), aunque sensible para detectar estas lesiones, no es específica de su etiología. La observación neurorradiológica de una gran lesión en la profundidad de la sustancia blanca con importante efecto de masa, y que se revele clínicamente por signos de aumento de la presión intracraneal, es muy sospechosa de una neoplasia en el SNC. En casos raros, un trastorno desmielinizante puede presentarse con síntomas atípicos e imágenes indicativas de un tumor cerebral. Estas llamadas lesiones desmielinizantes focales seudotumorales (LDFS) pueden ser un considerable desafío diagnóstico, tanto para el clínico como para el radiólogo.
La dificultad en el diagnóstico de la enfermedad desmielinizante focal seudotumoral a menudo conduce a la biopsia quirúrgica, la cual constituye todavía el máximo punto de apoyo para un diagnóstico concluyente.
En este estudio, se reportan 5 casos con diagnóstico patológico. Mediante la revisión de informes relacionados, clínicos, radiológicos y patológicos, se resumen las características del diagnóstico.
MétodosEn este estudio descriptivo, se reportan cinco casos con diagnóstico patológico. Se revisan las historias clínicas de los sujetos, se extraen datos clínicos como el perfil de presentación, las manifestaciones clínicas, el tratamiento instaurado y la respuesta a este, además se identifica la evolución clínica de los sujetos. Se revisa además las características imagenológicas de las lesiones en las imágenes de resonancia magnética, son descritos además los hallazgos microscópicos de las lesiones cuando fue posible.
ResultadosLa edad de los pacientes en el momento de la aparición de la lesión estuvo entre los 12 y los 60 años, 3 de los pacientes fueron de género femenino y los restantes 2, masculino. La duración desde el inicio de los síntomas y la admisión hospitalaria fue entre 3 días y 4 meses, teniendo manifestaciones clínicas muy diversas y dependientes de la localización de las lesiones; no obstante, el 80% de ellos presentaron signos piramidales, en ninguno de los casos se documentaron por clínica o neuroimagen lesiones medulares, el seguimiento de los pacientes abarca desde un año hasta 15 años en uno de ellos (véase la tabla 1).
Principales características clínicas y paraclínicas de los pacientes
| Caso | Edad | Sexo | Hallazgos en el comienzo clínico | Hallazgos imagenológicas | Hallazgos patológicos | Tratamiento | Seguimiento |
|---|---|---|---|---|---|---|---|
| 1 | 39 | M | Cefalea, vértigo | Lesiones frontal y temporal derechas, con hiperintensidad central, aspecto quístico, realce anular con gadolinio; además, lesiones en ganglios basales, lesiones periventriculares, en cuerpo calloso y radiación óptica | H&E donde se observa vaso sanguíneo rodeado por leucocitos, a su vez rodeados por macrófagos espumososPequeños astrocitos y gemihistocíticos benignosPlata de Bielschowski, que muestra áreas con pérdida de la mielina y un número significante de axones preservados | Alferon® 10 años; después interferón beta 1A | 15 años de seguimiento sin recaídas |
| 2 | 12 | F | Pérdida aguda de la visión en el OD no tratada, 4 meses después afasia y hemiplejía derecha | Lesión frontal derecha hiperintensa en T2, hipointensa en T1 y FLAIR, con edema vasogénico adyacente y escaso efecto de masa. Imágenes indicativas de estructuras vasculares en el interior de la lesión. Perfusión cerebral donde se observa hipoperfusión y espectroscopia con pico de colina a 3,23ppm elevado, pico de NAA a 2,05ppm disminuido y pico de glutamato y glutamina a 2,4-2,5ppm | LFB y H&E. Se observan macrófagos espumosos abundantes en ausencia de Necrosis de coagulación, astrocitos reactivos atípicos (células de Creutzfeldt-Peters). Vénulas con manguitos perivasculares de linfocitos. LFB evidencia zonas de desmielinización, con bordes claramente definidos; dichas áreas tienden a confluir | Tratamiento agudo con metilprednisolona por 5 días, seguido de un ciclo de 5 sesiones de plasmaféresis; no se inició tratamiento inmunomodulador | Recuperación completa de la fuerza en el hemicuerpo derecho y trastorno del lenguaje, atrofia óptica OD secuelarActualmente, con un seguimiento de un año sin recaídas |
| 3 | 23 | F | Un mes antes, hemianopsia homónima, parestesias en 4 extremidades; en el momento del diagnóstico estaba asintomática | Lesión en la sustancia blanca occipital, hiperintensa en T2, hipointensa en T1 y FLAIR. Perfusión cerebral donde se observa hipoperfusión y espectroscopia con pico de colina a 3,23ppm elevado, pico de NAA a 2,05ppm disminuido y pico de glutamato y glutamina a 2,4-2,5ppm | No requirió biopsia | No se inició tratamiento | 6 años después se encontró signo de Babinski en el examen físico; se solicitó RM que mostró nuevas lesiones, lo que indicó el inicio del interferón |
| 4 | 60 | F | Un mes de evolución de episodios sincopales y hemiparesia izquierda | Tomografía de cráneo donde se observa lesión hipodensa córtico-subcortical derecha indicativa de glioblastoma, por lo que se realiza una biopsia cerebral | H&E, PAS y azul de toluidina, donde se observa lesión con componente desmielinizante extenso, astrocitosis reactiva y vasos de paredes engrosadas con luz reducida. Microglía fagocitando la mielina, linfocitos infiltrando las paredes de los vasos | Desconocido, la paciente no continuó en seguimiento | Desconocido |
| 5 | 42 | M | 5 días de evolución de paresia en el miembro superior izquierdo | Lesión redondeada, localizada en la corteza del giro poscentral del hemisferio cerebral derecho, hipointensa en T1 e hiperintensa en T2, sin edema importante, realza con el gadolinio en forma de anillo con bordes regulares | Proceso desmielinizante focal con abundantes macrófagos, preferencialmente rodeando vasos sanguíneos, axones preservados, discreto infiltrado inflamatorio linfocitario y abundantes astrocitos reactivos | Tratamiento agudo con metilprednisolona por 5 días | Recuperación completa; seguimiento a 8 años sin recaídas |
F: femenino; H&E: hematoxilina y eosina; LFB: Luxol Fast Blue; M: masculino; NAA: N-acetil-aspartato; OD: ojo derecho; RM: resonancia magnética; PAS: periodic acid shift.
Desde los años setenta y ochenta, se han descrito lesiones desmielinizantes similares a tumores cerebrales, donde el diagnóstico diferencial se hacía con biopsia cerebral3,4; más tarde, en el año 1993, Kepes5 describió a 31 pacientes, 24 con lesiones solitarias y 7 con lesiones multifocales, todos estudiados con biopsia cerebral y las cuales simulaban tumores, abscesos, quistes de neurocisticercosis, gliomas y metástasis. Esta forma de enfermedad desmielinizante se denominó seudotumoral o forma tumefacta por la apariencia en la RM. Kepes inicialmente las interpretó como una entidad intermedia entre EM y EMAD; hoy algunos autores las reconocen como variantes de la EM, pues en algunos casos se sobreponen con el contexto clínico y radiológico de una EM clásica, pero en otras ocasiones aparecen aisladas, con resolución completa y curso clínico monofásico, por lo cual todavía no hay un total acuerdo sobre su naturaleza. El trabajo de Kepes5 con sus 31 pacientes se puede considerar como «casos índices», por lo cual proponemos que estas formas sean denominadas «LDFS de Kepes», en honor a este gran neuropatólogo fallecido en febrero del 20106. Más adelante, es descrita por Lucchinetti et al.7 la serie más grande en nuestro conocimiento, presentando 168 pacientes con lesiones desmielinizantes mayores de 2cm confirmados mediante métodos histopatológicos.
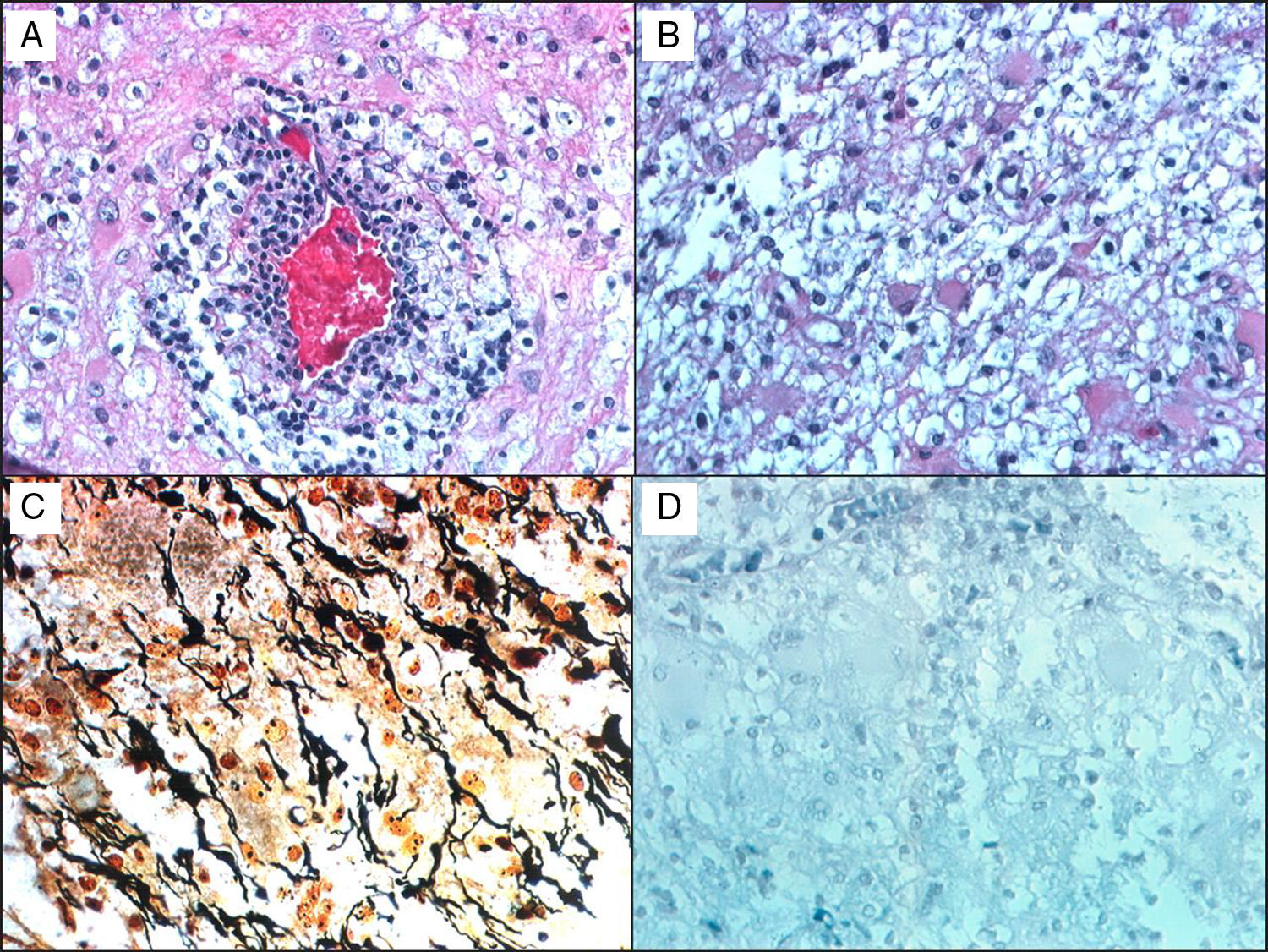
En la histología de estas lesiones se encuentra infiltrado crónico inflamatorio perivascular, mezcla de macrófagos con productos de degradación de la mielina, astrocitos reactivos, desmielinización con bordes claramente definidos y relativa preservación de los axones (fig. 1). Un proceso desmielinizante agudo puede simular la apariencia de un glioma maligno, el cual así mismo puede contener astrocitos pleomórficos, incluyendo células de Creutzfeldt; en los patrones patológicos encontrados en trastornos desmielinizantes que los hacen difíciles de diferenciar de los gliomas8, se observan: astrocitos pleomórficos, hipercelularidad, necrosis, figuras mitóticas y cambios quísticos. Estos astrocitos pleomórficos, incluyendo las formas multinucleadas o células de Creutzfeldt, pueden ser muy llamativos en las placas activas, especialmente hacia la periferia, y tienden a seguir un patrón de distribución homogéneo, contrario a lo observado en los gliomas, donde tienden a confluir, también contrario a los astrocitos neoplásicos, las células reactivas no se caracterizan por un núcleo hipercromático. Los macrófagos, a su vez, pueden ser confundidos con astrocitos u oligodendroglía, también reflejando proceso infiltrativo tumoral, por lo cual se requieren tinciones de inmunohistoquímica, como anti-HAM 56 y CD68, que tiñen los macrófagos, junto con tinciones para mielina para evidenciar el proceso desmielinizante (fig. 1).
Paciente de 38 años, masculino, con cuadro de cefalea y vértigo; se ordena RM, que reporta múltiples lesiones frontales y temporales derechas en ganglios basales, periventriculares, cuerpo calloso y radiación óptica, con hiperintensidad central en secuencia T2, aspecto quístico, realce anular con gadolinio. Examen neurológico normal. Biopsia evaluada por el Dr. Kepes (Kansas) y por Gabriel Toro (Bogotá): A) H&E donde se observa vaso sanguíneo rodeado por leucocitos, a su vez rodeados por macrófagos espumosos. B) Pequeños astrocitos gemihistociticos benignos. C) Plata de Bielschowski, que muestra áreas con pérdida de la mielina y un número significante de axones preservados. D) Tinción de Weil-Weigert que muestra pérdida casi total de la mielina. Hallazgos compatibles con enfermedad desmielinizante; el paciente tiene seguimiento durante 15 años, con excelente respuesta con el interferón.
El comportamiento biológico y clínico de estos pacientes difiere de la forma aguda monofásica maligna de Marburg9 y de la de Schilder10-12. Incluso según el reporte, hay claras diferencias en el patrón evolutivo. En la serie de Kepes la mayoría tuvo un curso monofásico, pero en ocasiones pueden comportarse de forma recurrente5; es posible que el curso clínico en las formas monofásicas pudiese ser debido a la relativa integridad de los axones, a diferencia de las EM crónica, donde hay pérdida axonal marcada. En la serie de Lucchinetti et al.7, el 70% de los pacientes presentaron curso recurrente, haciendo diagnóstico definitivo de EM por criterios de McDonald después de una mediana de seguimiento de 3,9 años, con un tiempo medio para presentar un segundo ataque de 4,8 años.
El diagnóstico de este tipo de desmielinización inicialmente requería biopsia cerebral pero, a medida que han avanzado las técnicas de tomografía computarizada (TAC) y RM avanzada, se hace con menor frecuencia. A continuación, se describen las secuencias de neuroimagen útiles en este tipo de enfermedades.
La TAC simple es de utilidad en el diagnóstico diferencial con gliomas cuando se correlaciona con la RM, pues el anillo visto en la secuencia de T1 contrastada se nota isodenso, distinto del de la TAC en lesiones desmielinizantes, la cual muestra un anillo hipodenso y en ocasiones no discernible comparado con el observado en la RM en secuencias T1 contrastada y T213. La TAC contrastada puede, en ocasiones, mostrar una lesión en anillo incompleto similar al observado en la RM, como se describe más adelante14.
En las secuencias de RM convencional se encuentran grandes lesiones únicas o multifocales que usualmente no muestran efecto de masa, no hay compromiso cortical y tienen edema escaso; este último, sumado a captación en anillo incompleto en las secuencias de T1 con gadolinio, tiene un valor de p<0,0513; la zona de realce indica la zona de desmielinización activa y se dirige a la sustancia blanca, distinta de como ocurre en las lesiones tumorales o abscesos, donde generalmente el anillo es completo15. Puede, además, haber presencia de otras lesiones desmielinizantes cerebrales o en la médula cervical típicas de EM y que ayudan para el diagnóstico diferencial14. Otra técnica descrita es la secuencia gradiente de eco (T2*-w) dinámica, obtenida durante la administración por vía IV del contraste y donde pueden observarse estructuras que semejan vasos sanguíneos, los cuales emergen desde el centro de la lesión hacia una vena subependimaria, la cual generalmente está dilatada16. La sensibilidad de la TAC sumada a la RM es del 97 vs. el 73,0% para RM sola (p=0,001)13.
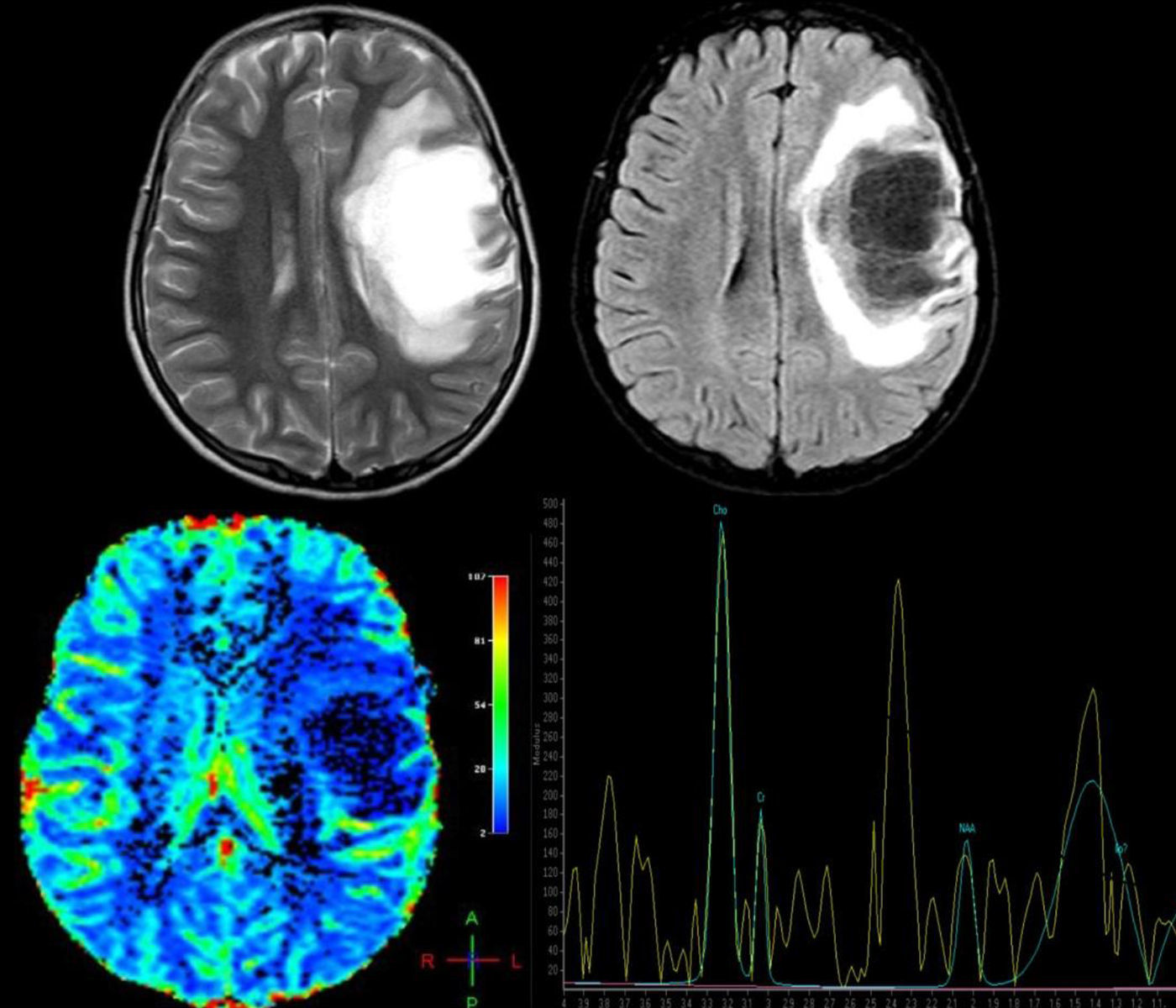
Las técnicas avanzadas de RM son igualmente útiles para el diagnóstico diferencial de estas lesiones. En la espectroscopia por RM se observa disminución del pico de N-acetil aspartato (NAA), lo cual refleja pérdida neuronal, aumento de la intensidad de resonancia del pico de colina (CHO) y lípidos (LIP), consistentes con rotura de la membrana celular y aumento del lactato (LAC), probablemente debido a isquemia secundaria al proceso inflamatorio agudo o producido por los macrófagos activados17,18. No obstante, estos hallazgos son altamente inespecíficos, por lo cual pierden validez y ha llevado a algunos autores a concluir que no es posible diferenciar entre lesiones tumorales y desmielinizantes por medio de la espectroscopia19; sin embargo, una vez el proceso desmielinizante se vuelve crónico, los picos de CHO, LIP, LAC se normalizan y el pico de NAA continua persistentemente bajo, al contrario de lo que sucede en las lesiones tumorales, donde todos los metabolitos continúan alterados, por lo cual algunos autores, en casos donde el diagnóstico no queda claro, recomiendan hacer tratamiento antiinflamatorio y espectroscopia de control para discernir entre ambos procesos17. También fue descrito por Cianfoni et al.20 un interesante hallazgo en la espectroscopia por RM con tiempo de eco corto; se observa un aumento marcado en los picos de glutamato y glutamina, los cuales no son vistos en lesiones tumorales intraaxiales y lo cual se cree sea secundario a reacción astrocitaria (fig. 2).
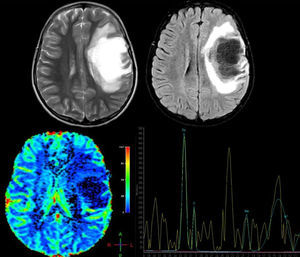
Paciente femenina de 12 años, sin antecedentes de importancia, quien presentó pérdida aguda de la visión en el ojo derecho (OD) no tratada, 4 meses después presentó afasia y hemiplejía derecha; se solicitó resonancia magnética cerebral (RM), donde se observa: arriba T2 axial y Fluid Attenuation Inversion Recovery (FLAIR) axial. Se observa lesión frontal derecha de comportamiento hiperintenso en T2, hipointenso en T1 y FLAIR con edema vasogénico adyacente y escaso efecto de masa sobre la línea media y el sistema ventricular. Hay imágenes indicativas de estructuras vasculares en el interior de la lesión; abajo, imagen de perfusión cerebral donde se observa disminución de la captación y espectroscopia por RM que demuestra pico de colina a 3,23ppm elevado (que indica un proceso de gliosis y remielinización) y un pico de N-acetil aspartato a 2,05ppm disminuido (que indica daño axonal neuronal) y pico de glutamato y glutamina a 2,4-2,5ppm, hallazgos compatibles con una forma seudotumoral de enfermedad desmielinizante. Se le realizó una biopsia cerebral y los hallazgos histopatológicos son consistentes con LDFS. Se inicia tratamiento con metilprednisolona por 5 días, seguido de un ciclo de plasmaféresis, con excelente respuesta clínica. La paciente recuperó completamente la fuerza del hemicuerpo derecho y el trastorno del lenguaje, permaneció con atrofia óptica del OD. Actualmente, con un seguimiento de un año, sin recaídas.
Otro método de gran utilidad en el diagnóstico diferencial de las lesiones neoplásicas y desmielinizantes son las técnicas de perfusión por RM; en las primeras (tanto gliomas como linfomas del SNC), debido al proceso de angiogénesis el volumen sanguíneo cerebral regional (VSCr) estará marcadamente aumentado y el tiempo de tránsito medio (TTM) se observará disminuido, al contrario de lo observado en las lesiones desmielinizantes, donde no se encuentra aumentado el VSCr, o incluso puede verse disminuido, y el TTM debe mostrarse aumentado14,16 (véase la fig. 2).
Recientemente, se informó de un caso de desmielinización tumefacta debido a neurotoxicidad por tacrolimús21 en una paciente trasplantada de hígado por un carcinoma hepatocelular; el posible mecanismo de desmielinización es mediado por inmunidad debido a un supuesto aumento de la activación de los linfocitos T. También han sido numerosos los casos de otros tipos de desmielinización sin una relación precisa, como un caso de neuritis óptica desencadenada por infección por Plasmodium falciparum22; esto denota el desconocimiento de este tipo de entidades y la variabilidad en los probables factores desencadenantes de la desmielinización.
Primero debe enunciarse que no existe información con adecuado nivel de evidencia para formular guías de manejo, dada la baja prevalencia de estos tipos de desmielinización en comparación con la EM.
El tratamiento de estas formas focales agudas de desmielinización tiene algunas similitudes y algunas diferencias con la EM. Como primera línea, siempre debe ofrecerse pulsos de metilprednisolona 1 g por vía IV cada día, por 3 a 5 días; los episodios desmielinizantes agudos del SNC se consideran no respondedores a esteroides si por lo menos 7 días después de culminar los esteroides no se presenta mejoría, por lo menos en un punto de la escala extendida de discapacidad23. Weinshenker et al.24 proponen como indicación para iniciar plasmaféresis: una mínima duración del déficit de 21 días desde el inicio, 14 días después del inicio de los esteroides por vía IV o 12 días desde el inicio del déficit si este continúa empeorando después de 5 días de la terapia con esteroides. En caso de cumplir alguno de estos estamentos, como segunda línea de tratamiento debe ofrecerse plasmaféresis, referente a la cual deben conocerse algunas particularidades. El propuesto mecanismo de acción de la plasmaféresis en estas enfermedades implica la extracción de factores patogénicos plasmáticos y humorales, lo cual sugiere que podría ser benéfica en trastornos mediados por el sistema humoral, como la EMAD, la neuromielitis óptica25,26 y la EM con patrón de desmielinización tipo ii de Lucchinetti27 (caracterizada por depósitos de inmunoglobulinas y activación del complemento). En un pequeño ensayo clínico con 10 pacientes se encontró mejoría moderada a marcada con esta terapia en este tipo de afección28; algunos autores proponen que sea el tipo de daño observado en la enfermedad de Marburg29,30. En la enfermedad de Baló, la cual sigue un patrón de desmielinización tipo iii27, y donde en su patogénesis no están implicados factores humorales, en el mismo ensayo clínico con plasmaféresis en 6 pacientes no se encontró respuesta alguna al tratamiento con esta28. Tres estudios evalúan los factores predictores de buena respuesta en trastornos desmielinizantes26,31,32; entre los factores comúnmente encontrados y con validez estadística tenemos: tratamiento temprano, corta duración de la enfermedad, reflejos osteotendinosos conservados, diagnóstico a posteriori de EM y lesiones que realzan en anillo en la RM.
Luego de esto, está menos definido el paso a seguir, simplemente se conocen informes de casos anecdóticos, refractarios a los esteroides y la plasmaféresis, donde se utilizan a largo plazo fármacos como los interferones, la ciclofosfamida33–36 y la mitoxantrona37, acompañado de manejo de soporte de las complicaciones inherentes a este tipo de compromiso severo y extenso, como la hipertensión endocraneal.
ConclusionesLas LDFS exigen urgentemente todo esfuerzo que ayude a enriquecer el conocimiento que de ellas tenemos hasta ahora, máxime por sus diferencias de comportamiento con otros trastornos desmielinizantes.
En general, las formas monofásicas seudotumorales tienen un pronóstico aceptable y en algunos casos excelente, a diferencia de las formas recurrentes y de las formas agresivas e incluso fatales, como la tipo Marburg.
En la mayoría de ellas se llega al diagnóstico con el cuadro clínico y las neuroimágenes que, como vimos, tienen un papel de suma importancia, resaltando el realce en anillo incompleto, la restricción periférica a la difusibilidad, el realce venular, la presencia de glutamato en la espectroscopia por RM y la ausencia de incremento en el flujo sanguíneo cerebral en las imágenes de perfusión por RM; sin embargo, su diagnóstico inequívoco requiere la biopsia cerebral.
No existe información con nivel adecuado de evidencia para formular guías de manejo de estas afecciones menos conocidas de la mielina, por lo tanto, el tratamiento de estas formas de desmielinización es similar a los reportados en EM clásica durante el periodo de recaída; como primera línea, se utilizan los esteroides a dosis altas, en caso de no haber respuesta a estos, se recurre a la plasmaféresis y, en algunos casos refractarios, se han utilizado otros inmunosupresores, como ciclofosfamida o mitoxantrona.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.