Se ha comunicado la asociación de ictus isquémico y COVID-19, con mayor frecuencia en aquellos pacientes más graves. Sin embargo, se desconoce en qué medida podría estar en relación con la inflamación sistémica y la hipercoagulabilidad producidas en el contexto de la infección.
MétodosDescripción de 4pacientes atendidos en nuestro centro por ictus isquémico y diagnóstico de COVID-19, clasificándolos según el grado de probabilidad causal entre el estado de hipercoagulabilidad y el ictus isquémico. Revisión de la literatura sobre los posibles mecanismos implicados en la etiopatogenia del ictus isquémico en este contexto.
ResultadosDos pacientes se consideraron con alta probabilidad causal: presentaban infartos corticales, sin enfermedad cardioembólica ni arterial significativa, con parámetros de inflamación sistémica e hipercoagulabilidad; las otras 2pacientes eran de edad avanzada y el ictus isquémico se consideró cardioembólico, con una probable asociación casual de COVID-19.
ConclusionesLa inflamación sistémica, junto con la posible acción directa del virus, provocaría disfunción endotelial, generando un estado de hipercoagulabilidad que podría considerarse una causa potencial de ictus isquémico. Sin embargo, puesto que los mecanismos del ictus pueden ser múltiples, se precisan estudios más amplios que evalúen esta hipótesis. Mientras tanto, el estudio etiológico del ictus en pacientes con COVID-19 debe ser sistemático atendiendo a los protocolos vigentes, con las adaptaciones necesarias en relación con las circunstancias clínicas y epidemiológicas de la actual pandemia.
Ischaemic stroke has been reported in patients with COVID-19, particularly in more severe cases. However, it is unclear to what extent this is linked to systemic inflammation and hypercoagulability secondary to the infection.
MethodsWe describe the cases of 4 patients with ischaemic stroke and COVID-19 who were attended at our hospital. Patients are classified according to the likelihood of a causal relationship between the hypercoagulable state and ischaemic stroke. We also conducted a review of studies addressing the possible mechanisms involved in the aetiopathogenesis of ischaemic stroke in these patients.
ResultsThe association between COVID-19 and stroke was probably causal in 2 patients, who presented cortical infarcts and had no relevant arterial or cardioembolic disease, but did show signs of hypercoagulability and systemic inflammation in laboratory analyses. The other 2 patients were of advanced age and presented cardioembolic ischaemic stroke; the association in these patients was probably incidental.
ConclusionsSystemic inflammation and the potential direct action of the virus may cause endothelial dysfunction, resulting in a hypercoagulable state that could be considered a potential cause of ischaemic stroke. However, stroke involves multiple pathophysiological mechanisms; studies with larger samples are therefore needed to confirm our hypothesis. The management protocol for patients with stroke and COVID-19 should include a complete aetiological study, with the appropriate safety precautions always being observed.
En pacientes con enfermedad por coronavirus (CoV)-2019 (COVID-19) se ha descrito la presencia de manifestaciones neurológicas1, entre las cuales se encuentra el ictus isquémico2,3. En una serie de 214 pacientes con COVID-19 hospitalizados en la ciudad china de Wuhan, el 2,8% presentó ictus isquémico, el 5,7% en el subgrupo de 88 pacientes con enfermedad más grave, los cuales presentaban niveles de dímero-D más elevados de forma significativa, planteándose el estado protrombótico como posible etiología del ictus2. En un registro llevado a cabo por la Sociedad Española de Neurología4, el ictus isquémico fue la segunda condición neurológica recogida con más frecuencia (22,8%), solo por debajo del síndrome confusional (28,3%). En una publicación reciente, se comunicaron 3 pacientes con COVID-19 que presentaron ictus isquémico y que, además de las manifestaciones analíticas típicas de inflamación sistémica y dímero-D elevado, asociaban anticuerpos antifosfolípidos5.
Con los datos disponibles actualmente, no queda claro en qué medida podría existir una relación de causalidad entre el estado protrombótico asociado a COVID-19 y el ictus isquémico. Con el fin de contribuir a dilucidar esta cuestión, presentamos una serie de 4pacientes atendidos en nuestro centro por ictus isquémico y COVID-19, además de realizar una revisión de la literatura al respecto.
MétodosDescripción de 4pacientes consecutivos con ictus isquémico y COVID-19 atendidos entre el 25 de marzo y el 17 de abril del 2020 en un hospital de referencia. Debido a la situación de pandemia por CoV 2 del síndrome respiratorio agudo grave (SARS-CoV-2), la información a los pacientes o a sus representantes legales, así como la aceptación del consentimiento informado, se realizó verbalmente por vía telefónica, tras la aprobación por el Comité Ético de Investigación Clínica de Granada.
Se recogieron los siguientes grupos de variables: demográficas/basales; relacionadas con la clínica al ingreso y con la COVID-19; relacionadas con el ictus isquémico; parámetros de laboratorio en el momento del ictus y evolución clínica. La etiología del ictus se estimó siguiendo los criterios del sistema de clasificación Ensayo de Org-10172 como Tratamiento del Ictus Agudo (Trial Org-10172 Acute Stroke Treatment [TOAST])6. Los pacientes se clasificaron según el «grado de causalidad» estimado entre el estado de hipercoagulabilidad asociado a COVID-19 y el ictus.
A propósito de los casos descritos, realizamos una revisión bibliográfica sobre la posible relación causal del ictus isquémico con la infección por SARS-CoV-2.
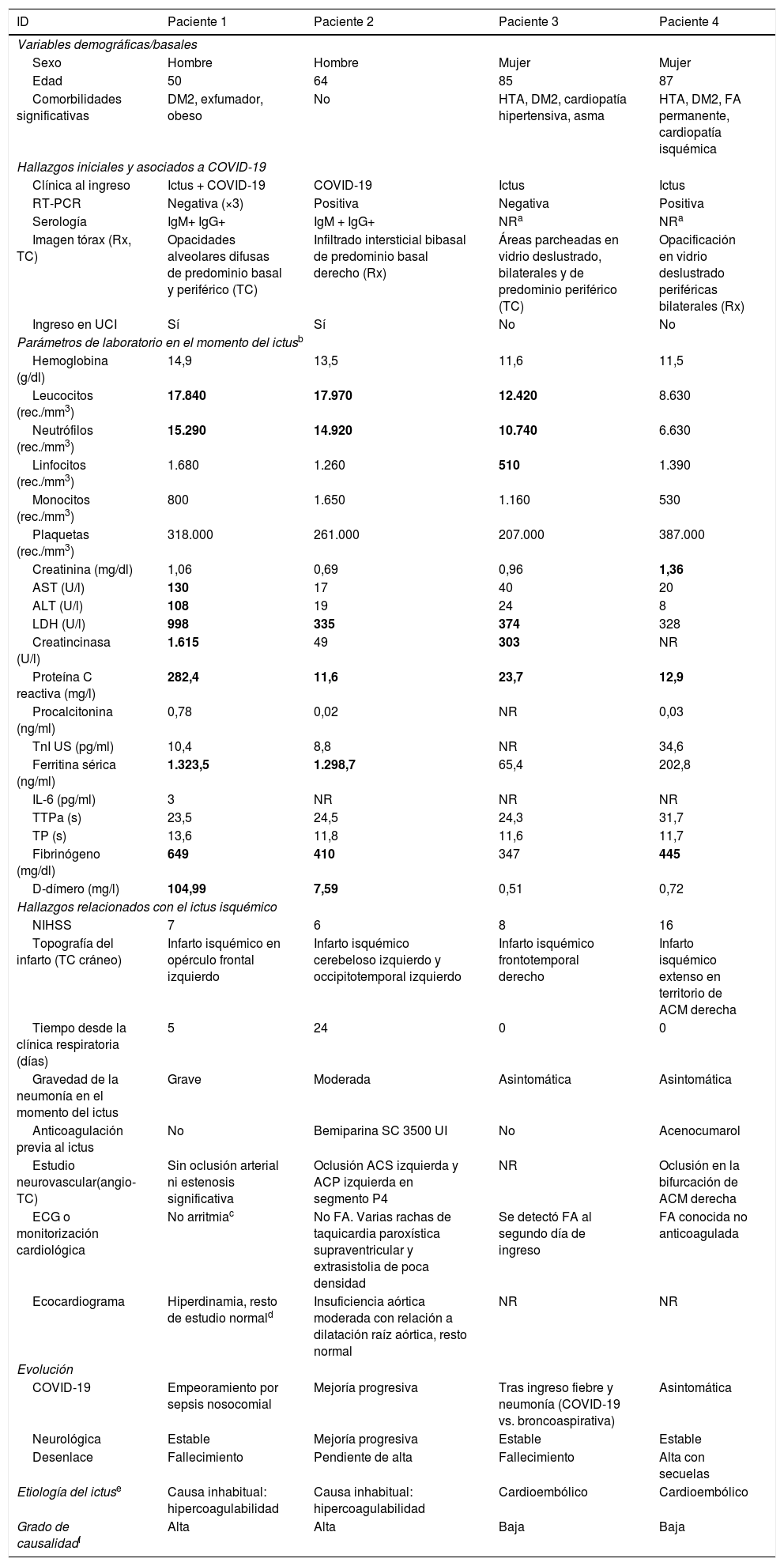
ResultadosEn la tabla 1 se exponen los datos clínicos y complementarios de los 4pacientes incluidos (véanse también figuras 1-3 y la descripción de los casos en el anexo). Se incluye también la etiología del ictus según los criterios TOAST y el «grado de causalidad» estimado entre el estado de hipercoagulabilidad asociado a COVID-19 y el ictus isquémico.
Variables descriptivas de los pacientes con ictus isquémico y COVID-19
| ID | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 |
|---|---|---|---|---|
| Variables demográficas/basales | ||||
| Sexo | Hombre | Hombre | Mujer | Mujer |
| Edad | 50 | 64 | 85 | 87 |
| Comorbilidades significativas | DM2, exfumador, obeso | No | HTA, DM2, cardiopatía hipertensiva, asma | HTA, DM2, FA permanente, cardiopatía isquémica |
| Hallazgos iniciales y asociados a COVID-19 | ||||
| Clínica al ingreso | Ictus + COVID-19 | COVID-19 | Ictus | Ictus |
| RT-PCR | Negativa (×3) | Positiva | Negativa | Positiva |
| Serología | IgM+ IgG+ | IgM + IgG+ | NRa | NRa |
| Imagen tórax (Rx, TC) | Opacidades alveolares difusas de predominio basal y periférico (TC) | Infiltrado intersticial bibasal de predominio basal derecho (Rx) | Áreas parcheadas en vidrio deslustrado, bilaterales y de predominio periférico (TC) | Opacificación en vidrio deslustrado periféricas bilaterales (Rx) |
| Ingreso en UCI | Sí | Sí | No | No |
| Parámetros de laboratorio en el momento del ictusb | ||||
| Hemoglobina (g/dl) | 14,9 | 13,5 | 11,6 | 11,5 |
| Leucocitos (rec./mm3) | 17.840 | 17.970 | 12.420 | 8.630 |
| Neutrófilos (rec./mm3) | 15.290 | 14.920 | 10.740 | 6.630 |
| Linfocitos (rec./mm3) | 1.680 | 1.260 | 510 | 1.390 |
| Monocitos (rec./mm3) | 800 | 1.650 | 1.160 | 530 |
| Plaquetas (rec./mm3) | 318.000 | 261.000 | 207.000 | 387.000 |
| Creatinina (mg/dl) | 1,06 | 0,69 | 0,96 | 1,36 |
| AST (U/l) | 130 | 17 | 40 | 20 |
| ALT (U/l) | 108 | 19 | 24 | 8 |
| LDH (U/l) | 998 | 335 | 374 | 328 |
| Creatincinasa (U/l) | 1.615 | 49 | 303 | NR |
| Proteína C reactiva (mg/l) | 282,4 | 11,6 | 23,7 | 12,9 |
| Procalcitonina (ng/ml) | 0,78 | 0,02 | NR | 0,03 |
| TnI US (pg/ml) | 10,4 | 8,8 | NR | 34,6 |
| Ferritina sérica (ng/ml) | 1.323,5 | 1.298,7 | 65,4 | 202,8 |
| IL-6 (pg/ml) | 3 | NR | NR | NR |
| TTPa (s) | 23,5 | 24,5 | 24,3 | 31,7 |
| TP (s) | 13,6 | 11,8 | 11,6 | 11,7 |
| Fibrinógeno (mg/dl) | 649 | 410 | 347 | 445 |
| D-dímero (mg/l) | 104,99 | 7,59 | 0,51 | 0,72 |
| Hallazgos relacionados con el ictus isquémico | ||||
| NIHSS | 7 | 6 | 8 | 16 |
| Topografía del infarto (TC cráneo) | Infarto isquémico en opérculo frontal izquierdo | Infarto isquémico cerebeloso izquierdo y occipitotemporal izquierdo | Infarto isquémico frontotemporal derecho | Infarto isquémico extenso en territorio de ACM derecha |
| Tiempo desde la clínica respiratoria (días) | 5 | 24 | 0 | 0 |
| Gravedad de la neumonía en el momento del ictus | Grave | Moderada | Asintomática | Asintomática |
| Anticoagulación previa al ictus | No | Bemiparina SC 3500 UI | No | Acenocumarol |
| Estudio neurovascular(angio-TC) | Sin oclusión arterial ni estenosis significativa | Oclusión ACS izquierda y ACP izquierda en segmento P4 | NR | Oclusión en la bifurcación de ACM derecha |
| ECG o monitorización cardiológica | No arritmiac | No FA. Varias rachas de taquicardia paroxística supraventricular y extrasistolia de poca densidad | Se detectó FA al segundo día de ingreso | FA conocida no anticoagulada |
| Ecocardiograma | Hiperdinamia, resto de estudio normald | Insuficiencia aórtica moderada con relación a dilatación raíz aórtica, resto normal | NR | NR |
| Evolución | ||||
| COVID-19 | Empeoramiento por sepsis nosocomial | Mejoría progresiva | Tras ingreso fiebre y neumonía (COVID-19 vs. broncoaspirativa) | Asintomática |
| Neurológica | Estable | Mejoría progresiva | Estable | Estable |
| Desenlace | Fallecimiento | Pendiente de alta | Fallecimiento | Alta con secuelas |
| Etiología del ictuse | Causa inhabitual: hipercoagulabilidad | Causa inhabitual: hipercoagulabilidad | Cardioembólico | Cardioembólico |
| Grado de causalidadf | Alta | Alta | Baja | Baja |
ACM: arteria cerebral media; ACP: arteria cerebral posterior; ACS: arteria cerebelosa superior; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; COVID-19: enfermedad por coronavirus-2019; DM2: diabetes mellitus de tipo 2; ECG: electrocardiograma; FA: fibrilación auricular; HTA: hipertensión arterial; IgM: inmunoglobulina M; IgG: inmunoglobulina G; IL-6: interleucina-6; LDH: lactato deshidrogenasa; NIHSS: escala de ictus de los Institutos Nacionales de la Salud de EE. UU.; NR: no realizado; RT-PCR: reacción en cadena de la polimerasa con transcripción inversa; Rx: radiografía; TC: tomografía computarizada; TnI US: troponina ultrasensible; TOAST: Ensayo de Org 10172 como Tratamiento del Ictus Agudo; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado; UCI: Unidad de Cuidados Intensivos.
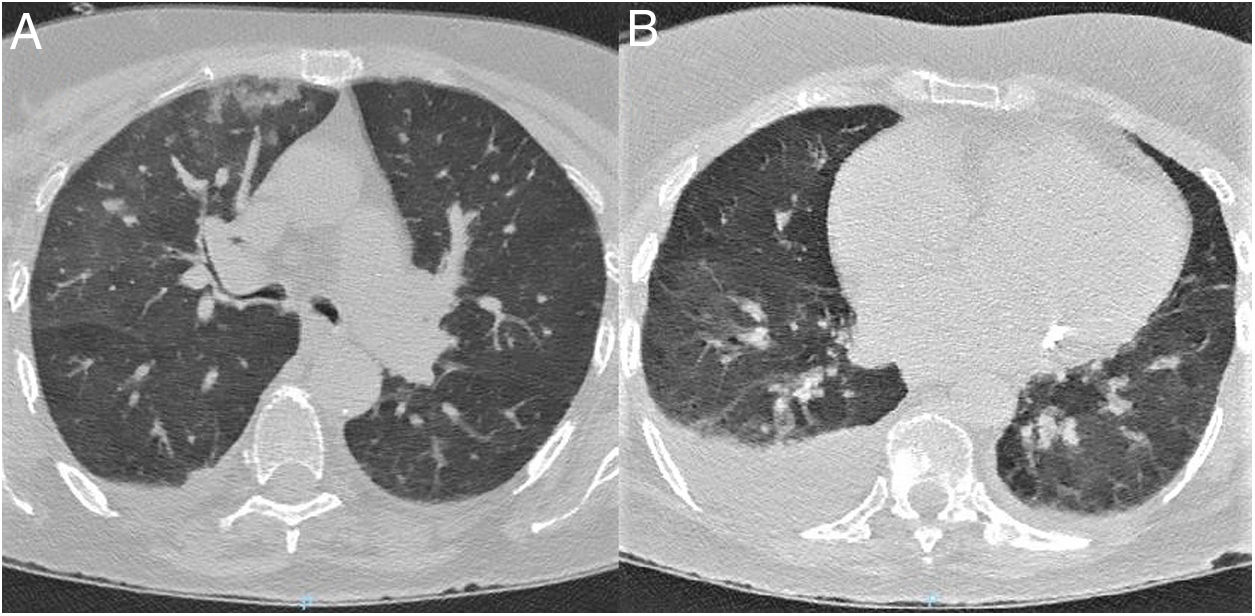
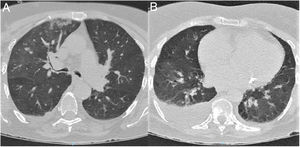
TC de tórax al ingreso. A) Corte a nivel de lóbulos superiores. B) Corte a nivel de lóbulos inferiores. Se observan opacificaciones en vidrio deslustrado bilaterales de predominio derecho. Presentan distribución central y sobre todo periférica. También existen consolidaciones parenquimatosas que afectan al lóbulo superior derecho, así como un derrame pleural derecho moderado.
La COVID-19 aguda tiene 3 fases: infecciosa temprana, pulmonar e hiperinflamatoria grave7-9. En algunos pacientes la respuesta inflamatoria continúa y se amplifica enormemente, provocando una tormenta de citocinas y gran participación de linfocitos T10, con elevación de marcadores como interleucina 6 (IL-6), ferritina y proteína C reactiva, asociados a mayor mortalidad11. La tormenta de citocinas provoca disfunción endotelial9,12-14, que, a su vez, podría verse favorecida por la invasión directa de las células endoteliales por el virus, a través de la interacción entre la proteína de espícula S y los receptores de la enzima conversora de la angiotensina II (ECA II), expresados en el endotelio capilar15. La disfunción endotelial produce un aumento en la síntesis de trombina y una disminución de la fibrinólisis que contribuyen a un estado protrombótico, lo cual justifica la alta tasa de complicaciones trombóticas observada en series de pacientes con COVID-198,16. De este modo, la elevación del dímero-D en estos pacientes se ha propuesto como marcador de hipercoagulabilidad y mal pronóstico11,17.
Respecto al ictus como complicación trombótica, se ha planteado el estado de hipercoagulabilidad como mecanismo etiopatogénico al observarse niveles de dímero-D más elevados en pacientes con COVID-19 grave2,13. Dicha posibilidad ya se postuló en la epidemia del Coronavirus del síndrome respiratorio agudo grave (SARS-CoV) de 2002-2004, al observarse la aparición de ictus isquémico en pacientes de edad no muy avanzada, con escasos factores de riesgo vascular y enfermedad severa16. Aquel CoV comparte con el actual SARS-CoV-2 la afinidad por ECA II7. Recientemente, se han comunicado 3pacientes con COVID-19 grave e ictus isquémicos, en los cuales se detectaron anticuerpos antifosfolípidos y alteraciones analíticas compatibles con inflamación sistémica y coagulopatía5. Además de caracterizar el síndrome antifosfolipídico primario, dichos anticuerpos se han detectado en enfermedades inflamatorias sistémicas e infecciones virales, asociándose a un mayor riesgo de complicaciones tromboembólicas18. Asimismo, en pacientes con COVID-19 grave hay que contemplar la posibilidad de otros mecanismos etiopatogénicos de ictus isquémico, como cardioembolias secundarias a daño miocárdico o mecanismo hemodinámico secundario a shock séptico o cardiogénico16. La microangiopatía asociada a disfunción endotelial se ha postulado también como mecanismo de isquemia19.
Entre nuestros pacientes (tabla 1), el 1 y el 2 se incluyeron en el grupo de alta probabilidad causal, pues presentaban parámetros analíticos de inflamación sistémica e hipercoagulabilidad, así como un estudio etiológico sin otra causa evidente que justificase el ictus isquémico. El paciente 1 presentó un infarto cortical sin enfermedad arterial significativa y en ausencia de cardiopatía embolígena. En el paciente 2, el ictus ocurrió mientras se encontraba ingresado, a pesar de estar en tratamiento con heparina a dosis profilácticas. Como se ha mencionado en observaciones previas, estos hallazgos respaldan la hipótesis del estado de hipercoagulabilidad como etiología del ictus isquémico en pacientes con COVID-19 con coagulopatía significativa2,5. Sin embargo, debemos tener en cuenta que los mecanismos del ictus isquémico pueden ser múltiples y complejos, más aún en pacientes con situación cardiorrespiratoria comprometida. Debemos destacar que, debido a la situación de pandemia actual, en muchas ocasiones se retrasan o no pueden llevarse a cabo todas las pruebas de estudio etiológico20. Debido a ello, son necesarios documentos de consenso y adaptaciones de los protocolos vigentes de atención al ictus, como la reciente publicación de las Recomendaciones Plan Ictus Madrid21.
Las pacientes 3 y 4 se incluyeron en el grupo de baja causalidad por varios motivos. Tenían en común la edad avanzada, múltiples comorbilidades, el hallazgo casual de la infección COVID-19 y la etiología más probable del ictus fue cardioembólica. En ambos casos, el inicio clínico fue neurológico, sin evidencia de infección por SARS-CoV-2 en el momento del ictus. La descripción de estos casos remarca que la coexistencia de ictus isquémico en pacientes con COVID-19 no siempre implica una relación causal, por lo que el diagnóstico de infección por SARS-CoV-2 no debe limitar el estudio etiológico de ictus isquémico20,21.
En pacientes con COVID-19 que precisen ingreso hospitalario, se ha recomendado la anticoagulación profiláctica con heparina, con incremento de la dosis en pacientes críticos y con alto riesgo trombótico13,22. En un reciente estudio, se observó una menor mortalidad en pacientes tratados con dosis profilácticas de heparina que presentaban un dímero-D elevado por encima de 6 veces su límite normal (> 3mg/l) y una puntuación de coagulopatía inducida por sepsis (SIC) mayor o igual a 4 puntos13. Esta puntuación incluye el tiempo de protrombina, el recuento plaquetario y la escala Evaluación del fallo orgánico secuencial (SOFA), y ha sido propuesta como un método de identificación precoz de coagulación intravascular diseminada asociada a sepsis23. Sin embargo, en casos de ictus isquémico en pacientes con infección por SARS-CoV-2 con coagulopatía y respuesta hiperinflamatoria, el tratamiento precoz con heparina a dosis intermedias o terapéuticas resulta controvertido, debido al riesgo asociado de transformación hemorrágica24. De hecho, actualmente no hay evidencia para recomendar la anticoagulación precoz20,24, por lo que la decisión se debe individualizar teniendo en cuenta la presencia de estado protrombótico o inflamación sistémica, la extensión del ictus isquémico y el balance riesgo-beneficio.
No debemos pasar por alto las limitaciones que presenta nuestro estudio: la serie de pacientes descrita es pequeña; la experiencia escasa en la atención a pacientes con ictus isquémico y COVID-19, y la problemática relacionada con el manejo diagnóstico-terapéutico que implica la pandemia por SARS-CoV-2; a lo cual se añade la escasa evidencia científica disponible respecto al conocimiento del ictus isquémico en pacientes con COVID-19.
ConclusionesEl estado de hipercoagulabilidad asociado a la respuesta hiperinflamatoria desencadenada por COVID-19 se podría considerar una causa potencial de ictus isquémico. Sin embargo, puesto que los mecanismos etiopatogénicos implicados pueden ser múltiples y complejos, se precisan estudios más amplios que evalúen esta hipótesis, así como el papel del daño endotelial producido por la invasión directa del virus. Mientras tanto, el estudio etiológico del ictus en pacientes con COVID-19 debe ser sistemático y atendiendo a los protocolos vigentes, con las adaptaciones necesarias en relación con las circunstancias clínicas y epidemiológicas de la actual pandemia. Actualmente, no existe evidencia para recomendar la anticoagulación precoz tras un ictus isquémico en pacientes con COVID-19 y parámetros de hipercoagulabilidad. Son necesarios más estudios, idealmente en forma de ensayos clínicos, que aporten evidencias más sólidas sobre la indicación de anticoagulación en estos pacientes. Entretanto, debemos valorar el balance riesgo-beneficio de forma individualizada.
FinanciaciónLa presente investigación no ha recibido financiación ni ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores de este estudio declaran no tener ningún conflicto de intereses.
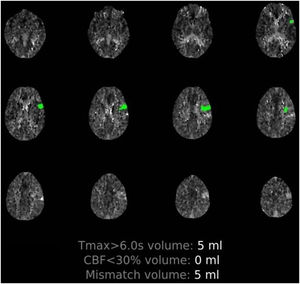
Paciente 1: hombre de 50 años, con varias comorbilidades (tabla 1), que inició bruscamente con alteración del lenguaje, precedida de 5días de fiebre, tos y disnea. En la exploración en el servicio de Urgencias presentaba fiebre y clínica respiratoria hipoxemiante, asociada a una disfasia motora y una paresia facial supranuclear derecha. En el estudio de imagen, se detectó una hipoperfusión en el territorio distal de la arteria cerebral media (ACM) izquierda (fig. 1) y una tomografía computarizada (TC) de tórax con hallazgos compatibles con neumonía por COVID-19. Se trató con fibrinólisis por intravenosa e ingresó en la Unidad de Cuidados Intensivos (UCI) para vigilancia neurológica y respiratoria. En los análisis de sangre se detectaron parámetros analíticos asociados a inflamación sistémica y dímero-D muy elevados (tabla 1). Aunque 3estudios sucesivos de reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) fueron negativos (2 en exudado nasofaríngeo y uno en lavado broncoalveolar), el estudio serológico confirmó positividad de inmunoglobulina M (IgM) e inmunoglobulina G (IgG) para SARS-CoV-2. La evolución clínica fue desfavorable, falleciendo 12días tras el inicio neurológico en el contexto de sepsis grave nosocomial.
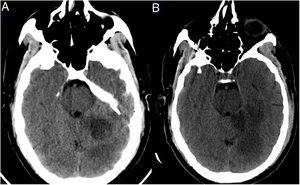
Paciente 2: hombre de 64 años de edad, sin comorbilidades significativas, ingresado por insuficiencia respiratoria con resultado positivo para SARS-CoV-2 en la RT-PCR. Al inicio precisó ingreso en la UCI y oxigenoterapia nasal de alto flujo, continuando el seguimiento clínico en planta tras constatarse mejoría respiratoria. Doce días tras el ingreso, presentó alteración del habla, mareo y vómitos, objetivándose a la exploración un nistagmo horizontorrotatorio, disartria inteligible y dismetría de las extremidades izquierdas. Se solicitó una TC craneal multimodal urgente que mostró una oclusión distal de la arteria cerebelosa superior izquierda y una oclusión de la arteria cerebral posterior izquierda en su segmento P4 (fig. 2). Se desestimó fibrinólisis por vía intravenosa al encontrarse fuera de ventana terapéutica. Posteriormente, se amplió el estudio etiológico del ictus, detectándose positividad para anticuerpos IgG beta-2-glucoproteína (27 U/ml; valores normales 0-10 U/ml), con anticuerpos anticardiolipina negativos. El paciente comenzó tratamiento rehabilitador respiratorio y neurológico, con evolución clínica favorable.
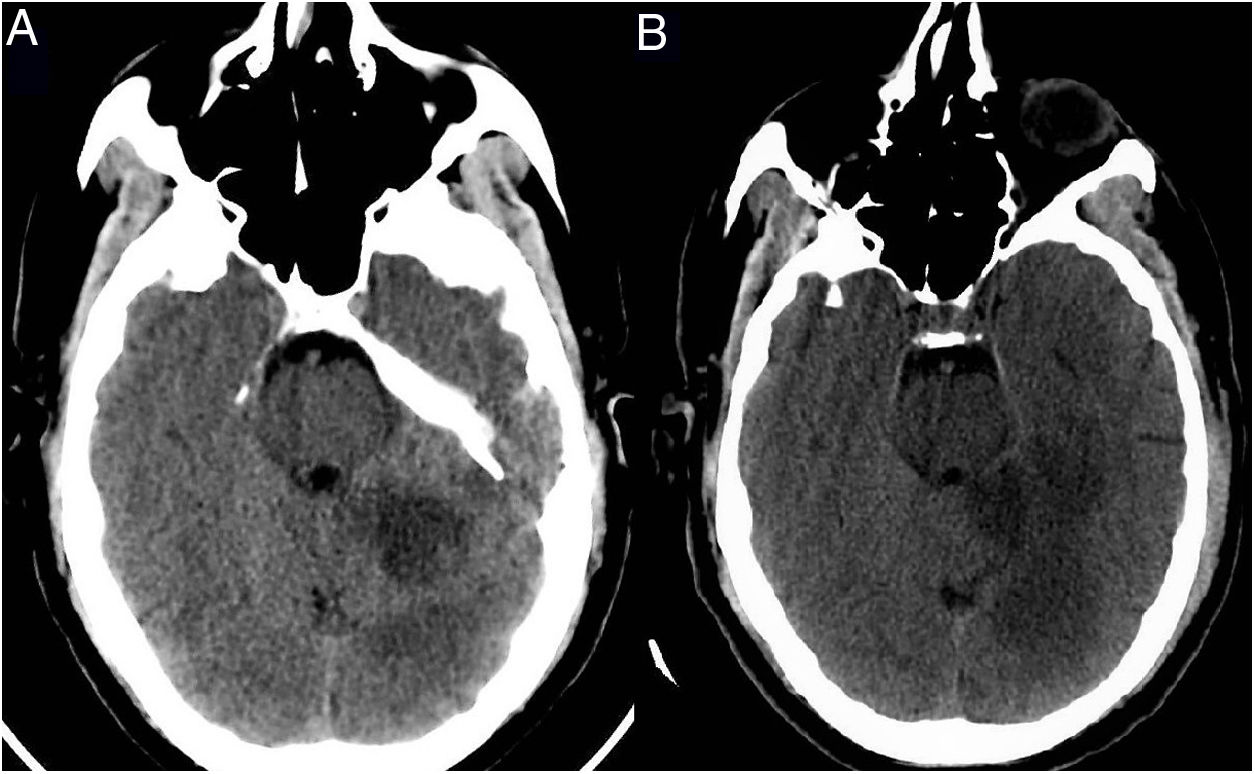
Paciente 3: mujer de 85 años de edad con comorbilidades significativas (tabla 1), que fue encontrada en su domicilio con debilidad de las extremidades izquierdas. Los familiares negaban sintomatología neurológica o infecciosa en los días previos. En Urgencias se encontraba afebril y sin clínica respiratoria, con disartria, anosognosia, hemianopsia homónima izquierda y hemiparesia leve de extremidades izquierdas. En la TC craneal se objetivó un infarto isquémico subagudo hemisférico derecho y en la TC de tórax un patrón sugerente de COVID-19 (fig. 3). El estudio RT-PCR en exudado nasofaríngeo fue negativo. Tras 2días de ingreso, se detectó una fibrilación auricular (FA) y posteriormente empeoró, presentando fiebre y hallazgos de neumonía, con evolución clínica, analítica y radiológica compatible con COVID-19. Falleció finalmente por insuficiencia respiratoria refractaria a tratamiento.
Paciente 4: mujer de 87 años de edad, con FA permanente sin tratamiento anticoagulante por incumplimiento terapéutico y otras comorbilidades significativas (tabla 1). Derivada al hospital por clínica compatible con ictus hemisférico derecho, observándose en la TC craneal multimodal una oclusión de la ACM derecha. Durante su estancia en Urgencias, se detectó fiebre, con estudio de RT-PCR positivo para SARS-CoV-2 en exudado nasofaríngeo. Posteriormente, la paciente tuvo una evolución favorable durante su ingreso, siendo dada de alta con reinicio de anticoagulación.