Describir las características basales y procedimentales asociadas al desarrollo de infarto estriatocapsular aislado (IECa) tras la trombectomía mecánica en los pacientes con oclusión de gran vaso de la circulación anterior, así como su pronóstico.
MétodosEstudio longitudinal en el que se identificaron los pacientes tratados con trombectomía mecánica en nuestro centro entre 2015 y 2017 y se dividieron en 2 grupos en función de la existencia o no de un IECa (grupo IECa y grupo nIECa) en la TC de control a las 24h.
ResultadosDe los 83 pacientes tratados con trombectomía mecánica, un 22,9% desarrollaron un IECa. No hubo diferencias estadísticamente significativas en cuanto a las características basales ni en cuanto a los tiempos de reperfusión. Los pacientes con IECa tuvieron mejor colateralidad y mejores tasas de reperfusión en el análisis bivariante. No hubo diferencias en la mortalidad al alta ni a los 3 meses, ni en el pronóstico funcional a los 3 meses.
ConclusionesAunque se consiga una reperfusión exitosa, el IECa es una secuela frecuente e independiente del tiempo de reperfusión, especialmente en aquellos pacientes con buena colateralidad.
To describe baseline and procedural characteristics and clinical outcomes of isolated striatocapsular infarct (iSCI) after mechanical thrombectomy in patients with large-vessel occlusion of the anterior cerebral circulation andits clinical outcome.
MethodsWe performed a longitudinal study including all patients treated with mechanical thrombectomy at our centre between 2015 and 2017; patients were divided into 2 groups (iSCI and non-iSCI) according to whether they presented iSCI in a control CT scan at 24h.
ResultsOf the 83 patients identified, 22.9% developed an iSCI. There were no statically significant differences in baseline characteristics or in reperfusion times. Patients presenting iSCI showed better collateral circulation and better reperfusion rates in the bivariate analysis. No significant difference was observed for mortality at discharge or at 3 months, or for functional prognosis at 3 months.
ConclusionsEven if successful reperfusion is achieved, iSCI is a common sequela, independently of reperfusion time, especially in patients with good collateral circulation.
El área estriatocapsular está compuesta por un conjunto de estructuras anatómicamente independientes pero fisiológicamente relacionadas entre sí, entre las que se encuentra el núcleo caudado, el putamen, la cápsula interna y el globo pálido. Además, estas estructuras están altamente conectadas anatómica y funcionalmente con la corteza cerebral, el diencéfalo y el troncoencéfalo, y, de modo conjunto, desempeñan un amplio abanico de funciones (control de movimientos, aprendizaje, cognición, memoria y leguaje, entre otras), por lo que lesiones circunscritas al área estriatocapsular pueden causar multitud de disfunciones neurológicas y comportarse clínicamente como lesiones extensas con afectación cortical, pudiendo resultar sumamente incapacitantes1. La irrigación del área estriatocapsular corre a cargo de un conjunto de arterias entre las que destacan la arteria recurrente de Heubner (rama de la arteria cerebral anterior) y las arterias lenticuloestriadas (ramas de la arteria cerebral media [ACM] en su segmento M1)2. A diferencia de la región cortical, no reciben irrigación de ramas colaterales y no se anastomosan con otras arterias2–4. Este hecho hace que sea una región especialmente vulnerable a la isquemia.
La trombectomía mecánica (TM) constituye un nuevo paradigma en el tratamiento del ictus agudo causado por una oclusión de una arteria de gran calibre de la circulación anterior. Sin embargo, debido a la ausencia de irrigación colateral profunda ya descrita, la capacidad de la TM para salvar el tejido isquémico de la región estriatocapsular tiene sus limitaciones cuando existe un bloqueo proximal a la salida de las arterias lenticuloestriadas2,5.
El objetivo del presente estudio consiste en analizar la prevalencia del infarto estriatocapsular aislado (IECa) en los pacientes que recibieron TM, evaluar las características basales y los parámetros procedimentales asociados a esta entidad, así como describir su pronóstico funcional.
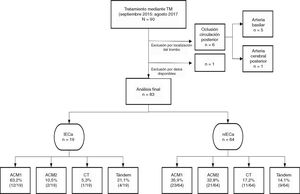
Sujetos y métodosSe realizó un estudio longitudinal en el que se recogieron de manera prospectiva todas las TM (con o sin fibrinólisis intravenosa) realizadas entre septiembre de 2015 y agosto de 2017 en nuestro centro (hospital de referencia y único con disponibilidad de TM en Aragón), provenientes de nuestro propio centro o de los diferentes hospitales de nuestra comunidad autónoma. Se incluyeron en el estudio aquellos pacientes con diagnóstico de ictus por oclusión de la arteria carótida interna intracraneal, la ACM proximal en su segmento M1 o M2 y oclusión en tándem (oclusión simultánea de la arteria carótida interna extracraneal y la ACM ipsilateral). Del mismo modo, se excluyeron aquellos que recibieron TM por una oclusión de la circulación posterior. Se identificaron aquellos pacientes en los que se visualizó un IECa en la TC de control a las 24h y se realizó un análisis descriptivo de la población a estudio.
A continuación, se realizó un análisis comparativo en el que se estableció como grupo de casos (grupo IECa) aquellos pacientes en los que tras la TM se visualizó un IECa en la TC cerebral de control, y como grupo control (grupo nIECa), aquellos donde no se evidenció este hallazgo radiológico. Comparamos estadísticamente las características basales (edad, sexo, hipertensión, diabetes, dislipidemia, tabaco, alcohol, fibrilación auricular, enfermedad carotidea previa, NIHSS de base, uso de fibrinólisis intravenosa, ictus de hora desconocida) y las características procedimentales (tiempos de reperfusión, grado de colateralidad y grado de reperfusión).
Para analizar el pronóstico (mortalidad intrahospitalaria, mortalidad a los 3 meses y pronóstico funcional a los 3 meses) se excluyeron del grupo nIECa tanto aquellos pacientes sin lesión evidenciable en la TC de control como aquellos con un infarto maligno, ya que ambos tienen características pronósticas claramente diferenciadas. De esta manera, se analizó comparativamente el grupo IECa con respecto a cada uno de los subgrupos definidos:
- •
Grupo IECa vs. grupo nIECa restante ([IECa+cortical]+lesión cortical aislada).
- •
Grupo IECa vs. (IECa+cortical).
- •
Grupo IECa vs. lesión cortical aislada.
Se definió IECa como una región hipodensa circunscrita al territorio estriatocapsular, objetivada en la TC cerebral de control (24h post-TM), que midiese más de 20mm de diámetro y sin afectación de ninguna otra área cerebral, y reperfusión exitosa como aquella con una puntuación TICI de 2b o 3. Los pacientes con un TICI 0/1 se consideraron como «reperfusión fallida». Para analizar la colateralidad se utilizó la escala Tan modificada6, según la cual se definió como «buena colateralidad» aquella con una puntuación de 2-3 y «colateralidad excelente» como aquella con una puntuación de 3. Los tiempos de reperfusión utilizados fueron el tiempo desde el inicio de los síntomas hasta la reperfusión (TISR) y desde el inicio de los síntomas hasta la punción inguinal (TISI). Para medir el pronóstico funcional se utilizó la Escala de Rankin modificada (mRS), y se definió como pronóstico favorable una puntuación≤2.
Análisis de datosLos datos fueron procesados utilizando los paquetes estadísticos de SPSS 16 y Office 2007. Para analizar la normalidad de las variables cuantitativas se utilizó la prueba de Kolmogorov-Smirnov. Para aquellas variables cuantitativas con distribución normal se usó la media aritmética y la desviación típica como medidas de tendencia central y de dispersión, respectivamente. Se utilizó la prueba t de Student para el análisis inferencial. Para analizar aquellas variables cuantitativas con distribución no normal se utilizó la mediana como medida de tendencia central, el rango intercuartílico como medida de dispersión y la prueba U de Mann-Whitney para el análisis inferencial. Las variables cualitativas se expresaron en frecuencias y porcentajes, y se compararon mediante la prueba de chi cuadrado en el análisis inferencial. El nivel de significación se fijó a priori en p<0,05. Se realizó un análisis multivariante mediante regresión logística binaria en el que se incluyeron aquellas variables estadísticamente significativas en el análisis bivariante y aquellas que se pensó que podían tener una influencia significativa en la variable dependiente.
ResultadosEstudio poblacionalSe obtuvo un total de 83 pacientes tratados mediante TM, de los cuales un 45,8% (38/83) fueron hombres. La mediana de edad fue de 74 (65-82) años y la mediana del NIHSS basal fue de 17 (13-21). La mediana del TISI y del TISR fue de 240 (158-285,7) y 315 (240-367,5) min, respectivamente. En un 23,4% (18/77) el comienzo de los síntomas fue de hora desconocida y un 65,8%(54/82) recibió, además de TM, tratamiento mediante fibrinólisis intravenosa (rtPA iv). Un 85,5% (71/83) comenzó clínicamente como infarto completo de la circulación anterior.
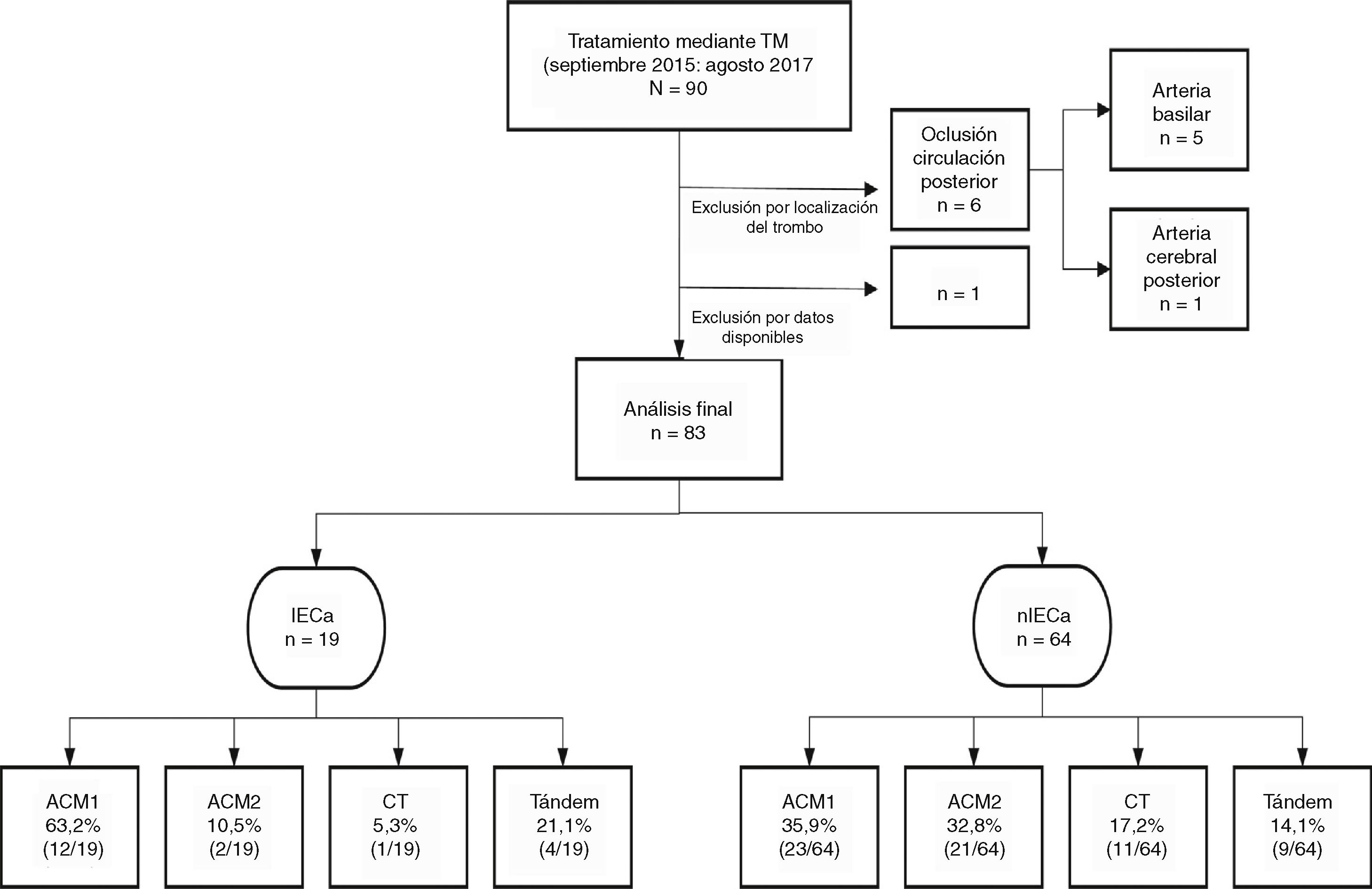
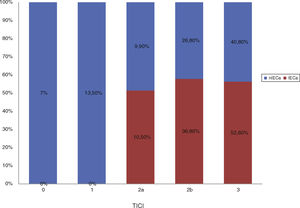
Del total de la muestra se identificó un IECa en un 22,9%(19/83) en la TC de control a las 24h. En cuanto a la localización del trombo, en la mayoría de los pacientes que desarrollaron un IECa estaba en la ACM, en su segmento M1 (63,1%), como se muestra en la figura 1.
Distribución de la muestra en función de la localización del trombo.
ACM1: arteria cerebral media, segmento M1; ACM2: arteria cerebral media, segmento M2; CT: carótida terminal; IECa: infarto estriatocapsular aislado; nIECa: no infarto estriatocapsular aislado; TM: Trombectomía mecánica.
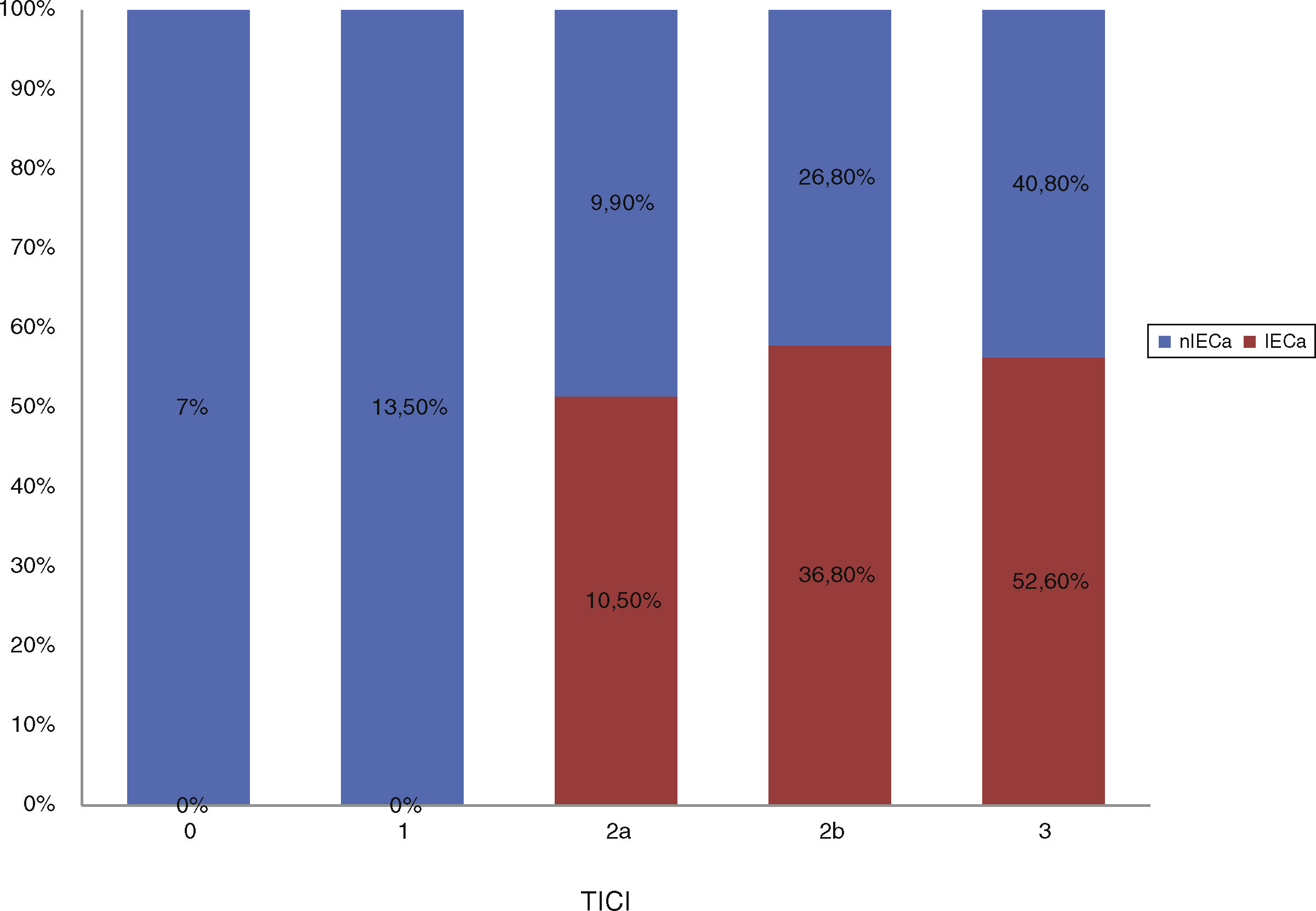
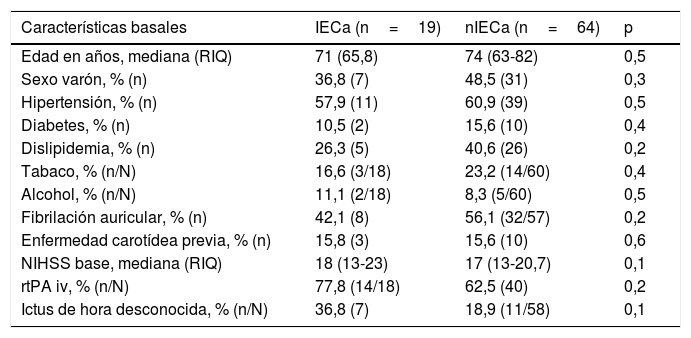
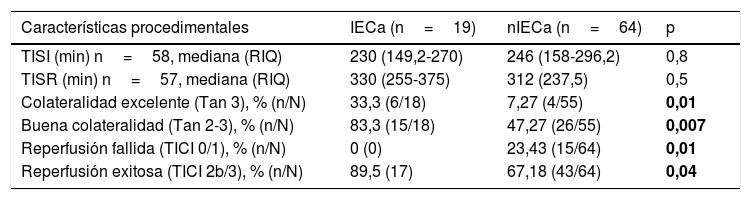
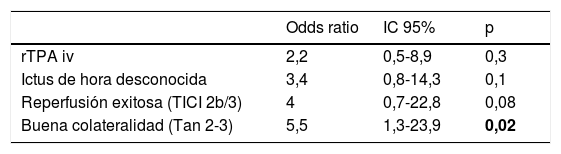
No hubo diferencias estadísticamente significativas entre las características basales de ambos grupos, como se muestra en la tabla 1. Comparando las características procedimentales (tabla 2), observamos que los pacientes con IECa tienen significativamente mejores tasas de reperfusión exitosa (TICI 2b/3: 89,5 vs. 67,2%; p=0,04) y un mayor grado de colateralidad (Tan 2-3: 83,3 vs. 47,3%; p<0,01; y Tan 3: 33,3 vs. 7,27%; p=0,007). No se observó ningún IECa en aquellos pacientes en los que no se consiguió ningún grado de reperfusión (TICI 0/1: 0 vs. 23,4%; p=0,013), como muestra la figura 2. La administración de fibrinolítico no difirió entre ambos grupos de un modo significativo (77,8 vs. 62.5%; p=0,2). El IECa fue algo más frecuente en los ictus de hora desconocida del inicio de los síntomas (36,8 vs. 18,9%; p=0,1), con tendencia a la significación en el análisis multivariante (OR 3,4; IC 95% 0,8-14,3; p=0,08). El TISI y el TISR tampoco diferían entre ambos grupos (mediana 240 vs. 246min y mediana 330 y 312min para IECa vs. nIECa, respectivamente). El análisis multivariante por regresión logística mostró que la buena colateralidad (Tan 2-3; OR 5,5; IC 95% 13-23,2) se asociaba a IECa; sin embargo, no se asoció la reperfusión exitosa (TICI 2b/3; OR 4; IC 95% 0,7-22,8; p=0,1), como se muestra en la tabla 3.
Características basales
| Características basales | IECa (n=19) | nIECa (n=64) | p |
|---|---|---|---|
| Edad en años, mediana (RIQ) | 71 (65,8) | 74 (63-82) | 0,5 |
| Sexo varón, % (n) | 36,8 (7) | 48,5 (31) | 0,3 |
| Hipertensión, % (n) | 57,9 (11) | 60,9 (39) | 0,5 |
| Diabetes, % (n) | 10,5 (2) | 15,6 (10) | 0,4 |
| Dislipidemia, % (n) | 26,3 (5) | 40,6 (26) | 0,2 |
| Tabaco, % (n/N) | 16,6 (3/18) | 23,2 (14/60) | 0,4 |
| Alcohol, % (n/N) | 11,1 (2/18) | 8,3 (5/60) | 0,5 |
| Fibrilación auricular, % (n) | 42,1 (8) | 56,1 (32/57) | 0,2 |
| Enfermedad carotídea previa, % (n) | 15,8 (3) | 15,6 (10) | 0,6 |
| NIHSS base, mediana (RIQ) | 18 (13-23) | 17 (13-20,7) | 0,1 |
| rtPA iv, % (n/N) | 77,8 (14/18) | 62,5 (40) | 0,2 |
| Ictus de hora desconocida, % (n/N) | 36,8 (7) | 18,9 (11/58) | 0,1 |
IECa: infarto estriatocapsular aislado; nIECa: no infarto estriatocapsular aislado; NIHSS: National Institute of Health Stroke Scale; RIQ: rango intercuartílico; rtPA iv: activador recombinante del plasminógeno tisular intravenoso.
Características procedimentales
| Características procedimentales | IECa (n=19) | nIECa (n=64) | p |
|---|---|---|---|
| TISI (min) n=58, mediana (RIQ) | 230 (149,2-270) | 246 (158-296,2) | 0,8 |
| TISR (min) n=57, mediana (RIQ) | 330 (255-375) | 312 (237,5) | 0,5 |
| Colateralidad excelente (Tan 3), % (n/N) | 33,3 (6/18) | 7,27 (4/55) | 0,01 |
| Buena colateralidad (Tan 2-3), % (n/N) | 83,3 (15/18) | 47,27 (26/55) | 0,007 |
| Reperfusión fallida (TICI 0/1), % (n/N) | 0 (0) | 23,43 (15/64) | 0,01 |
| Reperfusión exitosa (TICI 2b/3), % (n/N) | 89,5 (17) | 67,18 (43/64) | 0,04 |
Negrita: valores p < 0,05 con significación estadística.
IECa: infarto estriatocapsular aislado; nIECa: no infarto estriatocapsular aislado; RIQ: rango intercuartílico; TICI: Thrombolysis in Cerebral Infarction; TISI: tiempo inicio de síntomas-punción inguinal; TISR: tiempo inicio de síntomas-reperfusión.
Análisis multivariante mediante regresión logística binaria
| Odds ratio | IC 95% | p | |
|---|---|---|---|
| rTPA iv | 2,2 | 0,5-8,9 | 0,3 |
| Ictus de hora desconocida | 3,4 | 0,8-14,3 | 0,1 |
| Reperfusión exitosa (TICI 2b/3) | 4 | 0,7-22,8 | 0,08 |
| Buena colateralidad (Tan 2-3) | 5,5 | 1,3-23,9 | 0,02 |
Negrita: valores p < 0,05 con significación estadística.
IC 95%: intervalo de confianza al 95%; rTPA iv: activador recombinante del plasminógeno tisular intravenoso; TICI: Thrombolysis in Cerebral Infarction.
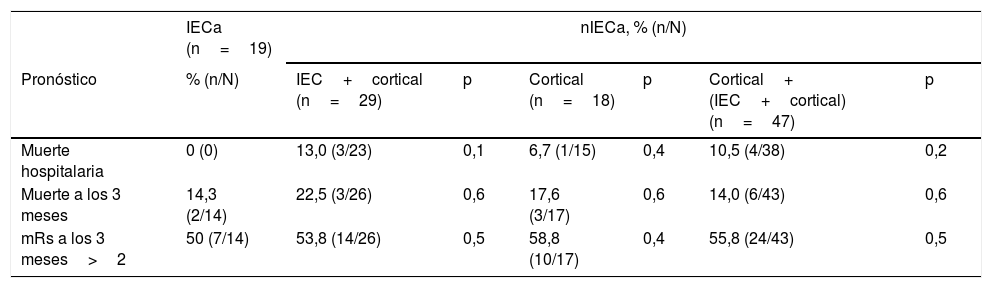
No hubo diferencias estadísticamente significativas en cuanto a la mortalidad al alta, la mortalidad a los 3 meses o el mRs a los 3 meses comparando el grupo IECa con los demás subgrupos (tabla 4).
Resultados
| IECa (n=19) | nIECa, % (n/N) | ||||||
|---|---|---|---|---|---|---|---|
| Pronóstico | % (n/N) | IEC+cortical (n=29) | p | Cortical (n=18) | p | Cortical+ (IEC+cortical) (n=47) | p |
| Muerte hospitalaria | 0 (0) | 13,0 (3/23) | 0,1 | 6,7 (1/15) | 0,4 | 10,5 (4/38) | 0,2 |
| Muerte a los 3 meses | 14,3 (2/14) | 22,5 (3/26) | 0,6 | 17,6 (3/17) | 0,6 | 14,0 (6/43) | 0,6 |
| mRs a los 3 meses>2 | 50 (7/14) | 53,8 (14/26) | 0,5 | 58,8 (10/17) | 0,4 | 55,8 (24/43) | 0,5 |
IECa: infarto estriatocapsular aislado; mRs: Escala de Rankin modificada; nIECa: no infarto estriatocapsular aislado.
El IECa se define como aquel infarto isquémico mayor de 20mm de diámetro en el territorio irrigado por más de una arteria lenticuloestriada7.
Aunque la enfermedad ateroesclerótica de la ACM puede dar lugar a IECa en un número pequeño de casos, estos infartos se producen fundamentalmente por un bloqueo simultáneo de múltiples arterias perforantes vecinas. La causa de este bloqueo es una oclusión en la ACM proximal, en la carótida interna terminal, o por una oclusión en tándem que compromete el flujo de las arterias lenticuloestriadas4.
De este modo, los IECa difieren patogénicamente de los infartos lacunares, ya que estos últimos se producen por la oclusión de una única arteria lenticuloestriada, fundamentalmente por lipohialinosis ateroesclerótica, produciendo un infarto de un tamaño≤15mm de diámetro6. En nuestra muestra de IECa, hasta en un 89,5% de los mismos el trombo se localizó en alguna de las localizaciones descritas, y tan solo en 2 casos (10,5%) el trombo se localizó en el segmento M2 de la ACM, si bien pensamos que dicho trombo pudo migrar distalmente después de infartar la región estriatocapsular.
Antes del advenimiento de las terapias de reperfusión en la atención del ictus agudo, los IECa se observaban en un número pequeño de casos (desde un 0,01 a un 6%, según registros)1,4. Este hecho se debe a que para que se forme un IECa es necesaria una reperfusión exitosa que salve de la isquemia a la corteza cerebral y evite un infarto completo.
El tratamiento mediante fibrinólisis intravenosa tiene sus limitaciones en las oclusiones de arteria de gran calibre4,8,9, y es en estas situaciones en las que la TM ha revolucionado la atención del ictus agudo, siendo más eficaz que la fibrinólisis intravenosa aislada10–14. Al obtener mayores tasas de reperfusión con la TM, es de esperar que se asocie con más frecuencia al IECa (hasta en un 22,9% en nuestra muestra).
Asimismo, la TM tiene sus limitaciones en salvar la isquemia del área estriatocapsular cuando se produce un bloqueo proximal a la salida de las arterias lenticuloestriadas4. Esto se debe a que la región estriatocapsular es muy vulnerable a la isquemia por su escasa irrigación colateral, a diferencia de la región cortical periférica2–4. Debido precisamente a esa falta de colateralidad, la isquemia de la región estriatocapsular depende fundamentalmente de la localización del trombo, con la subsiguiente involucración de las arterias perforantes2,5. Sin embargo, la preservación de la región periférica cortical dependerá tanto del grado de colateralidad como del tiempo de reperfusión, previniendo de esta manera el desarrollo de infarto cortical antes de que dichas colaterales claudiquen.
Nuestro estudio muestra una fuerte asociación entre el grado de colateralidad y el desarrollo de IECa en los pacientes sometidos a TM por una oclusión de la circulación anterior, lo que cuadra con la patogénesis del IECa y con la literatura previa4.
La asociación entre reperfusión exitosa (TICI 2b/3) y el IECa fue significativa en el análisis bivariante. Además, no se encontró ningún caso de IECa entre aquellos pacientes con una reperfusión fallida (TICI 0/1), ya que estas personas tuvieron infartos completos con afectación cortical, siendo la reperfusión necesaria para el desarrollo de un IECa.
Por tanto, un paciente con un bloqueo proximal a la salida de las arterias lenticuloestriadas desarrollará un IECa si el tejido cerebral periférico se preserva por el sistema de colateralidad y si hay una liberación del bloqueo, ya sea de manera espontánea, por rtPA iv, TM o ambas.
No se encontró asociación estadística significativa entre los tiempos de reperfusión (TISI y TISR) y la aparición de IECa, como ya había sido descrito previamente4. Este hecho pone de relevancia la importancia de la colateralidad en preservar la penumbra cortical mediante un proceso de «todo o nada», en el que los pacientes sin suficiente colateralidad verán su tejido cortical infartado antes de conseguir la reperfusión, y aquellos con una buena colateralidad aguantarán más en el tiempo, pudiendo desarrollar en última instancia un IECa si se bloquea el flujo de las arterias lenticuloestriadas de manera prolongada. De esta manera, sabemos que el volumen del infarto no depende exclusivamente del tiempo, sino también de la competencia de la circulación colateral15.
Esta independencia de los tiempos de reperfusión en el desarrollo de IECa tiene que ver con los hallazgos descritos en los ensayos clínicos DAWN y DEFUSE 3, en los que pacientes seleccionados con una buena colateralidad (crecimiento lento del infarto) pueden beneficiarse de la TM más allá de las 6h desde el inicio de los síntomas16,17. Esto nos lleva a pensar que, tras aumentar la ventana temporal en este tipo de pacientes seleccionados, presenciaremos un aumento en la incidencia de IECa, cobrando esta entidad cada vez más relevancia.
El IECa fue algo más frecuente en aquellos pacientes con ictus de hora de inicio desconocida, con cierta tendencia a la significación estadística en el análisis multivariante. Este hecho también puede tener relación con los hallazgos de los ensayos clínicos anteriormente mencionados y con que estos pacientes, seleccionados en nuestro centro por una TC de perfusión, mantengan viable su tejido periférico gracias al sistema de irrigación colateral, lo que permitirá que este sea salvable incluso traspasando la ventana terapéutica clásica de las 6h.
Desde el punto de vista pronóstico no se encontraron diferencias estadísticamente significativas en cuanto a la mortalidad al alta, la mortalidad a los 3 meses o el mRs a los 3 meses, comparando el grupo IECa con los demás subgrupos.
Aunque los pacientes con un IECa se asocian a una mayor tasa de reperfusión exitosa que permite preservar todo el neocórtex cerebral, nuestros datos reflejan un pronóstico similar entre los diferentes grupos. Esto podría deberse a la compleja conectividad de las estructuras que engloban el área estriatocapsular con la corteza cerebral y el tálamo, lo que hace que lesiones circunscritas a esta región puedan causar multitud de síntomas neurológicos. De este modo, aunque salvemos un área cerebral importante mediante las terapias de reperfusión cerebral, las secuelas del IECa pueden llegar a ser incapacitantes y, en ocasiones, pueden comportarse como lesiones extensas con afectación cortical o, también, causar diferentes disfunciones neuropsicológicas1,18. Este último hecho cobra especial relevancia sabiendo que aproximadamente la mitad de los pacientes que sufren un ictus agudo y presentan un buen resultado funcional muestran alteraciones cognitivas y depresión a los 3 años del mismo, hecho no valorado en la mRs19.
Nuestro estudio presenta algunas limitaciones. En primer lugar, tiene las limitaciones características de un estudio con diseño retrospectivo. En segundo lugar, el tamaño muestral es pequeño, lo que limita su potencia estadística. Por último, aunque somos conscientes de que la resonancia magnética cerebral es más sensible que la TC en la detección de posibles infartos que sobrepasen el territorio estriatocapsular, la disponibilidad de recursos en nuestro medio hace que no se posible realizarla de manera precoz a los pacientes estudiados.
ConclusionesLa incidencia del IECa en aquellos pacientes que reciben TM en las oclusiones de arteria de gran calibre de la circulación anterior no es desdeñable y es superior a la descrita en series previas a las nuevas estrategias de reperfusión cerebral.
La gran sensibilidad a la isquemia de la región estriatocapsular hace que se formen infartos estriatocapsulares en las oclusiones proximales de la circulación anterior, a pesar de ser adecuadamente reperfundidas, sobre todo en aquellos pacientes que son capaces de mantener su tejido cortical viable gracias a la consistencia de su circulación colateral. La penumbra cortical de estos pacientes se mantendrá de manera prolongada en el tiempo, por lo que la formación de un IECa no depende de los tiempos de reperfusión, una vez que dicha región se ha infartado.
Además, es importante señalar que el IECa puede llegar a ser tan incapacitante como un infarto completo, a pesar de reperfundir toda la corteza cerebral, por lo que conseguir la reperfusión antes de que la región estriatocapsular se infarte es esencial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.