La enfermedad de Alzheimer (EA) produce un deterioro cognitivo progresivo que conlleva la pérdida de independencia para las actividades de la vida diaria, siendo la rivastigmina uno de los fármacos utilizados para su tratamiento sintomático.
ObjetivoEvaluar el manejo terapéutico con distintas formas galénicas de rivastigmina, en sujetos con EA en la práctica clínica habitual.
Pacientes y métodosEstudio transversal, multicéntrico realizado en consultas españolas de Geriatría, Psiquiatría y Neurología, en sujetos con EA de leve a moderadamente grave que recibían rivastigmina. Se recogieron datos sobre el modo de uso de rivastigmina oral (RO) y transdérmica (RTD), el cumplimiento terapéutico (grado de adherencia) y la satisfacción del cuidador.
ResultadosSe evaluaron 2.252 sujetos con edad media de 77,2 años; 60,2% mujeres. El 58,4% presentaban EA moderada-moderadamente grave. El 54,4% habían iniciado el tratamiento con RO y el 45,6% con RTD; el 35,6% de aquellos con RO cambiaron a la vía transdérmica. El 77,5% con RTD requirió un solo ajuste de dosis vs. 11,8% con RO. El 80,8% de los sujetos con RTD alcanzaron la dosis máxima de rivastigmina (vs. 57,1% RO) en menos tiempo (51,6 vs. 205,8 días). El cumplimiento fue mayor con RTD (60,5 vs. 47,2%) así como el porcentaje de cuidadores satisfechos con el tratamiento (89,4 vs.81,9%).
ConclusionesEn la práctica clínica habitual, la RTD facilita la dosificación y mejora el cumplimiento, permitiendo a un mayor porcentaje de sujetos alcanzar la dosis máxima recomendada de rivastigmina en un plazo de tiempo menor.
Alzheimer disease (AD) causes progressive cognitive decline leading to loss of independence for activities of daily living; rivastigmine is one of the drugs used for symptomatic management.
ObjectiveTo assess the therapeutic use of different pharmaceutical forms of rivastigmine in patients with AD in normal clinical practice.
Patients and methodsCross-sectional, observational, multi-centre study conducted on patients with mild to moderate AD treated with rivastigmine in Spanish outpatient clinics specialising in Geriatrics, Psychiatry, and Neurology. Data regarding use of oral (OR) and transdermal (TDR) rivastigmine, compliance (degree of adherence), and caregiver satisfaction with treatment were evaluated.
ResultsIn total, 2252 patients with a mean age of 77.2 years were included; 60.2% were women. AD was moderate to moderately severe in 58.4%. Rivastigmine treatment was started orally in 54.4% of the patients and transdermally in 45.6%; 35.6% of those who started treatment by the OR route switched to TDR. A single dose adjustment was sufficient for 77.5% of patients on TDR treatment vs 11.8% of patients receiving OR treatment. More patients on TDR treatment (80.8% vs. 57.1% on OR treatment) reached the maximum therapeutic dose of rivastigmine and did so in a shorter period of time (51.6 vs 205.8 days). Compliance rates (60.5% vs 47.2%) and caregivers’ satisfaction with treatment (89.4% vs 81.9%) were also higher for TDR.
ConclusionsIn normal clinical practice, using the TDR route of administration improves dose titration and drug compliance, allowing more patients to reach the maximum recommended dose of rivastigmine in a shorter time period.
La enfermedad de Alzheimer (EA) representa hoy día la causa de demencia más frecuente, con la presencia de trastornos cognitivos, que progresan hacia el deterioro de otras funciones mentales e incapacidad para realizar las actividades de la vida diaria, y de síntomas psicológicos y conductuales1,2.
Para su manejo farmacológico específico solo se dispone de tratamientos sintomáticos: los inhibidores de la colinesterasa (rivastigmina, galantamina y donepezilo), indicados en la EA leve a moderadamente grave, y la memantina, indicada en la EA moderada a grave. La rivastigmina mejora el estado cognitivo y la funcionalidad de los pacientes con EA, y reduce los síntomas psicológicos y conductuales3–6.
La rivastigmina fue comercializada inicialmente para su uso por vía oral (cápsulas o solución) y más recientemente en forma transdérmica (parches), siendo la exposición media al fármaco similar para ambas formas galénicas. No obstante, la concentración plasmática durante 24h de rivastigmina oral (RO) muestra un pico cada 12h mientras que la de rivastigmina transdérmica (RTD) es más sostenida en el tiempo7,8, lo cual puede ofrecer algunas ventajas en la práctica clínica habitual.
La eficacia, seguridad y tolerabilidad de la administración de RTD ha sido demostrada9,10, sin que se encontraran diferencias en cuanto a la eficacia entre las vías de administración oral y transdérmica. Sin embargo, se observaron con mayor frecuencia trastornos gastrointestinales con la administración de RO11, siendo la presencia de náuseas y vómitos 3 veces mayor en la RO que en la RTD, concluyendo así que la tolerabilidad de la RTD era mejor que la RO.
El cumplimiento terapéutico es fundamental para que una terapia sea eficaz, especialmente en las enfermedades crónicas. Una de la mejores estrategias para optimizar el cumplimiento terapéutico es simplificar los regímenes, mediante la utilización de vías de administración más cómodas o reduciendo el número de tomas al día; especialmente en pacientes de edad avanzada y/o con demencia12,13. En patologías como la EA, en la que el paciente debido a sus deficiencias cognitivas y trastornos neuropsiquiátricos depende en muchos casos de su cuidador para el seguimiento del tratamiento, la administración transdérmica puede facilitar el cumplimiento terapéutico14.
Aunque la RTD ofrece ventajas teóricas, hay pocos datos que avalen si estas ventajas se traducen de alguna forma en la práctica clínica habitual. El presente estudio pretendió obtener información acerca del manejo terapéutico de pacientes tratados con rivastigmina en las 2 formulaciones disponibles actualmente (oral y transdérmica), analizando la forma en que se ajusta la dosis, el cumplimiento terapéutico y la satisfacción de los cuidadores.
Pacientes y métodosEstudio transversal, observacional y multicéntrico, realizado en consultas ambulatorias de Geriatría, Psiquiatría y Neurología de toda España. Cada investigador debía incluir a 10 pacientes ambulatorios consecutivos de ambos sexos con diagnóstico de EA según DSM-IV-TR15, con edad igual o superior a 18 años; en estadio de leve a moderadamente grave (Mini Mental State Examination de Folstein≥10)16, que estuvieran recibiendo tratamiento con RO o RTD a dosis estables al menos en los 3 meses previos a la inclusión en el estudio, que hubiesen otorgado su consentimiento informado. Cada investigador debía incluir a 5 sujetos en tratamiento con RO y 5 con RTD.
Se calculó el tamaño de la muestra en función de los resultados del estudio TRAIN17, estimándose una muestra a reclutar de 1.587 sujetos con cada tratamiento, previendo por tanto la inclusión de un total de 3.174 sujetos.
Cada investigador recogió los datos en una única visita a partir de la historia clínica del paciente y mediante entrevista al cuidador, recogiendo datos sociodemográficos, antecedentes patológicos y clínicos, y la historia de tratamiento con rivastigmina (desde el inicio del tratamiento hasta la visita del estudio: vía de administración, dosis, ajustes y cambios de vías realizados durante la subida de dosis).
Se evaluó el cumplimiento terapéutico mediante el test de Morisky-Green18 y la satisfacción del cuidador habitual con el tratamiento mediante un cuestionario ad hoc, similar al del estudio KAPPA19, de 4 preguntas sobre: 1) la facilidad de uso del tratamiento, 2) la facilidad de seguimiento de la pauta de administración, 3) la frecuencia con la que el tratamiento interfiere en la vida diaria del cuidador y 4) la satisfacción global con el tratamiento. Las preguntas 1, 2 y 4 tenían 4 categorías de respuesta: 2 favorables como «muy fácil/muy satisfecho» y «fácil/satisfecho» y 2 desfavorables como «difícil/insatisfecho» y «muy difícil/muy insatisfecho». La pregunta 3 tenía 5 categorías de respuestas: «siempre», «la mayoría de las veces», «algunas veces», «raras veces» y «nunca», siendo consideradas como desfavorables las 3 primeras categorías. Para la evaluación de la satisfacción del cuidador se agruparon las respuestas en favorables versus desfavorables.
Las variables categóricas se describieron mediante frecuencias absolutas y relativas, y las variables continuas con la media, la desviación estándar, la mediana y el intervalo (mínimo y máximo), incluyendo el número total de valores válidos para cada parámetro. Los subgrupos de sujetos se compararon utilizando la prueba U de Mann-Whitney para las variables cuantitativas; y con la prueba de Chi-cuadrado para las variables cualitativas. Los análisis estadísticos se realizaron con el paquete estadístico SAS para Windows versión 9.1.3, aplicando pruebas bilaterales con un nivel de significación 0,05.
El protocolo fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Ramón y Cajal de Madrid.
ResultadosDescripción de la muestraEntre marzo y septiembre de 2009, 268 investigadores incluyeron a 2.708 sujetos de los que 2.252 resultaron válidos para el análisis estadístico. Los 456 sujetos restantes fueron excluidos del análisis por incumplimiento de algún criterio de selección, especialmente al no recibir dosis estables de rivastigmina en los últimos 3 meses.
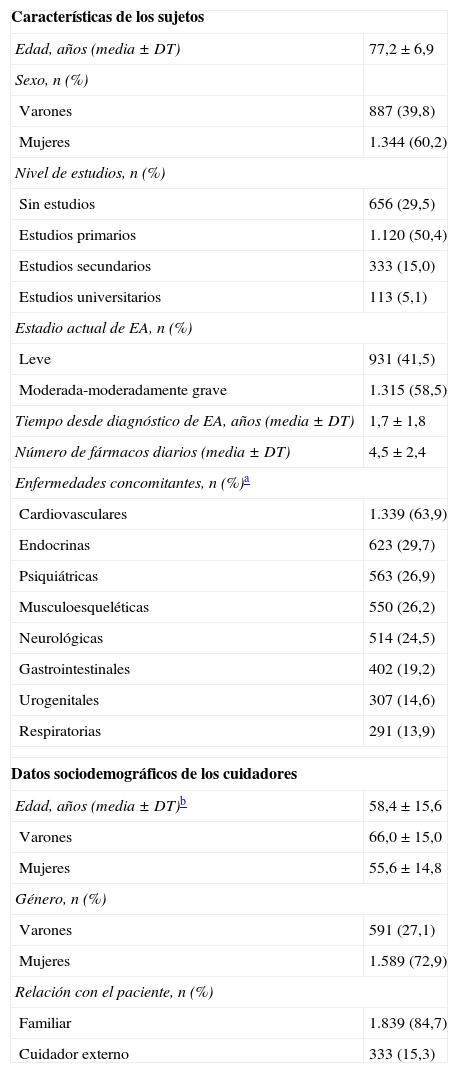
En cuanto a las características sociodemográficas y clínicas de los sujetos (tabla 1), más de la mitad eran mujeres, con una media de edad significativamente mayor que la de los varones (77,6±6,8 años vs. 76,7±6,9 años; prueba U de Mann-Whitney; p=0,0004). El 55,8% estaban casados o vivían en pareja y un 37,7% eran viudos. Casi todos vivían acompañados (95,1%) frente a un 4,9% que lo hacían solos. La mayoría de los sujetos que vivían acompañados lo hacían en familia (78,1%), un 11,7% en residencias y un 5,8% con un cuidador externo. El 58,5% presentaban EA moderada-moderadamente grave y el tiempo medio desde el diagnóstico fue de 1,7±1,8 años.
Características sociodemográficas y clínicas de los sujetos y datos sociodemográficos de los cuidadores
| Características de los sujetos | |
| Edad, años (media±DT) | 77,2±6,9 |
| Sexo, n (%) | |
| Varones | 887 (39,8) |
| Mujeres | 1.344 (60,2) |
| Nivel de estudios, n (%) | |
| Sin estudios | 656 (29,5) |
| Estudios primarios | 1.120 (50,4) |
| Estudios secundarios | 333 (15,0) |
| Estudios universitarios | 113 (5,1) |
| Estadio actual de EA, n (%) | |
| Leve | 931 (41,5) |
| Moderada-moderadamente grave | 1.315 (58,5) |
| Tiempo desde diagnóstico de EA, años (media±DT) | 1,7±1,8 |
| Número de fármacos diarios (media±DT) | 4,5±2,4 |
| Enfermedades concomitantes, n (%)a | |
| Cardiovasculares | 1.339 (63,9) |
| Endocrinas | 623 (29,7) |
| Psiquiátricas | 563 (26,9) |
| Musculoesqueléticas | 550 (26,2) |
| Neurológicas | 514 (24,5) |
| Gastrointestinales | 402 (19,2) |
| Urogenitales | 307 (14,6) |
| Respiratorias | 291 (13,9) |
| Datos sociodemográficos de los cuidadores | |
| Edad, años (media±DT)b | 58,4±15,6 |
| Varones | 66,0±15,0 |
| Mujeres | 55,6±14,8 |
| Género, n (%) | |
| Varones | 591 (27,1) |
| Mujeres | 1.589 (72,9) |
| Relación con el paciente, n (%) | |
| Familiar | 1.839 (84,7) |
| Cuidador externo | 333 (15,3) |
DT: desviación típica; EA: enfermedad de Alzheimer.
Por su parte los cuidadores fueron mayoritariamente mujeres (72,9%), con una media de edad de 58,4±15,6 años, siendo significativamente más jóvenes las mujeres que los varones (55,6±14,8 años vs. 66,0±15,0 años; prueba U de Mann-Whitney; p<0,0001). La mayoría de los cuidadores tenía estudios primarios (44,0%) o secundarios (32,9%) y tenían una relación familiar con el paciente (84,7%).
Manejo terapéutico con rivastigminaEl 54,4% de los sujetos (n=1.222) habían iniciado el tratamiento con RO frente a un 45,6% (n=1026) que lo hicieron con RTD. La dosis de inicio más habitual de RO fue de 1,5mg/12h (88,9%) y de RTD de 4,6mg/24h (97,0%).
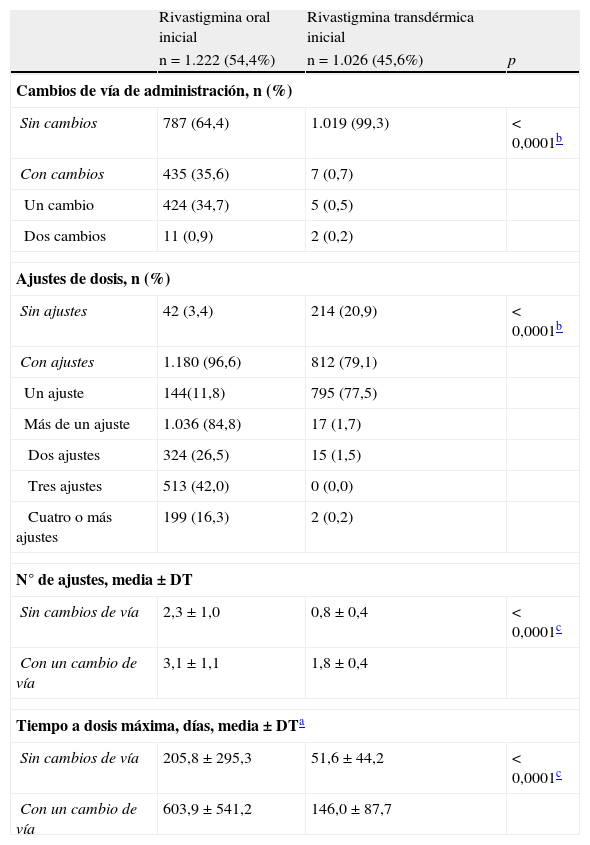
Un 34,7% de los sujetos (n=424) que iniciaron tratamiento con RO cambiaron a RTD, y un 0,9% (n=11) volvieron nuevamente a RO tras haber cambiado a la vía transdérmica. Solo un 0,7% (n=7) de los que iniciaron tratamiento con RTD cambiaron de vía de administración, un 0,5% (n=5) cambiaron a RO y un 0,2% (n=2) regresaron al tratamiento con RTD después de haber cambiado a RO temporalmente (tabla 2). En consecuencia, en el momento de la visita del estudio un 36,8% (n=827) utilizaban RO y un 63,2% RTD (n=1.421). El tiempo medio desde el inicio del tratamiento con rivastigmina hasta la visita del estudio era de 2,0±1,7 años para los sujetos con RO en el momento de la visita actual y de 0,4±0,3 años para los sujetos con RTD; siendo el tiempo medio significativamente mayor para los sujetos en tratamiento oral (prueba U de Mann-Whitney; p<0,0001).
Cambios de la vía de administración y ajustes de dosis de rivastigmina
| Rivastigmina oral inicial | Rivastigmina transdérmica inicial | ||
| n=1.222 (54,4%) | n=1.026 (45,6%) | p | |
| Cambios de vía de administración, n (%) | |||
| Sin cambios | 787 (64,4) | 1.019 (99,3) | <0,0001b |
| Con cambios | 435 (35,6) | 7 (0,7) | |
| Un cambio | 424 (34,7) | 5 (0,5) | |
| Dos cambios | 11 (0,9) | 2 (0,2) | |
| Ajustes de dosis, n (%) | |||
| Sin ajustes | 42 (3,4) | 214 (20,9) | <0,0001b |
| Con ajustes | 1.180 (96,6) | 812 (79,1) | |
| Un ajuste | 144(11,8) | 795 (77,5) | |
| Más de un ajuste | 1.036 (84,8) | 17 (1,7) | |
| Dos ajustes | 324 (26,5) | 15 (1,5) | |
| Tres ajustes | 513 (42,0) | 0 (0,0) | |
| Cuatro o más ajustes | 199 (16,3) | 2 (0,2) | |
| N° de ajustes, media±DT | |||
| Sin cambios de vía | 2,3±1,0 | 0,8±0,4 | <0,0001c |
| Con un cambio de vía | 3,1±1,1 | 1,8±0,4 | |
| Tiempo a dosis máxima, días, media±DTa | |||
| Sin cambios de vía | 205,8±295,3 | 51,6±44,2 | <0,0001c |
| Con un cambio de vía | 603,9±541,2 | 146,0±87,7 | |
DT: desviación típica.
Porcentajes calculados respecto al número total de pacientes evaluables que iniciaron el tratamiento por vías de administración.
Se realizaron ajustes de dosis en la mayoría de los sujetos, en un 96,6% (n=1.180) de los tratados inicialmente con RO y en un 79,1% (n=812) de los tratados con RTD, siendo esta diferencia entre ambos grupos significativa (prueba Chi-cuadrado; p<0,0001; tabla 2). En el 58% (n=712) de los sujetos tratados con RO se realizaron 3 o más ajustes de dosis hasta alcanzar la dosis final. Solo el 1,7% (n=17) de los sujetos tratados con RTD realizaron 2 o más ajustes de dosis para alcanzar dicha dosis. El número de ajustes fue significativamente mayor en los sujetos tratados oralmente (prueba U de Mann-Whitney; p<0,0001; tabla 2).
El 72,4% (n=1.628) de los sujetos estaban siendo tratados, en el momento de la visita del estudio, con la dosis terapéutica máxima recomendada según la vía de administración, siendo el porcentaje de sujetos tratados a dicha dosis significativamente más elevado en los que recibían RTD (9,5mg/24h) respecto a los sujetos en tratamiento con RO (6mg/12h): 80,8 vs. 57,1%, respectivamente (prueba U de Mann-Whitney; p<0,0001).
El tiempo medio hasta alcanzar la dosis máxima en los sujetos que no cambiaron la vía de administración fue de 205,8±295,3 días para RO y de 51,6±44,2 días para RTD, siendo la diferencia significativa (prueba U de Mann-Whitney; p<0,0001). En los sujetos en los que se cambió la vía de administración, los tiempos hasta alcanzar la dosis máxima fueron mayores tanto si inicialmente recibían la vía oral (603,9±541,2días) como la transdérmica (146,0±87,7días).
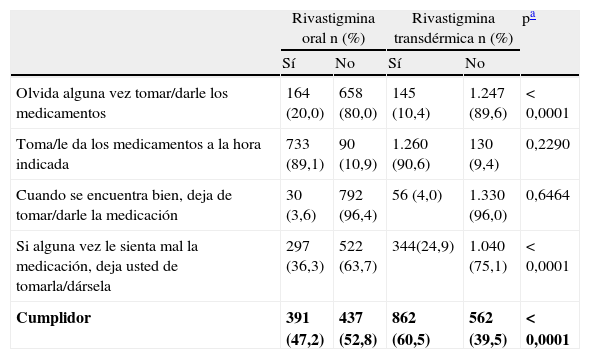
Cumplimiento del tratamientoEl 22,1% de los sujetos tratados con RO y el 23,8% de los que recibían RTD se autoadministraban la medicación (prueba Chi-cuadrado; p=0,3468). Mediante el test de Morisky-Green, se observó que un 20,0% de los sujetos tratados con RO olvidaban la toma de la medicación frente a un 10,4% de los tratados con RTD (prueba Chi-cuadrado; p<0,0001). El porcentaje de sujetos que no tomaban la medicación en caso de que esta le sentara mal era del 36,3% en los tratados con RO y del 24,9% en los tratados con RTD (prueba Chi-cuadrado; p<0,0001). No se encontraron diferencias entre ambos grupos de tratamiento en cuanto a la toma de la medicación en las horas indicadas ni en cuanto a dejar de tomar la medicación en caso de encontrarse bien. El cumplimiento terapéutico global era significativamente mayor en los sujetos tratados con RTD (60,5%) que en los tratados con RO (47,2%) (prueba Chi-cuadrado; p<0,0001; tabla 3).
Test de Morisky-Green
| Rivastigmina oral n (%) | Rivastigmina transdérmica n (%) | pa | |||
| Sí | No | Sí | No | ||
| Olvida alguna vez tomar/darle los medicamentos | 164 (20,0) | 658 (80,0) | 145 (10,4) | 1.247 (89,6) | <0,0001 |
| Toma/le da los medicamentos a la hora indicada | 733 (89,1) | 90 (10,9) | 1.260 (90,6) | 130 (9,4) | 0,2290 |
| Cuando se encuentra bien, deja de tomar/darle la medicación | 30 (3,6) | 792 (96,4) | 56 (4,0) | 1.330 (96,0) | 0,6464 |
| Si alguna vez le sienta mal la medicación, deja usted de tomarla/dársela | 297 (36,3) | 522 (63,7) | 344(24,9) | 1.040 (75,1) | <0,0001 |
| Cumplidor | 391 (47,2) | 437 (52,8) | 862 (60,5) | 562 (39,5) | <0,0001 |
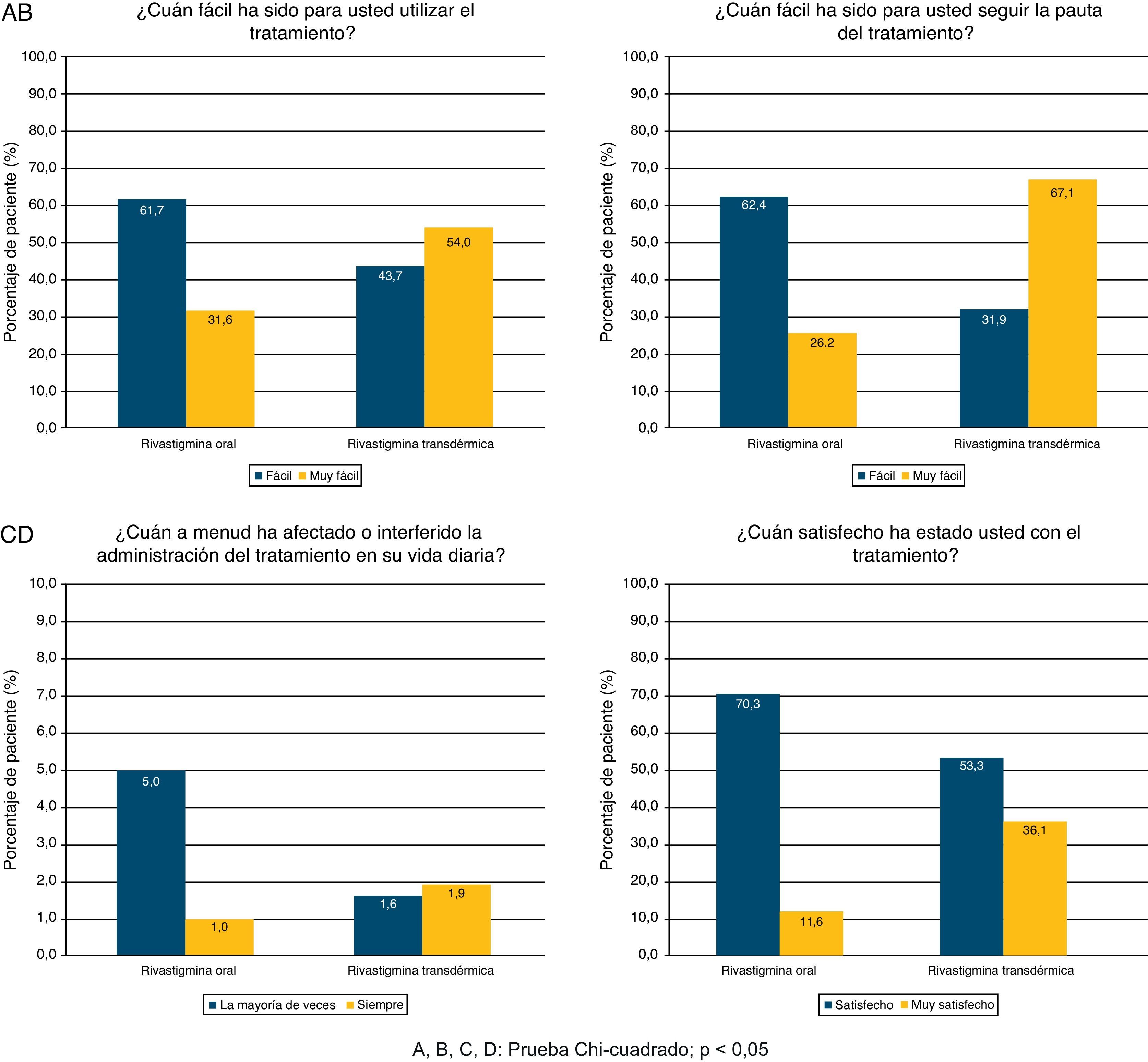
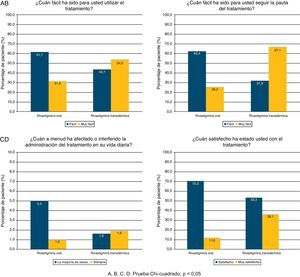
En el cuestionario de satisfacción del cuidador habitual, se observó que para el 54,0% de los cuidadores de los sujetos tratados con RTD fue fácil utilizar el tratamiento y el 36,1% estaban satisfechos. Para los cuidadores de los sujetos con RO, estos porcentajes fueron del 31,6 y 11,6%, respectivamente. El seguimiento de la pauta resultó más sencillo con RTD (67,1 vs. 26,2%), mientras que el tratamiento con RO interfería con la vida diaria más frecuentemente (37,0 vs. 11,6%). Se observaron diferencias significativas en todas las preguntas sobre la satisfacción del cuidador a favor de RTD (prueba Chi-cuadrado; p<0,0001; fig. 1).
DiscusiónEn este estudio se evaluó el manejo terapéutico del tratamiento con RO y RTD en 2.252 sujetos con EA en estadio leve a moderadamente grave en situación de práctica clínica habitual.
Los datos sociodemográficos y clínicos mostraron que la población estudiada tenía características similares a las observadas en sujetos con EA en otros estudios: edad avanzada, mayor prevalencia en mujeres, nivel académico bajo, presencia de enfermedades concomitantes (especialmente enfermedades cardiovasculares) y polimedicación1,19. Más de 3 cuartas partes de los sujetos vivían en familia y era un familiar (78,1%) quien se encargaba de la administración del tratamiento, coincidiendo con lo observado en otros estudios aunque los porcentajes varían entre países, que señala un porcentaje mayor de sujetos viviendo con sus familiares en países subdesarrollados respecto a desarrollados, en medio rural respecto a urbano, en el norte de Europa respecto al sur, o en países con menos infraestructuras residenciales y/o ayudas para la institucionalización20–22. La mayoría de los cuidadores de este estudio eran mujeres, tanto si era un familiar como un cuidador externo, en concordancia con lo observado en los países evaluados por la organización Alzheimer's Disease International22.
Este estudio es uno de los primeros que aborda el manejo terapéutico de la rivastigmina con la participación de las 3 especialidades autorizadas para prescribir fármacos para la EA en nuestro país, en la práctica clínica habitual, con el propósito de entender mejor los comportamientos a la hora de prescribir y su repercusión en el paciente y su cuidador. Globalmente, los resultados parecen mostrar que la administración de rivastigmina en forma transdérmica es más beneficiosa que la oral, ya que mejoran la mayoría de los parámetros del manejo terapéutico (cumplimiento, dosis óptima, tiempo en conseguir el tratamiento).
Según la relación dosis-respuesta, la eficacia de rivastigmina mejora al aumentar la dosis, sobre todo al alcanzar la dosis máxima recomendada9,11,23, no obstante, es necesario equilibrar la dosis con una aceptable tolerabilidad24. De hecho, los datos preliminares de un estudio muy reciente señalan la posibilidad de usar dosis mayores que las recomendadas actualmente25. En nuestro estudio, el porcentaje de sujetos que recibían la dosis terapéutica máxima recomendada era mayor con RTD que con RO, siendo esta dosis alcanzada en un tiempo significativamente menor (unos 5 meses). Este último hallazgo es relevante, ya que la introducción precoz del tratamiento de la EA está cobrando una importancia creciente. En el ensayo IDEAL, el porcentaje de sujetos que alcanzaron el objetivo de la dosis terapéutica máxima recomendada también fue mayor para la formulación transdérmica7,9. Los resultados del presente estudio son similares, a pesar de haber sido obtenidos en condiciones de práctica clínica habitual.
Un aspecto relevante de este estudio es el análisis detallado del manejo de dosis y vías en cada sujeto desde la prescripción. Se recomienda que la RO se ajuste en 3 pasos y la RTD en un solo paso, por tanto sorprende, que en casi la mitad (41,7%) de los sujetos tratados con RO se hayan hecho menos de 2 ajustes de dosis o ninguno, posiblemente porque el escalado con RO resulta más complejo que el de RTD. Aunque nuestro estudio no estaba diseñado para conocer el motivo de los ajustes, este hecho puede reflejar problemas de tolerancia o cumplimiento, desconocimiento de la dosis óptima u otros problemas asistenciales. Con RTD, solo un 20,9% no realizaron ningún ajuste de dosis, lo cual puede deberse a la elevada frecuencia de cambio de RO a RTD, que en ocasiones permite elegir directamente la dosis óptima en función de la respuesta y tolerancia a la dosis oral. La necesidad de hacer menos ajustes puede simplificar el seguimiento y reducir el número de visitas que precisan estos enfermos en las primeras fases del tratamiento.
En el estudio SCALEX se comprobó que el tratamiento con RO en régimen lento de ajuste de dosis resultaba en interrupciones frecuentes por falta de eficacia debido al uso de dosis subterapéuticas en periodos de tiempo dilatados en comparación con el régimen de ajuste de dosis recomendado actualmente26. Una de las ventajas de la RTD es el beneficio clínico obtenido por el paciente al alcanzar dosis terapéuticas en menos tiempo que con administraciones orales.
En este estudio tanto el cumplimiento terapéutico como la satisfacción con el tratamiento fueron significativamente mejores en los sujetos que recibían RTD en comparación con RO. Borah et al.27 observaron que en sujetos con EA el 42% no cumplía con el tratamiento oral y sugerían el uso de tratamientos transdérmicos como estrategia de mejora del cumplimiento. La complejidad del ajuste de la dosis oral de rivastigmina, basada en los ensayos clínicos, y su mala tolerancia digestiva pueden contribuir a explicar la mayor satisfacción con el tratamiento por vía transdérmica.
No se dispone de un método específico para evaluar el cumplimiento del tratamiento de la EA, por lo que en este estudio se utilizó el test de Morisky-Green, que es un cuestionario breve bien validado y usado ampliamente en distintos tipos de enfermos crónicos18. Los datos obtenidos indican que un 52,8% de los sujetos tratados con RO presentaban incumplimiento con la terapia, mientras que el porcentaje era significativamente menor (39,5%) con RTD. Estas diferencias se debían principalmente a que los sujetos con RO con mayor frecuencia olvidaban la toma de la dosis y si este le sentaba mal dejaban de tomar el fármaco, lo que indica que una de las ventajas de la vía transdérmica radica en su administración una vez al día, lo cual parece influir en un mejor cumplimiento con el tratamiento. Una mejora del 13,3% en el cumplimiento se puede considerar relevante, especialmente en un área terapéutica en la que el cumplimiento plantea tantos problemas28. Resultados muy recientemente publicados en pacientes españoles con EA coinciden con los datos aquí mostrados29.
Nuestro estudio muestra también una mayor preferencia del cuidador por la forma transdérmica. En el ensayo clínico IDEAL, el 72% de los cuidadores prefería la RTD al final del estudio, siendo la facilidad del uso y de la posología los motivos más referidos. Dicha evaluación se realizó mediante el cuestionario validado de preferencias de los cuidadores de EA (Alzheimer's Disease Caregiver Preference Questionnaire [ADCPQ])30,31. En el presente estudio no se utilizó dicho cuestionario dado que algunas preguntas valoran la eficacia de ambas presentaciones del tratamiento y este no era el objetivo del estudio. Por ello se optó por utilizar un cuestionario similar al del estudio KAPPA32 con el mismo esquema que el ADCPQ, centra las preguntas en la satisfacción con el tratamiento, siendo los resultados de ambos estudios comparables.
Entre las debilidades de nuestro estudio destaca, en primer lugar, el no haber alcanzado el tamaño de la muestra previsto de 3.174 sujetos; aunque el número de sujetos evaluados fue suficiente para analizar los objetivos del estudio con un margen de error del 2,6% y con la misma potencia prevista por protocolo. La muestra fue suficientemente amplia, pudiendo ser una buena aproximación a la población afecta de EA, al observarse características similares a las descritas en otros estudios internacionales1,19. Por otro lado, pudo existir un sesgo de selección, dado por la posible selección de enfermos para incluir en el estudio, aunque el protocolo especificaba expresamente la recogida de sujetos consecutivos, la cual es una limitación habitual en muchos estudios que evalúan la práctica clínica habitual, en contraposición a los ensayos clínicos. En cuanto a la satisfacción del cuidador, el profesional pudo transmitir a priori una impresión positiva sobre la formulación transdérmica, como formulación mejorada de la oral, lo que podría haber influido en los resultados.
Con los resultados del presente estudio se puede concluir que, en la práctica clínica habitual y en comparación con la vía oral, la formulación transdérmica permite la administración de rivastigmina facilitando el alcance de la dosis terapéutica máxima recomendada y de forma más rápida, con un mejor cumplimiento terapéutico y mejor satisfacción para el cuidador.
Conflicto de interesesEl presente estudio ha sido financiado por Novartis Farmacéutica, S.A.
Alfonso J. Cruz Jentoft ha participado como moderador o ponente en actividades docentes organizadas por Grunenthal, Janssen-Cilag, Lundbeck, y Novartis, empresas que comercializan productos para el tratamiento de la enfermedad de Alzheimer. Basilio Hernández es empleado a tiempo completo de Novartis Farmacéutica, S.A., Barcelona (España).
Los autores agradecen su participación a todos los investigadores que colaboraron en el estudio ENTERPRISE (véase Anexo 1). La empresa ADKNOMA colaboró eficazmente en la logística del estudio y el análisis de los datos. Mirle Ferrer y Mercè Viladrich han participado como redactora médica en la elaboración del artículo y en el análisis estadístico, respectivamente.
J. Abella Corral, H. Arquitecto Marcide, Ferrol; I. Abellan Miralles, H. San Vicente, Alicante; E. Aguera Morales, H. Reina Sofía, Córdoba; J.J. Aguirre Sánchez, H.U. Infanta Cristina, Badajoz; A. Alayon Fumero, C. Privada, Santa Cruz Tenerife; J. Alberca de Castro, C. Salud Mental Linares, Linares; J. Almajano Martínez, J. Benito León, H. 12 Octubre, Madrid; F. Alonso de Teso, C. Especialidades, Valladolid; J. Álvarez Gurtierrez, R. Andrés Celda, H. El Bierzo, Fuentes Nuevas; M.S. Amor Andrés, H. Virgen del Valle, Toledo; D. Apolinar García Estévez, H. Monforte, Lugo; S. Arabceta Arilla, CAP Cerdanyola-Ripollet, Ripollet; C. Arenas Cabrera, A. Marques de Paradas, Sevilla; J.A. Arenas Sánchez, Clínica Ponenet, Lleida; G. Ariza Zafra, H. Virgen del Perpetuo Socorro, Albacete; M.A. Arizcuren Domeño, R. G. Landazabal, Burlada; A. Arjona Padillo, A. Especialidades Bola Azul, Almería; M- Amaldos Paya, H. Santa María del Rosell, Cartagena; V. Arroyo Martínez, C. Privada, Bilbao; A. Avila Rivera, H. G. L’Hospitalet, L.Hospitalet; L. Benítez Rangel, H. Juan Grade, Jerez de la Frontera; J.A. Bergache Yarza; H. C. Bidasoa, Hondarribia; M.T. Bernal Bernal, F. Sanitaria Igualada, Igualada; V. Bertol Alegre, H.U. Miguel Servet, Zaragoza; E. Bescansa Heredero, H. Reina Sofía, Códoba; J.A. Boltes Alandi, H.G. Granollers, Granollers; M. Bonet Valls, H. Arnau Vilanova, Valencia; S. Boyero Durán, H. Cruces, Barakaldo; H. J. Bueno Perdomo, H. N. Señora de la Candelaria, La Laguna; M. Bujanda Alegría, H. Navarra, Pamplona; A. Burriel Roselló, H. Clínico Universitario, Zaragoza; N. Caballol Pons, CAP La Rambla, Sant Feliu de Llobregat; P. Cacabelo Pérez, H. C. Universitario de Salamanca, Salamanca; A. Callen Soto, H. Sant Boi, Sant Boi de Llobregat; J.M. Camacho Cuartero, C. Salud Mental Torrent, Torrente; A.B. Caminero Rodríguez, H. Ntra. Señora de Sonsoles, Ávila; J. Campdelacreu Fumadó, H. Bellvitge, L’Hospitalet de Llobregat; A. Cano Orgaz, H. Mataró, Barcelona; S. Cantanero Duque, H. Móstoles, Móstoles; F. Cañadillas Hidalgo, H. Reina Sofía, Córdoba; A. Cardozo Dodera, H. Provincial Santa María, Lleida; F.J. Carrillo Padilla, H.U. de Canarias, Santa Cruz de Tenerife; T. Casadevall Codina, H. Sant Jaume de Cellla, Barcelona; V. Casado Ruiz, H. Mataró, Barcelona; C. Castejón Gabriel, ABS Chafarinas, Barcelona; L. Castilla Guerra, H. Ntra Señora de la Merced, Osuna; J. Cerda Fayos, H. Provincial de Castellón, Castellón de la Plana; R. P. Chamarro Lazaro, H. C. U. Valencia; A. Da Silva González, R. Geriátrica Fuentes Blancas, Burgos; R.M. de Eugenio Huelamo, R. Geriátrica Palamós, Palamós; I. de la Serna de Pedro, M. de Toledo Heras, H. Ramón y Cajal, Madrid; R. de la Vega Cotarelo, H. Punta de Europa, Algeciras; B. del Amo Martínez, C. Padre Menni, Navarra; V.F. del Olmo García, C. Privada, Valladolid; M.A. del Real Francia, H. G. de Ciudad Real, Ciudad Real; E. Delgado Parada, H. Comarcal Jarrio, Coaña; C. Díaz Marín, H. de la Marina Baixa, Vila Joiosa; S. Díaz Nicolás, O. Fabre Pi, H. G. de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria; A. Díaz Ortuño, H. Reina Sofía, Córdoba; M. Diez Lopez, C. Privada, Burgos; L. Docasar Bertolo, U.Salud Mental Monforte, Monforte de Lemos; J.A. Dominguez Moran, H. de la Ribera, Alzira; E. Duaso Magaña, H. Sant Llatzer, Terrassa; J.C. Duran Alonso, H. Juan Grande, Jerez de la Frontera; C. Echeandía Ajamil, H. Central de la Defensa Gómez Ulla, Madrid; P. Eguia del Río, H.G. Lanzarote, Arrecife; J. Escudero Torrella, A. Especialidades Juan Llorens, Valencia; F.J. Espada Oliván, H. Sant Jaume de Calella, Calella; J. Esparza Rodríguez, H. Provincial Divino Valles, Burgos; A. Espino Montoro, H. Nuestra Señora de la Merced, Osuna; M.C. Espinosa Val, H. Sant Jaume, Barcelona; M.J. Esteban Dombriz, H. G. U. Guadalajara, Guadalajara; J. Estrany Bauza, Policlínica Miramar, Palma de Mallorca; E. Fages Caravaca, H. Santa María del Rosell, Cartagena; Y. Fernández Bullido, A. Moratalaz, Madrid; S. Fernández González, H. Creu Roja, Barcelona; D. Fernández Uria, H. Cabueñes, Gijón; J.M. Fernández-Cuesta Cuesta, A. Centro Diagnóstico Santander, Santander; E. Ferreira González de Viñaspre, H. Txagorritxu, Vitoria-Gateiz; A. Ferreros Vilar, Centro Salud Xativa, Xàtiva; A. Formica Martínez, A. Nuestra Señora del Coro, Donostia-San Sebastián; F. Formiga Pérez, H. Duran i Reynals, L’Hospitalet de Llobregat; J. Foronda Bengoa, H. Ciudad de Jaén, Jaén; M. Fragoso Martínez, Consorci Sanitari de Terrassa, Terrassa; J.I. Franch Valverde, H. Clínico, Valladolid; E. Franquet Gómez, H. Residencia Sant Camil, Sant Pere de Ribes; C.A. Gahete Jiménez, H. Virgen del Puerto, Plasencia; M.A. García Alhambra, H.G.U. Gregorio Marañón, Madrid; M.C. García de Cassasola García, H. Rambla, Santa Cruz de Tenerife; A. García de Vinuesa Matute, A. Especialidades Villanueva de la Serena, Villanueva de la Serena; G. García Gómez, R. Ancianos San Juan de Dios, El Álamo; C. Gacía Guijo, H.G. Jerez de la Frontera, Jerez de la Frontera; M.T. García López, A. Especialidades Bola Azul, Almería; H. García Miranda, H. Zumarraga, Zumarraga; J.M. García Moreno, H. Virgen de Macarena, Sevilla; M.I. García Tomás, H.G. Almansa, Albacete; F.J. Garzón, Maldonado, H. Virgen de la Victoria, Málaga; J. Gascón Bayari, CAP Ramona Via i Pros, El Prat de Llobregat; M.I. Gastón Zubimendi H. Virgen del Camimo, Pamplona; F. Gazquez Martínez, C. Salud El Ejido, El Ejido; J.M. Giménez García, H. Virgen de Altagracia, Manzanares; J.J. Giron Ubeda, H. G. Jerez de la Frontera, Jerez de la Frontera; M. Gómez Beldarrain, H. Galdakao, Galdakao; J.L. González Gutiérrez, H.C. San Carlos, Madrid; F. González Martínez, H. Cuenca, Cuenca; M. González Platas, H. Comarcal Blanes, Blanes; V. González Torres, H. Ciudad de Jaén, Jaén; F. Gracia Fleta, H.G. de Alicante, Alicante; M. Gracia Naya, A. San José, Zaragoza; C. Guerrero castaño, H. Sant Jaume de Calella, Calella; D. Guillen Mesado, C. Especialidades Peña Prieta-Hermanos Sangro, Madrid; J. Gutiérrez García, H.U. San Cecilio, Granada; L. Gutiérrez Rojas, A. Baza, Baza; J. Hernández Vara, H. Vall d’Hebron, Barcelona; F. Herrero Cerezo, H. Mataró, Mataró; R.E. Ibañez Alonso, H.G. Ciudad Real, Ciudad Real; R. Ibañez Corrales, C.S. Alcalá la Real, Alcalá la Real; J.A. Iniesta Valera, C.M. Jurado Cobo, H.G. Reina Sofía, Murcia; A. Jaen Peraire, CAP Numancia, Barcelona; J.Jara González, P. Pablo Luengo, Navalmoral de la Mata; S. Jauma Classen, CAP La Gabarra, Cornellà de Llobregat; J.M. Jiménez Paez, H. Cruz Roja, Córdoba; L. Lacruz Ballester H. San Francisco de Borja, Gandia; F. Lacruz Bescos, H. Navarra, Pamplona; L. Lillo Triguero, H.G.Univ. Gregorio Marañón, Madrid; J.M. Lomba Borrajo, C. Saude A Ponte, Ourense; J. Lominchar Espada, C.S.H.G.Univ. Valencia, Valencia; J.M. Lopez Arlandis, H. Virgen de los Lirios, Alcoy; A.I. López Fraile, H. Virgen de Altagracia, Manzanares; A.M. López Real, H. Juan Canalejo, A Coruña; M. López Roa, H. Psquiátric Febles Campos, Santa Cruz de Tenerife; I. Lopez Zuazo, H.G. Univ. Guadalajara, Guadalajara; J.M. Losada Domingo, H. Cruces, Barakaldo; P. Lozano Sanmartín, C. Sagrado Corazón, Sevilla; A. Luengo Dos Santos, A. Henares, Madrid; A. Luna Rodríguez, H. Palamós, Palamós; O. Llamazares de la Fuente, C. San Francisco, León; M. Llanero Luque, C.P.S. R. Calvo, Madrid; M.A. Llaneza González, H. Arquitecto Marcide, Ferrol; A. Maestre Martínez, H. Ciudad de Jaén, Jaén; S. Manzano Palomo, H.C. San Carlos, Madrid; M.M. Marcos Toledano, H. Mérida, Mérida; J. Marey López, H. Juan Canalejo, A Coruña; C. Margarito Rangel, H. Virgen del Perpetuo Socorro, Albacete; C. Marques, Clonus, Palma de Mallorca; M. Márquez Martínez, H. Virgen de la Victoria, Málaga; C. Marsal Alonso, H. Virgen de la Salud, Toledo; S. Martin Balbuena, H. Vega del Río Segura, Cieza; J.C. Martín Berra, C. Santa María de la Asunción, Tolosa; M.E. Martin Correa, H. Virgen del Valle, Toledo; J.J. Martín Fernández, J. Meca Lallana, H. U. Virgen de la Arrixaca, El Palmar; J. Martín Polo, H.G. Rio Carrión, Palencia; J.R. Martínez Calvo, H. Calde, Calde; R. Martínez Fernández, H. Figueres, Figueres; D. Martínez Lozano, H. G. Castellón, Castelló de la Plana; J. Matarredona Catalá, U.S.M. Alcoy, Alcoy; J.A. Mauri Llerda, H.C.Univ. Lozano Blesa, ZaragozaV. Medrano Martínez, H. Elda, Alicante; P.A. Megia López, H. Prov. San Telmo, Palencia; J.C. Miñana Climent, H. Monte Naranco, Oviedo; F.J. H. Son Dureta, Palma de Mallorca; T. Molina Nieto, H. Reina Sofía, Córdoba; A. Molins Albanell, H. Josep Trueta, Girona; J.A. Monge Argiles, H.G.Univ. Alicante, Alicante; E. Montes Latorre, H. Univ. Virgen del Rocío, Sevilla; M.D. Morales Martínez H. Virgen de la Macarena, Sevilla; A. Moya Rodrigo, C. Salud Xàtiva, Xàtiva; C. Muñoz Fernández, Amb. Especialidades Bola Azul, Almería; C. Obiol Madrid, UFISS C. de la Mercè, Barcelona; J.J. Ochoa Amor, J.J. Ochoa Sepúlveda, H. Reina Sofía, Córdoba; T. Ojea Ortega, H. G. Málaga, Málaga; J.A. Olivan Usieto, H. Comarcal Alcañiz, Alcañiz; C. Oliveras Ley, H. del Mar, Barcelona; C. Oreja Guevara, H. La Oaz, Madrid; JC Ortigosa Digon, C.S. Mental Naranco, Oviedo; M. Ortigosa Luque, H. Princesa de España, Jaén; A. Oterino Duran, H. Marqués de Valdecilla, Santander; P. Otermin Vallejo, H. G. Granollers, Granollers; F. Padilla Parrado, H. Clínico, Málaga; S. Palau Duarte, H. San Vicente del Raspeig, San Vicente del Raspeig; A. Pampliega Pérez, H. G. U. de Alicante, Alicante; M.C. Pardo Bustamante, H. de Sant Andreu, Manresa; G. Pardo Castillo, Amb. Baza, Baza; LF Pascual Millan, H. C. U. Lozano Blesa; B. Pascual Sedano H Santa Creu i Sant Pau, Barcelona; J.C. Pastor de la Fuente, Residencia Ancianos San Juan de Dios, El Álamo; A. Pato Pato, H Povisa, S.A., Vigo; J.M. Paz González, H. Xeral de Lugo, Lugo; R. Pego Reigosa, H. Xeral de Lugo, Lugo; C. Peiro Vilaplana, H. de la Ribera; J. Peña Martinez, H. San Agustin, Avilés; D. Perez Martinez, H. Infanta Cristina de Parla, Parla; M.C. Perez Vieitez, H.G. de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria; C. Perla Muedra, H. Arnau de Vilanova, Valencia; V.C. Peset Mancebo, C.S. Aldaia - Antic Regne, Aldaia; S. Piles Galdon Fundació Privada H. de Mollet, Mollet del Vallès; L. Piqueras Rodriguez, H. de Elda, Alicante; M. Platero Roman, H.G. de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria; J.F. Plaza Nieto, H. del Sureste, Arganda del Rey; A. Ponz de Tienda, H.C.U Valencia, Valencia; R. Portillo Rivero, H.Reina Sofia, Córdoba; N. Prieto Mestre, C.S. Alamedilla, Salamanca; P. Quiroga Yañez, C. Saude A Ponte, Ourense; R. Reñe Ramirez, H.U. de Bellvitge, L’Hospitalet de Llobregat; A. Revuelta Argomaniz, H.U. Getafe; C. Ríos Gómez, H. de Barbastro, Huesca; M.C. Riveira Rodriguez, H.C.U de Salamanca, Salamanca; R.M. Rodriguez Fernandez, C. Hospitalario Ourense, Ourense; E. Rodriguez Moreno; H. Nuestra Señora de Valme, Sevilla; J. Rodriguez Vico, H.G. de Segovia, Segovia; A. Rojo Pantoja, Amb. Mollabao, Pontevedra; A. Rojo Sebastian, H.U. Príncipe de Asturias, Alcalá de Henares; J.J. Roldan Larreta, C. Psicogeriatrica Josefina Arregui; G. Romero Caballero, Residencia Pensionistas Inserso, Albacete; I. Rouco Axpe, H. de Cruces, Barakaldo, G. Rubio Esteban, H.G. Jerez de la Frontera, Jerez de la Frontera; M. Ruibal Salgado, H. de Zumarraga, Zumarraga; N. Ruiz Lavilla, H. Nuestra Señora de la Candelaria, La Laguna; M.J. Saenz San Juan, H. Virgen de los Lirios, Alcoy; J.M. Sanchez Alvarez, H. de Cabueñes, Gijón; C. Sánchez Castellano, H. Ramón y Cajal, Madrid; O Sanchez del Valle, Instituto de Ciencias de la Salud, Talavera de la Reina; P. Sanchez Ladeira, H. Psiquiatrico Conxo, Santiago de Compostela; F. Sanchez Lopez, C. Sanchez Ortiz, H. Reina Sofia, Córdoba; S.I. Sanchez Valiente, C.M. Especialidades Grande Covian, Zaragoza; C. Santafé Mara, H.C.U. Valencia, Valencia; L. Santolaria Martinez, Mutua Adeslas Zaragoza, Zaragoza; M.P. Sanz Cartagena, H. de Mataró, Barcelona, C.L. Sanz de la Garza, H. de Jove, Gijón; M. Seijo Martinez, H. Comarcal Do Sanes, Pontevedra; C. Sistiaga Berasategui, H. Comarcal de Bidasoa, Hondarribia; J.M. Soler Insa, H.G. Sant Joan de Deu, Manresa; G. Soriano Hernández, H. de Navarra, Pamplona; J. Súarez Muñoz, H.G. de Gran Canaria Dr. Negrín, Palmas de Gran Canaria; A.I. Tercero Uribe, Corporació Sanitaria Parc Taulí; F. Terriza Garcia, H. Santa Maria del Puerto, Cádiz; B. Tijero Merino, H de Cruces, Barakaldo; J .Tort Llobet, CAP Quevedo, Barcelona; D. Tortosa Conesa, H.U. Virgen Arrixaca, El Palmar; R. Trias Sanchez, H. Santa Clotilde, Santander; E. Ugalde López, H.G .Santa Cruz de la Palma, Santa Cruz de Tenerife; F. Uriz Otano, H. San Juan de Dios, Navarra; V. Valverde Moyar, C.S. Mental Miraflores, Alcobendas; O. Vega Lopez, Consultas Medicas Córdoba, Córdoba; J.M. Vega Perez, H. Ciudad de Jaén, Jaén; F. Veiga Fernandez, H. de Calde, Calde; R. Vela Yebra, Torrevieja Salud, Alicante; F. Velasco Juanes, H. de Cruces, Barakaldo; F.J. Viguera Romero, H. Virgen de la Macarena, Sevilla; E.M. Villar Villar, C. Especialidades Móstoles, Móstoles; A. Villarejo Galende, H.U. 12 de Octubre, Madrid; I. Villegas Rodriguez, H. Ciudad de Jaén, Jaén; M. Viñuela Beneitez, Amb. El Carmen, Palma de Mallorca; B. Zarza Sanz, H. Ramón y Cajal, Madrid; M.A. Zea Sevilla, H.U La Paz, Madrid.
Parte de los resultados del presente trabajo fueron presentados en la reunión de la SEN de 2010.