Los pacientes con un ictus tienen más probabilidades de supervivencia e independencia si son atendidos en una unidad de ictus. La información disponible en nuestro entorno acerca de la influencia del aprendizaje sobre estos resultados es escasa. Analizamos la situación funcional y mortalidad en nuestros pacientes en función de la experiencia acumulada en una unidad de ictus.
Pacientes y métodosEstudio de cohortes retrospectivo de pacientes ingresados en una unidad de ictus. Diferenciamos 2 grupos según el año de ingreso: grupo A (julio 2007-diciembre 2009) y grupo B (enero 2010-diciembre 2011), analizando la evolución precoz en función de la puntuación en la escala de ictus del National Institute of Health y la mortalidad al alta y la situación funcional a medio plazo en función de la mortalidad y estado funcional según la escala Rankin a los 3 meses.
ResultadosSe incluyó a 1.070 pacientes. No se obtuvo diferencias entre los grupos ni en la evolución favorable (68,3% vs. 63,9), ni en la mortalidad tanto hospitalaria (5,1% vs. 6,6%), como a los 90 días (12,8% vs. 13,1%), siendo mayor el porcentaje de independientes a los 90 días en el grupo B (56,3% vs. 65,5%: p=0,03). El análisis multivariante ajustado por subtipo de ictus y tratamiento fibrinolítico mantuvo la asociación entre la independencia y el período de ingreso.
ConclusionesLa probabilidad de independencia funcional de nuestros pacientes aumentó con la experiencia acumulada de nuestra Unidad de Ictus sin observarse diferencias en la mortalidad.
Patients with acute stroke are more likely to survive and achieve independence if they are treated in a stroke unit. Available information in our setting is scarce. We analyse the outcomes of our patients on the basis of cumulative experience in a stroke unit.
Patients and methodsA retrospective cohort study of patients admitted to a stroke unit. We differentiate between two groups according to the year of admission: group A (July 2007-December 2009) and group B (January 2010-December 2011), analysing early outcome based on the score on the National Institute of Health stroke scale and mortality at discharge, and medium-term outcome in terms of mortality and functional status according to the modified Rankin scale at three months.
ResultsA total 1070 patients were included. There were no differences between groups with respect to favourable outcome (68.3% vs 63.9), hospital mortality (5.1% vs 6.6%), or 90-day mortality (12.8% vs 13.1%). The percentage of patients who were independent at 90 days was greater in group B (56.3% vs 65.5%, P=.03). In the multivariate analysis adjusted for stroke subtype and fibrinolytic therapy, the association between patient independence and admission period remained present.
ConclusionsThe probability of functional independence in our patients increased alongside accumulated experience in our stroke unit with no differences in mortality.
El ictus constituye un problema de salud pública de primer orden1. En España, según los datos del estudio Iberictus2, cada año ocurren entre 80.000 y 90.000 ictus incidentes, que suponen la tercera causa de muerte en varones y la primera en mujeres3. Además, ocasiona una gran discapacidad en los supervivientes, siendo la primera causa de la misma en adultos4, resultando así en una de las enfermedades que genera mayor carga social y económica5.
En los últimos años, 4 intervenciones han probado su eficacia en los pacientes con un ictus agudo6, asumiéndose que el ictus es una urgencia médica7 y desterrándose para siempre el nihilismo terapéutico asociado a esta afección durante décadas8.
Sobre la base de esta evidencia, en nuestro medio; representantes del Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la Sociedad Española de Neurología, publicaron un documento alertando de la necesidad de implantar un sistema organizado de atención al paciente con ictus para dar respuesta a sus necesidades y optimizar la utilización de los recursos sanitarios9. Esta iniciativa se amplifica y culmina con la participación de múltiples sociedades científicas mediante la elaboración de la Estrategia en Ictus del Sistema Nacional de Salud10, que recoge entre sus líneas estratégicas la atención en fase aguda del paciente con ictus, contemplando como una prioridad la asistencia de estos en unidades de ictus (UI).
En la actualidad, existen 39 UI en España11, pero son pocas las publicaciones sobre sus características, actividad y resultados12. Nuestro objetivo es analizar el pronóstico precoz y a los 90 días de los pacientes ingresados en nuestra UI en función de la experiencia acumulada de la misma.
Pacientes y métodosEstudio de cohortes con análisis retrospectivo de pacientes consecutivos ingresados en la UI del Hospital San Pedro de Alcántara de Cáceres (HSPA-CC) desde su inauguración. Los pacientes se distribuyeron en 2 grupos según el año de ingreso: grupo A, que incluyó a aquellos ingresados entre julio del 2007 y el 31 de diciembre del 2009, y grupo B, desde el 1 de enero del 2010 hasta el 31 de diciembre del 2011.
El HSPA-CC atiende a una población de 200.000 habitantes. La UI del HSPA-CC es de referencia para toda la provincia (411.633habitante) y puede recibir pacientes de toda Extremadura. Es una estructura cerrada, localizada en la sala de hospitalización del Servicio de Neurología, que consta de 4 camas de agudos dotadas de monitorización multiparámetro no invasiva y una cama de «presalida» no monitorizada, destinada a ofrecer tratamiento rehabilitador. Está integrada por un equipo multidisciplinar, coordinado por un neurólogo que cuenta con personal de enfermería propio y neurólogo de presencia física las 24 h del día. Su actividad se rige por un «Manual de procedimientos». A todos los pacientes ingresados se les incluye de forma prospectiva en una base de datos en la que se registran sus características demográficas, antecedentes clínicos, factores de riesgo, variables descriptivas del proceso agudo, escalas de evaluación neurológica13, pruebas paraclínicas, complicaciones14, diagnóstico final según las recomendaciones del GEECV15 y situación funcional al alta. Para la clasificación del ictus isquémico se siguen los criterios Oxfordshire Community Stroke Project (OCSP)16 y Trial of Org 10172 in Acute Stroke (TOAST)17. Los pacientes supervivientes son evaluados en una consulta monográfica de Neurología Vascular en períodos que dependen del subtipo etiológico del ictus.
Para analizar la evolución de los pacientes se diferenció entre evolución precoz, considerando una resultado favorable precoz la mejoría en más del 20% en la puntuación en la escala de ictus del Nacional Institute of Health (NIHSS)18 al alta respecto al ingreso y la mortalidad hospitalaria, y evolución a los 90 días según la situación funcional mediante la escala de Rankin y la mortalidad. La independencia funcional se definió por una puntuación en la escala de Rankin ≤ 2.
El análisis estadístico se realizó con el programa informático SPSS versión 18.
Las variables cuantitativas se expresan por la media ± desviación típica o la mediana y el rango intercuartílico según la normalidad de la distribución. Las variables categóricas se presentan con su frecuencia absoluta y relativa.
La asociación entre variables cualitativas se estudió mediante el test de la ji al cuadrado y las cuantitativas con la prueba de t de Student o la U de Mann Whitney, según la normalidad.
De forma independiente en los ictus isquémicos y hemorrágicos, para determinar los factores pronósticos asociados a mortalidad hospitalaria, la evolución neurológica precoz, la mortalidad a 90 días y el pronóstico funcional a los 3 meses, se realizaron los modelos de análisis multivariante mediante regresión logística binaria, siendo las variables dependientes las comentadas y como variables independientes aquellas que presentaban una asociación en el análisis bivariante con un nivel de significación < 0,20. Las variables que se mantuvieron en el modelo fueron aquellas que seguían manteniendo la asociación con el mismo nivel de significación (p < 0,20), con elevado valor clínico o las que hacían variar la odds ratio (OR) de alguna de las variables ya presentes al menos un 10%. El método utilizado fue el de introducir para forzar el ajuste. La discriminación del modelo se evaluó mediante una curva ROC y la calibración con el test de Hosmer-Lemeshow.
Para observar la tendencia temporal de la mortalidad hospitalaria, la evolución neurológica precoz, la mortalidad a 90 días y el pronóstico funcional a los 3 meses se clasificó a los pacientes de acuerdo con la fecha de la hospitalización índice en períodos anuales (de 2007 al 2011). Para ello se utilizó el test de tendencia lineal de la ji al cuadrado de Maentel-Haenszel.
ResultadosDurante el período de estudio, ingresaron 1.276 pacientes, de los cuales 26 (2,03%) tuvieron al alta un diagnóstico distinto al de ictus. De los restantes, en 180 casos (14,4%) se realizó el diagnóstico de ataque isquémico transitorio, por lo que en el análisis definitivo se incluyó a 1.070 pacientes. De estos, se desconocía el estado funcional a los 3 meses en 49 casos (4,5%), que no se incluyeron en el análisis de su situación funcional a los 90 días, resultando para esta variable un número final de 1.021 pacientes para su análisis.
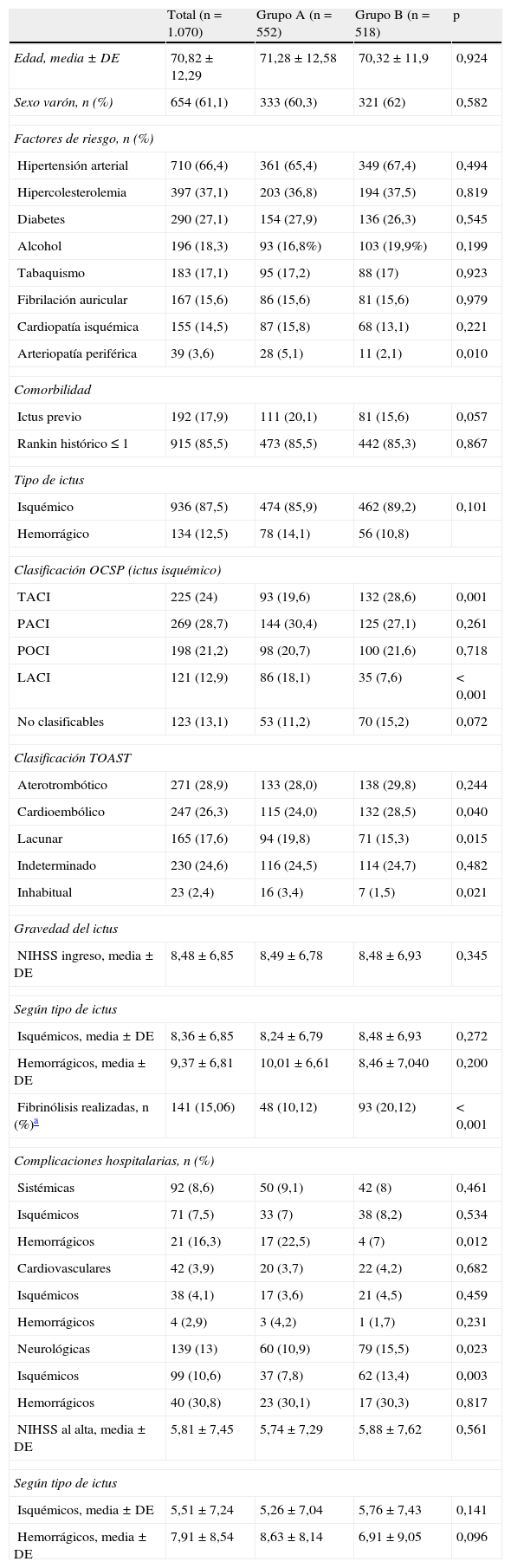
En la tabla 1 se recogen las características basales de los pacientes, la distribución por tipo de ictus, la gravedad al ingreso y la aparición de complicaciones. Se observaron diferencias significativas entre ambos grupos respecto a la presencia de arteriopatía periférica (5,1% vs. 2,1%), infarto cerebral tipo total anterior cerebral infarction (TACI) (19,6% vs. 28,6%) y lacunar cerebral infarction (LACI) (18,1% vs. 7,6%), subtipo etiológico de ictus isquémico: cardioembólico (24% vs. 28,5%), lacunar (19,8% vs. 15,3%) y de causa infrecuente (3,4% vs. 1,5%) y porcentaje de fibrinólisis sistémica realizada (10,1% vs. 20,1%), alcanzando los porcentajes diferencias significativas para las realizadas en los pacientes con ictus tipo TACI (27,9% vs. 43,9%; p<0,0001) y posterior cerebral infarction (POCI) (2,1% vs. 11%). No existieron diferencias ni en la gravedad del ictus al ingreso (8,49 ± 6,78 vs. 8,48 ± 6,93) ni en la puntuación en la escala NIHSS al alta de la UI (5,74 ± 7,29 vs. 5,88 ± 7,62). En cuanto a la aparición de complicaciones, las neurológicas fueron las más frecuentes (13%), existiendo diferencias significativas entre grupos (10,9% vs. 15,5%; p = 0,023), siendo similares la presencia de complicaciones cardiacas y sistémicas (3,7% vs. 4,2% y 9,1% vs. 8%), aunque para el ictus hemorrágico las complicaciones sistémicas fueron más frecuentes en el grupo A (22,5% vs. 7%; p = 0,012).
Características basales de los pacientes. Distribución y tipo de ictus. Gravedad al ingreso. Complicaciones hospitalarias
| Total (n=1.070) | Grupo A (n=552) | Grupo B (n=518) | p | |
| Edad, media ± DE | 70,82 ± 12,29 | 71,28 ± 12,58 | 70,32 ± 11,9 | 0,924 |
| Sexo varón, n (%) | 654 (61,1) | 333 (60,3) | 321 (62) | 0,582 |
| Factores de riesgo, n (%) | ||||
| Hipertensión arterial | 710 (66,4) | 361 (65,4) | 349 (67,4) | 0,494 |
| Hipercolesterolemia | 397 (37,1) | 203 (36,8) | 194 (37,5) | 0,819 |
| Diabetes | 290 (27,1) | 154 (27,9) | 136 (26,3) | 0,545 |
| Alcohol | 196 (18,3) | 93 (16,8%) | 103 (19,9%) | 0,199 |
| Tabaquismo | 183 (17,1) | 95 (17,2) | 88 (17) | 0,923 |
| Fibrilación auricular | 167 (15,6) | 86 (15,6) | 81 (15,6) | 0,979 |
| Cardiopatía isquémica | 155 (14,5) | 87 (15,8) | 68 (13,1) | 0,221 |
| Arteriopatía periférica | 39 (3,6) | 28 (5,1) | 11 (2,1) | 0,010 |
| Comorbilidad | ||||
| Ictus previo | 192 (17,9) | 111 (20,1) | 81 (15,6) | 0,057 |
| Rankin histórico ≤ 1 | 915 (85,5) | 473 (85,5) | 442 (85,3) | 0,867 |
| Tipo de ictus | ||||
| Isquémico | 936 (87,5) | 474 (85,9) | 462 (89,2) | 0,101 |
| Hemorrágico | 134 (12,5) | 78 (14,1) | 56 (10,8) | |
| Clasificación OCSP (ictus isquémico) | ||||
| TACI | 225 (24) | 93 (19,6) | 132 (28,6) | 0,001 |
| PACI | 269 (28,7) | 144 (30,4) | 125 (27,1) | 0,261 |
| POCI | 198 (21,2) | 98 (20,7) | 100 (21,6) | 0,718 |
| LACI | 121 (12,9) | 86 (18,1) | 35 (7,6) | < 0,001 |
| No clasificables | 123 (13,1) | 53 (11,2) | 70 (15,2) | 0,072 |
| Clasificación TOAST | ||||
| Aterotrombótico | 271 (28,9) | 133 (28,0) | 138 (29,8) | 0,244 |
| Cardioembólico | 247 (26,3) | 115 (24,0) | 132 (28,5) | 0,040 |
| Lacunar | 165 (17,6) | 94 (19,8) | 71 (15,3) | 0,015 |
| Indeterminado | 230 (24,6) | 116 (24,5) | 114 (24,7) | 0,482 |
| Inhabitual | 23 (2,4) | 16 (3,4) | 7 (1,5) | 0,021 |
| Gravedad del ictus | ||||
| NIHSS ingreso, media ± DE | 8,48 ± 6,85 | 8,49 ± 6,78 | 8,48 ± 6,93 | 0,345 |
| Según tipo de ictus | ||||
| Isquémicos, media ± DE | 8,36 ± 6,85 | 8,24 ± 6,79 | 8,48 ± 6,93 | 0,272 |
| Hemorrágicos, media ± DE | 9,37 ± 6,81 | 10,01 ± 6,61 | 8,46 ± 7,040 | 0,200 |
| Fibrinólisis realizadas, n (%)a | 141 (15,06) | 48 (10,12) | 93 (20,12) | < 0,001 |
| Complicaciones hospitalarias, n (%) | ||||
| Sistémicas | 92 (8,6) | 50 (9,1) | 42 (8) | 0,461 |
| Isquémicos | 71 (7,5) | 33 (7) | 38 (8,2) | 0,534 |
| Hemorrágicos | 21 (16,3) | 17 (22,5) | 4 (7) | 0,012 |
| Cardiovasculares | 42 (3,9) | 20 (3,7) | 22 (4,2) | 0,682 |
| Isquémicos | 38 (4,1) | 17 (3,6) | 21 (4,5) | 0,459 |
| Hemorrágicos | 4 (2,9) | 3 (4,2) | 1 (1,7) | 0,231 |
| Neurológicas | 139 (13) | 60 (10,9) | 79 (15,5) | 0,023 |
| Isquémicos | 99 (10,6) | 37 (7,8) | 62 (13,4) | 0,003 |
| Hemorrágicos | 40 (30,8) | 23 (30,1) | 17 (30,3) | 0,817 |
| NIHSS al alta, media ± DE | 5,81 ± 7,45 | 5,74 ± 7,29 | 5,88 ± 7,62 | 0,561 |
| Según tipo de ictus | ||||
| Isquémicos, media ± DE | 5,51 ± 7,24 | 5,26 ± 7,04 | 5,76 ± 7,43 | 0,141 |
| Hemorrágicos, media ± DE | 7,91 ± 8,54 | 8,63 ± 8,14 | 6,91 ± 9,05 | 0,096 |
DE: desviación estándar; II: infarto isquémico; LACI: lacunar cerebral infarction; NIHSS: National Institute of Health Stroke Scale; OCSP: Oxfordshire Community Stroke Project; PACI: parcial anterior cerebral infarction; POCI: posterior cerebral infarction; TACI: total anterior cerebral infarction; TOAST: Trial of Org 10172 in Acute Stroke.
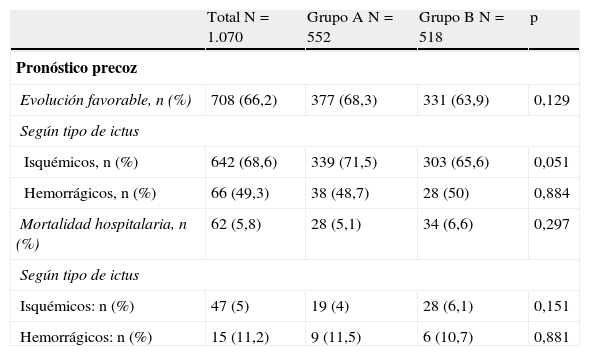
Considerando la evolución precoz y a los 90 días de los pacientes (tabla 2), no hubo diferencias ni en la evolución favorable precoz (68,3% vs. 63,9%) ni en la mortalidad, tanto hospitalaria (5,1% vs. 6,6%) como a los 90 días (12,8% vs. 13,1%), existiendo un mayor porcentaje de independientes a los 90 días en el grupo B (56,3% vs. 65,5%; p=0,03), siendo esta diferencia significativa tanto para el ictus isquémico (58,5% vs. 65,2%) como para el hemorrágico (42,9% vs. 68%).
Evolución de los pacientes
| Total N=1.070 | Grupo A N=552 | Grupo B N=518 | p | |
| Pronóstico precoz | ||||
| Evolución favorable, n (%) | 708 (66,2) | 377 (68,3) | 331 (63,9) | 0,129 |
| Según tipo de ictus | ||||
| Isquémicos, n (%) | 642 (68,6) | 339 (71,5) | 303 (65,6) | 0,051 |
| Hemorrágicos, n (%) | 66 (49,3) | 38 (48,7) | 28 (50) | 0,884 |
| Mortalidad hospitalaria, n (%) | 62 (5,8) | 28 (5,1) | 34 (6,6) | 0,297 |
| Según tipo de ictus | ||||
| Isquémicos: n (%) | 47 (5) | 19 (4) | 28 (6,1) | 0,151 |
| Hemorrágicos: n (%) | 15 (11,2) | 9 (11,5) | 6 (10,7) | 0,881 |
| Total N=1.021 | Grupo A N=540 | Grupo B N=481 | p | |
| Pronóstico a 90 díasa | ||||
| Total de la muestra | ||||
| Rankin, mediana (rango) | 2 (1-4) | 2 (1-5) | 2 (1-4) | 0,018 |
| Independientes, n (%) | 619 (60,6) | 304 (56,3) | 315 (65,5) | 0,003 |
| Mortalidad, n (%) | 132 (12,9) | 69 (12,8) | 63 (13,1) | 0,879 |
| Según tipo de ictus | ||||
| Isquémicos, n | 894 | 463 | 431 | 0,304 |
| Rankin, mediana (rango) | 2 (1-4) | 2 (1-5) | 2 (1-4) | 0,04 |
| Independientes, n (%) | 552 (61,7) | 271 (58,5) | 281 (65,2) | 0,419 |
| Mortalidad, n (%) | 108 (12,1) | 52 (11,2) | 56 (13) | |
| Hemorrágicos, n | 127 | 77 | 50 | 0,001 |
| Rankin, mediana (rango) | 2 (1-5) | 4 (2-5) | 2 (0-3) | 0,006 |
| Independientes, n (%) | 67 (52,8) | 33 (42,9) | 34 (68) | 0,256 |
| Mortalidad, n (%) | 24 (18,9) | 17 (22,1) | 7 (14) | |
NIHSS: National Institute of Health Stroke Scale.
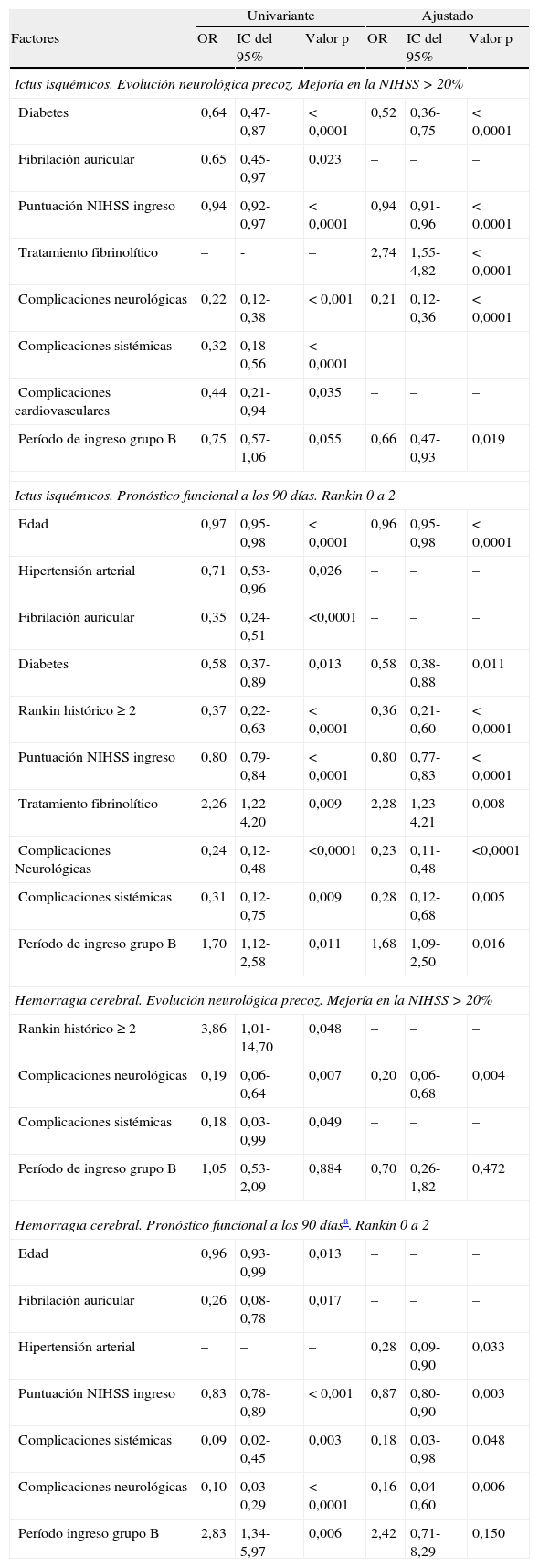
En cuanto a los factores asociados a la evolución favorable precoz y a la situación funcional de independencia a los 90 días (tabla 3), observamos cómo para el ictus isquémico el período de ingreso no se relacionó a una evolución favorable precoz en el análisis univariante, aunque tras el análisis ajustado sí se asoció de forma significativa (grupo B: OR=0,66 (0,47-0,93]). En cuanto a la situación funcional de independencia, el período de ingreso del grupo B se asoció de forma favorable tanto en el análisis univariante (OR=1,70 [1,12-2,58]) como en el ajustado (OR=1,68 [1,09-2,50]). Para el ictus hemorrágico, el período de ingreso no se asoció a una evolución favorable precoz y sí lo hizo para la situación funcional de independencia a los 90 días en el análisis univariante (grupo B: OR=2,83 [1,34-5,97]; p=0,006), no así tras el análisis ajustado (grupo B: OR=2,42 [IC del 95%, 0,71-8,29]; p=0,150).
Factores asociados a la evolución neurológica favorable precoz e independencia a 90 días
| Univariante | Ajustado | |||||
| Factores | OR | IC del 95% | Valor p | OR | IC del 95% | Valor p |
| Ictus isquémicos. Evolución neurológica precoz. Mejoría en la NIHSS > 20% | ||||||
| Diabetes | 0,64 | 0,47-0,87 | < 0,0001 | 0,52 | 0,36-0,75 | < 0,0001 |
| Fibrilación auricular | 0,65 | 0,45-0,97 | 0,023 | – | – | – |
| Puntuación NIHSS ingreso | 0,94 | 0,92-0,97 | < 0,0001 | 0,94 | 0,91-0,96 | < 0,0001 |
| Tratamiento fibrinolítico | – | - | – | 2,74 | 1,55-4,82 | < 0,0001 |
| Complicaciones neurológicas | 0,22 | 0,12-0,38 | < 0,001 | 0,21 | 0,12-0,36 | < 0,0001 |
| Complicaciones sistémicas | 0,32 | 0,18-0,56 | < 0,0001 | – | – | – |
| Complicaciones cardiovasculares | 0,44 | 0,21-0,94 | 0,035 | – | – | – |
| Período de ingreso grupo B | 0,75 | 0,57-1,06 | 0,055 | 0,66 | 0,47-0,93 | 0,019 |
| Ictus isquémicos. Pronóstico funcional a los 90 días. Rankin 0 a 2 | ||||||
| Edad | 0,97 | 0,95-0,98 | < 0,0001 | 0,96 | 0,95-0,98 | < 0,0001 |
| Hipertensión arterial | 0,71 | 0,53-0,96 | 0,026 | – | – | – |
| Fibrilación auricular | 0,35 | 0,24-0,51 | <0,0001 | – | – | – |
| Diabetes | 0,58 | 0,37-0,89 | 0,013 | 0,58 | 0,38-0,88 | 0,011 |
| Rankin histórico ≥ 2 | 0,37 | 0,22-0,63 | < 0,0001 | 0,36 | 0,21-0,60 | < 0,0001 |
| Puntuación NIHSS ingreso | 0,80 | 0,79-0,84 | < 0,0001 | 0,80 | 0,77-0,83 | < 0,0001 |
| Tratamiento fibrinolítico | 2,26 | 1,22-4,20 | 0,009 | 2,28 | 1,23-4,21 | 0,008 |
| Complicaciones Neurológicas | 0,24 | 0,12-0,48 | <0,0001 | 0,23 | 0,11-0,48 | <0,0001 |
| Complicaciones sistémicas | 0,31 | 0,12-0,75 | 0,009 | 0,28 | 0,12-0,68 | 0,005 |
| Período de ingreso grupo B | 1,70 | 1,12-2,58 | 0,011 | 1,68 | 1,09-2,50 | 0,016 |
| Hemorragia cerebral. Evolución neurológica precoz. Mejoría en la NIHSS > 20% | ||||||
| Rankin histórico ≥ 2 | 3,86 | 1,01-14,70 | 0,048 | – | – | – |
| Complicaciones neurológicas | 0,19 | 0,06-0,64 | 0,007 | 0,20 | 0,06-0,68 | 0,004 |
| Complicaciones sistémicas | 0,18 | 0,03-0,99 | 0,049 | – | – | – |
| Período de ingreso grupo B | 1,05 | 0,53-2,09 | 0,884 | 0,70 | 0,26-1,82 | 0,472 |
| Hemorragia cerebral. Pronóstico funcional a los 90 díasa. Rankin 0 a 2 | ||||||
| Edad | 0,96 | 0,93-0,99 | 0,013 | – | – | – |
| Fibrilación auricular | 0,26 | 0,08-0,78 | 0,017 | – | – | – |
| Hipertensión arterial | – | – | – | 0,28 | 0,09-0,90 | 0,033 |
| Puntuación NIHSS ingreso | 0,83 | 0,78-0,89 | < 0,001 | 0,87 | 0,80-0,90 | 0,003 |
| Complicaciones sistémicas | 0,09 | 0,02-0,45 | 0,003 | 0,18 | 0,03-0,98 | 0,048 |
| Complicaciones neurológicas | 0,10 | 0,03-0,29 | < 0,0001 | 0,16 | 0,04-0,60 | 0,006 |
| Período ingreso grupo B | 2,83 | 1,34-5,97 | 0,006 | 2,42 | 0,71-8,29 | 0,150 |
IC del 95%: intervalo de confianza del 95%; NIHSS: National Institute of Health Stroke Scale; OR: odds ratio.
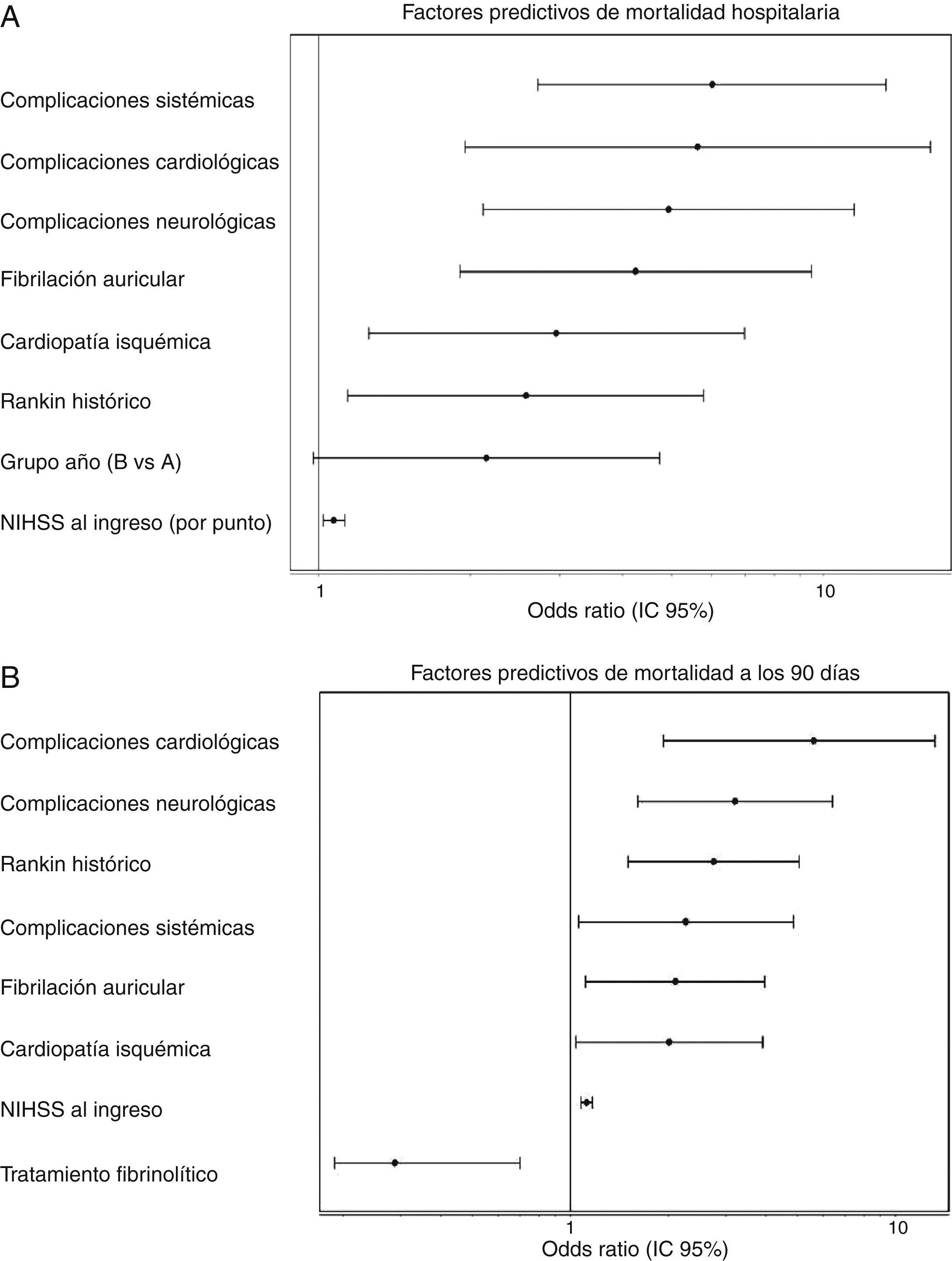
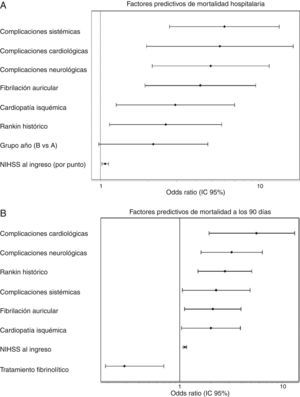
Para la mortalidad, tanto hospitalaria como a los 90 días, el período de ingreso no se relacionó de forma significativa ni en el análisis univariante ni en el multivariante. En el análisis univariante, para el ictus isquémico, el período de ingreso del grupo B alcanzó una OR de 1,54 (0,85-2,80), p=0,153, para la mortalidad hospitalaria mientras que para la mortalidad a los 90 días fue de OR de 1,18 (0,78-1,76), p=0,420. En la figura 1 se muestra cómo en el análisis multivariante el período de ingreso no se asoció, para el ictus isquémico, ni con la mortalidad hospitalaria (grupo B: OR=2,51 [0,977-4,736]; p=0,051) ni con la mortalidad a los 90 días (grupo B: OR=1,394 [0,822-2,599]; p 0,105). Para el ictus hemorrágico, el período de ingreso no se asoció de forma significativa ni a la mortalidad hospitalaria ni a los 90 días (OR=0,92 [0,308-2,751]; p=0,881 y OR 0,575 [0,219-1,506]; p=0,260, respectivamente]. El principal predictor, en análisis ajustado, para la mortalidad hospitalaria fue la puntuación en la escala NIHSS al ingreso (OR=1,399 [1,140-1,717], p<0,0001), mientras que para la mortalidad a los 90 días estos fueron la puntuación en la escala NIHSS al ingreso (OR=1,158 [1,033-1,288]; p<0,0001), la edad (OR=1,123 [1,022-1,234]; p=0,014), la presencia de fibrilación auricular (OR=9,19 [1,432-58,979]; p=0,001) y la aparición de complicaciones sistémicas (OR=23,058 [IC del 95%, 4,145-128,12]; p<0,0001).
A) Factores predictivos de mortalidad hospitalaria. Análisis multivariante ajustado. Test Hosmer-Lemeshov 2,241 (p=0,973). ROC 0,883 (0,830-0,936) p<0,0001. B) Factores predictivos de mortalidad a los 90 días. Análisis multivariante ajustado. Test Hosmer-Lemeshov 3,976 (p=0,944). ROC 0,858 (0,815-0,901) p<0,0001.
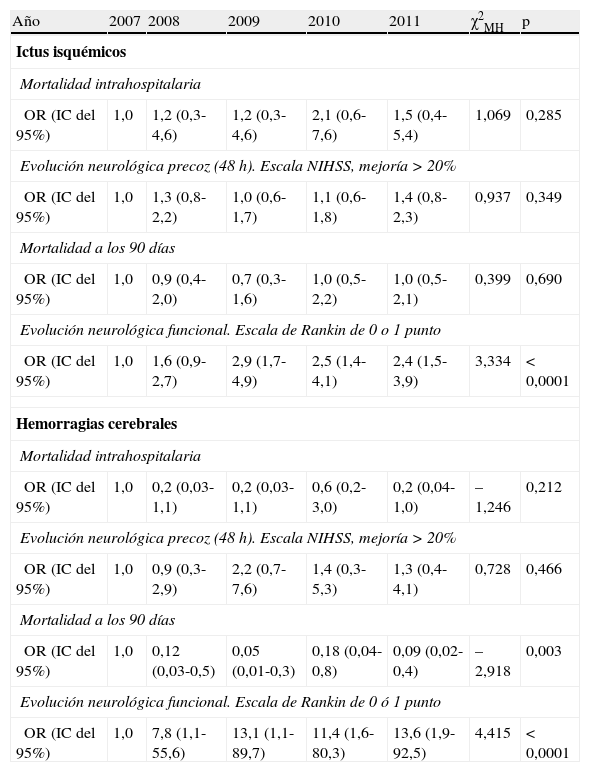
El análisis de tendencias (tabla 4) para la mortalidad hospitalaria y a 90 días, así como para el pronóstico precoz y a los 90 días, mostró cómo la situación funcional de independencia a los 90 días se relacionó con el período de ingreso de forma significativa, tanto para el ictus isquémico como para el hemorrágico.
Test de tendencia lineal de Mantel-Haenszel según subtipo etiológico y año de ingreso para cada una de las variables pronosticas del estudio
| Año | 2007 | 2008 | 2009 | 2010 | 2011 | χ2MH | p |
| Ictus isquémicos | |||||||
| Mortalidad intrahospitalaria | |||||||
| OR (IC del 95%) | 1,0 | 1,2 (0,3-4,6) | 1,2 (0,3-4,6) | 2,1 (0,6-7,6) | 1,5 (0,4-5,4) | 1,069 | 0,285 |
| Evolución neurológica precoz (48 h). Escala NIHSS, mejoría > 20% | |||||||
| OR (IC del 95%) | 1,0 | 1,3 (0,8-2,2) | 1,0 (0,6-1,7) | 1,1 (0,6-1,8) | 1,4 (0,8-2,3) | 0,937 | 0,349 |
| Mortalidad a los 90 días | |||||||
| OR (IC del 95%) | 1,0 | 0,9 (0,4-2,0) | 0,7 (0,3-1,6) | 1,0 (0,5-2,2) | 1,0 (0,5-2,1) | 0,399 | 0,690 |
| Evolución neurológica funcional. Escala de Rankin de 0 o 1 punto | |||||||
| OR (IC del 95%) | 1,0 | 1,6 (0,9-2,7) | 2,9 (1,7-4,9) | 2,5 (1,4-4,1) | 2,4 (1,5-3,9) | 3,334 | < 0,0001 |
| Hemorragias cerebrales | |||||||
| Mortalidad intrahospitalaria | |||||||
| OR (IC del 95%) | 1,0 | 0,2 (0,03-1,1) | 0,2 (0,03-1,1) | 0,6 (0,2-3,0) | 0,2 (0,04-1,0) | –1,246 | 0,212 |
| Evolución neurológica precoz (48 h). Escala NIHSS, mejoría > 20% | |||||||
| OR (IC del 95%) | 1,0 | 0,9 (0,3-2,9) | 2,2 (0,7-7,6) | 1,4 (0,3-5,3) | 1,3 (0,4-4,1) | 0,728 | 0,466 |
| Mortalidad a los 90 días | |||||||
| OR (IC del 95%) | 1,0 | 0,12 (0,03-0,5) | 0,05 (0,01-0,3) | 0,18 (0,04-0,8) | 0,09 (0,02-0,4) | –2,918 | 0,003 |
| Evolución neurológica funcional. Escala de Rankin de 0 ó 1 punto | |||||||
| OR (IC del 95%) | 1,0 | 7,8 (1,1-55,6) | 13,1 (1,1-89,7) | 11,4 (1,6-80,3) | 13,6 (1,9-92,5) | 4,415 | < 0,0001 |
IC del 95%: intervalo de confianza al 95%; NIHSS: National Institute of Health Stroke Scale; OR: odds ratio; χ2MH: estadístico de Mantel-Haenszel.
En este estudio se observa que tanto la evolución precoz como la situación funcional a los 90 días de los pacientes que son atendidos en la UI es similar a la de los resultados publicados por otras UI de nuestro entorno12, confirmándose que la situación funcional de los pacientes a los 3 meses del ictus fue mejor en aquellos que fueron atendidos cuando la experiencia acumulada en la UI era mayor19, sin observar diferencias ni en la evolución favorable precoz ni en la mortalidad.
Los factores asociados a una peor evolución favorable precoz y a la mortalidad, tanto hospitalaria como a los 90 días, fueron la presencia de diabetes mellitus, fibrilación auricular, la gravedad del ictus al ingreso y la aparición de complicaciones, variables bien establecidas en la literatura20, siendo esperable que el período temporal, por el que definimos los grupos A y B, tenga una escasa influencia para modificar esta evolución, una vez que la atención y los tratamientos dispensados se realizan de forma protocolizada en nuestra UI. La diferencia existente entre ambos grupos, tras el análisis ajustado, para una peor evolución favorable precoz en el ictus isquémico, es probable que se debiera a la mayor frecuencia de complicaciones neurológicas en el grupo B, motivada por el mayor porcentaje de ictus más graves en este grupo (ictus tipo TACI); sin embargo, estas diferencias en la distribución de los subtipos de ictus isquémico no influyó ni en la mortalidad hospitalaria ni a los 90 días debido, probablemente, al mayor número de tratamiento fibrinolítico realizados en el grupo B para pacientes con ictus tipo TACI.
Sí se observaron diferencias en la situación funcional a los 90 días en los pacientes con ictus isquémicos y hemorrágicos. En el caso de los ictus isquémicos, las diferencias observadas no son atribuibles ni a las características demográficas de los pacientes ni a la gravedad del ictus al ingreso, ya que fueron similares en ambos grupos, y equiparables a la de los pacientes atendidos en otras UI12,22. A pesar de la relación existente en nuestro estudio entre la gravedad del ictus y un peor pronóstico funcional, y a las recientes descripciones de una menor eficacia de las UI en el pronóstico funcional de los pacientes con infartos de tipo lacunar23, la influencia de la distinta distribución en los subtipos de ictus en nuestra serie no se relacionó con la situación funcional a los 90 días tras realizar el análisis ajustado. A las mismas conclusiones podemos llegar en referencia al tratamiento fibrinolítico que, como era de esperar tras la ampliación de la ventana de tratamiento24 y el mayor número de derivaciones desde otros hospitales a nuestra UI21, fue más frecuente en los pacientes del grupo B; sin embargo, tras el análisis ajustado, los pacientes atendidos en el grupo B seguían teniendo un mejor pronóstico funcional a 90 días. Para el ictus hemorrágico la pérdida de asociación, en el análisis ajustado, entre el período de ingreso del grupo B y la situación funcional de independencia a los 90 días pudo deberse a la diferencia en la frecuencia de complicaciones sistémicas existentes entre ambos grupos, ya que la aparición de este tipo de complicaciones fue uno de los principales factores predictores de mala evolución funcional a los 90 días.
Con los resultados de nuestro estudio, resulta difícil determinar los motivos por los que los pacientes atendidos en el grupo B presentaban una mejor situación funcional a los 90 días. Son varias las causas que parecen relacionar la atención en una UI con una menor mortalidad y una mayor probabilidad de independencia, destacándose la atención especializada precoz, el control de factores relacionados con una peor evolución de la enfermedad y la prevención y la detección precoz de complicaciones neurológicas y sistémicas25–27. En nuestro caso, teniendo en cuenta que el equipo responsable no ha variado en el tiempo analizado, es probable que la experiencia acumulada haya permitido una mejor atención a estos factores. Además, tanto la mejor conexión con los servicios extrahospitalarios, que permite una atención más precoz de los pacientes, como con los servicios de rehabilitación y el inicio de esta de forma precoz, se han relacionado con un mejor pronóstico funcional28,29. En nuestra UI, se produjo un aumento progresivo en el volumen de pacientes ingresados al año (261 en el año 2008 vs. 350 en el año 2011), siendo este un factor que parece influir, de forma significativa, en la evolución funcional de los pacientes, fundamentalmente debido a la calidad de los cuidados recibidos, aunque, como en nuestra experiencia, no parece que influya en la mortalidad19.
Una limitación de nuestro estudio es la arbitraria diferenciación temporal por la que hemos definido los grupos A y B. Sin embargo, dado el tiempo de funcionamiento de nuestra UI (54 meses), decidimos agrupar a los pacientes en al menos 2 años para obtener una muestra amplia en cada grupo y para hacerlos más homogéneos, evitando posibles diferencias en las características de los pacientes ingresados en períodos más cortos. De tal forma, en nuestro análisis obtuvimos una muestra amplia para cada grupo, además de ser estos homogéneos tanto en las características de los pacientes, el tipo de ictus y en la gravedad de la enfermedad, aunque no para los distintos subtipos de ictus isquémicos, ni para el porcentaje de tratamiento fibrinolítico sistémico.
Por tanto, con nuestro estudio podemos concluir que se obtuvo una mayor probabilidad de independencia funcional a los 90 días en los pacientes atendidos en nuestra UI en el período 2010-2011 frente al período 2007-2009, sin que se observasen diferencias en la evolución precoz ni en la mortalidad a los 3 meses, y que, con las limitaciones reseñadas, esta diferencia podría relacionarse con la experiencia acumulada por el personal dedicado a la atención al ictus en la misma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de enfermería de la Sección de Neurología y fisioterapeutas de nuestro hospital. Al personal de los Servicios de Urgencias y Emergencias 112 de los hospitales de Extremadura.