La tractografía cerebral es una técnica que permite visualizar los fascículos de sustancia blanca que conectan distintas partes del cerebro y realizar estudios cuantitativos de diversa índole sobre ellos. En este trabajo de investigación se realizó un estudio cuantitativo por tractografía cerebral mediante imágenes de resonancia magnética potenciadas en difusión en pacientes con deterioro cognitivo leve, enfermedad de Alzheimer y controles normales, con el fin de analizar la reproducibilidad y validez de los resultados.
Sujetos y métodosSe realizaron mediciones de anisotropía fraccional (FA) y difusividad media (MD) en el fascículo uncinado y el fascículo cingulado posterior, en imágenes obtenidas de una base de datos y de un centro de investigación, en 52 sujetos distribuidos en los 3 grupos de interés. Dos observadores realizaron las mediciones 2 veces para evaluar la reproducibilidad intra- e interobservador.
ResultadosEn el estudio de reproducibilidad se obtuvieron coeficientes de correlación intraclase superior a 0,9 para las medidas de FA y MD del fascículo uncinado, y mayor de 0,68 para las del fascículo cingulado posterior. Los pacientes con enfermedad de Alzheimer mostraron menores valores de FA y mayores valores de MD para el fascículo uncinado derecho correspondiente al centro de investigación. Existieron diferencias significativas en la comparación entre los datos de la base de datos y los del centro de investigación.
ConclusionesSe estableció una metodología reproducible para realizar tractografía en los fascículos estudiados. Los índices de FA y MD podrían ser indicadores tempranos de la enfermedad de Alzheimer, siendo necesario considerar el equipo y el método de adquisición de imágenes ya que pueden influir en los resultados como se comprobó en la comparación entre los 2 conjuntos de datos empleados.
Brain tractography is a non-invasive medical imaging technique which enables in vivo visualisation and various types of quantitative studies of white matter fibre tracts connecting different parts of the brain. We completed a quantitative study using brain tractography with diffusion tensor imaging in patients with mild cognitive impairment, patients with Alzheimer disease, and normal controls, in order to analyse the reproducibility and validity of the results.
Subjects and methodsFractional anisotropy (FA) and mean diffusivity (MD) were measured across the uncinate fasciculus and the posterior cingulate fasciculus in images, obtained from a database and a research centre, representing 52 subjects distributed among the 3 study groups. Two observers took the measurements twice in order to evaluate intra- and inter-observer reproducibility.
ResultsMeasurements of FA and MD of the uncinate fasciculus delivered an intraclass correlation coefficient above 0.9; ICC was above 0.68 for the posterior cingulate fasciculus. Patients with Alzheimer disease showed lower values of FA and higher MD values in the right uncinate fasciculus in images from the research centre. A comparison of the measurements from the 2 centres revealed significant differences.
ConclusionWe established a reproducible methodology for performing tractography of the tracts in question. FA and MD indexes may serve as early indicators of Alzheimer disease. The type of equipment and the method used to acquire images must be considered because they may alter results as shown by comparing the 2 data sets in this study.
La imagen por tensor de difusión (DTI) es una técnica especial de imágenes por resonancia magnética (RM) que se basa en la difusión del agua en los tejidos biológicos1. La tractografía cerebral utiliza las imágenes DTI para reconstruir y representar en 3D las conexiones de sustancia blanca del cerebro. Esta es actualmente la única técnica que permite visualizar los fascículos cerebrales in vivo y de forma no invasiva2. No obstante, es necesaria la validación de la técnica para que los resultados reflejen detalles anatómicos verdaderos, que sean suficientemente reproducibles y puedan ser empleados en análisis cuantitativos3. Aunque existen disponibles diversos programas informáticos que permiten realizar tractografía, algunos de uso libre con fines de investigación, los resultados obtenidos con uno u otro pueden sufrir variaciones sea por el algoritmo que emplean o por la manejabilidad de los mismos, ya que la reproducibilidad depende en cierto grado de la interacción del usuario con el programa informático4. En los estudios multicéntricos también existen variaciones debido a los distintos equipos de RM y al protocolo empleado para la adquisición de las imágenes DTI; estos pueden influir en la cuantificación de los resultados empleando tractografía tal como lo indican Fischer et al.5 y Heiervang et al.6, que encontraron diferencias en la cuantificación de los fascículos cerebrales aplicando distintos gradientes de difusión. Además, en el consorcio Alzheimer's Disease Neuroimaging Initiative (ADNI) se ha estimado que la variación entre equipos de 1,5T y 3T cambia en un 5% el diagnóstico automatizado de enfermedad de Alzheimer (EA) basado en volumetría7.
La EA es la demencia más frecuente cuyo síntoma más precoz y notorio es la pérdida de memoria8. El deterioro cognitivo leve (DCL) se refiere al estado clínico previo a la demencia, en donde se manifiestan los primeros cambios en la memoria y habilidades cognitivas que pueden ser notados por otras personas pero que no son tan severos como para interferir en la vida cotidiana del que lo sufre9. En la revisión de Chua et al., 200810, se menciona que existen diferencias en la cuantificación de ciertos fascículos en el DCL y en la EA. Debido a esto es muy probable que la tractografía sea una potencial herramienta clínica para la detección temprana y control de la enfermedad en pacientes con dichas enfermedades. Estudios previos demuestran la disminución de las conexiones de sustancia blanca en pacientes con DCL y EA, sobre todo un aumento de la difusividad media (MD) y una disminución de la anisotropía fraccional (FA) de estos pacientes en comparación con controles normales. Estos cambios fueron encontrados en el fascículo cingulado posterior (PCF)11–13, en el fascículo uncinado (UNC)14,15 y en ambos16.
Como hasta el momento no existe estudio en la bibliografía en español sobre la reproducibilidad de la tractografía ni su aplicación en la EA, se presenta este trabajo de investigación cuyo objetivo fue estudiar la reproducibilidad en la cuantificación mediante tractografía cerebral de determinados fascículos, empleando una herramienta informática dada y DTI de pacientes con DCL, EA y controles normales, provenientes de una base de datos y de un centro de investigación.
Sujetos y métodosSe emplearon imágenes de RM potenciadas en difusión descargadas de la base de datos de la ADNI (adni.loni.ucla.edu), y otras facilitadas por la Fundación Centro de Investigación de Enfermedades Neurológicas (CIEN) de Madrid (www.fundacioncien.es).
Sobre Alzheimer's Disease Neuroimaging Initiative y la Fundación Centro de Investigación de Enfermedades NeurológicasEl consorcio ADNI fue lanzado en el 2003 por el National Institute on Aging, el National Institute of Biomedical Imaging and Bioengineering, la Food and Drug Administration, compañías farmacéuticas privadas y organizaciones sin fines de lucro, como un consorcio público-privado a 5 años y con una financiación de 60 millones de dólares. El principal propósito de ADNI ha sido verificar si era posible el combinar parámetros de imágenes de RM, de tomografía por emisión de positrones así como otros marcadores biológicos, junto con una valoración clínica y neuropsicológica para medir la progresión del DCL y de estadios tempranos de la EA. El principal investigador de la iniciativa es el Dr. Michael W. Weiner, VA Medical Center and University of California – San Francisco. Se puede encontrar más información en www.adni-info.org.
La Fundación CIEN nació con el objeto de fomentar la creación de un centro en red que apoye, promocione y coordine la investigación en todos los campos de la neurología básica, clínica y epidemiológica, con especial énfasis en los problemas relacionados con las enfermedades del sistema nervioso, a través de núcleos de investigación distribuidos por la geografía española y articulados como centros de investigación monográficos, con científicos que trabajen en diversas líneas dentro de las neurociencias y dispongan de una infraestructura física y un equipamiento común. Se le asignó la gestión de la Unidad de Investigación del Proyecto Alzheimer una vez que la Fundación Reina Sofía cedió el uso del edificio a la Fundación CIEN. La Unidad permite la investigación de forma prioritaria de la EA y otras demencias y de forma complementaria la investigación sobre otras enfermedades neurodegenerativas.
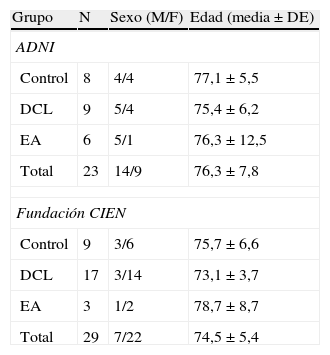
Población de estudioEn total se estudiaron 52 sujetos, 23 de ADNI y 29 de CIEN, 21 varones y 31 mujeres, de los cuales 17 eran controles normales, 26 DCL y 9 EA, con una edad de 75,3±6,5 años (media±desviación típica), (rango 55–90 años), sin diferencias en la edad respecto al grupo diagnóstico. En la tabla 1 se presenta la descripción de la muestra estudiada clasificada por grupos. Los pacientes con EA presentaban un miniexamen cognoscitivo 23,3±2,1 con edad 75,5±7,5 y CDR (clasificación clínica de demencia) 1-2. Los pacientes con DCL no presentaban otros signos neurológicos con un miniexamen cognoscitivo 27,2±1,7; déficit de memoria verbal medido con WMS-R Logical Memory II parte A 5,9±5,2 (máximo, 25) y un índice CDR 0,5.
Descripción de la población de estudio
| Grupo | N | Sexo (M/F) | Edad (media±DE) |
| ADNI | |||
| Control | 8 | 4/4 | 77,1±5,5 |
| DCL | 9 | 5/4 | 75,4±6,2 |
| EA | 6 | 5/1 | 76,3±12,5 |
| Total | 23 | 14/9 | 76,3±7,8 |
| Fundación CIEN | |||
| Control | 9 | 3/6 | 75,7±6,6 |
| DCL | 17 | 3/14 | 73,1±3,7 |
| EA | 3 | 1/2 | 78,7±8,7 |
| Total | 29 | 7/22 | 74,5±5,4 |
ADNI: Alzheimer's Disease Neuroimaging Initiative (adni.loni.ucla.edu); CIEN: Fundación Centro de Investigación de Enfermedades Neurológicas, Madrid (www.fundacioncien.es); DCL: deterioro cognitivo leve; DE: desviación estándar; EA: enfermedad de Alzheimer.
Los datos descargados de la base de datos de ADNI fueron adquiridos con un equipo de RM de 3T de la marca General Electric, modelo Discovery MR750. Secuencia de imagen eco planar con tiempo de eco de 61,9ms y tiempo de repetición de 9.050ms. Se usaron 41 direcciones de gradiente de difusión independientes con valor b de 1.000 s/mm2, y 5 volúmenes sin potenciación de difusión con valor b igual a 0. Matriz de imagen de 256×256 con tamaño de píxel de 1,36mm. Por otra parte, los de la Fundación CIEN fueron adquiridos con un equipo de RM de 3T de la marca General Electric, modelo Signa HDx. Secuencia de imagen eco planar con tiempo de eco de 84,9ms y tiempo de repetición de 8.200ms. Con 15 direcciones de gradiente de difusión independientes con valor b de 1.000 s/mm2, y un volumen sin potenciación de difusión con valor b igual a 0. Matriz de imagen de 256×256 con tamaño de píxel de 0,93mm. Todos los datos estaban en formato DICOM y se convirtieron al formato NITFI con la herramienta dcm2nii disponible dentro del paquete de MRIcron (www.mccauslandcenter.sc.edu/mricro/mricron/).
Fascículos estudiadosEn el estudio realizado por Morikawa et al. en 201017 encontraron que en el UNC los índices de anisotropía y difusividad están correlacionados significativamente con la capacidad cognitiva en personas con EA. Teniendo en cuenta estudios previos13–17, y la hipótesis de que el UNC y el PCF cumplen un papel importante en el conocimiento y la memoria16, se decidió estudiar estos fascículos en ambos hemisferios cerebrales. Se midió la FA y la MD, el volumen y el número de fibras en cada una de ellas para estudiar la reproducibilidad de las mismas. Siendo FA y MD los índices de importancia diagnóstica según estudios previos, se hicieron comparaciones entre los grupos de estudio para cada conjunto de datos (ADNI por un lado y, por otro, CIEN), y luego una comparación entre estas últimas.
TractografíaLas reconstrucciones de los fascículos UNC y PCF fueron realizadas con el programa MedINRIA 1.9.2 (http://med.inria.fr/)18, el cual utiliza un algoritmo determinístico que emplea la estimación de 2 modelos de tensores. Empezando desde un punto semilla, cada fibra es trazada siguiendo el tensor cuya principal dirección de difusión es la más cercana a la dirección anterior19. La tractografía fue realizada con umbral de FA1 y FA2 de 0,2; siendo FA1 el umbral a partir del cual el algoritmo empieza a reconstruir las fibras y FA2 el umbral que indica que se reconstruyen las fibras hasta que su FA sea menor a este valor. La longitud mínima de las fibras fue especificada en 10mm; es decir, que fibras inferiores a esa longitud no fueron obtenidas. Las fibras fueron reconstruidas vóxel por vóxel con un umbral de reducción de 500, por debajo del cual los tensores no fueron estimados ya que correspondían a zonas de la imagen que no eran de interés para la obtención de los fascículos estudiados. También se empleó el filtro propio de MedINRIA para reducir el ruido presente en las imágenes.
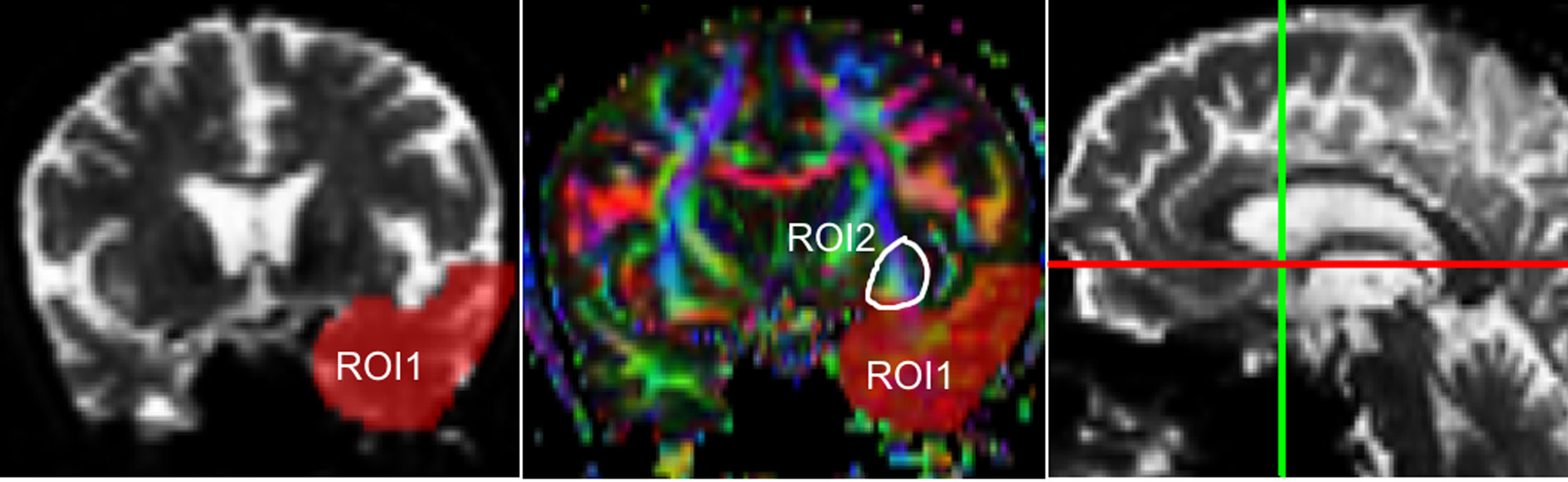
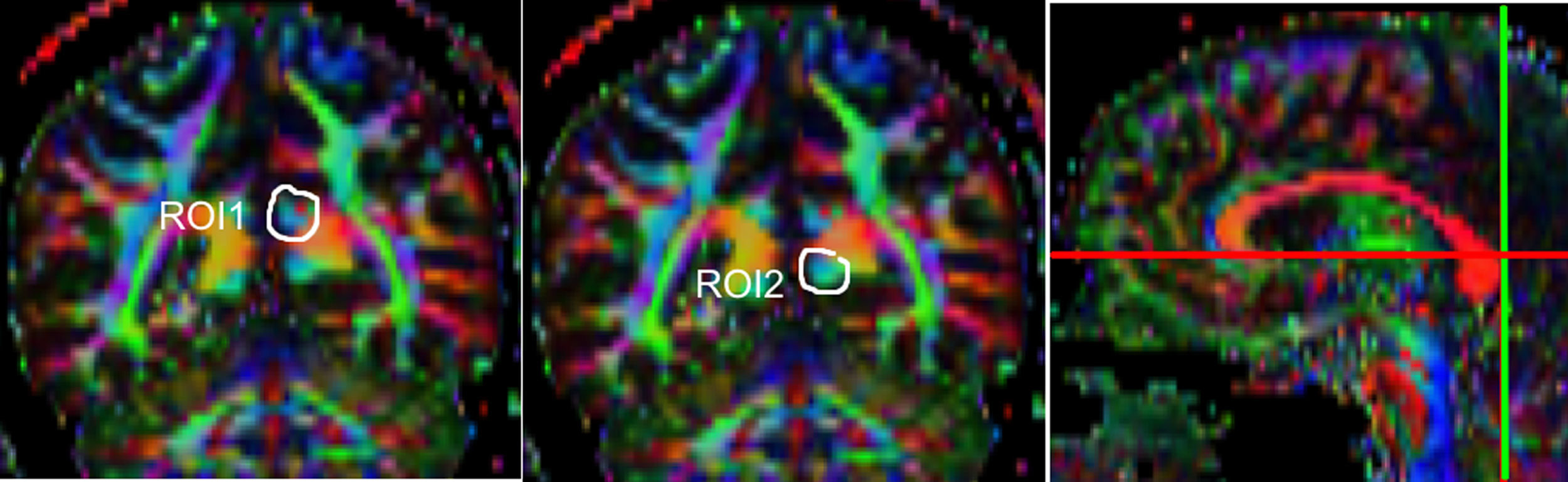
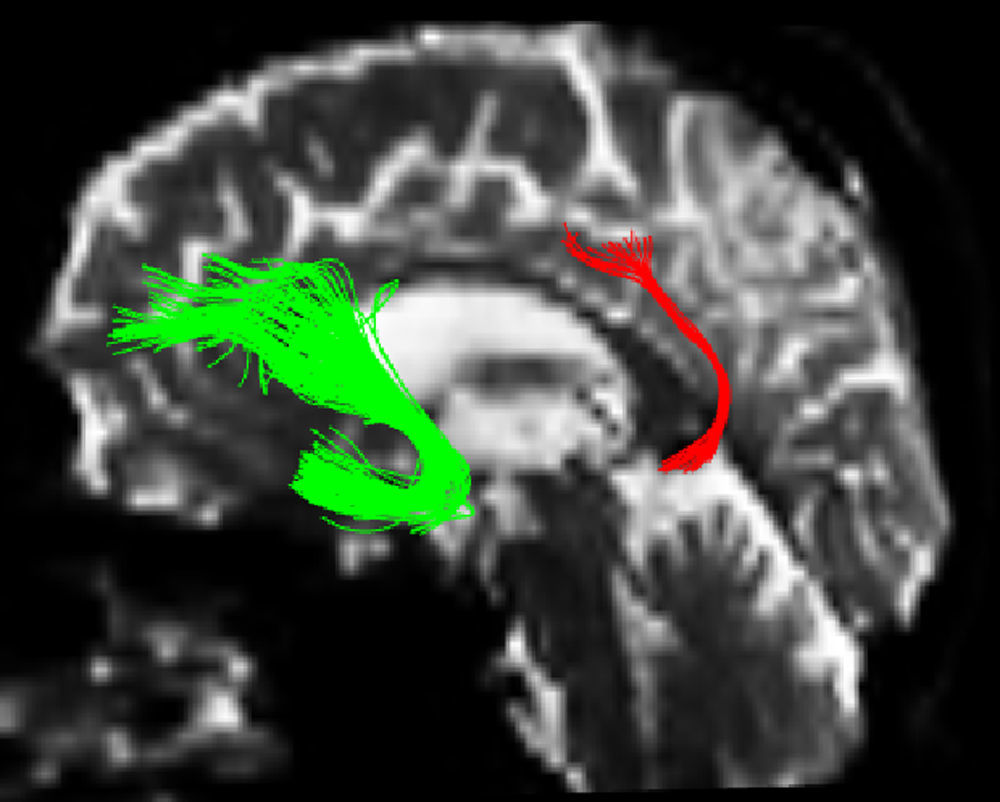
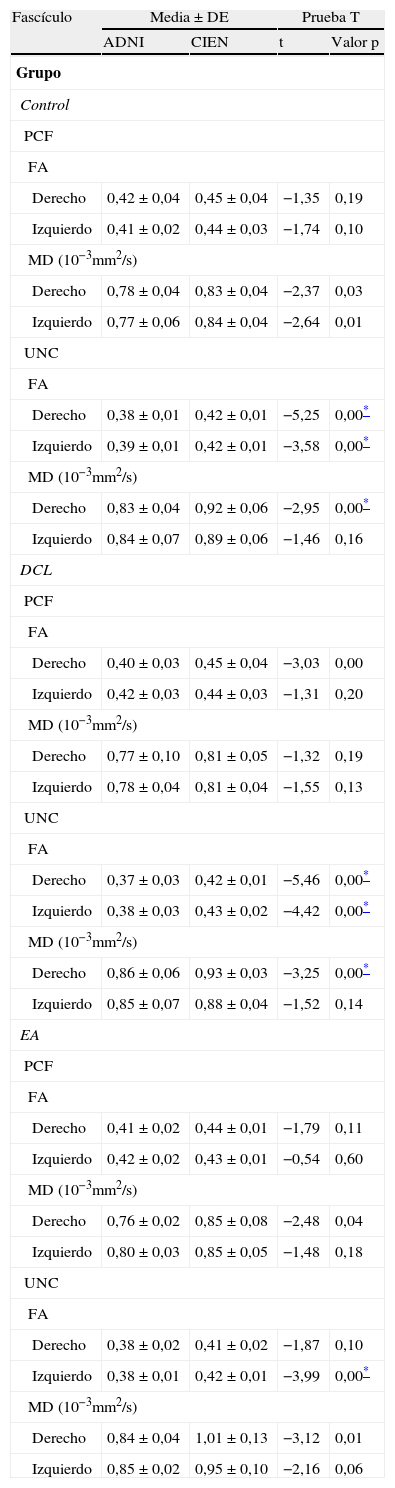
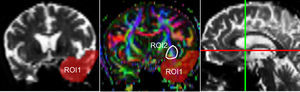
Una de las principales fuentes de variación proviene de la ubicación de las regiones de interés (ROI) para identificar fascículos de sustancia blanca específicos3. Existen distintos métodos de posicionamiento pudiendo variar la localización, el tamaño y la forma de las ROI; además los fascículos extraídos con esta técnica pueden incluir varias fibras que no corresponden a la de interés6. Como en este trabajo se estudió la reproducibilidad de las medidas entre 2 observadores, previamente se definió un protocolo para la ubicación de las ROI que permita reconstruir dichos fascículos. Estos protocolos se basan en los descritos por Wakana et al.3 para el UNC y por Kiuchi et al.16 para el PCF. En la figura 1 .se ven las ubicaciones de las ROI y la ubicación del corte coronal sobre un corte sagital para seleccionar el UNC izquierdo. Se dibujan 2 ROI sobre un corte coronal, que sería el más posterior en donde el lóbulo temporal y el frontal están separados, utilizando una imagen sin potenciación en difusión (b0) para apreciar mejor la anatomía. La primera ROI (rojo) se dibuja de manera que cubra todo el lóbulo temporal y la segunda (blanco) que cubra las proyecciones sobre el lóbulo frontal. Para la segunda ROI es mejor utilizar una imagen FA color para apreciar esta proyección que sería la pequeña zona verde de la imagen que se muestra marcada como ROI2. Luego se emplea una opción AND para que solo las fibras que pasen por ambas ROI marcadas sean seleccionadas. Para el PCF, empleando un mapa FA color se ubica un corte coronal tal que se puedan apreciar 2 proyecciones del PCF sobre ella, entonces se dibuja una primera ROI sobre una proyección y la segunda ROI sobre la otra proyección. En la figura 2 .se muestran estas ubicaciones, en donde las proyecciones del PCF se distinguen en el mapa FA color como zonas azules, y la ubicación del corte coronal sobre un corte sagital para seleccionar el PCF. También se emplea una opción AND para que solo las fibras que pasen por ambas ROI marcadas sean seleccionadas. Estos protocolos para la ubicación de las ROI fueron incluidos en un manual de operaciones que fue entregado a un segundo observador para el estudio de reproducibilidad, y servirá como guía para personas interesadas en realizar tractografía con MedINRIA 1.9.2. En la figura 3 .se muestra un ejemplo de los fascículos obtenidos con el protocolo propuesto, donde se aprecia el UNC en verde y el PCF en rojo, ambos correspondientes al hemisferio cerebral izquierdo.
Se empleó el programa IBM SPSS Statistics versión 20 (IBM, NY, EE. UU.). El análisis de los datos fue llevado a cabo tomando separadamente los conjuntos de datos (ADNI y CIEN). Primeramente se comprobó que las medidas seguían una distribución normal utilizando la prueba de Kolmogorov-Smirnov. Se calculó el coeficiente de correlación intraclase (CCI) para analizar la reproducibilidad intra- e interobservador de las medidas de FA, MD, volumen y número de fibras para el UNC y el PCF derecho e izquierdo en todos los sujetos estudiados. Los valores del CCI por encima de 0,80 indican una excelente correspondencia, mientras que valores entre 0,60 y 0,79 indican acuerdo sustancial20. Empleando la prueba ANOVA de un factor se buscaron diferencias significativas entre las medias de los 3 grupos estudiados. La significación estadística fue establecida en α=0,05 para todas estas pruebas.
Como las imágenes empleadas provienen de 2 fuentes, es decir, adquiridas con equipos y protocolos diferentes, se hizo una prueba T para buscar diferencias significativas entre las medias de ambos conjuntos de datos. Debido a las múltiples comparaciones en cada grupo de sujetos se realizó un ajuste de Bonferroni obteniendo un nivel de significación 0,05/8=0,006 para cada uno de los grupos.
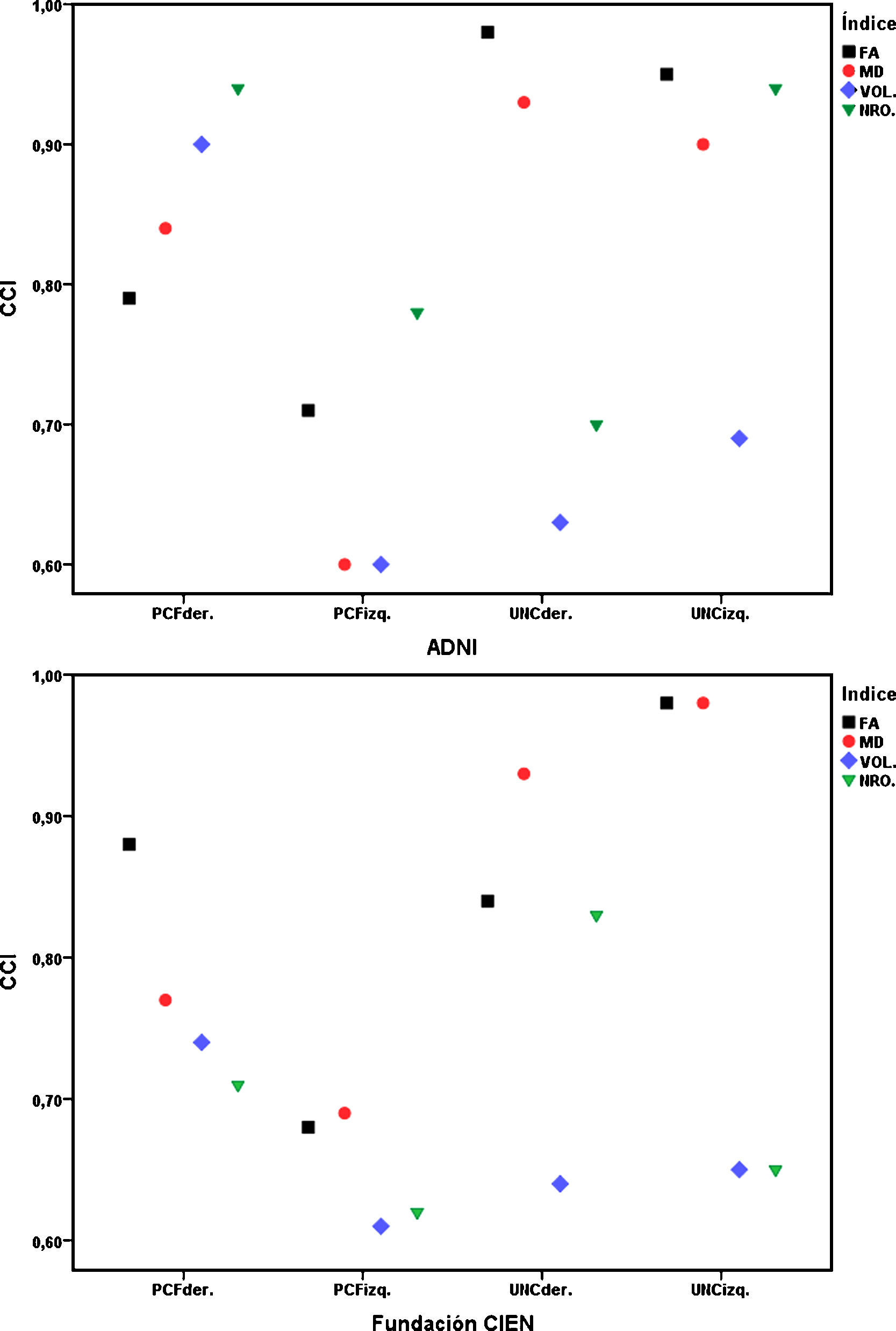
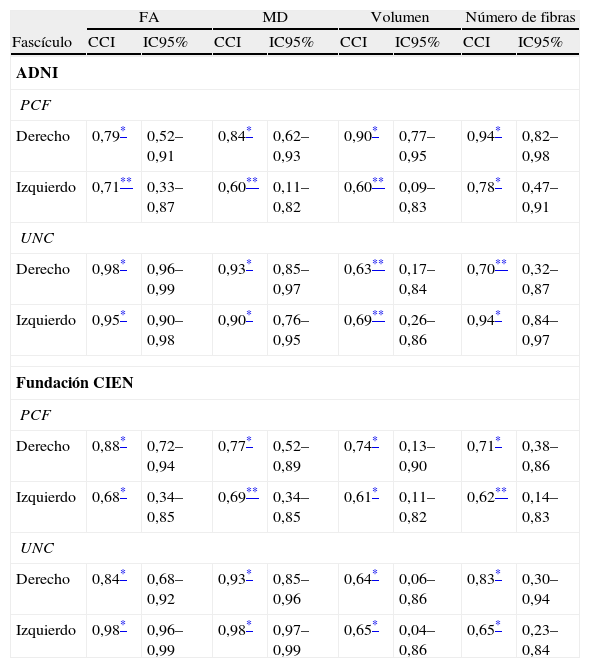
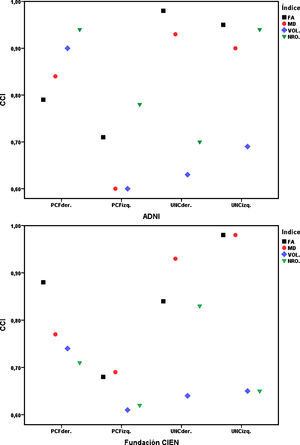
ResultadosTodas las variables siguen una distribución normal según la prueba de Kolmogorov-Smirnov. Los valores del CCI para la reproducibilidad intraobservador estuvieron dentro del rango de 0,90–0,99 para el UNC, y entre 0,68–0,86 para el PCF para las 4 variables medidas tanto para los datos de ADNI como para los de la Fundación CIEN, todos con intervalo de confianza de 95% y con significación estadística p<0,001. En la reproducibilidad interobservador se obtuvieron los valores mostrados en la tabla 2, donde los mayores valores del CCI corresponden a los índices FA y MD del UNC dentro del rango de 0,84–0,98, lo que indica excelente correspondencia, mientras que para el resto de las medidas se puede decir que se obtuvo una reproducibilidad sustancial. En la figura 4 se aprecian gráficamente los valores del CCI para las variables en la comparación interobservador, notándose la mejor reproducibilidad para los índices FA y MD correspondientes al UNC.
Reproducibilidad interobservador
| FA | MD | Volumen | Número de fibras | |||||
| Fascículo | CCI | IC95% | CCI | IC95% | CCI | IC95% | CCI | IC95% |
| ADNI | ||||||||
| PCF | ||||||||
| Derecho | 0,79* | 0,52–0,91 | 0,84* | 0,62–0,93 | 0,90* | 0,77–0,95 | 0,94* | 0,82–0,98 |
| Izquierdo | 0,71** | 0,33–0,87 | 0,60** | 0,11–0,82 | 0,60** | 0,09–0,83 | 0,78* | 0,47–0,91 |
| UNC | ||||||||
| Derecho | 0,98* | 0,96–0,99 | 0,93* | 0,85–0,97 | 0,63** | 0,17–0,84 | 0,70** | 0,32–0,87 |
| Izquierdo | 0,95* | 0,90–0,98 | 0,90* | 0,76–0,95 | 0,69** | 0,26–0,86 | 0,94* | 0,84–0,97 |
| Fundación CIEN | ||||||||
| PCF | ||||||||
| Derecho | 0,88* | 0,72–0,94 | 0,77* | 0,52–0,89 | 0,74* | 0,13–0,90 | 0,71* | 0,38–0,86 |
| Izquierdo | 0,68* | 0,34–0,85 | 0,69** | 0,34–0,85 | 0,61* | 0,11–0,82 | 0,62** | 0,14–0,83 |
| UNC | ||||||||
| Derecho | 0,84* | 0,68–0,92 | 0,93* | 0,85–0,96 | 0,64* | 0,06–0,86 | 0,83* | 0,30–0,94 |
| Izquierdo | 0,98* | 0,96–0,99 | 0,98* | 0,97–0,99 | 0,65* | 0,04–0,86 | 0,65* | 0,23–0,84 |
CCI: coeficiente de correlación intraclase; FA: anisotropía fraccional; IC95%: intervalo de confianza de 95%; MD: difusividad media; PCF: fascículo cingulado posterior; UNC: fascículo uncinado.
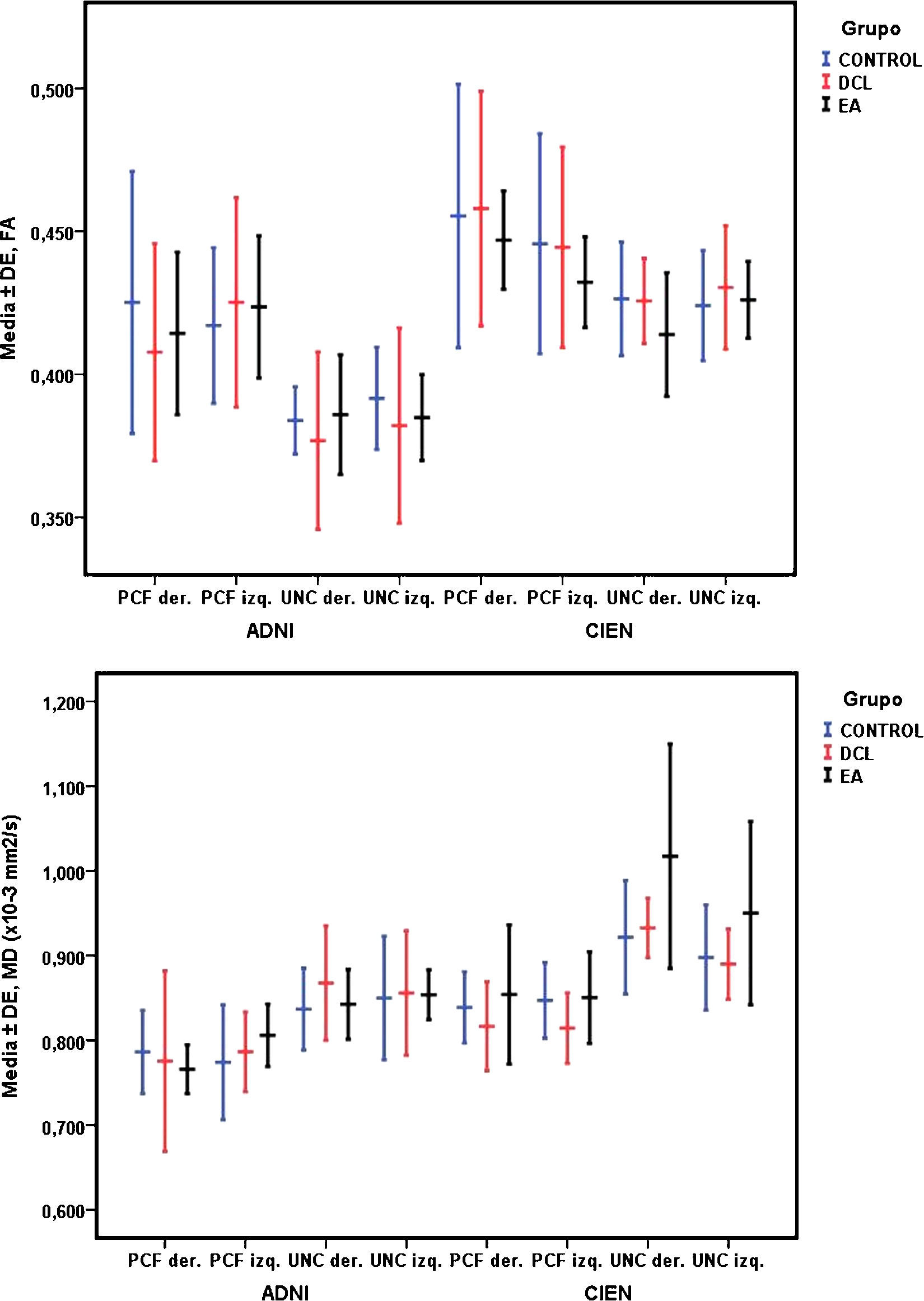
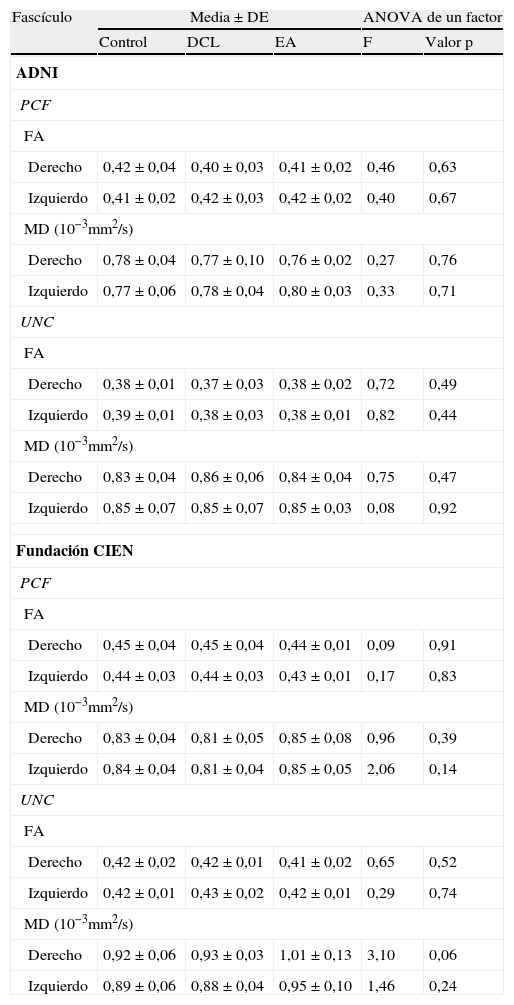
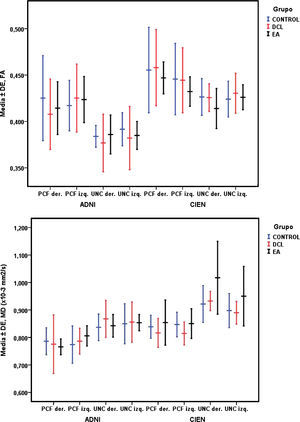
Con la prueba ANOVA de un factor no se encontraron diferencias significativas entre las medias de los 3 grupos estudiados, sin embargo, como se aprecia en la tabla 3, se obtuvo un valor casi significativo, de p=0,06 para el UNC derecho de la medida MD para los datos obtenidos de la Fundación CIEN. Esta diferencia casi significativa se observa gráficamente en la figura 5, siendo mayor el valor de MD para el grupo EA en comparación con DCL, y este mayor en comparación con el grupo control. A la inversa, se observa una tendencia en la disminución de los valores de FA del mismo fascículo.
Comparación de igualdad de medias entre grupos
| Fascículo | Media±DE | ANOVA de un factor | |||
| Control | DCL | EA | F | Valor p | |
| ADNI | |||||
| PCF | |||||
| FA | |||||
| Derecho | 0,42±0,04 | 0,40±0,03 | 0,41±0,02 | 0,46 | 0,63 |
| Izquierdo | 0,41±0,02 | 0,42±0,03 | 0,42±0,02 | 0,40 | 0,67 |
| MD (10−3mm2/s) | |||||
| Derecho | 0,78±0,04 | 0,77±0,10 | 0,76±0,02 | 0,27 | 0,76 |
| Izquierdo | 0,77±0,06 | 0,78±0,04 | 0,80±0,03 | 0,33 | 0,71 |
| UNC | |||||
| FA | |||||
| Derecho | 0,38±0,01 | 0,37±0,03 | 0,38±0,02 | 0,72 | 0,49 |
| Izquierdo | 0,39±0,01 | 0,38±0,03 | 0,38±0,01 | 0,82 | 0,44 |
| MD (10−3mm2/s) | |||||
| Derecho | 0,83±0,04 | 0,86±0,06 | 0,84±0,04 | 0,75 | 0,47 |
| Izquierdo | 0,85±0,07 | 0,85±0,07 | 0,85±0,03 | 0,08 | 0,92 |
| Fundación CIEN | |||||
| PCF | |||||
| FA | |||||
| Derecho | 0,45±0,04 | 0,45±0,04 | 0,44±0,01 | 0,09 | 0,91 |
| Izquierdo | 0,44±0,03 | 0,44±0,03 | 0,43±0,01 | 0,17 | 0,83 |
| MD (10−3mm2/s) | |||||
| Derecho | 0,83±0,04 | 0,81±0,05 | 0,85±0,08 | 0,96 | 0,39 |
| Izquierdo | 0,84±0,04 | 0,81±0,04 | 0,85±0,05 | 2,06 | 0,14 |
| UNC | |||||
| FA | |||||
| Derecho | 0,42±0,02 | 0,42±0,01 | 0,41±0,02 | 0,65 | 0,52 |
| Izquierdo | 0,42±0,01 | 0,43±0,02 | 0,42±0,01 | 0,29 | 0,74 |
| MD (10−3mm2/s) | |||||
| Derecho | 0,92±0,06 | 0,93±0,03 | 1,01±0,13 | 3,10 | 0,06 |
| Izquierdo | 0,89±0,06 | 0,88±0,04 | 0,95±0,10 | 1,46 | 0,24 |
ADNI: Alzheimer's Disease Neuroimaging Initiative (adni.loni.ucla.edu); CIEN: Fundación Centro de Investigación de Enfermedades Neurológicas, Madrid (www.fundacioncien.es); DCL: deterioro cognitivo leve; DE: desviación estándar; EA: enfermedad de Alzheimer; FA: anisotropía fraccional; MD: difusividad media; PCF: fascículo cingulado posterior; UNC: fascículo uncinado.
Hubo variaciones significativas, entre los datos provenientes de ADNI y la Fundación CIEN, mediante la prueba T para muestras independientes para el fascículo uncinado en los 3 grupos estudiados (tabla 4). En la FA fueron bilaterales en el UNC de los grupos control y DCL, y para el izquierdo en el grupo de EA. Hubo diferencias en la MD en el UNC derecho tanto para el grupo control como en el DCL; La mayoría de los valores medidos resultaron ser menores para los de ADNI que para los de la Fundación CIEN.
Comparación de igualdad de medias entre ADNI y CIEN
| Fascículo | Media±DE | Prueba T | ||
| ADNI | CIEN | t | Valor p | |
| Grupo | ||||
| Control | ||||
| PCF | ||||
| FA | ||||
| Derecho | 0,42±0,04 | 0,45±0,04 | −1,35 | 0,19 |
| Izquierdo | 0,41±0,02 | 0,44±0,03 | −1,74 | 0,10 |
| MD (10−3mm2/s) | ||||
| Derecho | 0,78±0,04 | 0,83±0,04 | −2,37 | 0,03 |
| Izquierdo | 0,77±0,06 | 0,84±0,04 | −2,64 | 0,01 |
| UNC | ||||
| FA | ||||
| Derecho | 0,38±0,01 | 0,42±0,01 | −5,25 | 0,00* |
| Izquierdo | 0,39±0,01 | 0,42±0,01 | −3,58 | 0,00* |
| MD (10−3mm2/s) | ||||
| Derecho | 0,83±0,04 | 0,92±0,06 | −2,95 | 0,00* |
| Izquierdo | 0,84±0,07 | 0,89±0,06 | −1,46 | 0,16 |
| DCL | ||||
| PCF | ||||
| FA | ||||
| Derecho | 0,40±0,03 | 0,45±0,04 | −3,03 | 0,00 |
| Izquierdo | 0,42±0,03 | 0,44±0,03 | −1,31 | 0,20 |
| MD (10−3mm2/s) | ||||
| Derecho | 0,77±0,10 | 0,81±0,05 | −1,32 | 0,19 |
| Izquierdo | 0,78±0,04 | 0,81±0,04 | −1,55 | 0,13 |
| UNC | ||||
| FA | ||||
| Derecho | 0,37±0,03 | 0,42±0,01 | −5,46 | 0,00* |
| Izquierdo | 0,38±0,03 | 0,43±0,02 | −4,42 | 0,00* |
| MD (10−3mm2/s) | ||||
| Derecho | 0,86±0,06 | 0,93±0,03 | −3,25 | 0,00* |
| Izquierdo | 0,85±0,07 | 0,88±0,04 | −1,52 | 0,14 |
| EA | ||||
| PCF | ||||
| FA | ||||
| Derecho | 0,41±0,02 | 0,44±0,01 | −1,79 | 0,11 |
| Izquierdo | 0,42±0,02 | 0,43±0,01 | −0,54 | 0,60 |
| MD (10−3mm2/s) | ||||
| Derecho | 0,76±0,02 | 0,85±0,08 | −2,48 | 0,04 |
| Izquierdo | 0,80±0,03 | 0,85±0,05 | −1,48 | 0,18 |
| UNC | ||||
| FA | ||||
| Derecho | 0,38±0,02 | 0,41±0,02 | −1,87 | 0,10 |
| Izquierdo | 0,38±0,01 | 0,42±0,01 | −3,99 | 0,00* |
| MD (10−3mm2/s) | ||||
| Derecho | 0,84±0,04 | 1,01±0,13 | −3,12 | 0,01 |
| Izquierdo | 0,85±0,02 | 0,95±0,10 | −2,16 | 0,06 |
DCL: deterioro cognitivo leve; DE: desviación estándar; EA: enfermedad de Alzheimer; FA: anisotropía fraccional; MD: difusividad media; PCF: fascículo cingulado posterior; UNC: fascículo uncinado.
Los índices FA y MD son parámetros de imagen habitualmente utilizados para las alteraciones de la sustancia blanca en varias enfermedades1–4. Se piensa que factores como la densidad axonal, melinización y homogeneidad en la orientación axonal afectan al grado de anisotropía en la difusión. Se estima que una disminución de la FA y un aumento de la MD reflejan una disminución en la integridad del tejido cerebral10.
La reproducibilidad resultó ser excelente para las medidas de FA y MD en el UNC, y sustancial para las mediciones de volumen y número de fibras; y para todas las medidas del PCF. De forma similar a los resultados obtenidos, Heiervang et al.6 encontraron más reproducibles las medidas de FA y MD que las de volumen. Como se mencionó previamente, la principal fuente de variación del método es la ubicación de las ROI. La mejor reproducibilidad para el UNC se debe a que extraer este fascículo es más fácil que el PCF, dado que la tractografía del UNC no se ve contaminada por otras fibras que pasan en distintas direcciones17. Estos resultados indican que la metodología empleada para la ubicación de las ROI es reproducible sobre todo para el UNC. El manual propuesto para realizar tractografía con el MedINRIA 1.9.2, el cual fue utilizado por el segundo observador, es útil para una persona no avezada con dicho programa informático y está disponible para todo lector interesado a vuelta de correo electrónico a los autores.
Aunque no se hayan encontrado diferencias significativas entre los 3 grupos estudiados, para el caso casi significativo (MD del UNC derecho de CIEN) aquellos con EA mostraron mayores valores de MD respecto a DCL y controles normales respectivamente. A su vez, los pacientes con EA mostraron menores valores de FA respecto a los otros 2 grupos para el UNC derecho de CIEN. Esta tendencia coincide con los resultados de estudios previos12,13,16. Estas alteraciones en los fascículos uncinados también se han observado en otras demencias como la de cuerpos de Lewy21. En la enfermedad de Parkinson también existe descenso de la FA tanto en fibras cingulares anteriores como posteriores22, que lo sitúa como un indicador de enfermedades neurodegenerativas, que debe ser estudiado más extensamente10.
La comparación de las medidas entre los datos de ambos centros estableció que existen diferencias en los parámetros medidos en las distintas poblaciones. Estas diferencias muy probablemente son debidas a la heterogeneidad en el reclutamiento de pacientes con distintos perfiles basales23. Los estudios DTI son de adquisición compleja, que además de ser secuencias de adquisición larga (más sensibles a los movimientos del paciente) requieren equipos de RM con altos gradientes, no disponibles ampliamente. Según Fischer et al.5 la principal variación es el número de gradientes de difusión con la que fueron adquiridas las imágenes. En nuestro caso, menores valores de FA y MD en ADNI (41 gradientes) respecto a Fundación CIEN (15 gradientes). Sin embargo, los resultados obtenidos por Heiervang et al.6 contrastan con los de este estudio, ya que muestran que los fascículos reconstruidos derivados de un menor número de gradientes (12) tienen menores valores de MD y mayores valores de FA que los extraídos usando 60 direcciones de gradientes. La mayor limitación del estudio realizado fue el pequeño tamaño muestral, muy probablemente la causa de no haber encontrado diferencias significativas entre los grupos. Las limitaciones mencionadas en estas técnicas de RM hacen que tampoco sean empleadas de rutina en ADNI24.
Incluso con las limitaciones reseñadas entre los datos de ADNI y CIEN, la metodología presentada es reproducible. Cuando esta técnica esté más ampliamente disponible y sea homogénea, se necesitarán más estudios para comprobar una diferencia significativa entre grupos de pacientes, controlados por los distintos estadios de demencia. Esto podría hacer que las diferencias, aquí apuntadas en los índices de FA y MD, pudieran ser considerados como otros biomarcadores de la EA.
FinanciaciónParte de los datos empleados para este trabajo fueron financiados por la Alzheimer's Disease Neuroimaging Initiative (ADNI) (beca de los National Institutes of Health U01 AG024904). El consorcio ADNI es financiado por la National Institute on Aging, la National Institute of Biomedical Imaging and Bioingeneering y por medio de generosas contribuciones de: Abbott; Alzheimer's Association; Alzheimer's Drug Discovery Foundation; Amorfix Life Sciences Ltd.; AustraZeneca; Bayer HealthCare; BioClinica, Inc.; Biogen Idec Inc.; Bristol-Myers Squibb Company; Eisai Inc.; Elan Pharmaceuticals Inc.; Eli Lilly and Company; F. Hoffmann-La Roche Ltd and its affiliated company Genentech, Inc.; GE Healthcare; Innogenetics, N.V.; IXICO Ltd.; Janssen Alzheimer Immunotherapy Research & Development, LLC.; Johnson & Johnson Pharmaceutical Research & Development LLC.; Medpace, Inc.; Merck & Co., Inc.; Meso Scale Diagnostics, LLC.; Novartis Pharmaceuticals Corporation; Pfizer Inc.; Servier; Synarc Inc.; y Takeda Pharmaceutical Company. La Canadian Institutes of Health Research está proporcionando financiación para ayudar a los sitios clínicos de ADNI en Canadá. Las contribuciones por parte del sector privado se encauzan a través de la Foundation for the National Institutes of Health (www.fnih.org). La organización que respalda este consorcio es la Northern California Institute for Research and Education, y el estudio está coordinado por la Alzheimer's Disease Cooperative Study de la Universidad de California, San Diego. Los datos de ADNI son diseminados por el Laboratory for Neuro Imaging de la Universidad de California, Los Ángeles. Esta investigación también ha sido financiada por las becas NIH P30 AG010129 y K01 AG030514.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.
Al Dr. Juan Álvarez-Linera de la Fundación Centro Investigación Enfermedades Neurológicas (CIEN), Madrid, por su amable cesión de imágenes.
Parte de los datos usados en la preparación de este artículo fueron obtenidos de la base de datos de la Alzheimer's Disease Neuroimaging Initiative (ADNI) (adni.loni.ucla.edu). Por lo tanto, los investigadores de la ADNI contribuyeron en el diseño e implementación de la ADNI y la provisión de datos pero no participaron en el análisis o redacción de este trabajo. Una lista completa de los investigadores de la ADNI se puede encontrar en: http://adni.loni.ucla.edu/wp-content/uploads/how_to_apply/ADNI_Acknowledgement_List.pdf