Existe un creciente interés en las nuevas estrategias terapéuticas para la enfermedad de Alzheimer (EA) orientadas a reducir la carga de péptido β-amiloide (Aβ) en el cerebro mediante el secuestro de Aβ en el plasma, un alto porcentaje del cual se encuentra unido a albúmina y otras proteínas plasmáticas. En esta revisión, se analizan los conceptos de interacción entre Aβ y albúmina que han conducido al desarrollo del proyecto AMBAR (Alzheimer Management By Albumin Replacement), un nuevo estudio clínico multicéntrico, aleatorizado y controlado para el tratamiento de la EA.
DesarrolloResultados de estudios de investigación básica indican que Albutein® (albúmina terapéutica, Grifols) contiene niveles no cuantificables de Aβ. Asimismo demuestran la capacidad de Albutein® de unirse a Aβ. Por otro lado, en la EA existe un elevado estrés nitro-oxidativo asociado a los agregados fibrilares de Aβ que puede inducir la modificación de la albúmina, afectando a sus funciones biológicas. Resultados del estudio en fase ii confirman que el reemplazo de la albúmina endógena con Albutein® 5% mediante aféresis terapéutica es factible y seguro en pacientes con EA, produciendo una movilización de Aβ, además de una mejoría cognitiva de los pacientes tratados. En el estudio AMBAR se ensayará el uso combinado de aféresis terapéutica y hemoféresis con el posible efecto potenciador de Albutein® con reposición de inmunoglobulina por vía intravenosa (Flebogamma ® DIF). Se evaluarán los cambios cognitivos, funcionales y conductuales en pacientes con EA leve o moderada.
ConclusionesEl estudio AMBAR representa una nueva perspectiva terapéutica ante la EA.
There is a growing interest in new therapeutic strategies for the treatment of Alzheimer disease (AD) which focus on reducing the beta-amyloid peptide (Aβ) burden in the brain by sequestering plasma Aβ, a large proportion of which is bound to albumin and other proteins. This review discusses the concepts of interaction between Aβ and albumin that have given rise to AMBAR (Alzheimer's Disease Management by Albumin Replacement) project, a new multicentre, randomised, controlled clinical trial for the treatment of AD.
DevelopmentResults from preliminary research suggest that Albutein® (therapeutic albumin, Grifols) contains no quantifiable levels of Aβ. Studies also show that Albutein® has Aβ binding capacity. On the other hand, AD entails a high level of nitro-oxidative stress associated with fibrillar aggregates of Aβ that can induce albumin modification, thus affecting its biological functions. Results from the phase ii study confirm that using therapeutic apheresis to replace endogenous albumin with Albutein® 5% is feasible and safe in patients with AD. This process resulted in mobilisation of Aβ and cognitive improvement in treated patients. The AMBAR study will test combination therapy with therapeutic apheresis and haemopheresis with the possible leverage effect of Albutein® with intravenous immunoglobulin replacement (Flebogamma® DIF). Cognitive, functional, and behavioural changes in patients with mild to moderate AD will be assessed.
Conclusionsthe AMBAR study represents a new therapeutic perspective for AD.
La enfermedad de Alzheimer (EA) es un proceso neurodegenerativo atribuido a la aparición de depósitos intracelulares (ovillos neurofibrilares de proteína tau fosforilada) como consecuencia de la acción de agregados extracelulares de péptido β-amiloide (Aβ) que dan lugar a las placas seniles en el parénquima cerebral1-3 y se acumulan en los vasos cerebrales formando los depósitos amiloideos4.
Hay una creciente evidencia de que en la EA hay un aumento de los niveles de Aβ agregado en el cerebro concomitante con una disminución del Aβ soluble en el líquido cefalorraquídeo (LCR)5. Esta observación ha conducido al diseño de nuevas estrategias terapéuticas orientadas a reducir la carga de Aβ en el cerebro mediante la inducción de cambios en la dinámica del transporte del Aβ a través de la barrera hematoencefálica. Así, el secuestro de Aβ en el plasma podría aumentar el transporte de Aβ libre desde el LCR hacia el plasma y reducir la carga de Aβ en el cerebro, con el fin de restaurar el equilibrio intrínseco entre el cerebro y la sangre de los niveles de Aβ6. Para llevar a cabo estas nuevas estrategias terapéuticas, las diferentes modalidades de aféresis desempeñarían un papel fundamental.
La plasmaféresis es una técnica que separa el plasma de los componentes formes de la sangre, los cuales se devuelven al paciente sin el plasma. En el recambio plasmático, el plasma extraído se repone con un volumen equivalente de plasma, soluciones coloides o cristaloides. En la aféresis terapéutica, la extracción del plasma tiene como finalidad la eliminación de elementos patógenos del mismo7. Se estima que alrededor de un 90% del Aβ plasmático se encuentra unido a la albúmina circulante para favorecer su degradación por el hígado8, por lo que resulta evidente el interés en la aféresis terapéutica, basada en la plasmaféresis y el recambio plasmático combinado con su reposición por albúmina, como posible nueva terapia para la EA. Por su parte, la inmunoterapia con anticuerpos que se unen a Aβ en el plasma se ha demostrado capaz de reducir la carga amiloide cerebral en modelos de ratón9, así como en humanos10,11.
En el presente artículo se revisan conceptos de la dinámica de unión de la albúmina al Aβ y del papel que desempeña la albúmina bajo el estrés nitro-oxidativo asociado a los oligómeros de Aβ, enfatizando su aplicación en el tratamiento de la EA. Asimismo se presenta un avance de los alentadores resultados del reciente estudio en fase ii de aféresis terapéutica con albúmina en la EA, que han motivado la puesta en marcha del proyecto AMBAR (Alzheimer Management By Albumin Replacement), un nuevo estudio clínico para el tratamiento de la EA que ensaya el uso combinado de aféresis terapéutica con albúmina e inmunoglobulina (IG) por vía intravenosa a diferentes dosis, cuyos detalles fueron presentados por Grifols en el marco de la pasada Reunión Anual de la Sociedad Española de Neurología.
DesarrolloDinámica de unión de Albutein® a betaamiloideLas principales evidencias que dieron lugar al proyecto de investigación de Grifols asociado a la EA fueron las siguientes: 1) la existencia de oligómeros solubles de Aβ, más tóxicos que las fibras, incrementadas en cerebros de afectados de EA, asociados al deterioro cognitivo12; 2) la existencia en el plasma de un alto porcentaje de Aβ unido a la albúmina, lo que indica que esta proteína puede desempeñar un papel relevante en evitar la agregación de Aβ13, y 3) la existencia de un equilibrio dinámico entre los niveles de Aβ periféricos y centrales, por una parte, y el aclaramiento de Aβ, por otra. La alteración de dicho equilibro podría ser central en la patogénesis y progresión de la EA14,15. Distintos agentes con capacidad de unir Aβ y desplazar el equilibrio hacia el plasma, tales como los anticuerpos anti-Aβ, han sido y están siendo objeto de evaluación10,11,16.
A raíz de estas investigaciones, y teniendo en cuenta la experiencia de Grifols en la realización de plasmaféresis y en la producción de una albúmina terapéutica, la compañía decidió iniciar la investigación de un nuevo abordaje terapéutico para la EA basado en la aféresis terapéutica combinada con reposición de volumen mediante albúmina terapéutica. Posteriormente, otras publicaciones de distintos autores han aportado nuevo apoyo a dicha aproximación17.
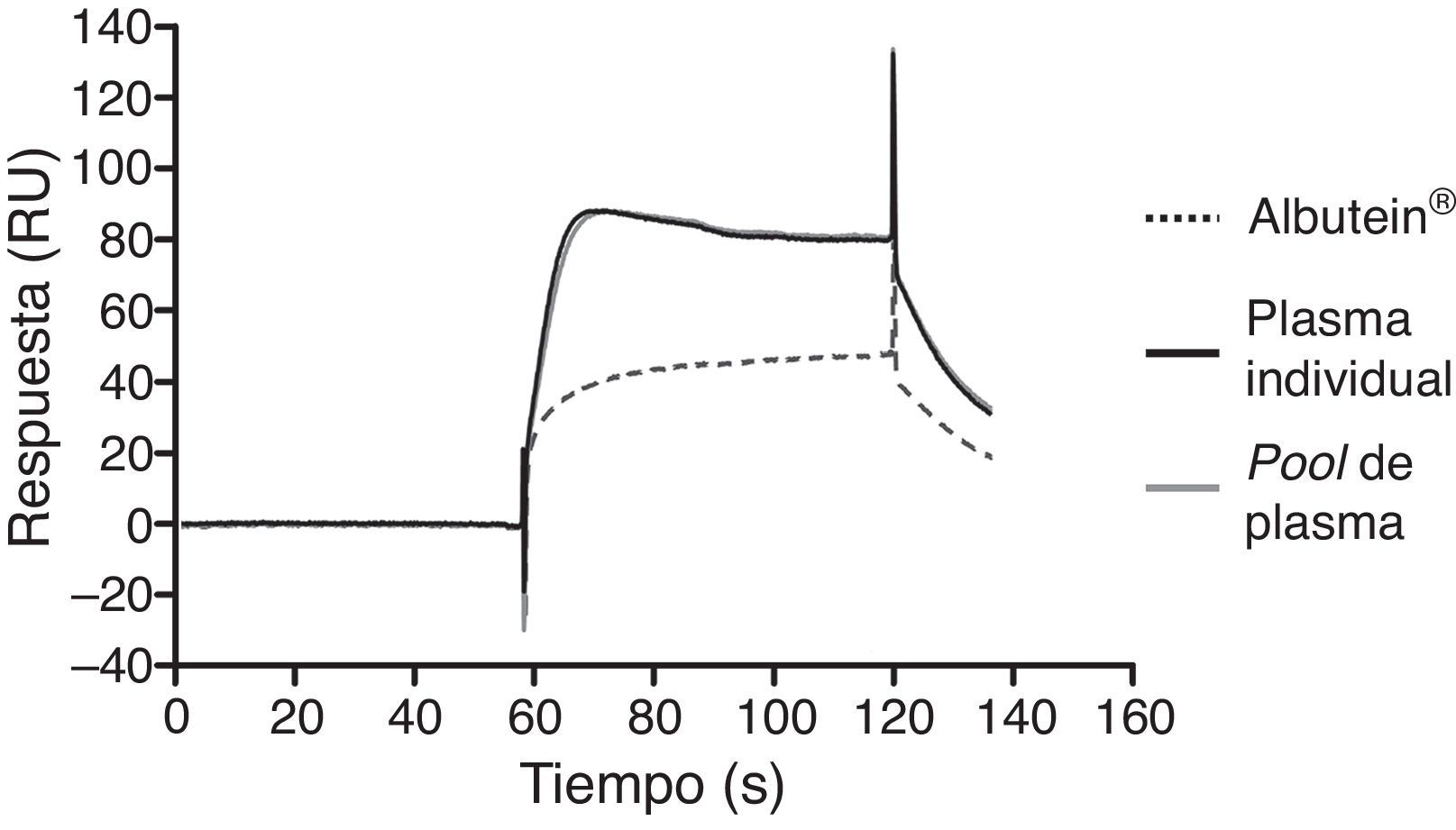
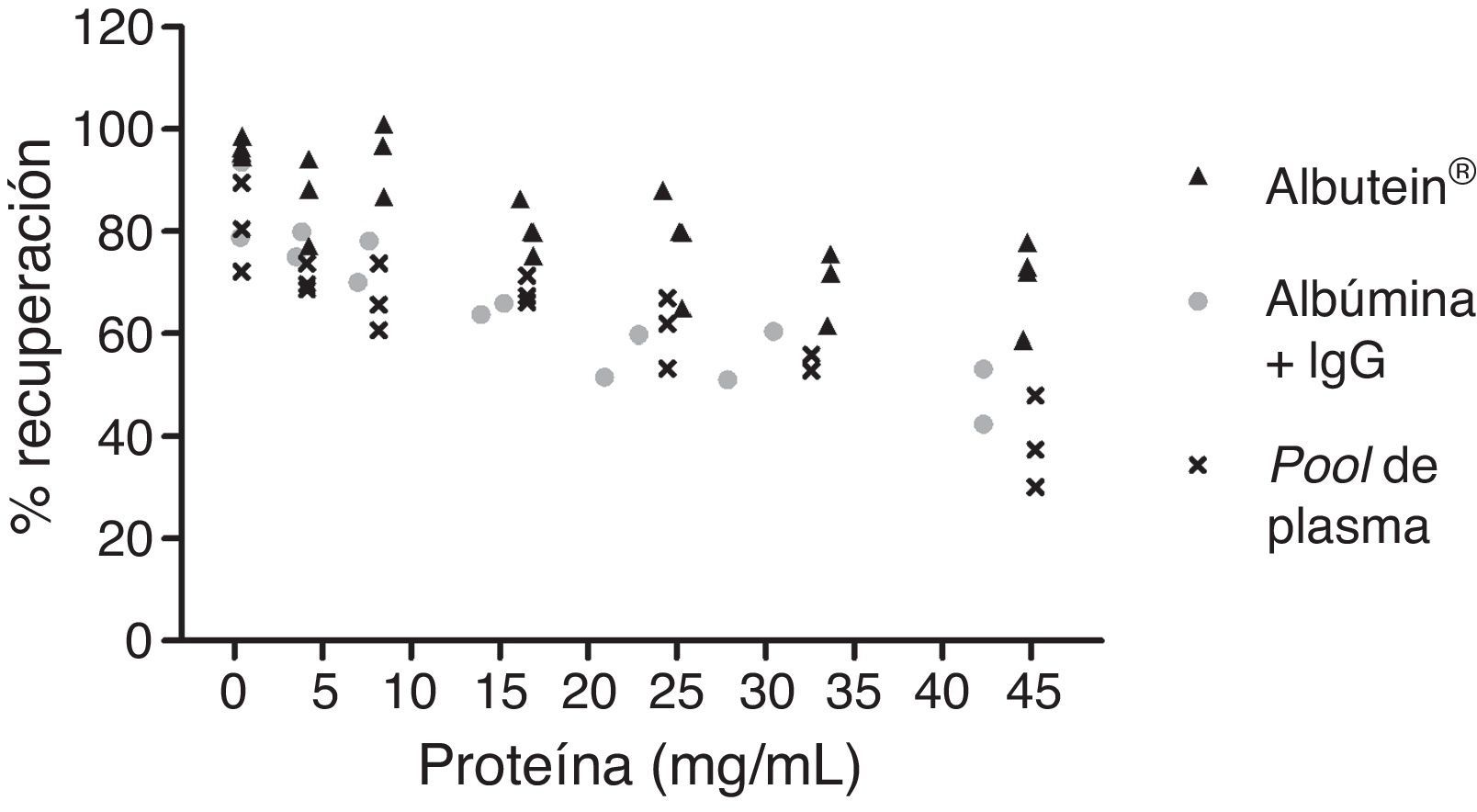
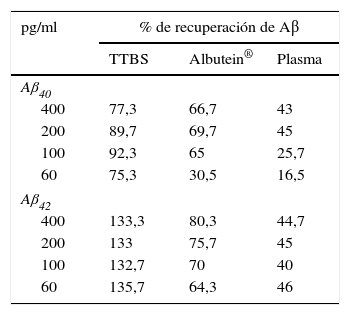
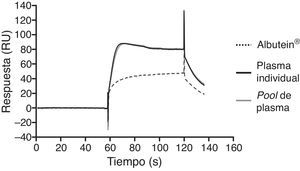
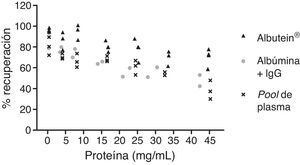
En una serie de estudios de investigación básica para corroborar estos resultados previos y afianzar la hipótesis de trabajo, se cuantificó en primer lugar el contenido de Aβ40 y Aβ42 en Albutein® 5%, 20% y 25% (albúmina terapéutica Grifols), usando distintos enzimoinmunoanálisis (ELISA) comerciales disponibles y el ABtest® (Araclon Biotech, Zaragoza), desarrollado específicamente para la determinación de Aβ en muestras de sangre. Los resultados obtenidos indican que Albutein® no contiene, o contiene niveles no cuantificables, de Aβ18. En segundo lugar, se analizó la capacidad de unión de la albúmina terapéutica a péptidos sintéticos con la secuencia humana de Aβ mediante distintas aproximaciones de ELISA, así como con tecnología de resonancia de plasmones de superficie (SPR)18. Los resultados demuestran la capacidad de Albutein® de unirse a Aβ. Se observó que la recuperación de Aβ «accesible» (Aβ40 y Aβ42) en diluciones seriadas en tampón, plasma y Albutein®, hasta concentraciones finales cuantificables por ELISA, disminuye a medida que la capacidad de unión de la «solución de dilución» a Aβ aumenta: plasma>albúmina>tampón (tabla 1)18. Por otro lado, la capacidad de Albutein® de unión a Aβ se demostró también mediante SPR (fig. 1). El plasma refleja una respuesta superior a la de las albúminas purificadas debido a la presencia de otras proteínas plasmáticas capaces de unirse al péptido Aβ42, tales como la Ig humana (IgG)10,11. Así, el análisis por ELISA del contenido de sAβ «accesible» en mezclas obtenidas tras la adición e incubación de una cantidad exacta de Aβ a concentraciones crecientes de proteína, muestra que la unión de Aβ disminuye conforme aumenta la concentración de proteína y para cada concentración en concreto sigue la siguiente proporción:
Capacidad de Albutein® de unión a Aβ. Recuperación de Aβ «accesible» (Aβ40 y Aβ42) en diluciones seriadas en solución tampón (TTBS), Albutein® y plasma, hasta concentraciones finales cuantificables por ELISA
| pg/ml | % de recuperación de Aβ | ||
|---|---|---|---|
| TTBS | Albutein® | Plasma | |
| Aβ40 | |||
| 400 | 77,3 | 66,7 | 43 |
| 200 | 89,7 | 69,7 | 45 |
| 100 | 92,3 | 65 | 25,7 |
| 60 | 75,3 | 30,5 | 16,5 |
| Aβ42 | |||
| 400 | 133,3 | 80,3 | 44,7 |
| 200 | 133 | 75,7 | 45 |
| 100 | 132,7 | 70 | 40 |
| 60 | 135,7 | 64,3 | 46 |
plasma>albúmina+IgG>albúmina (fig. 2)18.
Otras líneas de investigación en marcha incluyen la evaluación del posible papel protector de la albúmina en modelos in vitro de EA. Así, en cultivos primarios de neuronas corticales de rata, se ha observado que la adición de Aβ agregado reduce significativamente la supervivencia celular, pero parte de esta neurotoxicidad puede ser inhibida por el cotratamiento con Albutein®. En otra serie de estudios in vitro, se pretende comprobar cómo Albutein® puede inhibir la autoasociación de Aβ uniéndose selectivamente a oligómeros de Aβ más que a monómeros, impidiendo el crecimiento de los agregados de Aβ.
Por otro lado, se está desarrollando actualmente una caracterización exhaustiva de la albúmina de los pacientes con EA ya que, tal y como sucede en otras enfermedades como la cirrosis hepática o la diabetes, la albúmina de pacientes con EA podría presentar alteraciones importantes a nivel estructural y/o funcional19. Finalmente, resultados preliminares obtenidos mediante la técnica de resonancia paramagnética electrónica indican que la albúmina de pacientes con EA tiene una funcionalidad reducida en comparación con la de donantes sanos, la cual mejora tras finalizar el tratamiento de aféresis terapéutica con reposición de volumen con Albutein®.
Todos estos resultados corroboran la hipótesis del uso de albúmina en el tratamiento de la EA y, en concreto, apoyarían la aproximación terapéutica propuesta basada en el uso de Albutein® y de Flebogamma® DIF (inmumoglobulina por vía intravenosa; IGIV), en combinación con aféresis terapéuticas, y que está siendo objeto de investigación clínica como posible nueva terapia para la EA.
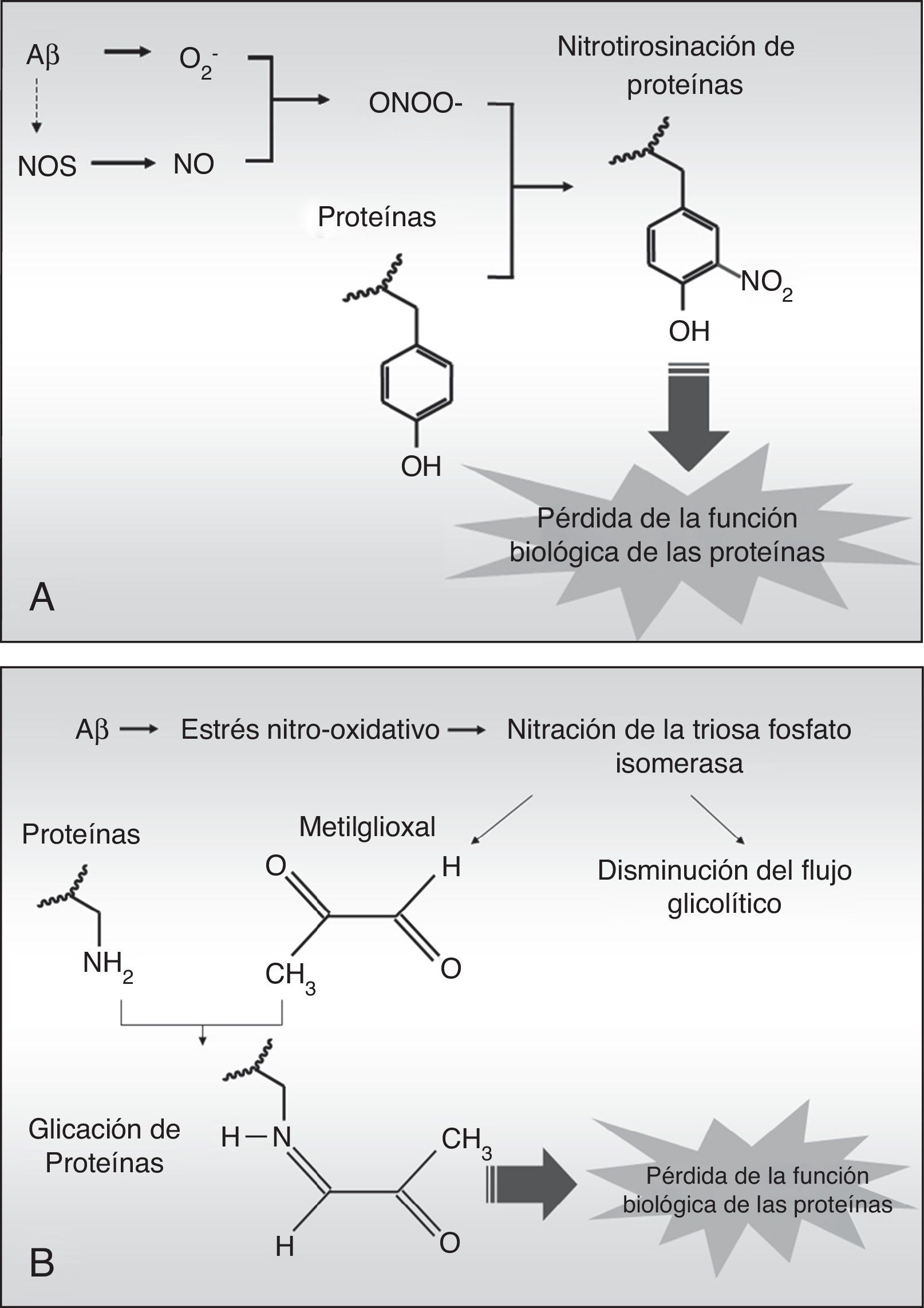
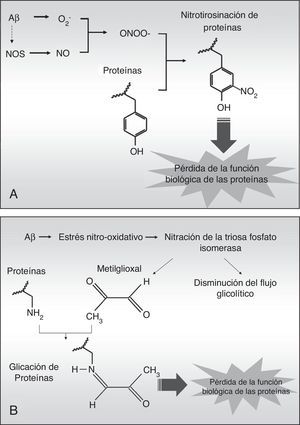
La nitrotirosinación de la albúmina por estrés nitro-oxidativo aumenta su capacidad de unir fibras de péptido betaamiloideEn la EA existe un elevado estrés nitro-oxidativo asociado a los agregados fibrilares de Aβ, los cuales producen radicales libres per se20 que inducen dentro de las células cascadas de compuestos reactivos de oxígeno, que a su vez pueden difundir fácilmente a los tejidos circundantes debido a su naturaleza química. El anión superóxido (O2–) es especialmente nocivo porque puede desencadenar procesos de oxidación directamente, y de nitración y glucación indirectamente. El superóxido puede reaccionar con el óxido nítrico (NO) procedente del endotelio, las neuronas o la glía para generar anión peroxinitrito (ONOO–), el cual es altamente reactivo y nitra las tirosinas de las proteínas en un proceso denominado nitrotirosinación (fig. 3 A), proceso que ha sido descrito previamente en la EA21. La nitrotirosinación de las proteínas induce su pérdida de función biológica, al igual que ocurre con la glucación, un proceso oxidativo producido directamente por el subproducto glucolítico metilglioxal (fig. 3 B) o indirectamente por un alto contenido en azúcares simples en el medio extracelular19,22. Así, en un ambiente prooxidativo, la albúmina puede ser nitrotirosinada y glucada, lo que afectaría a sus funciones biológicas.
Se planteó un estudio para investigar el efecto de la nitrotirosinación y de la glucación de la albúmina en la unión a Aβ42, que se llevó a cabo con la colaboración de los siguientes centros de Barcelona: Laboratorio de Fisiología Molecular y Canalopatías, Departamento de Ciencias Experimentales y de la Salud de la Universitat Pompeu Fabra, Instituto Grifols, Fundació ACE-Institut Català de Neurociències Aplicades y Departamento de Neurología del Hospital Universitario Vall d’Hebron.
En primer lugar, se procedió a la caracterización de fibras de Aβ42 (Sigma-Aldrich, St. Louis, MO, EE.UU.) por microscopia electrónica de transmisión. Tras ello, se incubaron con Aβ42 soluble y agregado en fibras, albúmina (Grifols) nativa, albúmina nitrotirosinada in vitro con SIN-1 (Sigma-Aldrich), un dador de peroxinitrito, y albúmina glucada in vitro con metilglioxal (CosmoBio Co., LTD). Las muestras se inmunoprecipitaron con anticuerpo antialbúmina (Acris Antibodies, Herford, Germany). La concentración de Aβ42 se cuantificó en los sobrenadantes mediante el Human Amyloid β assay kit (Immuno-Biological Laboratories Co., LTD, Tokyo, Japan).
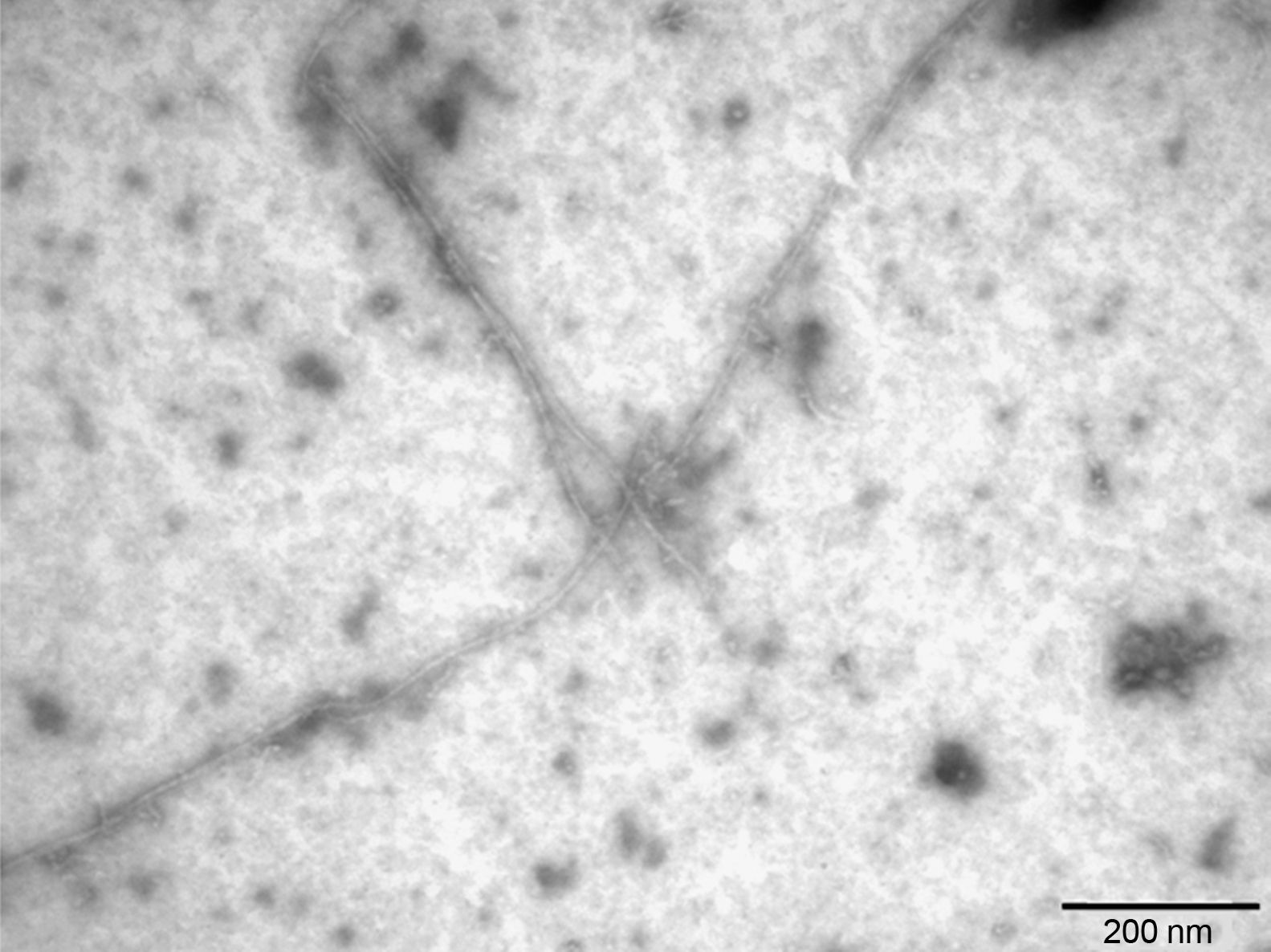
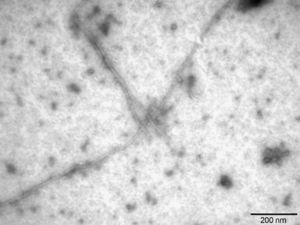
La literatura sobre la EA demuestra que el Aβ42 se produce de forma minoritaria comparado con el Aβ40; sin embargo, el Aβ42 tiene una mayor tendencia a agregar por ser más hidrofóbico y, por tanto, tiene una mayor relevancia patológica en la EA23. En el estudio se prepararon fibras de Aβ421, que se caracterizaron por microscopia electrónica de transmisión (fig. 4), pudiendo observar las fibras de Aβ42 como un amiloide típico de diámetro continuo, helicoidal y no ramificado.
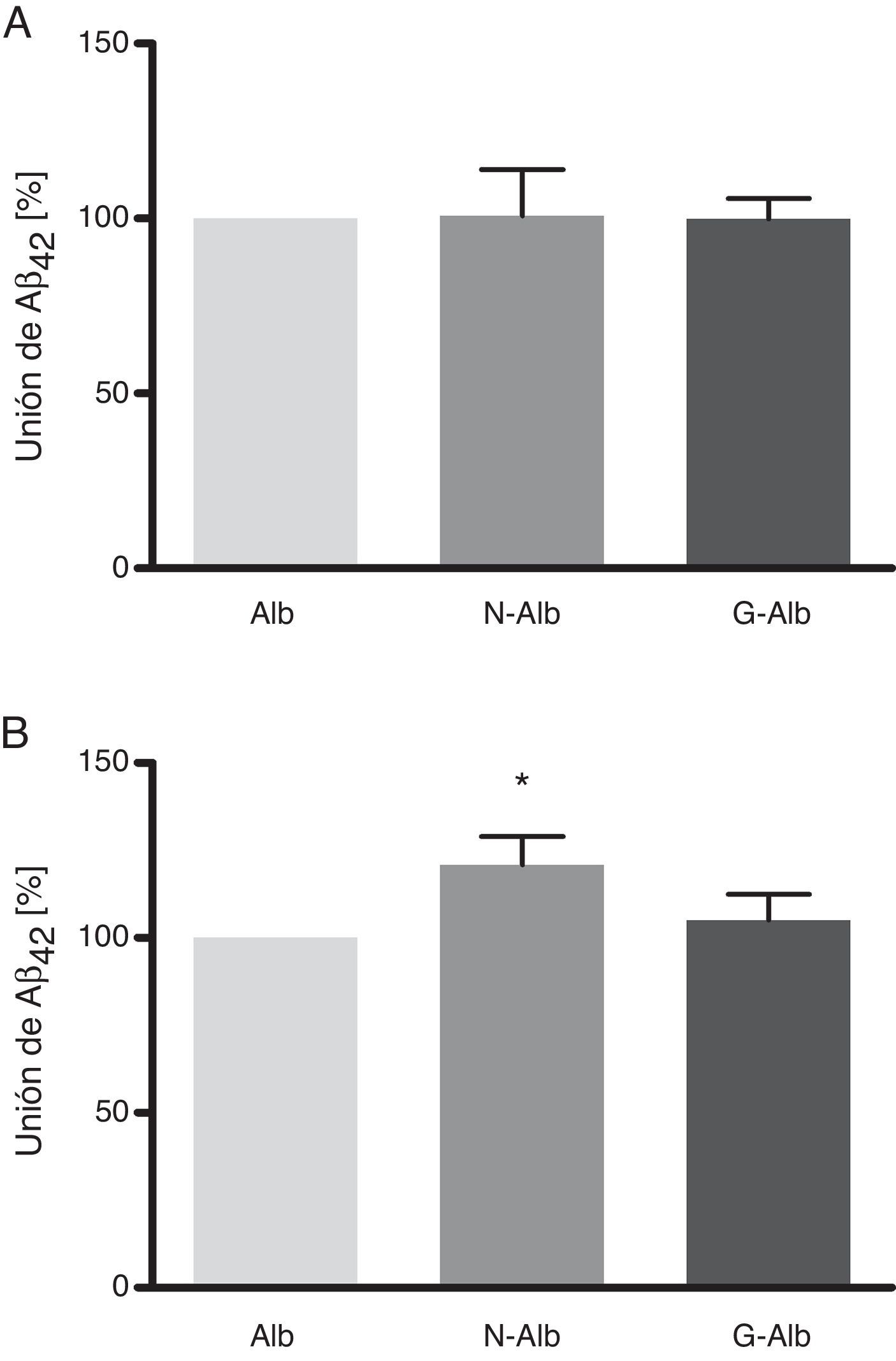
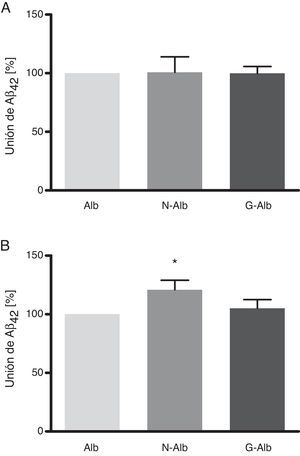
Estos datos demuestran que la nitrotirosinación y la glucación de la albúmina no afectan a su unión al Aβ42 soluble (fig. 5 A), la forma de Aβ no tóxica para las células. Sin embargo, la nitrotirosinación de la albúmina sí que produjo un aumento de la unión de las formas fibrilares de Aβ42 (fig. 5 B; p<0,05). La relevancia fisiopatológica de estos datos se situaría en una mayor resistencia de la albúmina nitrotirosinada a ser degradada. Este escenario es plausible, considerando que la nitración de las proteínas conduce a la formación de puentes ditirosina entre las tirosinas nitradas de distintas proteínas, generando agregados proteicos que son difícilmente digeribles por los sistemas degradadores24.
Los efectos beneficiosos de la aféresis terapéutica que han sido propuestos en el tratamiento de la EA25 podrían estar relacionados en mayor o menor grado con la eliminación de esta albúmina nitrotirosinada y, por tanto, con el aclaramiento mecánico de Aβ42.
Avance de resultados del estudio fase ii de aféresis terapéutica con albúmina en la enfermedad de AlzheimerLa estrategia clínica propuesta por Grifols pasa por el diseño de diferentes estudios clínicos consecutivos con el objetivo de demostrar la eficacia y la seguridad del tratamiento de aféresis terapéutica con albúmina en EA.
El estudio piloto con el que se inició el proyecto25 reclutó a 10 pacientes con EA leve-moderada que recibieron 6 aféresis terapéuticas con albúmina Grifols 5% (Albutein®) en 3 semanas, con una frecuencia de 2 aféresis terapéuticas por semana. Tras el tratamiento y al año de seguimiento, con determinación de variables bioquímicas, cognitivas y de neuroimagen, los resultados positivos obtenidos en cognición junto con la satisfacción de los pacientes y sus familiares invitaron a replicar el estudio. La extensión del estudio permitió confirmar los resultados y consolidar la experiencia de dicho tratamiento en este tipo de población. A los pacientes del estudio piloto se les ofreció la posibilidad de ser tratados con IGIV (Flebogamma® DIF, Grifols)16, comprobando que dicha molécula podría tener también un efecto terapéutico en la EA. Avanzando en esta línea de investigación con albúmina en aféresis terapéutica, se concibió el estudio fase ii25.
El estudio fase ii se diseñó como un estudio multicéntrico, aleatorizado, ciego, controlado y de grupos paralelos. Su objetivo principal fue evaluar si la aféresis terapéutica con Albutein® 5% era capaz de modificar la concentración de Aβ40 y Aβ42 en plasma y LCR en el grupo tratado entre la visita basal y la última, además de conseguir la estabilidad o la mejoría de las capacidades cognitivas como objetivo secundario. Otros objetivos fueron la valoración de los cambios estructurales y funcionales en la neuroimagen mediante resonancia magnética (RM) y tomografía computarizada por emisión de fotones individuales (SPECT) cerebrales, así como valorar la seguridad del tratamiento.
Los pacientes, de entre 55 y 85 años de edad, con EA leve-moderada en tratamiento estable con inhibidores de la acetilcolinesterasa, se reclutaron en 4 centros, 2 españoles y 2 americanos. Los pacientes se aleatorizaron en 2 brazos (1:1): el tratado, brazo activo (19 individuos), y el control (20 individuos). El grupo control siguió el mismo programa de tratamiento, excepto para las aféresis terapéuticas, que fueron simuladas («sham»). Ambos grupos de pacientes recibieron un máximo de 18 aféresis terapéuticas con Albutein® 5%, siguiendo 3 pautas de tratamiento diferentes: a) 2 aféresis terapéuticas a la semana, durante 3 semanas; b) una aféresis terapéutica a la semana, durante 6 semanas, y c) una aféresis terapéutica cada 2 semanas, durante 12 semanas. Después del periodo de tratamiento (21 semanas), ambos grupos entraron en un periodo de seguimiento de 6 meses.
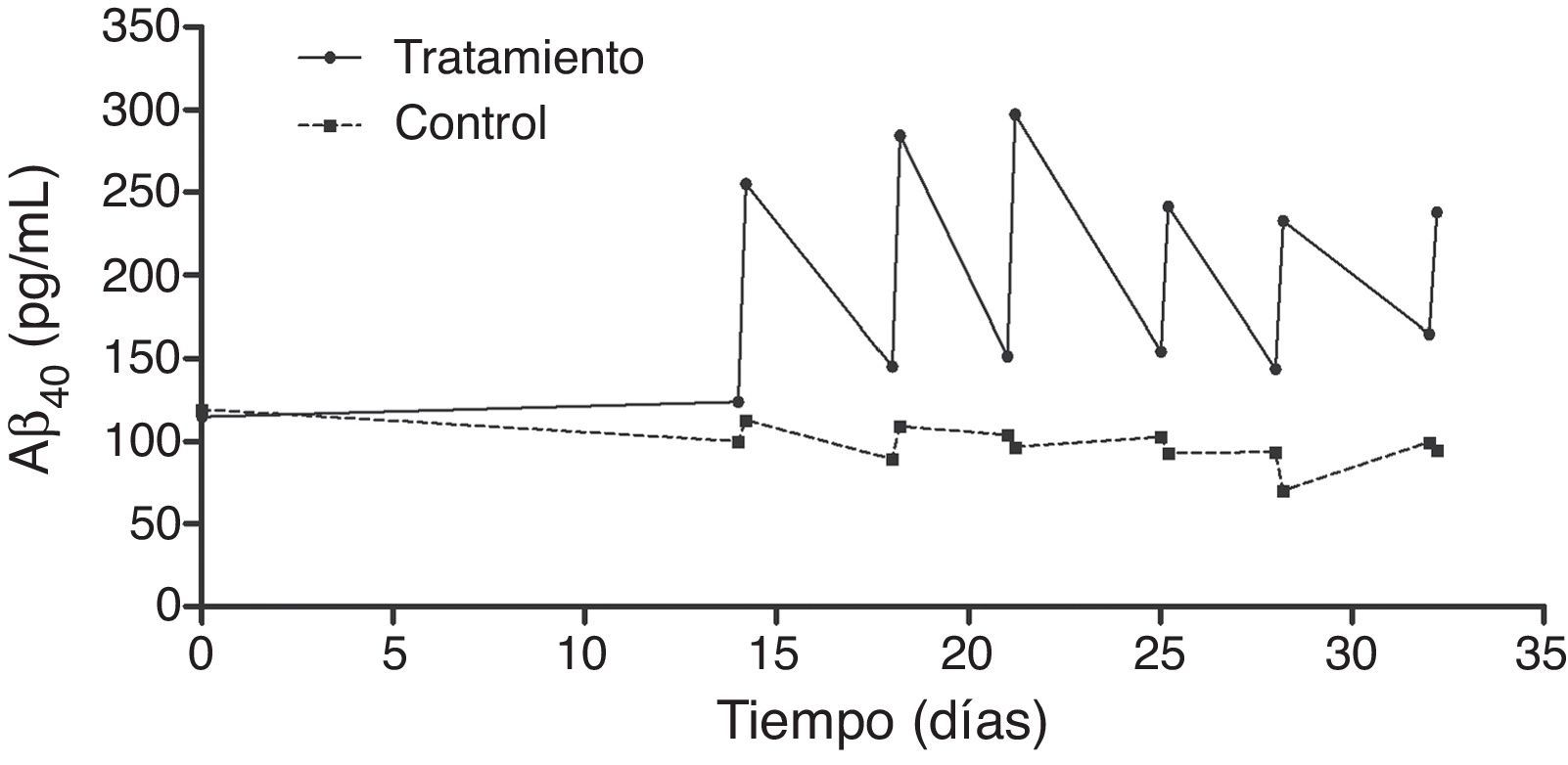
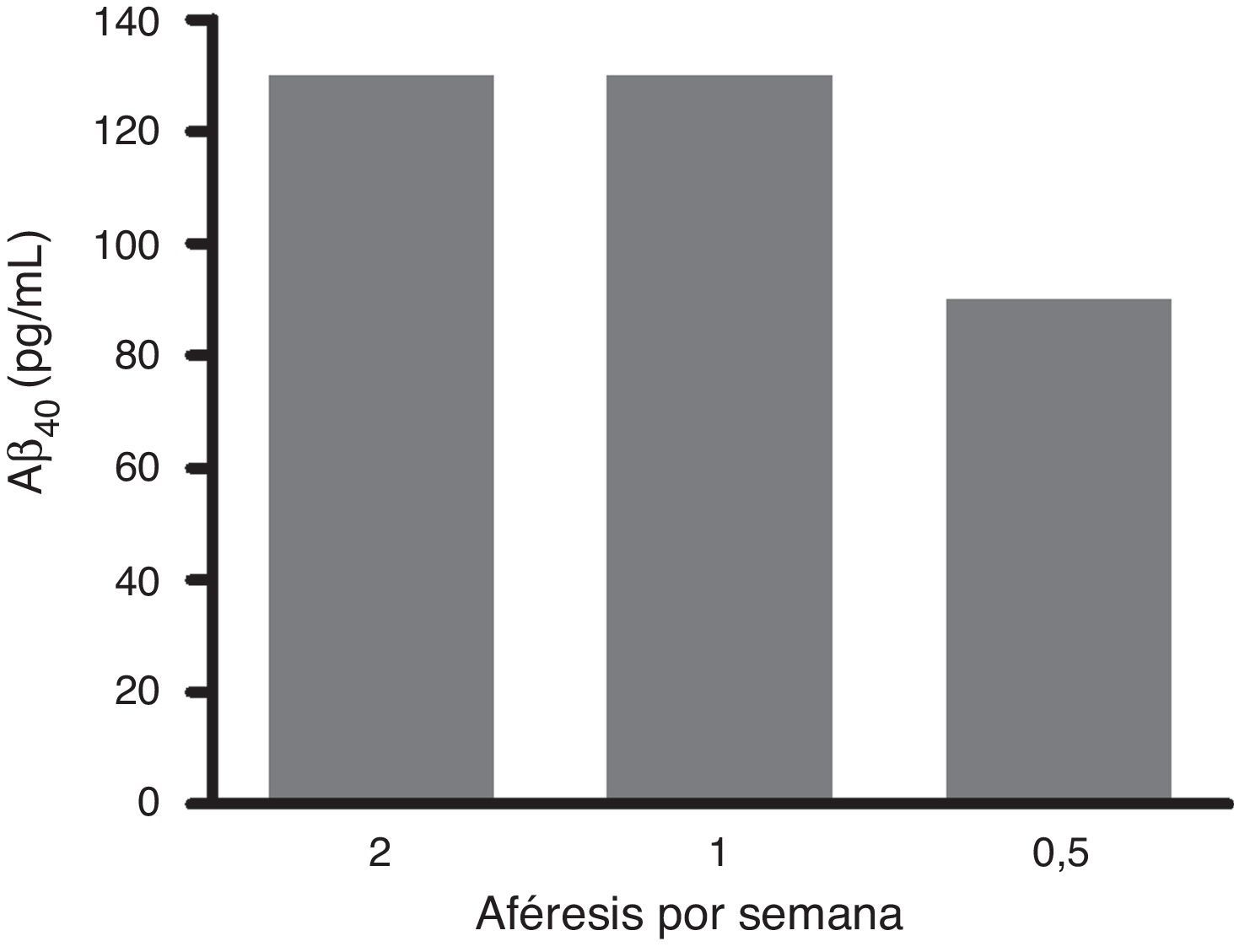
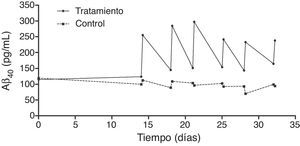
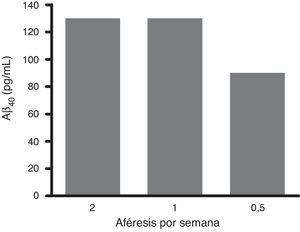
El análisis en profundidad de los resultados del estudio fase ii se halla en curso y próximamente se espera su publicación completa. No obstante, en un avance de los mismos, se pueden anticipar algunas tendencias observadas. Así, los resultados obtenidos en los niveles de Aβ40 plasmáticos en el grupo tratado mostraron variaciones consistentes siguiendo un patrón oscilante en forma de dientes de sierra (fig. 6) a lo largo de los 3 periodos de aféresis terapéutica (no así para Aβ42), replicando los hallazgos previamente observados en el estudio piloto. Después de los periodos de las aféresis terapéuticas, los niveles de Aβ40 regresaron a sus valores basales. Durante el periodo de tratamiento se observó que, después de cada aféresis terapéutica, los niveles de Aβ40 plasmático aumentaban de forma considerable en comparación con los pacientes del grupo control. La movilización absoluta (cantidad de péptido movilizado por mililitro de plasma procesado en cada periodo) de Aβ40 fue similar para el periodo de tratamiento con 2 aféresis terapéuticas por semana que para una aféresis terapéutica por semana (fig. 7). Respecto a la variación de los niveles plasmáticos de Aβ42, estos mostraron variaciones en ambos grupos, pero el patrón global no fue tan claro como en los niveles plasmáticos de Aβ40. Por otro lado, los niveles de Aβ40 y Aβ42 en el LCR no demostraron diferencias entre ambos grupos.
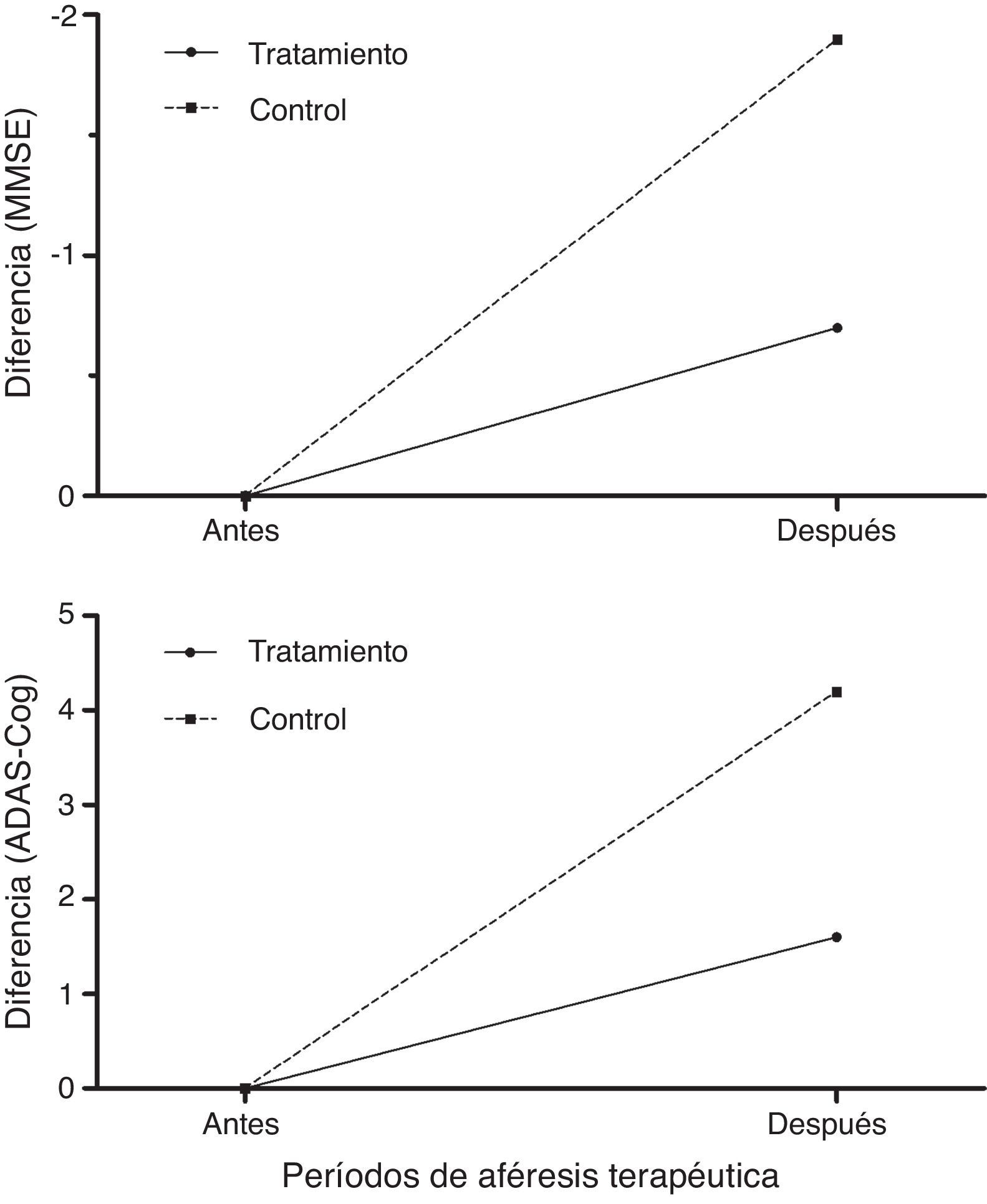
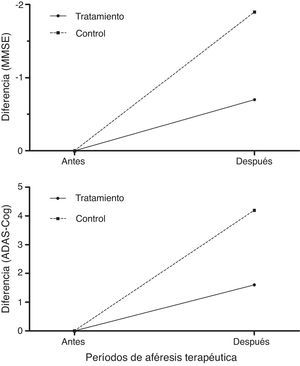
Los pacientes tratados puntuaron mejor que los controles en la evaluación cognitiva con MMSE y ADAS-Cog26,27 tras los periodos de aféresis terapéutica (fig. 8), empeorando a los 12 meses de seguimiento (6 meses después de finalizar la última aféresis terapéutica).
Respecto a los resultados de neuroimagen por RM, en ambos grupos el hipocampo sufrió una pérdida de volumen progresiva, encontrándose diferencias significativas a lo largo de la evolución del estudio. Sin embargo, el volumen posterior del cíngulo y el volumen total cerebral no mostraron una disminución significativa. Por otro lado, la neuroimagen por SPECT demostró una tendencia a la estabilización del metabolismo cerebral de los pacientes del grupo tratado inmediatamente después del periodo de tratamiento de máxima intensidad y un empeoramiento una vez finalizado el periodo de tratamiento. En cambio, el grupo control mostró un empeoramiento progresivo a lo largo de todo el estudio.
Respecto a la seguridad, no se produjeron acontecimientos adversos graves ni no graves relacionados con el producto, Albutein® 5%, ni con el procedimiento de aféresis. Se pudo constatar que la aféresis terapéutica presentó una buena tolerancia y un buen perfil de seguridad para este tipo de pacientes.
Aunque en estos resultados preliminares del estudio fase ii se observan cambios a nivel clínico y de neuroimagen, los mismos deben ser interpretados con cautela a la espera del análisis completo de los datos del estudio y su publicación. No obstante, la tendencia positiva de los datos disponibles hasta este momento confirmaría la hipótesis que el estudio piloto ya indicó: el reemplazo de la albúmina endógena con Albutein® 5% mediante aféresis terapéutica es factible y seguro en pacientes con EA, produce una movilización de los niveles de Aβ plasmático de forma consistente y muestra una estabilización cognitiva de los pacientes tratados. Estos resultados, junto con los obtenidos con la IGIV de Grifols, han conducido al concepto del nuevo estudio AMBAR, cuyos detalles se presentan a continuación.
Estudio AMBAR: aféresis terapéutica y hemoféresis con albúmina e inmunoglobulina por vía intravenosaA partir de los alentadores resultados positivos de los estudios previos en el que se combinaron la aféresis terapéutica con Albutein® como tratamiento en la EA y el conocimiento generado posteriormente25, se ha diseñado el nuevo estudio AMBAR (NCT01561053), registrado como fase iii en Europa (España) y como fase iib en los Estados Unidos de Norteamérica.
La estrategia del estudio AMBAR se basa en el uso combinado de la aféresis terapéutica y la hemoféresis con albúmina (Albutein®) y con reposición de IGIV (Flebogamma® DIF) a 3 dosis diferentes, bajo la hipótesis de su capacidad de unirse a Aβ y, al mismo tiempo, ajustar un posible déficit inmunológico. La hemoféresis es un tipo de aféresis terapéutica que separa las células sanguíneas mediante centrifugación, las cuales se devuelven al paciente, y extrae un volumen limitado de plasma (entre 650 y 800ml), que se reemplaza por una solución de albúmina o de Ig equivalente en gramos a la cantidad extraída con el plasma.
El estudio AMBAR combina una primera fase de tratamiento intensivo seguida de una segunda fase de mantenimiento. El tratamiento intensivo inicial consta de 6 semanas con una aféresis terapéutica por semana que consiste en la extracción de 2,5-3 l de plasma del paciente y reemplazo con el mismo volumen con Albutein® 5%. Se utilizan una vía central, un catéter de acceso central de doble luz en la vena subclavia o yugular, y un aparato de aféresis convencional (centrifugación o filtración). A continuación, se sigue con un periodo de hemoféresis, considerado de mantenimiento, durante 12 meses, en el que se realiza una aféresis terapéutica de bajo volumen plasmático por mes, aproximadamente de 650-800ml, siendo este remplazado por Albutein® 20% (un máximo de 100ml o 200ml), y alternado con Flebogamma® DIF (un máximo de 10g o 20g), de acuerdo con el brazo de tratamiento. Las dosis de albúmina se ajustan de acuerdo con el volumen real de plasma extraído (dependiendo del peso del paciente) y las dosis de Flebogamma® DIF se fijan para cada grupo. El acceso es periférico y se utiliza un aparato de aféresis basado en el prototipo Grifols (Fenwal). Cabe destacar que en el estudio se ha puesto especial atención en reducir las incomodidades del tratamiento para el paciente, tanto en la concepción de la máquina de plasmaféresis como en la infusión alternada de albúmina e Ig.
El estudio AMBAR se ha diseñado como multicéntrico, aleatorizado y controlado con grupos paralelos para evaluar los cambios cognitivos, funcionales y conductuales en pacientes con EA de leve a moderada. Se compone de 3 grupos de tratamiento a dosis diferentes y un grupo control sometido a tratamiento simulado «sham». Los sujetos se aleatorizan en una proporción 1:1:1:1. El cálculo de la muestra para obtener los resultados prefijados es de 350 pacientes distribuidos entre los centros en España y Estados Unidos de Norteamérica.
La variable principal de eficacia será el cambio respecto al valor basal en las puntuaciones cognitivas obtenidas con el ADAS-Cog (6 mediciones) en los 3 brazos de tratamiento.
Como variables secundarias de eficacia, se determinarán los cambios respecto al valor basal en las puntuaciones de las pruebas cognitivas, funcionales, de conducta y evolución global al cambio, medidos por el MMSE, batería neuropsicológica, inventario neuropsiquiátrico, Alzheimer's Disease Co-operative Study-Activities of Daily Living Inventory, Clinical Dementia Rating Sum of Boxes, Alzheimer's Disease Cooperative Study-Clinical Global Impression of Change, Cornell Scale for Depression in Dementia, Columbia-Suicide Severity Rating Scale, Quality of Life- Alzheimer's Disease y Resource Utilization in Dementia (RUD-Lite®). También se evaluarán los cambios de concentración del péptido Aβ, niveles de Aβ40 y Aβ42 en plasma y en LCR, y niveles de T-tau y P-tau en LCR. Asimismo se evaluarán los cambios estructurales en el volumen del hipocampo, cíngulo posterior y otras áreas de interés por RM (6 mediciones), los cambios funcionales del cerebro con18 fluorodeoxiglucosa-tomografía por emisión de positrones.
Respecto a la seguridad del tratamiento de hemoféresis con albúmina humana combinado con IGIV, se calculará el porcentaje de procedimientos que estén asociados como mínimo a un acontecimiento adverso que pueda estar relacionado con el procedimiento de estudio, los signos vitales y diferentes parámetros de laboratorio. También durante los periodos de tratamiento se realizarán pruebas de ansiedad y agitación según la Escala de agresividad manifiesta y la Escala de comportamiento agitado, siempre que se crea oportuno.
A finales de noviembre del 2012, se había invitado a participar en el estudio a 19 pacientes, de los cuáles 18 fueron aleatorizados. Siete pacientes salieron del estudio, 3 debido a retirada del consentimiento por parte del paciente, 2 por efectos adversos (trombosis yugular en la fase intensiva) y otros 2 por venas inadecuadas en la fase de mantenimiento. De hecho, las complicaciones trombóticas relacionadas con el catéter no son inusuales28-31 y en nuestro caso en ambos se diagnóstico una enfermedad trombótica de base. Once pacientes continúan en activo a fecha de esta actualización.
ConclusionesLos resultados de modelos experimentales han confirmado la capacidad de Albutein® y de Flebogamma® DIF de unirse a Aβ, lo que indica que el posible efecto de ambas proteínas puede formar parte de una estrategia terapéutica para la EA. Por su parte, los estudios clínicos realizados hasta el momento usando aféresis terapéutica con Albutein® han probado que el tratamiento es capaz de modificar la concentración de Aβ en plasma y LCR en pacientes con EA, lo que ha ido asociado a una estabilidad o mejoría de las capacidades cognitivas. Estos positivos resultados han llevado al diseño del nuevo estudio AMBAR en el que se combinan los procedimientos de la aféresis terapéutica y la hemoféresis, con Albutein® (albúmina) y Flebogamma® DIF (Ig). En el estudio AMBAR, multicéntrico, aleatorizado y controlado con grupos paralelos, en el que se combinan diferentes componentes terapéuticos utilizados en diferentes dosis y procedimientos (Concomitant Multimodal Clinical Trial), se evaluarán los cambios cognitivos, funcionales y conductuales en pacientes con EA de leve a moderada. En definitiva, el estudio AMBAR abre nuevas perspectivas terapéuticas ante la EA.
Conflicto de interesesM Costa, AM Ortiz, JI Jorquera, M Torres y A Páez son empleados de Grifols. M Boada, FJ. Muñoz, E Ramos-Fernández y B Guivernau hacen constar que la financiación de los proyectos cuyas investigaciones se exponen en el presente artículo ha sido aportada por Grifols.
Los autores agradecen a las siguientes personas su participación en los estudios realizados: Ernest Palomer, Gerard ILL-Raga, Marta Tajes, Mònica Bosch-Morató, Miguel A. Valverde (Laboratorio de Fisiología Molecular y Canalopatías, Departamento de Ciencias Experimentales y de la Salud, Universitat Pompeu Fabra, Barcelona); Isabel Hernández, Mar Buendia, Lluís Tárraga (Fundació ACE. Institut Català de Neurociències Aplicades, Barcelona); Javier Olazarán (Servicio de Neurología, Hospital General Universitario Gregorio Marañón, Madrid); Fernando Anaya (Servicio de Nefrología, Hospital General Universitario Gregorio Marañón, Madrid); Joan Muñoz, Joan Ramón Grifols, Pilar Ortiz (Banc de Sang i Teixits, Barcelona); Isabel Roca, Gemma Cuberas (Servicio de Medicina Nuclear, Hospital General Universitari Vall d’Hebron, Barcelona); Lourdes Rubio, Gustavo Torres (Clínica Corachán, Barcelona); Ángel Bittini (Servicio de Medicina Nuclear, Hospital General Universitario Gregorio Marañón, Madrid); Juan Guzmán de Villoria (Servicio de Radiología, Hospital General Universitario Gregorio Marañón, Madrid); Isidre Ferrer (Institut de Neuropatologia, Hospital Universitario Bellvitge, Barcelona). Mercè Boada, Francisco J. Muñoz, Eva Ramos-Fernández y Biuse Guivernau agradecen a Grifols la financiación de los proyectos cuyas investigaciones se exponen en el presente artículo. Asimismo los autores agradecen a Jordi Bozzo (Grifols) la asistencia editorial brindada en la preparación del manuscrito.