El deterioro cognitivo es frecuente en la esclerosis múltiple (EM); se correlaciona con diferentes medidas de atrofia cerebral y tiene un impacto negativo en los ámbitos de la vida social, familiar y laboral. La manera de estudiar este deterioro cognitivo en la práctica clínica diaria implica emplear test simples como el Symbol Digit Modalities Test (SDMT) y obtener los datos de atrofia cerebral de una resonancia magnética (RM) convencional.
ObjetivoValorar el deterioro cognitivo (SDMT) y su correlación con medidas bidimensionales de atrofia cerebral en RM. Como medidas de atrofia se ha calculado el índice del cuerpo calloso (ICC) y la anchura del tercer ventrículo (A3V).
Pacientes y métodosSe estudiaron 113 pacientes con EM recurrente remitente procedentes de la consulta monográfica de EM. A todos los pacientes se les administró el SDMT y se calcularon el ICC y la A3V. Para las correlaciones se empleó la r de Pearson.
ResultadosLas puntuaciones brutas del SDMT se correlacionaron significativamente (p<0,001) con la edad (r=−0,58), la Expanded Disability Status Scale (r=−0,49), el ICC (r=0,43) y la A3V (r=−0,57). Las medidas de atrofia cerebral en nuestro estudio mostraron una alta correlación entre ellas (r=−0,72, p<0,0001). Al incluir la edad en las medidas de atrofia cerebral mejoraron las correlaciones: ICC/Edad (r=0,63, p<0,001) y A3V×Edad (r=−0,66, p<0,001).
ConclusionesEl SDMT es una buena herramienta de cribado del deterioro cognitivo en la EM y presenta una correlación moderada con la discapacidad y alta con las medidas de atrofia cerebral.
Cognitive impairment is common in patients with multiple sclerosis (MS); it correlates with different measurements of brain atrophy and has a negative impact on social, family, and work activities. In clinical practice, cognitive impairment is studied with simple tests such as the Symbol Digit Modalities Test (SDMT) and through the acquisition of brain atrophy data with conventional magnetic resonance imaging (MRI).
ObjectiveThis study aimed to evaluate cognitive impairment (SDMT) and its correlation with two-dimensional measurements of brain atrophy in MRI studies. To measure atrophy, we calculated the corpus callosum index (CCI) and third ventricle width (TVW).
Patients and methodsWe studied 113 patients with relapsing-remitting MS from our centre's MS unit. All patients completed the SDMT, and CCI and TVW were calculated. The Pearson r statistic was used to analyse correlations.
ResultsRaw SDMT scores showed a significant correlation (P<.001) with age (r=–0.58), Expanded Disability Status Scale score (r=–0.49), CCI (r=0.43), and TVW (r=–0.57). A strong correlation was observed between both measurements of brain atrophy (r=–0.72; P<.0001). When age was included in the analysis of brain atrophy, the correlations improved: CCI/age (r=0.63; P<.001) and TVW x age (r=–0.66; P<.001).
ConclusionsThe SDMT is useful in screening for cognitive impairment in patients with MS, and presents a moderate correlation with disability and a strong correlation with measurements of brain atrophy.
El deterioro cognitivo, en diferentes grados de severidad, está presente en más del 50% de los pacientes con esclerosis múltiple (EM) y progresa con la evolución de la enfermedad, llegando un pequeño porcentaje a presentar una discapacidad grave que afecta tanto a la vida sociofamiliar como a la laboral, es decir, una demencia franca en la práctica clínica. Es destacable que el deterioro cognitivo en la EM se ha demostrado ya en las fases iniciales de la enfermedad, es decir, en el síndrome clínico aislado (SCA) y en el denominado síndrome radiológico aislado (que en realidad es una forma asintomática de la EM)1–5.
Las alteraciones cognitivas características de la EM están bien caracterizadas, y afectan a la velocidad de procesamiento de la información, la atención, la memoria de trabajo y las funciones ejecutivas, cuya valoración se realiza con baterías cognitivas específicas6–8. En la práctica clínica diaria se emplea de forma habitual como herramienta de cribado del deterioro cognitivo el Symbol Digit Modalities Test (SDMT), ya que es de fácil comprensión por los pacientes y rápido de administrar, valora la atención y la velocidad de procesamiento de la información, cuya validez ha sido formalmente contrastada, y presenta superioridad frente al PASAT (Paced Auditory Serial Addition Test)9,10.
El deterioro cognitivo tiene como un sustrato anatómico importante la atrofia cerebral, y esta relación se ha cuantificado tanto con medidas bidimensionales en la resonancia magnética (RM) como con técnicas de volumetría cerebral11,12.
Cómo medir el deterioro cognitivo y la atrofia cerebral en la EM es motivo de controversia, y depende de los diferentes grupos de estudios clínicos y de investigación. En nuestra serie hemos decidido, por su rapidez y aplicabilidad en la práctica clínica diaria, estudiar el deterioro cognitivo en los pacientes con EM empleando el SDMT como herramienta de cribado, y cuantificar la atrofia empleando las medidas bidimensionales en una RM convencional (el índice del cuerpo calloso y la anchura del tercer ventrículo) en base a su rápida obtención en una consulta especializada.
Pacientes y métodosSe han estudiado 113 pacientes con EM recurrente remitente (EMRR) procedentes de la consulta monográfica de EM en nuestro hospital. A todos los pacientes se les administró el SDMT (del inglés, Symbol Digit Modalities Test), test cognitivo que valora la atención y la velocidad del procesamiento mental, en la consulta monográfica de EM. Los pacientes no debían presentar una deficiencia motora, de coordinación o visual que interfiriera en la realización escrita del SDMT. Los pacientes debían tener una RM realizada dentro de los 6 meses previos a la valoración cognitiva. La atrofia cerebral se estimó a través de medidas bidimensionales de atrofia cerebral, en concreto el índice del cuerpo calloso (ICC) y la anchura del tercer ventrículo cerebral (A3V). Estas medidas fueron seleccionadas ya que el cuerpo calloso es la principal comisura interhemisférica y el tercer ventrículo también ofrece información indirecta sobre la atrofia talámica. Las medidas fueron obtenidas por un neurólogo después de un periodo de adiestramiento en el servicio de Radiología de nuestro hospital. La medición del ICC se realiza sobre la mejor visualización del cuerpo calloso en una secuencia sagital ponderada en T1 centrada a nivel del vérmix cerebeloso, trazando una línea entre las partes más salientes del esplenio y la rodilla del cuerpo calloso (a-b), y el índice consiste en la suma del espesor de la rodilla (a_a’), del esplenio (b_b’) y del cuerpo (c_c’), y normalizada a la distancia a-b ((a_a’+b_b’+c_c’)/a_b)13.
Se ha registrado la edad (años), el tiempo de evolución de la enfermedad desde el primer síntoma (T-Evol, años), la puntuación en la escala EDSS (Expanded Disability Status Scale), la puntuación del SDMT, la puntuación del ICC y la A3V (mm).
Para el análisis estadístico se empleó el paquete estadístico SPSS. En primer lugar se comprobó la normalidad de las variables con el test de Kolmogorov-Smirnov (bondad de ajuste). En caso de normalidad se utilizó la estadística paramétrica (media, DE, test de ANOVA, la t-Student para muestras no pareadas, coeficiente r de correlación de Pearson) y en caso de no ser variables que se puedan normalizar se empleó la estadística no paramétrica (mediana, rango, test de Kruskal-Wallis, test Mann-Whitney para muestras independientes, y coeficiente de correlación de Spearman).
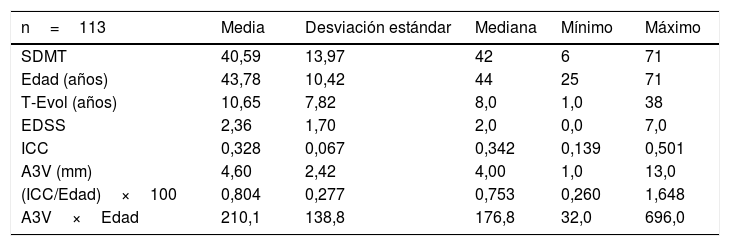
ResultadosLas características basales de los pacientes se exponen en la tabla 1. Se analizaron 113 pacientes con EMRR. Los tratamientos que realizaban los pacientes en el momento de la valoración fueron: interferones (15), acetato de glatirámero (8), teriflunomida (16), dimetilfumarato (19), fingolimod (18), cladribina (11), natalizumab (16), alemtuzumab (7), ocrelizumab (2) y azatioprina (1).
Parámetros basales de los pacientes con EMRR
| n=113 | Media | Desviación estándar | Mediana | Mínimo | Máximo |
|---|---|---|---|---|---|
| SDMT | 40,59 | 13,97 | 42 | 6 | 71 |
| Edad (años) | 43,78 | 10,42 | 44 | 25 | 71 |
| T-Evol (años) | 10,65 | 7,82 | 8,0 | 1,0 | 38 |
| EDSS | 2,36 | 1,70 | 2,0 | 0,0 | 7,0 |
| ICC | 0,328 | 0,067 | 0,342 | 0,139 | 0,501 |
| A3V (mm) | 4,60 | 2,42 | 4,00 | 1,0 | 13,0 |
| (ICC/Edad)×100 | 0,804 | 0,277 | 0,753 | 0,260 | 1,648 |
| A3V×Edad | 210,1 | 138,8 | 176,8 | 32,0 | 696,0 |
A3V: anchura del tercer ventrículo (mm); EDSS: Expanded Disability Status Scale; EMRR: esclerosis múltiple recurrente remitente; ICC: índice del cuerpo calloso; SDMT: Symbol Digit Modalities Test; T_Evol: tiempo de evolución desde el primer síntoma.
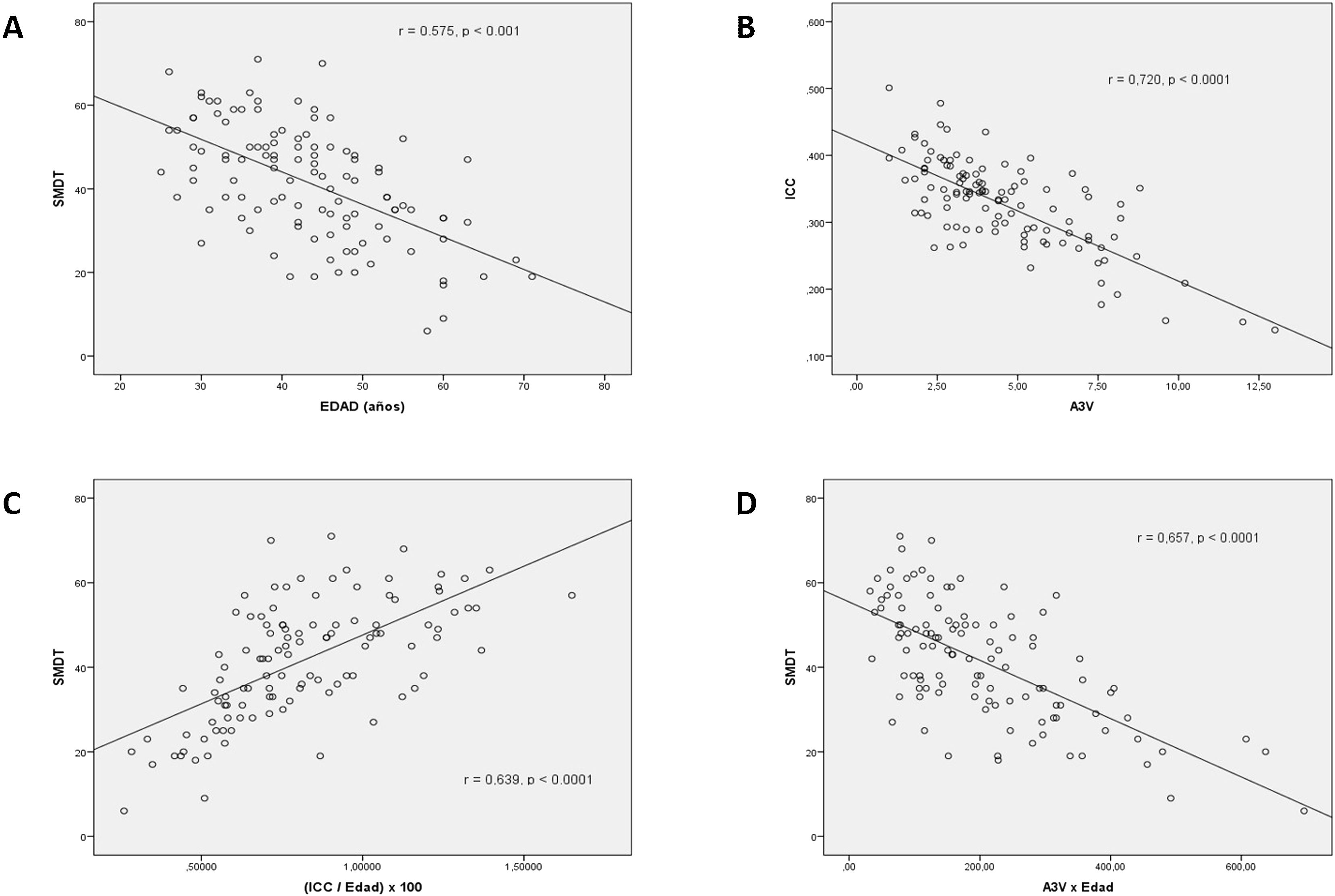
Las puntuaciones brutas del SDMT se correlacionaron significativamente (p<0,001) con la edad (r=−0,58), el T_Evol (r=−0,50), la EDSS (r=−0,49), el ICC (r=0,43) y la A3V (r=−0,57). Las medidas de atrofia cerebral en nuestro estudio mostraron una alta correlación entre ellas (r=−0,72, p<0,0001). Dada la influencia de la edad en la puntuación del SDMT y también sobre las medidas de la atrofia cerebral, se procedió a crear un nuevo índice que incluyera el efecto de la edad en estas medidas. Así el valor del ICC se dividió por la variable edad y la A3V se multiplicó por la variable edad. Las correlaciones de la puntuación del SDMT con los nuevos índices calculados se incrementaron: ICC/Edad (r=0,63, p<0,001) y la A3V×Edad (r=−0,66) (fig. 1).
Se muestran las correlaciones (r de Pearson) entre la Edad y el SDMT (A), entre el ICC y la A3V (B), y entre el SDMT con el ICC/Edad (C) y la A3V×Edad (D). Todas las correlaciones muestran una moderada-alta y significativa asociación. A3V: anchura del tercer ventrículo; ICC: índice del cuerpo calloso; SDMT: Symbol Digit Modalities Test.
La correlación de la discapacidad (EDSS) con las medidas de atrofia cerebral, aunque significativa, fue baja (ICC: r=−0,231, p=0,014; A3V: r=0,370, p<0,001).
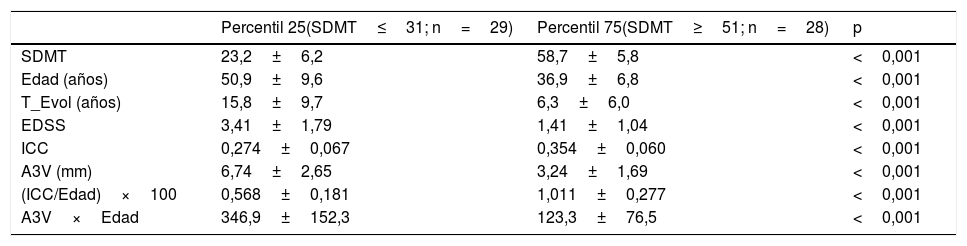
La muestra de pacientes se dividió en cuartiles considerando la puntuación del SDMT y se analizaron las diferencias entre los pacientes situados en el primer (n=29) y el cuarto (n=28) cuartil (tabla 2). La mediana de la puntuación bruta del SDMT en el cuarto cuartil (media 58,5; rango: 51-71) es la esperable para una población de control normal (proyecto NEURONORMA)14. Los pacientes situados en el primer cuartil, comparados con el cuartil superior, eran de más edad, con mayor tiempo de evolución de la EM y mayor discapacidad (EDSS), y presentaban mayor puntuación en los índices de atrofia cerebral. También hubo diferencias significativas en el nivel de estudios entre estos dos grupos (p<0,01), de forma que en el primer cuartil el 65,5% de los pacientes tenían una escolarización primaria frente al 7,1% del cuarto cuartil; y a la inversa, solo un 10,3% de los pacientes del primer cuartil tenían estudios universitarios comparados con el 46,4% de los pacientes del cuartil superior.
Comparación entre el primer y el cuarto cuartil en relación con el valor de SDMT
| Percentil 25(SDMT≤31; n=29) | Percentil 75(SDMT≥51; n=28) | p | |
|---|---|---|---|
| SDMT | 23,2±6,2 | 58,7±5,8 | <0,001 |
| Edad (años) | 50,9±9,6 | 36,9±6,8 | <0,001 |
| T_Evol (años) | 15,8±9,7 | 6,3±6,0 | <0,001 |
| EDSS | 3,41±1,79 | 1,41±1,04 | <0,001 |
| ICC | 0,274±0,067 | 0,354±0,060 | <0,001 |
| A3V (mm) | 6,74±2,65 | 3,24±1,69 | <0,001 |
| (ICC/Edad)×100 | 0,568±0,181 | 1,011±0,277 | <0,001 |
| A3V×Edad | 346,9±152,3 | 123,3±76,5 | <0,001 |
A3V: anchura del tercer ventrículo (mm); EDSS: Expanded Disability Status Scale; ICC: índice del cuerpo calloso; SDMT: Symbol Digit Modalities Test; T_Evol: tiempo de evolución desde el primer síntoma.
El deterioro cognitivo es frecuente en la EM y probablemente está infradiagnosticado. Las áreas que se afectan son la memoria de trabajo, la atención, la velocidad de procesamiento de la información y las funciones ejecutivas. El deterioro cognitivo va parejo a la evolución de la enfermedad y causa una grave repercusión en los ambientes social y familiar, y suele ser una causa principal de desempleo15,16.
La detección del deterioro cognitivo en la EM, aunque ya detectable en el SCA, suele tardar en diagnosticarse dado que los pacientes no suelen mostrar deterioro en los test de cribado cognitivos como el Mini-Mental Test. Se disponen de baterías específicas para valorar el deterioro cognitivo en los pacientes con EM, como son la BICAMS (Brief International Cognitive Assessment for Multiple Sclerosis), la BRB (Brief Repeatable Battery of Neuropsycology Test) y la MACFIMS (Minimal Assessment of Cognitive Function in Multiple Sclerosis)6,7. Recientemente se ha realizado la validación de la versión española del test MoCA (Montreal Cognitive Assessment) como una herramienta de valor para el cribado del deterioro cognitivo en la EM17.
Aunque las baterías exploran más funciones cognitivas que los test más simples, el problema del tiempo y de la no disponibilidad de un neuropsicólogo en las consultas de neurología se convierte en un problema para el seguimiento clínico y detección de la progresión de la enfermedad. En este contexto, disponer de test simples pero validados para el estudio de la función cognitiva en la EM es esencial para la actividad del neurólogo en su práctica clínica diaria. En el presente estudio nos hemos decidido por el SDMT, de administración rápida y dotado de validez y fiabilidad9, que se muestra superior al PASAT en la identificación del deterioro cognitivo en la EM10, se correlaciona con el volumen de la carga lesional en T2 y con el volumen cerebral12,18, y presenta una muy alta correlación con medidas de atrofia cerebral en RM como es el área del cuerpo calloso19,20.
La medición de la atrofia cerebral es compleja; así, pretender realizar su seguimiento con técnicas volumétricas que valoran la pérdida global de volumen cerebral o focal —atrofia talámica—, se alejan de la práctica clínica real y quedan relegadas hoy en día a centros de investigación y a los ensayos clínicos. Sin embargo, estas técnicas complejas de medición de la atrofia cerebral, y su correlación con el deterioro cognitivo, centran la mayoría de la literatura científica actual sobre el tema. Pero la realidad de la mayoría de los centros hospitalarios de segundo nivel asistencial es que se está lejos de disponer de la implantación de estas técnicas de neuroimagen más novedosas a corto-medio plazo. En consecuencia, dado el interés reciente que muestra el estudio del deterioro cognitivo en la EM, nos hemos decidido por valorar la atrofia con medidas bidimensionales en una RM convencional, realizada con los protocolos de estudio para la EM, eligiendo como medidas el ICC y la A3V, que son de fácil medición para un neurólogo entrenado y que muestran correlación con los test neurocognitivos y con la discapacidad medida por la escala EDSS.
Hubo una alta correlación entre el ICC y la A3V, por lo que en la práctica clínica no habría una predilección entre ambos índices, sin embargo, es mucho más rápido y fácil realizar la medición de la A3V. Como era de esperar, las puntuaciones brutas del SDMT se correlacionaron moderadamente con ambos índices de atrofia, y también se correlacionó negativamente con la edad y el tiempo de evolución de los síntomas de EM. También se encontró una correlación significativa entre la edad y los índices de atrofia cerebral. Por tanto, hemos elaborado un índice mixto que incluyera la influencia de la edad en los parámetros de atrofia, observando que las correlaciones con el SDMT mejoraron y con una alta significación estadística (ICC/Edad=0,64, p<0,0001; A3V×Edad=−0,66, p<0,0001). Este incremento en la correlación entre la afectación cognitiva y los índices de atrofia cerebral al incluir el efecto de la edad puede estar indicando un curso clínico más prolongado y por tanto asociar un mayor daño neurodegenerativo, y en algún grado puede estar midiendo los propios efectos intrínsecos de la edad sobre la atrofia cerebral.
Para profundizar en las características del deterioro cognitivo, analizamos los pacientes que se hallaban en el primer y cuarto cuartil de las puntuaciones brutas del SDMT. Los pacientes del primer cuartil tuvieron más edad, más tiempo de evolución, mayor discapacidad (EDSS) y una mayor atrofia cerebral, siendo todas las diferencias estadísticamente significativas (p<0,0001). Podría surgir la duda de que entre los pacientes del primer cuartil, que llevan en promedio 16 años de evolución, pudiera haber formas secundarias progresivas, a pesar de estar con tratamientos modificadores del curso evolutivo de la enfermedad. Sin embargo, la discapacidad medida por la EDSS no apoyaría firmemente esta hipótesis de trabajo [EDSS=3,41, IC95% (2,85-4,07)], y como hipótesis alternativa se podría inferir que estamos observando el verdadero efecto (efectividad) de los tratamientos modificadores del curso evolutivo de la EM.
La puntuación media del SDMT en nuestra muestra de pacientes con EMRR, corregida para la influencia del nivel de los años de escolarización, comparada con los datos de normalidad del proyecto NEURONORMA14, nos indica que la mitad de los pacientes presentaban deterioro cognitivo con este test. El nivel de estudios académicos es una variable importante asociada con el deterioro cognitivo, lo que probablemente esté relacionado con la denominada reserva cognitiva, de forma similar a como ocurre en la neurodegeneración de la enfermedad de Alzheimer21,22.
El presente estudio tiene las limitaciones de ser un estudio transversal y de que la puntuación del SDMT está influida por el estado anímico (depresión), la fatiga y la calidad del sueño, aspectos que no han sido formalmente valorados23. Además, nuestro estudio puede ser mejorado con el análisis de la calidad de vida y la valoración de la repercusión del deterioro cognitivo en la esfera laboral-desempleo.
En conclusión, este estudio pretende servir de utilidad para concienciar sobre la repercusión del deterioro cognitivo en la EM, que es frecuente —al menos el 50% en nuestra población y en diversos grados de severidad—, y cuya relevancia está pobremente ponderada en la escala EDSS, que sobrevalora el aspecto motor a partir de puntuaciones ≥4,0. Las medidas bidimensionales de atrofia cerebral, obtenidas de una RM convencional, son útiles y de fácil manejo para cuantificar la atrofia cerebral en la práctica clínica diaria y se correlacionan de forma moderada-alta con el grado de deterioro cognitivo cuando se emplea el SDMT como herramienta de cribado. Además, como aportación novedosa, creemos que es necesario incluir la edad cronológica en los índices que valoran la atrofia cerebral en las medidas bidimensionales, ya que mejoran la correlación con el SDMT. Por su rápida medición, la A3V es la medida de atrofia cerebral más tiempo-eficiente en la práctica clínica.
Responsabilidades éticasSe han seguido los protocolos de los centros de trabajo sobre tratamiento de la información de los pacientes.
FinanciaciónEl presente trabajo no ha recibido ninguna financiación pública ni privada.
Conflicto de interesesEl autor declara ausencia de conflictos de interés.