En el estudio de enfermedades neurodegenerativas, se ha considerado clásicamente a la enfermedad de Alzheimer (EA) con una presentación típica de síntomas cognitivos y cambios neuroanatómicos. No obstante, existen fenotipos clínicos de EA cuyas bases neurobiológicas presentan similitud con la demencia frontotemporal (DFT). En este sentido, la heterogeneidad de estos cuadros conlleva a procesos de evaluación y diagnóstico poco certeros, debido al escaso conocimiento sobre sus síntomas neurocognitivos. El objetivo de esta revisión sistemática es establecer características y similitudes neuropsicológicas en pacientes con EA y DFT, identificando elementos clave para su diagnóstico diferencial.
MetodologíaLa revisión sistemática se realizó bajo los criterios y diagrama de flujo establecidos en la declaración PRISMA, considerando estudios de las bases de datos Pubmed, Scopus y Web of Science entre los años 2005 y 2020.
ResultadosLa búsqueda dio como resultado 41 artículos finales para llevar a cabo el análisis crítico. La evidencia sugiere que existen diferencias claves en dominios cognitivos como el lenguaje (por ejemplo: fluidez verbal), la memoria, la cognición social, el funcionamiento ejecutivo y la conducta; debiendo ser estos aspectos considerados como fundamentales en todo proceso de evaluación y diagnóstico neuropsicológico.
ConclusionesExisten aspectos lingüísticos que prometen ser biomarcadores potentes para el diagnóstico diferencial entre EA y DFT, siendo estos la fluidez verbal tanto semántica como fonémica y las alteraciones semánticas-gramaticales.
Alzheimer's disease (AD) has classically been considered to present typical cognitive symptoms and neuroanatomical changes. However, the neurobiological basis of some clinical phenotypes of AD is similar to that of frontotemporal dementia (FTD). Therefore, the heterogeneity of these diseases leads to uncertain evaluation and diagnosis processes, due to limited understanding of the associated neurocognitive symptoms. This systematic review aims to describe neuropsychological characteristics and similarities in patients with AD and FTD, and to identify critical points for their differential diagnosis.
MethodsThe present study followed the PRISMA guidelines and included studies from the PubMed, Scopus, and Web of Science databases, published between 2005 and 2020.
ResultsThe search returned a total of 41 articles eligible for critical analysis. The available evidence points to key differences in such cognitive domains as language (eg, verbal fluency), memory, social cognition, executive functioning, and behaviour; these should be considered in all neuropsychological assessments and diagnostic processes.
ConclusionSuch language domains as verbal fluency (semantic and phonemic) and semantic/grammar alterations seem to be useful markers for differential diagnosis between AD and FTD.
Durante el envejecimiento, existe un aumento en el riesgo de aparición de enfermedades neurodegenerativas1. Dentro de estas, el trastorno neurocognitivo mayor (TNM) es considerado altamente prevalente en la vejez, afectando a alrededor de 44,3 millones de personas a nivel mundial, con mayor incidencia en la población femenina2,3. El TNM se caracteriza por una neurodegeneración significativa con impacto directo en las funciones cognitivas4, produciendo deterioro progresivo e irreversible5. Además, este declive cognitivo es capaz de causar pérdida de la independencia en las actividades de la vida diaria6.
Los adultos mayores con TNM experimentan cambios en el volumen cerebral y neuropatológicos, los cuales impactan en el funcionamiento cognitivo, conductual y también lingüístico7,8. Mediante estudios de neuroimagen9,10, se ha establecido que los dominios cognitivos con mayor deterioro en adultos mayores y pacientes con TNM son la velocidad del procesamiento de la información, las funciones ejecutivas, la memoria episódica, el razonamiento conceptual y el lenguaje (por ejemplo, el vocabulario).
La enfermedad de Alzheimer (EA) y la demencia frontotemporal (DFT) están dentro de las patologías neurodegenerativas que destacan por su alta prevalencia. La EA es la forma más común de TNM, correspondiendo al 60 a 70% de casos diagnosticados11,12. Se caracteriza por alteraciones en regiones cerebrales como el hipocampo y lóbulos temporales, con incidencia directa sobre la memoria13. Se postula que los déficits en proteína TAU son responsables no solo de la alteración sináptica en la EA, sino también del deterioro cognitivo manifestado14. Desde una perspectiva neuropsicológica, los sujetos con EA presentan bajo rendimiento en memoria, habilidades visuoespaciales y función ejecutiva15. Otros estudios también sugieren que las dificultades cognitivas en EA afectarían en etapas iniciales la memoria episódica, la fluidez verbal, la capacidad para formar conceptos y la velocidad psicomotora16,17. Clásicamente, la EA se asocia con un notorio declive en la memoria episódica y afasia progresiva primaria en su variante logopénica18; no obstante, la variante frontal de la EA se ha postulado como un fenotipo menos frecuente19 con bases neuropatológicas y síntomas neuropsicológicos diferentes a la EA clásica. Dentro de sus criterios diagnósticos destacan la apatía de carácter progresivo, la desinhibición y las conductas estereotipadas; siendo las alteraciones ejecutivas uno de sus principales rasgos distintivos20,21. Clínicamente, este fenotipo se puede manifestar con predominio de alteraciones conductuales y/o del funcionamiento ejecutivo, constituyendo así tres formas de presentación clínica: la variante conductual, la disejecutiva y la conductual/disejecutiva de la EA (EA-vCD)22.
La degeneración lobular frontotemporal corresponde a un deterioro generalizado que incluye diversas enfermedades neurodegenerativas que comparten como característica común el daño de los lóbulos frontales y temporales23. Los cuadros clínicos causados por esta degeneración son heterogéneos e incluyen diagnósticos tales como la parálisis supranuclear progresiva (PSP), síndrome corticobasal o DFT, los cuales comparten síntomas neurocognitivos en común. Por su parte, la DFT considera tres variantes clínicas por la heteregenoidad de alteraciones cognitvas: la conductual, la demencia semántica y la afasia progresiva primaria no fluente24; con una incidencia de 1,6/100.000 personas a nivel mundial, constituyendo la tercera causa de TNM25–27 después de la demencia vascular.
Las manifestaciones clínicas de la EA han permitido comprender que las dificultades ejecutivas no son síntomas de «exclusividad» para la DFT variante conductual (DFT-vC)22. Algunos estudios28,29 sugieren que estos trastornos manifiestan comportamientos similares; por su parte la DFT-vC puede cursar con amnesia severa, simulando EA, mientras que la EA puede presentarse con afectación severa en las funciones ejecutivas, simulando los déficits de la DFT-vC.
El diagnóstico diferencial es clave para distinguir ambos cuadros clínicos. Por ejemplo, neuropatológicamente se postula como un predictor diferencial la presencia de marcadores de placas beta amiloide, los cuales se expresan solo en EA y no en pacientes con DFT, especialmente en las primeras etapas de la enfermedad30. Diversos autores31,32 concuerdan con la relevancia del diagnóstico certero, ya que, entre un 10 a 40% de individuos diagnosticados en vida con DFT han sido confirmados en estudios post mortem como casos de EA.
Recientes estudios han reportado patrones de atrofia similares en ambos cuadros clínicos, afectando estructuras cerebrales como la corteza prefrontal dorsolateral y los lóbulos temporales mediales, incluidos el hipocampo y la región amigdaliana29,33. La similitud de las áreas afectadas sugiere que en estas patologías no existe un predominio exclusivo de síntomas cognitivos ni conductuales, por lo que basarse en esta premisa puede conducir a procesos de evaluación neuropsicológica y diagnósticos errados.
Si bien la variante frontal de la EA, en su clasificación EA-vCD presenta criterios diagnósticos establecidos, aún se debe especificar sobre sus síntomas iniciales (criterios diagnósticos vigentes), sus posibles factores de riesgo y su perfil neuropsicológico34,35. La evaluación neuropsicológica cobra vital importancia en la identificación de los problemas cognitivos, lingüísticos y conductuales manifestados en EA y DFT. Por ejemplo, la evidencia demuestra que muchos pacientes con DFT muestran deterioro a nivel de memoria similar a la de personas con EA, lo cual repercute en sus habilidades lingüísticas y conductuales36,37. Por tanto, lograr programas de intervención exitosos depende de una correcta evaluación neuropsicológica inicial, por medio de la cual se detecten los síntomas distintivos para cada cuadro.
Considerando los antecedentes expuestos, el objetivo de la presente revisión sistemática cualitativa es establecer características y similitudes neuropsicológicas en pacientes con EA y DFT, identificando elementos claves para su diagnóstico diferencial. Los resultados permitirán a profesionales de la salud que trabajan con personas con estas enfermedades neurodegenerativas, mejorar los procesos de evaluación, diagnóstico y consecuente tratamiento.
MetodologíaSe realizó una revisión sistemática cualitativa bajo los criterios y diagrama de flujo que establece la declaración PRISMA38. El protocolo de revisión sistemática fue registrado previamente en el repositorio PROSPERO con el código: CRD42020220759.
Estrategia de búsqueda para la identificación de estudiosLa búsqueda de referencias bibliográficas consideró las bases de datos PubMed, Scopus y Web of Science. La investigación estuvo limitada a artículos publicados entres los años 2005 al 2020. La sintaxis general de la búsqueda fue: [Alzheimer disease] AND [behavioral variant frontotemporal dementia], [frontal variant of Alzheimer disease], [differential diagnosis], [neuropsychological assessment], [cognitive function], and [language impairment].
Selección de estudios y criterios de inclusión/exclusiónLos artículos seleccionados por título y resumen debían cumplir con lo siguiente. Como criterios de inclusión se establecieron documentos exclusivamente en idioma inglés entre los años 2005 al 2020 y sujetos con una edad de 45 años y más con diagnósticos de DFT y/o EA. Asimismo, fueron incluidos artículos de investigación, de revisión, reportes de casos y ensayos clínicos. Finalmente, se excluyeron estudios en animales, aquellos con pacientes con EA mixta (por ejemplo, EA con cuerpos de Lewy) y los que reportaran sintomatología neuropsiquiátrica como alucinaciones en su muestra de pacientes.
Extracción de datosInicialmente, con el objetivo de eliminar artículos duplicados, se procedió a importar los estudios a software Mendeley versión 10.13. Posteriormente, se realizó una selección de documentos a través de lectura de título y resumen, proceso efectuado por dos investigadores en forma paralela e independiente. Dentro de la información extraída, se incluyeron las características generales de los estudios y de la población con enfermedades neurodegenerativas, tales como: autor(es), año de publicación, muestra, diagnóstico clínico de EA y DFT, edad y/o grupo etario y diseño del estudio. En forma complementaria, se extrajeron las principales características de la metodología de evaluación como instrumentos neuropsicológicos y de neuroimagen, además de los dominios cognitivos evaluados.
Estrategia para la síntesis de datosLa presente revisión sistemática de tipo cualitativa proporciona una síntesis de los hallazgos a partir de los estudios relacionados con la evaluación neuropsicológica en personas con EA y DFT, esenciales para establecer un diagnóstico diferencial entre ambos cuadros. La información medular es presentada en una tabla resumen en formato PICOS. De forma complementaria, durante la discusión se analizan los principales dominios cognitivos con declive en ambos cuadros, estableciendo correlaciones neurobiológicas y similitudes neuropsicológicas en EA y DFT. Finalmente, se indican algunas sugerencias clave para futuras investigaciones con el fin de promover mejoras en el diagnóstico neuropsicológico diferencial de estos cuadros clínicos.
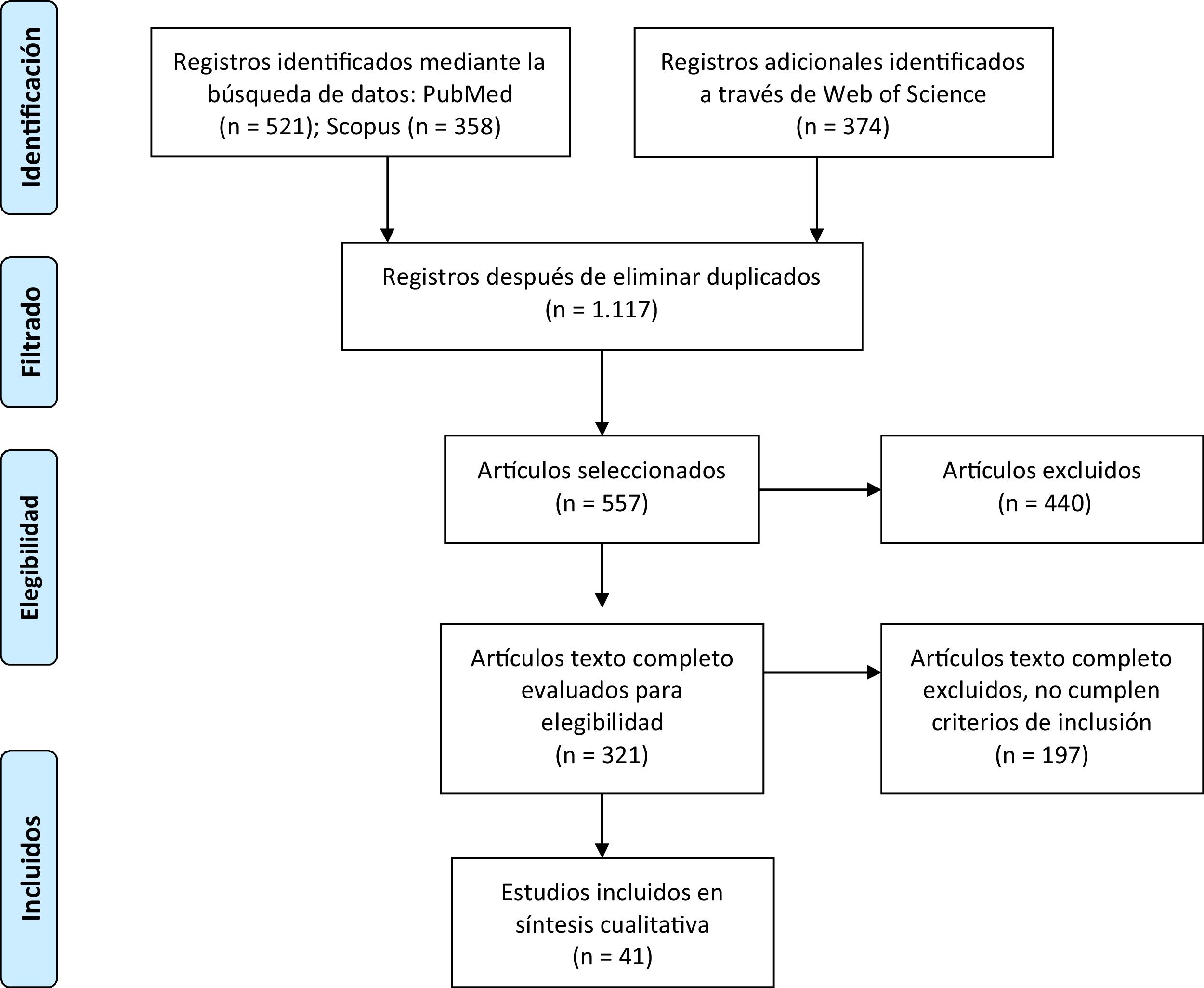
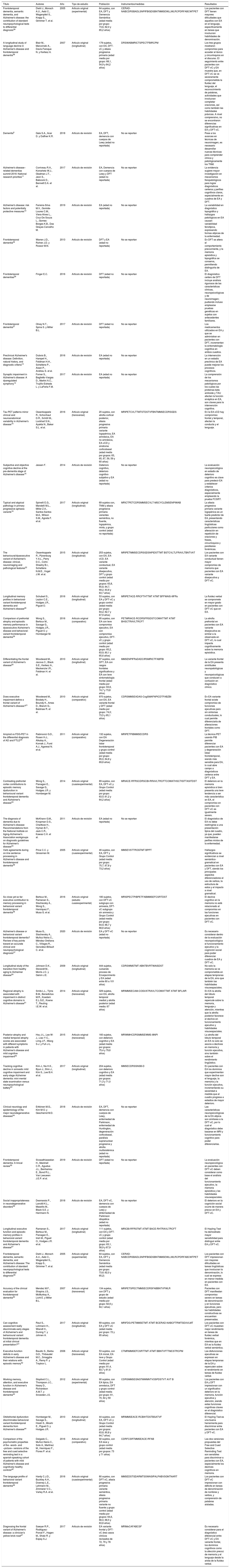
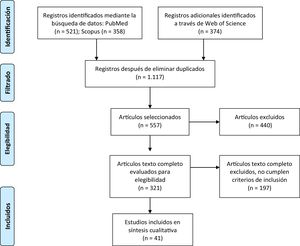
ResultadosBúsqueda de literaturaLa búsqueda y selección de publicaciones realizada en la presente revisión sistemática se ilustra en el diagrama de flujo PRISMA representado en la figura 1. Un total de 1.253 títulos fueron identificados inicialmente en las bases de datos consultadas, los cuales se redujeron tras la eliminación de duplicados a 1.117. Posteriormente, se aplicaron los criterios de cribado y de elegibilidad, los cuales consideraban: presencia de diagnóstico clínico de EA y/o DFT (incluidas sus variables), rango etario desde los 45 años y el tipo de estudio realizado. Con base en los criterios de elegibilidad, se obtuvieron 557 artículos, seleccionando posteriormente 321 a texto completo tras aplicar los criterios de exclusión, de los cuales 124 fueron analizados para elección y consideración. En la etapa final, aplicando criterios de selección, el proceso de búsqueda culminó con 41 artículos examinados. En forma complementaria, se presenta la tabla 1 en formato PICOS con un análisis de los artículos incluidos en la revisión sistemática, organizando la información con base en: título del estudio, autores, año de publicación, tipo de estudio, población analizada, instrumentos y medidas utilizadas así como los principales hallazgos de cada uno.
Estudios analizados
| Título | Autores | Año | Tipo de estudio | Población | Instrumentos/medidas | Resultados |
|---|---|---|---|---|---|---|
| Frontotemporal dementia, semantic dementia, and Alzheimer's disease: the contribution of standard neuropsychological tests to differential diagnosis39 | Diehl J., Monsch A.U., Aebi C., Wagenpfeil S., Krapp S., Grimmer T. et al. | 2005 | Artículo original (experimental) | 64 sujetos, con EA, DFT y Demencia Semántica (edad media por grupo: 73,6, 62,0 y 65,2 años) | CERAD-NABCDRSBADLSNPIFBIGDSBNTMMSEWLLWLRCPDRFABCWTPET | Los pacientes con DFT tienen mayores dificultades que aquellos con EA en el lenguaje, específicamente en tareas que involucran habilidades de denominación. |
| A longitudinal study of language decline in Alzheimer's disease and frontotemporal dementia48 | Blair M., Marczinski A., Davis-Faroque N. y Kertesz A. | 2007 | Artículo original (longitudinal) | 179 sujetos, con EA, DFT-vC y afasia progresiva primaria (edad media por grupo: 68,1, 54,9 y 64,2 años) | DRSWABMRICTSPECTFBIRCPM | Los tres grupos mostraron compromiso para acceder al léxico y circunloquios en el discurso. El seguimiento entre pacientes con DFT-vC y EA muestra que, en DFT-vC se ve severamente comprometida la fluidez del lenguaje, el reconocimiento de palabras, actividades que involucran completar oraciones, así como también las habilidades práxicas. A nivel comprensivo, no se encontraron diferencias significativas en EA y DFT-vC. |
| Dementia6 | Gale S.A., Acar D. y Daffner K.R. | 2018 | Artículo de revisión | EA, DFT, demencia con cuerpos de Lewy (edad no reportada) | No se reportan | Pese a los avances en técnicas de neuroimagen, es necesario desarrollar nuevas técnicas para comprender clínica y patológicamente los TNM. |
| Alzheimer's disease–related dementias summit 2016: National research priorities11 | Corriveau R.A., Koroshetz W.J., Gladman J.T., Jeon S., Babcock D., Bennett D.A. et al. | 2017 | Artículo de revisión | EA, Demencia con cuerpos de Lewy y DFT (edad no reportada) | No se reportan | La evidencia sugiere mayor investigación en mecanismos fisiopatológicos para lograr diagnósticos certeros y perfiles cognitivos claros, especialmente en cuadros de EA y DFT. |
| Alzheimer's disease: risk factors and potentially protective measures12 | Ferreira-Silva M.V., Gomide-Loures C.M., Viera-Alves L., Cruz-De Souza L., Gomes-Borges K.B., Das Graças-Carvalho M. | 2019 | Artículo de revisión | EA (edad no reportada) | No se reportan | La variabilidad en diagnóstico topográfico y hallazgos patológicos en EA causan variabilidad fenotípica, expresando formas atípicas de la enfermedad. |
| Frontotemporal dementia24 | Warren J.D., Rohrer J.D. y Rossor M.N. | 2013 | Artículo de revisión | DFT y EA (edad no reportada) | No se reportan | En DFT se altera el comportamiento precozmente, y la memoria episódica y topográfica se conserva, permitiendo distinguirla de EA. |
| Frontotemporal dementias26 | Finger E.C. | 2016 | Artículo de revisión | DFT (edad no reportada) | No se reportan | El diagnóstico certero de DFT incluye análisis rigurosos de las características clínicas, neuropsicológicas y de neuroimagen; pudiendo incluso emplearse pruebas genéticas en sujetos con antecedentes familiares. |
| Frontotemporal dementia27 | Olney N.T., Spina S. y Miller B.L. | 2017 | Artículo de revisión | DFT (edad no reportada) | No se reportan | Los medicamentos utilizados en EA y que se administran en pacientes con DFT, incrementan la sintomatología cognitiva en ambos cuadros. |
| Preclinical Alzheimer's disease: Definition, natural history, and diagnostic criteria13 | Dubois B., Hampel H., Feldman H.H., Scheltens P., Aisen P., Andrieu S. et al. | 2016 | Artículo de revisión | EA (edad no reportada) | No se reportan | La intervención en un estadio preclínico de EA puede mejorar los procesos cognitivos. |
| Synaptic impairment in Alzheimer's disease: A dysregulated symphony14 | Forner S., Baglietto-Vargas D., Martini A.C., Trujillo-Estrada L. y LaFerla F.M. | 2017 | Artículo de revisión | EA (edad no reportada) | No se reportan | La comprensión de los mecanismos patológicos por los cuales las proteínas beta amiloide y TAU afectan la función sináptica en EA, son claves para la intervención cognitiva. |
| Tau PET patterns mirror clinical and neuroanatomical variability in Alzheimer's disease15 | Ossenkoppele R., Schonhaut D.R., Schöll M., Lockhart S.N., Ayakta N., Baker S.L. et al. | 2016 | Artículo original (transversal) | 20 sujetos, con atrofia cortical posterior, afasia progresiva primaria variante logopénica, EA amnésica, EA no amnésica, EA-vCD y síndrome corticobasal (edad media por grupos: 63, 65, 67, 59, 59 y 60 años) | MRIPETCVLTTMTSTDSTVFBNTMMSECDRSGDS | En la EA-vCD hay compromiso frontal y temporal, afectan la conducta y el lenguaje. |
| Subjective and objective cognitive decline at the pre-dementia stage of Alzheimer's disease16 | Jessen F. | 2014 | Artículo de revisión | Deterioro cognitivo, deterioro cognitivo subjetivo y EA (edad no reportada) | No se reportan | La evaluación neuropsicológica en estadio de deterioro cognitivo es clave para predecir EA y establecer criterios diagnósticos, especialmente empleando la prueba FCSRT. |
| Typical and atypical pathology in primary progressive aphasia variants18 | Spinelli E.G., Mandelli M.L., Miller Z.A., Santos-Santos M.A., Wilson S.M., Agosta F. et al. | 2017 | Artículo original (longitudinal) | 69 sujetos con, TNM y afasia progresiva primaria variantes semántica, no fluente, logopénica, mixta, y grupo control (edad no reportada) | MRICTPETCDRSMMSECVLT-MSCYCLEMSENPIWAB | La afasia progresiva primaria variante logopénica es un fuerte predictor de EA, presentando características lingüísticas particulares como alteración en repetición de oraciones y frases, circunloquios y parafasias fonémicas. |
| The behavioural/dysexecutive variant of Alzheimer's disease: clinical, neuroimaging and pathological features22 | Ossenkoppele R., Pijnenburg Y.A.L., Perry D.C., Cohn-Sheehy B.I., Scheltens N.M.E., Vogel J.W. et al. | 2015 | Artículo original (longitudinal) | 253 sujetos, con EA, EA-vCD, EA variante conductual, EA variante disejecutiva, DFT y grupo control (edad media por grupos: 63,8, 65,8, 64,7, 69,2, 63,8 y 63,7 años) | MRIPETMMSECDRSGDSNPIDSTTMT BSTCVLTLFRAVLTBNTVAT | Los pacientes con EA variante conductual tienen mayor compromiso de memoria que pacientes con EA variante disejecutiva y DFT-vC. |
| Longitudinal memory profiles in behavioral-variant frontotemporal dementia and Alzheimer's disease28 | Schubert S., Leyton C.E., Hodges J.R., Piguet O. | 2016 | Artículo original (longitudinal) | 53 sujetos, con EA y DFT-vC y grupo control (edad media por grupo: 64,2, 62,7 y 67,9 años) | MRIPETACE-RRCFTHTTMT ATMT BFFWAIS-IIIFRs | La fluidez verbal se compromete en mayor grado en pacientes con DFT-vC que en EA. |
| Comparison of prefrontal atrophy and episodic memory performance in dysexecutive Alzheimer's disease and behavioral-variant frontotemporal dementia29 | Wong S., Bertoux M., Savage G., Hodges J.R., Piguet O. y Hornberger M. | 2016 | Artículo original (comparativo) | 95 sujetos, con EA con leve compromiso ejecutivo, EA con compromiso ejecutivo, DFT-vC y grupo control (edad media por grupo: 65,2, 63,9, 60,1 y 65,6 años) | PETMRIACE-RCDRSFRSDSTCOWATTMT ATMT BHSCTRAVLTRCFT | La atrofia prefrontal en pacientes con EA variante disejecutiva es similar a la observada en DFT-vC, lo cual impacta cognitivamente sobre la memoria episódica. |
| Differentiating the frontal variant of Alzheimer's disease20 | Woodward M., Jacova C., Black S.E., Kertesz A., Mackenzie I.R., Feldman H. et al. | 2010 | Artículo original (longitudinal) | 97 sujetos, con DFT, EA con rasgos frontales significativos y EA con leve sintomatología frontal (edad media por grupo: 63,6, 74,7 y 73,8 años) | MMSENPIFRsDADCIRSMRICTFABFBI | La variante frontal de la EA presenta similitudes neuropatológicas y neuropsicológicas que conducen a confusión en diagnóstico clínico. |
| Does executive impairment define a frontal variant of Alzheimer's disease?21 | Woodward M., Brodaty H., Boundy K., Ames D., Blanch G., Balshaw R. et al. | 2010 | Artículo original (comparativo) | 970 sujetos, con EA, EA variante frontal y DFT (edad media por grupo: 74,0; 73,5 y 65,1 años) | CDRSMMSEADAS-CogSMAFNPICDTFABZBI | En EA variante frontal existe compromiso de funciones ejecutivas pero sin síntomas conductuales, lo cual permite diferenciarla de alteraciones frontales como DFT. |
| Amyloid vs FDG-PET in the differential diagnosis of AD and FTLD32 | Rabinovici G.D., Rosen H.J., Alkalay A., Kornak J., Furst A.J., Agarwal N. et al. | 2011 | Artículo original (comparativo) | 132 sujetos, con EA Degeneración lobar frontotemporal y grupo control (edad media por grupo: 65,0, 64,8 y 69,8 años) | MRIPETPiBMMSECDRS | La técnica PET usando PiB permite diferenciar pacientes con EA y degeneración lobar frontotemporal, siendo más sensible para EA, lo cual abre campo a diagnósticos certeros entre DFT y EA. |
| Contrasting prefrontal cortex contributions to episodic memory dysfunction in behavioural variant frontotemporal dementia and Alzheimer's disease33 | Wong S., Flanagan E., Savage G., Hodges J.R. y Hornberger M. | 2014 | Artículo original (cuasiexperimental) | 89 sujetos, con EA, DFT-vC y Grupo Control (edad media por grupo: 63,5; 61,2 y 64,2 años) | MRIACE-RFRSCDRSCBI-RRAVLTRCFTCOWATHSCTIGTTASITDST | El deterioro en la memoria episódica si bien presenta una leve tendencia a ser más característica en EA, el compromiso en pacientes con DFT-vC es igualmente severo. |
| The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease34 | McKhann G.M., Knopman D.S., Chertkow H., Hyman B.T., Jack C.R., Kawas C.H. et al. | 2011 | Artículo de revisión | EA (edad no reportada) | No se reportan | El diagnóstico de EA no debe restringirse a una presentación típica del cuadro, ya que, pueden manifestarse perfiles mixtos de la enfermedad. |
| Verb agreements during on-line sentence processing in Alzheimer's disease and frontotemporal dementia49 | Price C.C. y Grossman M. | 2005 | Artículo original (cuasiexperimental) | 46 sujetos, con EA, DFT y Grupo Control (edad media por grupo: 75,7, 67,8 y 73,2 años) | MMSEVSTTROGTMT BPPT | Hallazgos significativos se evidencian a nivel semántico-gramatical en pacientes con EA y DFT, siendo los principales aspectos diferenciadores el uso de verbos, la estructura de estos y el impacto a nivel gramatical. |
| So close yet so far: executive contribution to memory processing in behavioral variant frontotemporal dementia36 | Bertoux M., Ramanan S., Slachevsky A., Wong S., Henriquez F., Musa G. et al. | 2016 | Artículo original (estudio cuasiexperimental) | 180 sujetos, con DFT-vC subgrupo con amnesia, DFT-vC subgrupo sin amnesia y Grupo Control (edad media por grupo: 64,9, 66,7 y 68,8 años) | MRISPECTPiBPETFABMMSEFCSRTDST | El declive cognitivo en la memoria no está relacionado al compromiso en las funciones ejecutivas en pacientes con DFT-vC. |
| Alzheimer's disease or behavioral variant frontotemporal dementia? Review of key points toward an accurate clinical and neuropsychological diagnosis37 | Musa G., Slachevsky A., Muñoz-Neira C., Méndez-Orellana C., Villagra R., González-Billault C. et al. | 2020 | Artículo de revisión | EA y DFT-vC (edad no reportada) | No se reportan | Es necesario considerar dentro de la evaluación neuropsicológica el funcionamiento ejecutivo y la cognición social para poder diferenciar cuadros de EA y DFT-vC. |
| Longitudinal study of the transition from healthy aging to Alzheimer disease50 | Johnson D.K., Storandt M., Morris J.C. y Galvin J.E. | 2009 | Artículo original (longitudinal) | 444 sujetos, cursando proceso de Envejecimiento y EA (edad entre 60 a 101 años) | CDRSWMSTMT ABNTBVRTWAISDST | No solo la memoria se ve comprometida en etapas tempranas de la EA, sino que también las habilidades visuoespaciales. |
| Regional atrophy is associated with impairment in distinct cognitive domains in Alzheimer's disease51 | Smits L.L., Tijms B.M., Benedictus M.R., Koedam E.L.G.E., Koene T., Reuling I.E.W. et al. | 2014 | Artículo original (transversal) | 329 sujetos, con EA, atrofia temporal medial y atrofia posterior (edad media: 67 años) | MRIMMSECAM-COGVATRAVLTCOWATTMT ATMT BFLAIR | En EA la atrofia del lóbulo temporal repercute sobre la memoria, lenguaje y atención, mientras que la atrofia posterior favorece el declive en funcionamiento ejecutivo y habilidades visuoespaciales. |
| Posterior atrophy and medial temporal atrophy scores are associated with different symptoms in patients with Alzheimer's disease and mild cognitive impairment52 | Hsu J-L., Lee W-J., Liao Y-C., Lirng J-F., Wang S-J. y Fuh J-L. | 2015 | Artículo original (transversal) | 160 sujetos, con deterioro cognitivo y EA (edad media por grupos: 75,4 y 79,6 años) | MRIWMHCDRSMMSEWMS-IIINPI | La atrofia del lóbulo temporal en EA no solo se asocia a declives en memoria y función ejecutiva, sino también sobre el rendimiento lingüístico. |
| Tracking cognitive decline in amnestic mild cognitive impairment and early-stage Alzheimer dementia: mini-mental state examination versus neuropsychological battery53 | Kim J., Na H.K., Byun J., Shin J., Kim S., Lee B.H. et al. | 2017 | Artículo original (longitudinal) | 204 sujetos, con deterioro cognitivo y EA (edad media por grupos: 71,3 y 71,0 años) | MMSECDRSSNSB-D | En pacientes con EA los dominios que experimentan mayor declive son el lenguaje, la memoria y la función ejecutiva, incrementando su severidad a medida que el cuadro progresa a estadios de mayor deterioro. |
| Clinical neurology and epidemiology of the major neurodegenerative diseases54 | Erkkinen M.G., Kim M-O. y Geschwind M.D. | 2018 | Artículo de revisión | EA, DFT, demencia con cuerpos de Lewy, enfermedad de Parkinson, enfermedad de Huntington, degeneración corticobasal, parálisis supranuclear progresiva y atrofia multisistémica (edad no reportada) | No se reportan | Las características neuropsicológicas de la EA atípica son similares a la DFT-vC, por lo cual el diagnóstico debe basarse en MRI y funcionamiento cognitivo para poder diferenciarlas. |
| Frontotemporal dementia: A linical review55 | Sivasathiaseelan H., Marshall C.R., Agustus J.L., Benhamou E., Bond R.L., Van Leeuwen J.E.P. et al. | 2019 | Artículo de revisión | DFT (edad no reportada) | No se reportan | La evaluación neuropsicológica en pacientes con DFT-vC deben considerar como base el análisis del funcionamiento ejecutivo, la memoria episódica y las habilidades visuoespaciales. |
| Social inappropriateness in neurodegenerative disorders56 | Desmarais P., Lanctôt K.L., Masellis M., Black S.E. y Herrmann N. | 2018 | Artículo de revisión | EA, DFT-vC, demencia con cuerpos de Lewy y dnfermedad de Parkinson idiopática (edad no reportada) | No se reportan | El deterioro en la cognición social ocurre de manera precoz en EA y DFT-vC. |
| Longitudinal executive function and episodic memory profiles in behavioral-variant frontotemporal dementia and Alzheimer's disease57 | Ramanan S., Bertoux M., Flanagan E., Irish M., Piguet O., Hodges J.R. et al. | 2017 | Artículo original (longitudinal) | 111 sujetos, con EA y DFT-vC y grupo control (edad media por grupo: 63,1, 58,9 y 67,9 años) | MRICBI-RFRSTMT ATMT BACE-RHTRAVLTRCFT | El Hayling Test ha demostrado mayor sensibilidad para distinguir entre EA y DFT-vC. |
| Frontotemporal dementia, semantic dementia, and Alzheimer's disease: The contribution of standard neuropsychological tests to differential diagnosis39 | Diehl J., Monsch A.U., Aebi C., Wagenpfeil S., Krapp S., Grimmer T. et al. | 2005 | Artículo original (experimental) | 64 sujetos, con EA, DFT y Demencia Semántica (edad media por grupo: 73,6; 62,0 y 65,2) | CERAD-NABCDRSBADLSNPIFBIGDSBNTMMSEWLLWLRCPDRFABCWTPET | Los pacientes con DFT impresionan con mayores dificultades en tareas lingüísticas que involucran la denominación, lo cual se expresa en menor medida en pacientes con EA. |
| Accuracy of the clinical evaluation for frontotemporal dementia40 | Mendez M.F., Shapira J.S., McMurtray A., Licht E. y Miller B.L. | 2007 | Artículo original (transversal) | 134 sujetos, con DFT y grupo de estudio (edad media por grupo: 62,6 y 64,1 años) | MRIPETSPECTMMSECDRSFABBNTVFWLR | Pacientes con DFT manifiestan compromiso severo en tareas de denominación y en funciones ejecutivas, pero las habilidades constructivas se encuentran preservadas. |
| Can cognitive assessment really discriminate early stages of Alzheimer's and behavioural variant frontotemporal dementia at initial clinical presentation?41 | Reul S., Lohmann H., Wiendl H., Duning T. y Johnen A. | 2017 | Artículo original (longitudinal) | 69 sujetos, con EA y DFT-vC (edad media por grupo: 72 y 65 años) | MRIFDG-PETMMSETMT ATMT BCERAD-NABCFTRWTSEAVLMT | Los pacientes con DFT-vC muestran mejor rendimiento en tareas de fluidez verbal fonémica, mientras que en EA es la fluidez verbal semántica. |
| Executive function deficits in early Alzheimer's disease and their relations with episodic memory42 | Baudic S., Barba G.D., Thibaudet M.C., Smagghe A., Remy P. y Traykov L. | 2006 | Artículo original (transversal) | 53 sujetos, con EA inicial, EA leve y Grupo Control (edad media por grupo: 81,4, 83,7 y 81,6 años) | CTMRIMMSEFCSRTTMT ATMT BBNTVFTTMCSTRCPM | Las disfunciones ejecutivas se expresan en etapas tempranas de la EA y repercuten sobre el rendimiento en tareas de fluidez verbal. |
| Working memory, attention, and executive function in Alzheimer's disease and frontotemporal dementia43 | Stopford C.L., Thompson J.C., Neary D., Richardson A.M.T. y Snowden J.S. | 2012 | Artículo original (experimental) | 90 sujetos, con EA típica, EA amnésica, DFT y grupo control (edad media por grupo: 61, 70, 64 y 59 años) | CDRSMMSEGNGTMWMNTVOSPDSTVT AVT B | Los pacientes con EA y DFT impresionan con un significativo deterioro en la memoria, función ejecutiva y atención, siendo estas funciones cognitivas claves en el diagnóstico diferencial. |
| Orbitofrontal dysfunction discriminates behavioral variant frontotemporal dementia from Alzheimer's disease44 | Hornberger M., Savage S., Hsieh S., Mioshi E., Piguet O. y Hodges J.R. | 2010 | Artículo original (longitudinal) | 44 sujetos, con EA, DFT-vC y Grupo Control (edad media por grupos: 63,8, 60,8 y 64,7 años) | MRIMMSEACE-RCBIHTDSTBSATVF | El Hayling Test es una buena herramienta para discriminar entre pacientes con EA y DFT-vC. |
| Comparison of the psychometric properties of the «word» and «picture» versions of the free and cued selective reminding test in a spanish-speaking cohort of patients with mild Alzheimer's disease and cognitively healthy controls45 | Delgado C., Muñoz-Neira C., Soto A., Martínez M., Henríquez F., Flores P. et al. | 2016 | Artículo original (comparativo) | 92 sujetos, con EA leve y grupo control (edad media por grupos: 73 y 71 años) | CDRFCSRTMMSEACE-RFAB | Las dos versiones propuestas del Free and Cued Selective Reminding Test son sensibles para discriminar a pacientes con EA, especialmente los declives cognitivos en memoria. |
| The language profile of behavioral variant frontotemporal dementia46 | Hardy C.J.D., Buckley A.H., Downey L.E., Lehmann M., Zimmerer V.C., Varley R.A. et al. | 2016 | Artículo original (cuasiexperimental) | 80 sujetos, con DFT-vC, afasia progresiva primaria variante semántica, afasia progresiva primaria variante no fluente y grupo control (edad media por grupos: 64,6, 66,0, 68,5 y 63,8 años) | MMSEDSTGDARMTSSWASIPALPABVSGNTNART | Los pacientes con DFT-vC impresionan con déficits en tareas de denominación de nombres y verbos, y comprensión de palabras aisladas. |
| Diagnosing the frontal variant of Alzheimer's disease: a clinician's yellow brick road47 | Sawyer R.P., Rodriguez-Porcel F., Hagen M., Shatz R. y Espay A.J. | 2017 | Artículo de revisión | EA variante frontal y DFT-vC (tres casos clínicos revisados de 72, 79 y 78 años) | MRIMoCAFABCSF | Es necesario considerar para el diagnóstico diferencial entre DFT-vC y EA variante frontal, los dominios cognitivos como la afección precoz de memoria y el lenguaje desde la arista de la fluidez verbal. |
ACE-R: Addenbrooke's Cognitive Examination-Revised; ADAS-Cog: Alzheimer's Disease Assessment Scale-Cognitive; BADLS: Bayer Activities of Daily Living Scale; BNT: Boston Naming Test; BSAT: Brixton Spatial Anticipation Test; BVRT: Benton Visual Retention Test; BVS: British Vocabulary Scale; CAM-COG: Cambridge Cognitive Examination; CBI: Cambridge Behavioural Inventory; CBI-R: Cambridge Behavioural Inventory Revised; CDT: Clock Drawing Test; CDRS: Clinical Dementia Rating Scale; CERAD-NAB: Consortium to Establish a Registry for Alzheimer's Disease–Neuropsychological Assessment Battery; CFT: Complex Figure Test; CIRS: Cumulative Illness Rating Scale; COWAT: Controlled Oral Word Association Test; CPDR: Constructional Praxis–Delayed Recall; CSF: Cerebral Spine Fluid; CT: Computerized Tomography; CVLT: California Verbal Learning Test; CVLT-MS: California Verbal Learning Test-Mental Status versión; CWT: Color Word Test; CYCLE: Curtiss-Yamada Comprehensive Language Evaluation; DAD: Disability Assessment for Dementia Scale; DFT: Demencia frontotemporal; DFT-vC: DFT variante conductual DRS: Dementia Rating Scale; DST: Digit Span Test; EA: Enfermedad de Alzheimer; EA-vCD: Variante conductual/disejecutiva de la EA; FAB: Frontal Assessment Battery; FBI: Frontal Behavioral Inventory; FCSRT: Free and Cued Selective Reminding Test; FDG-PET: F-fluorodeoxyglucose Positron Emission Tomography; FF: Phonemic Fluency; FLAIR: Fluid-attenuated Inversion Recovery; FRS: Frontotemporal Dementia Rating Scale; FRs: Functional Rating Scale; GDA: Graded Difficulty Arithmetic Test; GDS: Geriatric Depression Scale; GNGT: Go-no-Go Task; GNT: Graded Naming Test; HT: Hayling Test; HSCT: Hayling Sentence Completion Test; IGT: Iowa Gambling Task; LT: Letter Fluency; MCST: Modified Card Sorting Test; MMSE: Mini Mental State Examination; MoCA: Montreal Cognitive Assessment; MRI: Magnetic Resonance Imaging; MSE: Motor Speech Evaluation; MWMNT: Manchester word-picture matching and naming Tests; NART: National Adult Reading Test; NPI: Neuropsychiatric Inventory; PALPA: Psycholinguistic Assessment of Language Processing in Aphasia; PET: Positron Emission Tomography; PiB: Pittsburgh Compund-B; PPT: Pyramid and Palm Tree Test; RAVLT: Rey Auditory Verbal Learning Test; RCFT: Rey-Osterrieth Complex Figure Task; RCPM: Raven Colored Progressive Matrices; RMT: Recognition Memory Test; RWT: Regensburg Word Fluency Test; SEA: Social Cognition and Emotional Assessment; SMAF: Functional Autonomy Measurement System; SNSB-D: Dementia version of the Seoul Neuropsychological Screening Battery; SPECT: Single Photon Emission Computed Tomography; SS: Spatial Span; ST: Stroop Test; TASIT: Awareness of Social Inference Test; TMT A: Trail Making Test Part A; TMT B: Trail Making Test Part B; TROG: Test for the Repetition of Grammar; TT: Token Test; VAT: Visual Association Test; VF: Verbal Fluency; VLMT: Verbal Learning and Memory Test; VOSP: Visual Object and Space Perception battery; VST: Verbal Similarity Task; VT A: Vigilance Task A; VT B: Vigilance Task B; WAB: Western Aphasia Battery; WAIS: Wechsler Adult Intelligence Scale; WAIS-III: Wechsler Adult Intelligence Scale, third edition; WASI: Wechsler Abbreviated Scale of Intelligence; WLR: Word List Recall; WMH: White Matter Hyperintensity; WMS: Wechsler Memory Scale; WMS-III: Wechsler Memory Scale III; WWL: Word List Learning; ZBI: Zarit Caregiver Burden Interview
La evaluación neuropsicológica se ha descrito como un elemento primordial en la diferenciación de cuadros EA y DFT, pero presenta importantes desafíos para distinguir la DFT-vC de la variante EA-vCD por sus similitudes sintomatológicas en las alteraciones de las funciones ejecutivas, memoria y lenguaje.
Funcionamiento ejecutivoLas alteraciones de la función ejecutiva han sido asociadas tradicionalmente con la DFT-vC39,40. No obstante, un estudio41 que analizó 69 pacientes con EA y DFT-vC, evidencia que los sujetos con EA logran puntuaciones similares en el funcionamiento ejecutivo, e incluso, significativamente más bajas que los sujetos con DFT-vC. Estos resultados están en línea con un estudio previo que incluyó 253 personas con EA clásica, EA-vCD, EA variante conductual y variante disejecutiva, además de DFT-vC22. Los hallazgos sugieren que los pacientes con EA-vCD muestran un bajo rendimiento en habilidades ejecutivas como ocurre en DFT-vC. Sin embargo, la amplia diversidad de pruebas neuropsicológicas para evaluar el funcionamiento ejecutivo dificulta la elección sobre aquellas pruebas que tengan mayor sensibilidad para establecer el diagnóstico diferencial neuropsicológico entre estos cuadros42,43.
MemoriaEn cuanto a la evaluación de la memoria, se postula que los pacientes con EA clásica en etapas iniciales manifiestan un rendimiento significativamente más bajo que aquellos con DFT-vC, especialmente en los subdominios de reconocimiento verbal y recuerdo verbal; siendo este último aspecto diferenciador entre EA clásica y DFT-vC41. En esta línea, se ha demostrado que el Hayling Test y el Digit Span Backwards son pruebas que logran detectar correctamente en un 86% a los pacientes con DFT-vC y diferenciarlos de aquellos con EA clásica. Además, la identificación de alteraciones en la memoria episódica por medio de la prueba Free and Cued Selective Reminding Test parece ser crucial para detectar a sujetos con EA y consecuentemente, diferenciar este cuadro clínico de otros (por ejemplo, DFT-vC)43-45.
LenguajeResulta necesario destacar que la evaluación cognitiva incluye diferentes dominios, entre ellos el lingüístico; puesto que las habilidades de denominación y fluidez verbal se postulan como predictores para diferenciar entre DFT-vC y EA-vCD. Por ejemplo, los pacientes con DFT-vC impresionan con menor rendimiento en habilidades de denominación de objetos, nombres y verbos; mientras que aquellos con EA-vCD presentan un menor rendimiento en tareas de fluidez verbal de tipo semántica46,47. Estos resultados son confirmados en otro estudio retrospectivo donde se revelan marcados déficits en tareas de denominación de objetos, siendo los pacientes con EA-vCD quienes presentan mejor rendimiento en este dominio lingüístico vs. los sujetos con DFT-vC, que muestran un desempeño deficiente en este tipo de tareas. Asimismo, los participantes con EA-vCD muestran un mejor rendimiento en tareas de fluidez verbal semántica, mientras que los sujetos con DFT-vC presentan mejor rendimiento en cuestiones de fluidez verbal de tipo fonémica41.
El abordaje cognitivo-lingüístico parece ser un aspecto relevante de profundizar al momento de buscar perfiles diferenciadores. El estudio longitudinal de Blair et al.48 evaluó con el Western Aphasia Battery Test a pacientes con DFT, EA y con afasia progresiva primaria y encontró que inicialmente no existen diferencia entre EA y DFT-vC, pero sí halló que específicamente para DFT-vC sucesivamente se observaban alteraciones en la fluidez del lenguaje espontáneo, completación de oraciones y reconocimiento de palabras. Esto se confirma con un estudio posterior46 que propone que DFT-vC se asocia a un perfil de alteraciones semánticas verbales que prometen ser un biomarcador temprano. Este componente semántico verbal es de interés en diferenciar alteraciones del procesamiento del lenguaje. Pacientes con EA presentan modificaciones selectivas en el uso de verbos, específicamente en detectar el rol temático de las estructuras verbales mientras que las alteraciones en los pacientes DFT son más globales, viéndose afectado a nivel gramatical y las representaciones semánticas de los verbos49.
Correlato neurobiológico y síntomas neurocognitivosEn un estudio longitudinal con 204 sujetos se examinaron los dominios cognitivos afectados en EA más allá de los déficits en memoria episódica y función ejecutiva. Los hallazgos sugieren que las habilidades visuoespaciales se afectan de manera precoz (tres años antes del diagnóstico clínico de EA) y, que tras iniciado el cuadro, las repercusiones cognitivas en la memoria verbal, semántica y de trabajo serían consecuencia del déficit en habilidades visuoespaciales experimentadas previamente, manifestando de este modo un deterioro cognitivo significativo en los sujetos50.
La literatura51,52 sugiere que en sujetos con EA la atrofia temporal medial impacta en la memoria, el lenguaje y la atención; mientras que la atrofia temporal posterior repercute sobre el funcionamiento visuoespacial y ejecutivo. Estos resultados son consistentes con otro estudio53 donde se analizaron los déficits cognitivos en sujetos con deterioro cognitivo y EA, evidenciando que la pérdida significativa de sustancia gris repercute en el grado de severidad de la patología y el rendimiento cognitivo general en evaluaciones neuropsicológicas, especialmente aquellas que demandan el uso de habilidades mnésicas y lingüísticas.
Los cambios en el rendimiento cognitivo en la DFT-vC afectan el funcionamiento ejecutivo, la conducta y el lenguaje. Por ello, se postula que las repercusiones conductuales se atribuyen a la atrofia experimentada a nivel de corteza prefrontal, lo cual impacta en la autovalencia de los sujetos. A medida que el trastorno evoluciona, los síntomas clínicos convergen y afectan aspectos tanto cognitivos como no cognitivos (por ejemplo, la personalidad)54,55.
Similitudes neuropsicológicasAlgunas líneas de investigación recientes se han enfocado en analizar el comportamiento social y las funciones ejecutivas en pacientes con DFT-vC y EA. En consideración, se postula que los comportamientos sociales inadecuados se reportan en etapas iniciales de ambos cuadros, los cuales cursan con pérdida de empatía y marcada desinhibición. De igual forma, se reporta que la sintomatología neuropsiquiátrica como la falta de autocontrol, los déficits en la cognición social y la pérdida de habilidades para reconocer el lenguaje sarcástico, promueven un deterioro cognitivo en ambos cuadros clínicos56.
Asimismo, los hallazgos de un estudio longitudinal en 111 sujetos con EA y DFT-vC señalan que, en ambos cuadros neurodegenerativos, el deterioro cognitivo experimentado al inicio del estudio involucra deficiencias en las funciones ejecutivas, en la memoria y en la orientación; no obstante, tras un seguimiento de tres años, se evidencia mayor deterioro del funcionamiento ejecutivo en sujetos con DFT-vC en comparación con el grupo de EA. Los resultados también revelan que las conductas de desinhibición permitien discriminar entre pacientes con DFT-vC de aquellos con EA (tanto en etapas iniciales como avanzadas), puesto que en las personas con DFT-vC estas conductas tienden a ser más características y severas57.
ConclusiónExisten aspectos neuropsicológicos relevantes que pueden conducir a un diagnóstico diferencial entre EA y DFT-vC, no obstante, las bases neurobiológicas de estos cuadros (especialmente en las variantes atípicas de EA) pueden llevar a diagnósticos errados. La memoria y la función ejecutiva deben ser consideradas como ejes fundamentales en el proceso de evaluación neuropsicológica, así como también los aspectos lingüísticos que prometen ser biomarcadores potentes para el diagnóstico diferencial, tales como: la fluidez verbal tanto semántica como fonémica y las alteraciones semánticas-gramaticales. Asimismo, la evaluación cognitiva-lingüística en este grupo de pacientes debe considerar la sintomatología conductual, puesto que se evidencia sutiles diferencias que permiten distinguir EA-vCD de DFT-vC.
Investigaciones futuras deberían considerar la concepción de herramientas de evaluación neuropsicológicas atingentes basadas en cognición y lenguaje, analizando a este grupo de pacientes por medio de técnicas de neuroimagen no solo valorando el daño estructural sino también funcional, lo cual permitirá una visión más detallada del comportamiento cognitivo-lingüístico, así como también de las bases neurobiológicas de estos cuadros clínicos.
FinanciaciónEste trabajo se enmarca dentro del proyecto FONDECYT 1181472 (Gobierno de Chile), y en el proyecto 21172/IV/19 financiado por la Fundacion Seneca - Agencia de Ciencia y Tecnología de la Región de Murcia (Spain).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.