La enfermedad de Parkinson (EP) es una enfermedad neurodegenerativa cuyo tratamiento sintomático más eficaz es la L-dopa, sin embargo, puede inducir discinesias (DIL). La Mucuna pruriens (Mp) ha demostrado propiedades efectivas para el tratamiento de la EP reduciendo la DIL. Se comprobó la disminución de las discinesias en un modelo de Parkinson y discinesia en ratas Wistar tratadas con Mp. Se manipularon 28 machos, distribuidos en 4 grupos: Control, DIL, L-MP1 (Mp 75mg/kg) y L-MP2 (Mp 150mg/kg). La EP se indujo con 6-hidroxidopamina y la discinesia se provocó mediante inyección de L-Dopa y benserazida.
Se analizaron 4 tipos de movimientos involuntarios anormales (MIA); axial, miembro anterior, orolingual y locomotor, que disminuyeron significativamente en los grupos tratados con Mp: discinesia axial L-Mp1 x=0,05 y DIL x=1,60; miembro anterior L-Mp1 x=1,28 y DIL x=2,06; orolingual L-Mp1 x=0,18 y DIL x=1,34; locomotor L-Mp1 x=0,17 y DIL x=1,17. Se puede concluir que la Mp disminuye la frecuencia de las discinesias dependiendo de la topografía y dosis administrada.
Parkinson's disease (PD) is a neurodegenerative disease for which the most effective symptomatic treatment is levodopa; however, the drug can induce dyskinesia (levodopa-induce dyskinesia; LID). Mucuna pruriens (Mp) has shown to be effective for the treatment of PD by reducing the rate of LID. We tested this reduction in dyskinesia in a model of PD and dyskinesia in Wistar rats treated with Mp. We manipulated 28 male animals, distributed in 4 groups: control, LID, L-MP1 (Mp at 75mg/kg), and L-MP2 (Mp at 150mg/kg). PD was induced with 6-hydroxydopamine, and dyskinesia was induced with injection of levodopa and benserazide. We analysed 4 types of abnormal involuntary movements: axial, forelimb, orolingual, and locomotor. All 4 types of movements decreased significantly in the groups treated with Mp: axial dyskinesia (L-Mp1, x=0.05, vs LID, x=1.60); forelimb (L-Mp1, x=1.28, vs LID, x=2.06); orolingual (L-Mp1, x=0.18, vs LID, x=1.34); locomotor (L-Mp1, x=0.17, vs LID, x=1.17). We may conclude that Mp reduces the frequency of dyskinesia depending on the topography dose administered.
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más común en el mundo después de la enfermedad de Alzheimer; normalmente la EP es más usual en hombres que en mujeres y el riesgo aumenta con la edad1,2. Esta patología se caracteriza por la pérdida progresiva y selectiva de las neuronas dopaminérgicas de la sustancia nigra (SN)3,4.
Actualmente el tratamiento más utilizado y eficaz en la EP es la administración del precursor de dopamina L-Dopa5,6. En las primeras etapas, este tratamiento alivia la mayoría de los déficits motores que caracterizan la EP, pero está asociado con efectos secundarios como son las complicaciones motoras (fluctuaciones motoras y discinesias)6,7. La discinesia inducida por L-Dopa (DIL) se produce durante el tratamiento en pacientes con EP y se determina por la frecuencia de movimientos involuntarios anormales (MIA) tales como corea (movimientos hipercinéticos, sin propósito) o distonía (contracciones sostenidas, anormales musculares)8.
En vista de los efectos adversos (discinesia) ocasionados por el L-Dopa, se han realizado investigaciones acerca de nuevos tratamientos basados en la etnomedicina, en donde el polvo de semilla de Mucuna pruriens (Mp) se ha utilizado como un agente anti-inflamatorio9 y como un tratamiento para diferentes enfermedades mediadas por radicales libres como el envejecimiento, artritis reumatoide, diabetes y enfermedades neurodegenerativas10, en cuyo caso el uso de Mp no genera discinesia11, por lo que se quiere comprobar con el presente estudio, si la Mucuna pruriens no genera discinesias durante el tratamiento para la EP y posiblemente surja como una alternativa viable para mejorar la calidad de vida de los pacientes con EP.
Materiales y métodosAnimales de experimentaciónSe utilizaron 28 ratas Wistar (Rattus norvergicus) macho de 250 a 350g de peso corporal, las cuales fueron mantenidas en condiciones estandarizadas en el Bioterio de experimentación animal de la Universidad del Tolima. Los experimentos fueron aprobados por el Comité de Ética de la Universidad del Tolima y cumplieron con las normas dictadas por el National Institute of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80-23).
Diseño experimentalLos animales fueron distribuidos homogéneamente en 4 grupos: Control intacto, DIL (lesionados unilateralmente con 6-OHDA y posterior tratamiento de L-Dopa/benserazida) (Sigma-Aldrich® Lote #BCBL4153V), L-MP1 (lesionados unilateralmente con 6-OHDA y posterior tratamiento con Mp 75mg/kg) y L-MP2 (lesionados unilateralmente con 6-OHDA y posterior tratamiento con Mp 150mg/kg) (BONUSAN España). A los 3 meses de edad los animales fueron anestesiados con una dosis conjunta de ketamina y xilacina (Ketamina 50μg/kg/ Xilacina 20μg/kg de peso corporal) y posteriormente fueron sometidas a una inyección con 6-OHDA en la sustancia nigra pars compacta (SNpc) (3μl de una solución de 6-OHDA- HCl-8ug/3μl de solución salina (Sigma, Chemical Co. EE. UU., H-4381)) con el fin de lograr una lesión de la vía nigroestriatal en las coordenadas estereotáxicas: AP=−4,4, ML=+1,2mm DV=−7,8mm12.
Un mes después de realizada la lesión, los animales realizaron un ensayo de rotación inducido por apomorfina (0,5mg/kg) (Sigma-Aldrich®). De los 21 animales que presentaron más de 7 vueltas contralaterales a la lesión por minuto, 7 animales se trataron con L-Dopa (6mg/kg) y benserazida (12mg/kg). Por vía intraperitoneal i.p. (Sigma–Aldrich®. Lote #BCBL4153V) diariamente durante 19 días para poder inducir la discinesia y llegar a un nivel estable de MIA13 y 14 animales con el fitofármaco Mucuna pruriens (BONUSAN España) a 2 dosis diferentes, una a 75mg/kg y la otra a 150mg/kg, con una administración i.p. diaria de 19 días, con el fin de observar si los animales tratados con las diferentes dosis mostraban algún o ningún nivel de MIA para cada grupo experimental. Todos los procedimientos de tipo comportamental fueron llevados a cabo en horas de la mañana (8:00-11:00).
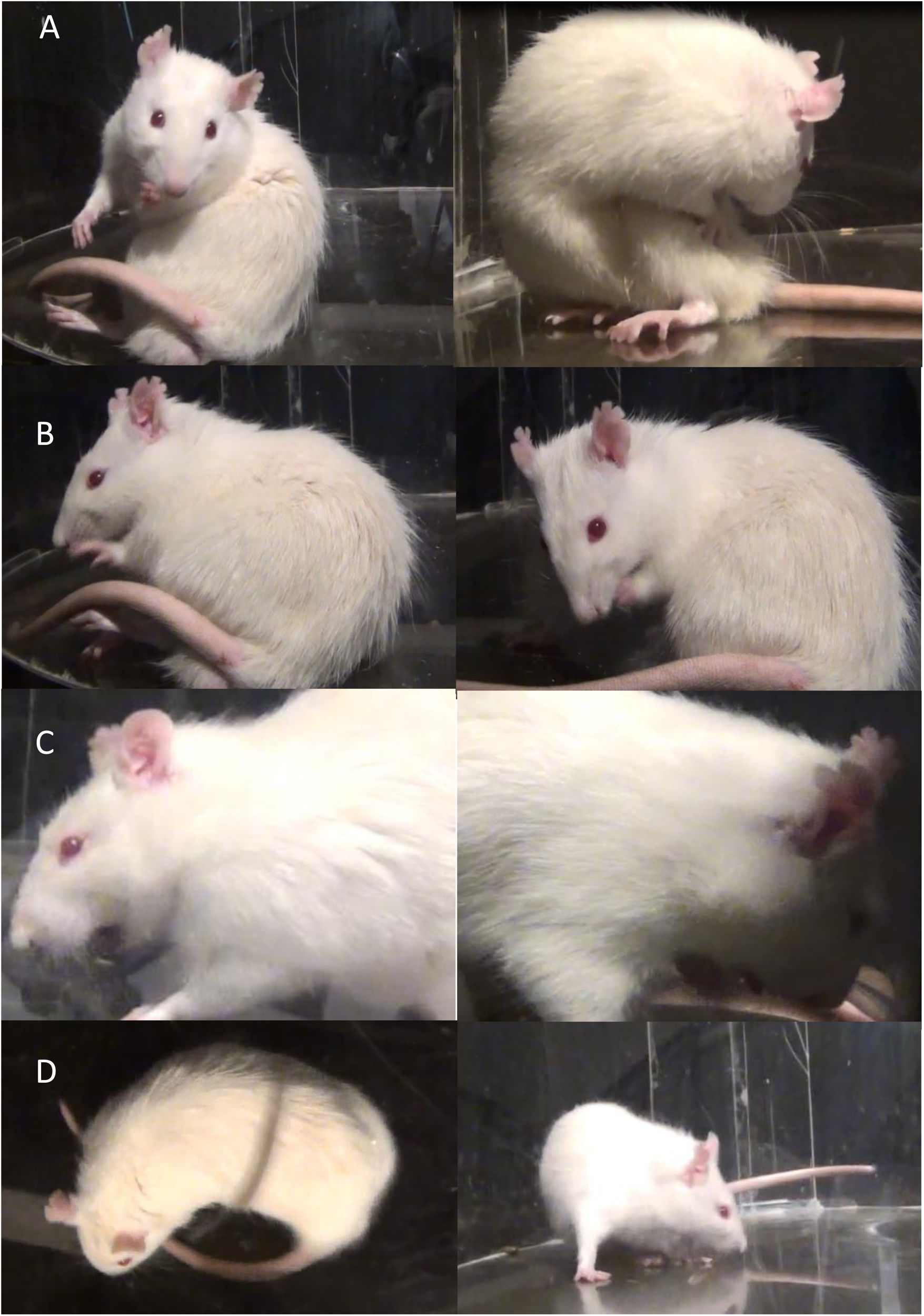
Análisis comportamentalSe realizó una batería de pruebas de comportamiento de los MIA, que consiste en la observación y grabación de animales (1hora con intervalos de descanso de 5min)14 en una caja transparente de acrílico circular de 50cm de diámetro y 30cm de altura. Los MIA fueron evaluados mediante la escala de discinesia en ratas descrita por Cenci et al.15–17 teniendo en cuenta 4 categorías: 1. Axial, incluye torsión distónica o coreiforme del tronco y el cuello hacia el lado contralateral a la lesión; 2. Miembro anterior, caracterizado por movimientos repetitivos y rítmicos o postura distónica de la extremidad anterior en el lado contralateral a la lesión; 3. Orolingual, incluye espasmos de los músculos orofaciales con movimientos masticatorios sin sentido y protrusión de la lengua hacia el lado contralateral a la lesión y 4. Locomotor, caracterizado por el aumento de locomoción con sesgo hacia el lado contralateral a la lesión14,15,18,19.
La gravedad de cada categoría de MIA se evaluó mediante las puntuaciones de 0 a 4 (1: ocasional, es decir, presente menos deL 50% del tiempo; 2: frecuente, es decir, presente más del 50% del tiempo; 3: continua, pero interrumpido por un fuerte estímulo sensorial; 4: continuo, no interrumpido por fuertes estímulos sensoriales)18,20.
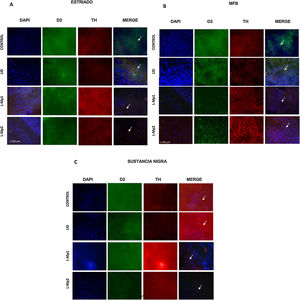
InmunofluorescenciaLos animales empleados en el estudio fueron sacrificados después de terminar los tratamientos y evaluaciones comportamentales, con una sobredosis de pentobarbital (50mg/kg, i.p), inmediatamente fueron perfundidos por el método de gravedad utilizando solución salina al 0,9% y paraformaldehído al 4% (PFA 4% Sigma–Aldrich). Los cerebros extraídos se sometieron a un proceso de deshidratación con sacarosa (Sucrosa Sigma–Aldrich), para ser cortados posteriormente en secciones coronales de 50μm de grosor en un Micrótomo KEDGE 33-58, y luego para llevar a cabo la inmunofluorescencia, se escogieron los cortes correspondientes a los bregmas: −0,96, −1,8, −3,72 y −4,6812, se eligieron 4 cortes por placa, correspondientes a cada animal y a cada bregma, con 2 réplicas por animal. Analizando las siguientes áreas: estriado, haz medial del cerebro anterior (CAM) y SNpc, para observar diferencias de inmunorreactividad en los diferentes grupos.
La inmunofluorescencia se realizó en placa, colocando 4 cortes por placa, correspondientes a cada animal y a cada bregma, utilizando triple marcaje con anticuerpos primarios para tirosina hidroxilasa (1:500; Sigma-Aldrich, EE. UU), receptor dopaminérgico D2 (1:800; Abcam, 2015) y DAPI (1:2000; Invitrogen, 2014). Como anticuerpos secundarios se usaron: Alexa flúor 488 anti rabbit polyclonal (1:500; Invitrogen, 2015) y Alexa flúor 594 anti mouse (1:500; Invitrogen, 2015).
Los cortes se fijaron con Fluoromount® (Sigma–Aldrich) para posteriormente capturar imágenes de las células inmunorreactivas con EVOS Floid® Cell Imaging Station #4471136 del Laboratorio de Biotecnología Animal de la Universidad del Tolima. La cuantificación del número de células positivas se hizo mediante el programa Image J Fiji (Versión 2017).
Análisis estadísticoLos resultados se analizaron utilizando el software INFOSTAT versión 2016. Se realizó estadística descriptiva y la prueba de normalidad de Shapiro-Wilk para establecer el método estadístico que correspondiera a la distribución de los datos. Cuando los datos no tuvieron una distribución normal se realizó la comparación de Kruskal-Wallis. Para datos con distribución normal se hizo un análisis de varianza ANOVA. El análisis de los MIA se evaluó mediante pruebas paramétricas y no paramétricas, respectivamente (ANOVA y Kruskal-Wallis), con la prueba post-hoc de Tukey para identificar las diferencias significativas específicas entre los grupos. La correlación entre los MIA según su distribución topográfica y el receptor D2 fue ejecutada mediante correlación lineal y coeficiente de correlación de Pearson. Se trabajó con un nivel de significación de 0,05.
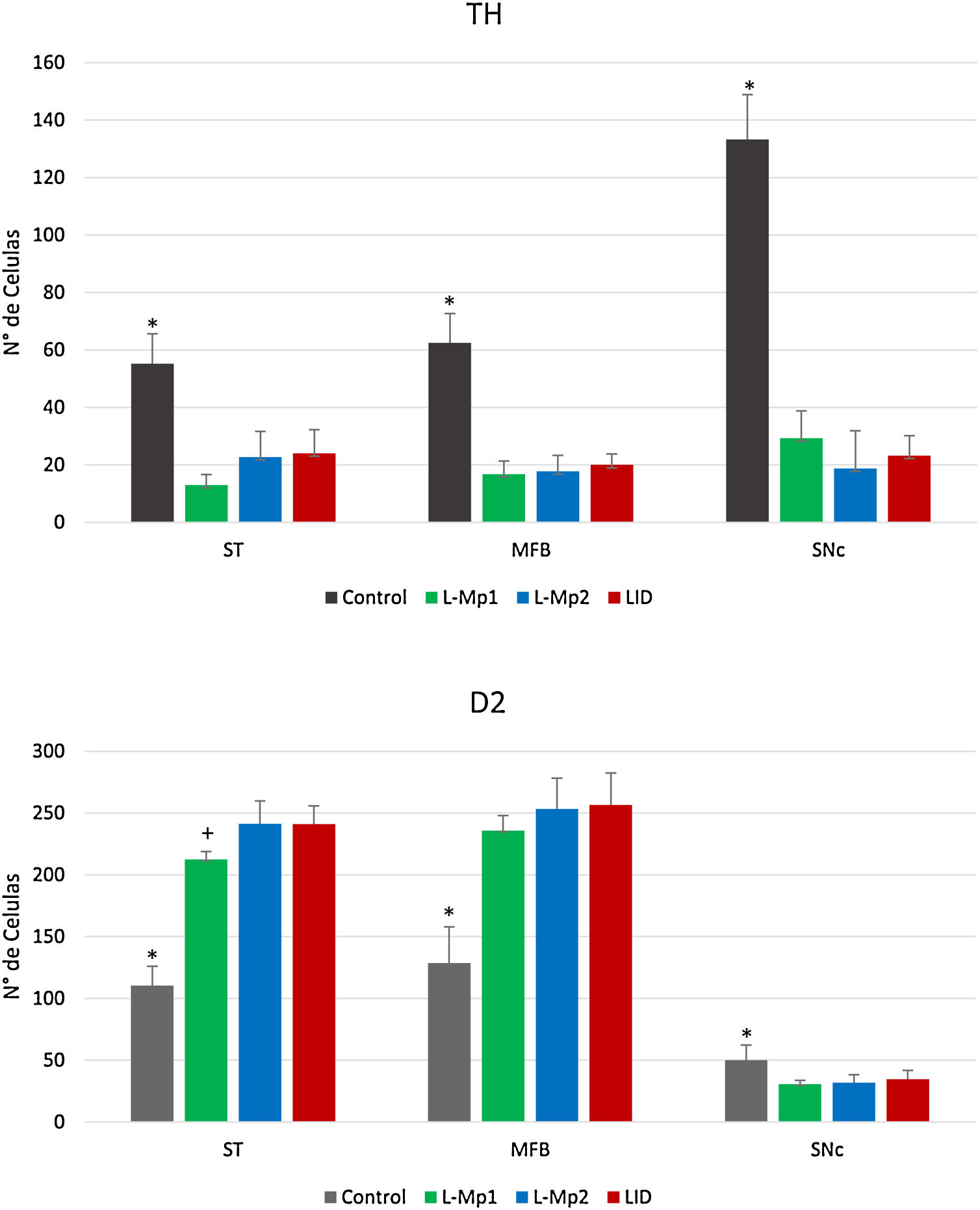
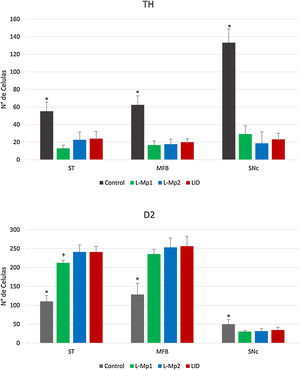
ResultadosValidación del modelo 6-OHDALos animales lesionados cumplieron con el número mínimo de vueltas (7 vueltas/min) contralaterales a la lesión reportada para el establecimiento de los modelos de 6-OHDA, mostrando un máximo de rotaciones equiparable. Asimismo, la lesión unilateral en el hemisferio derecho por inyección intracerebral de la neurotoxina 6-OHDA produjo una pérdida drástica de cuerpos celulares inmunorreactivos a la enzima TH alrededor del sitio de inyección SNpc, en donde se observó que el grupo control presentó diferencias significativas en el número de células TH+ en las tres zonas de estudio (estriado, CAM y SNpc) especialmente en la SNpc x=133,25 (p<0,05, F=86,95) con una diferencia relevante con los demás grupos: DIL x=23,25, L-Mp1 x=29,25 y L-Mp2=18,75 (fig. 5).
Tratamiento crónico con L-Dopa y el fitofármaco Mucuna pruriens, evaluado por la prueba conductual de MIAEl tratamiento crónico con L-Dopa y Mp indujo de manera gradual el desarrollo de movimientos involuntarios anormales en los grupos DIL, L-Mp1 y L-Mp2. Observamos y cuantificamos 4 tipos diferentes de MIA: axial, miembro anterior, orofacial y locomotor (fig. 1). Estos movimientos se manifestaron con un patrón repetitivo que tuvo diferencia de un animal a otro. No todos los animales que recibieron el tratamiento desarrollaron discinesia con la misma frecuencia ni al mismo tiempo después de iniciado el tratamiento. Sin embargo, todos los animales que desarrollaron discinesias presentaron los 4 tipos de movimientos involuntarios anormales analizados, aunque con gran variabilidad en la frecuencia.
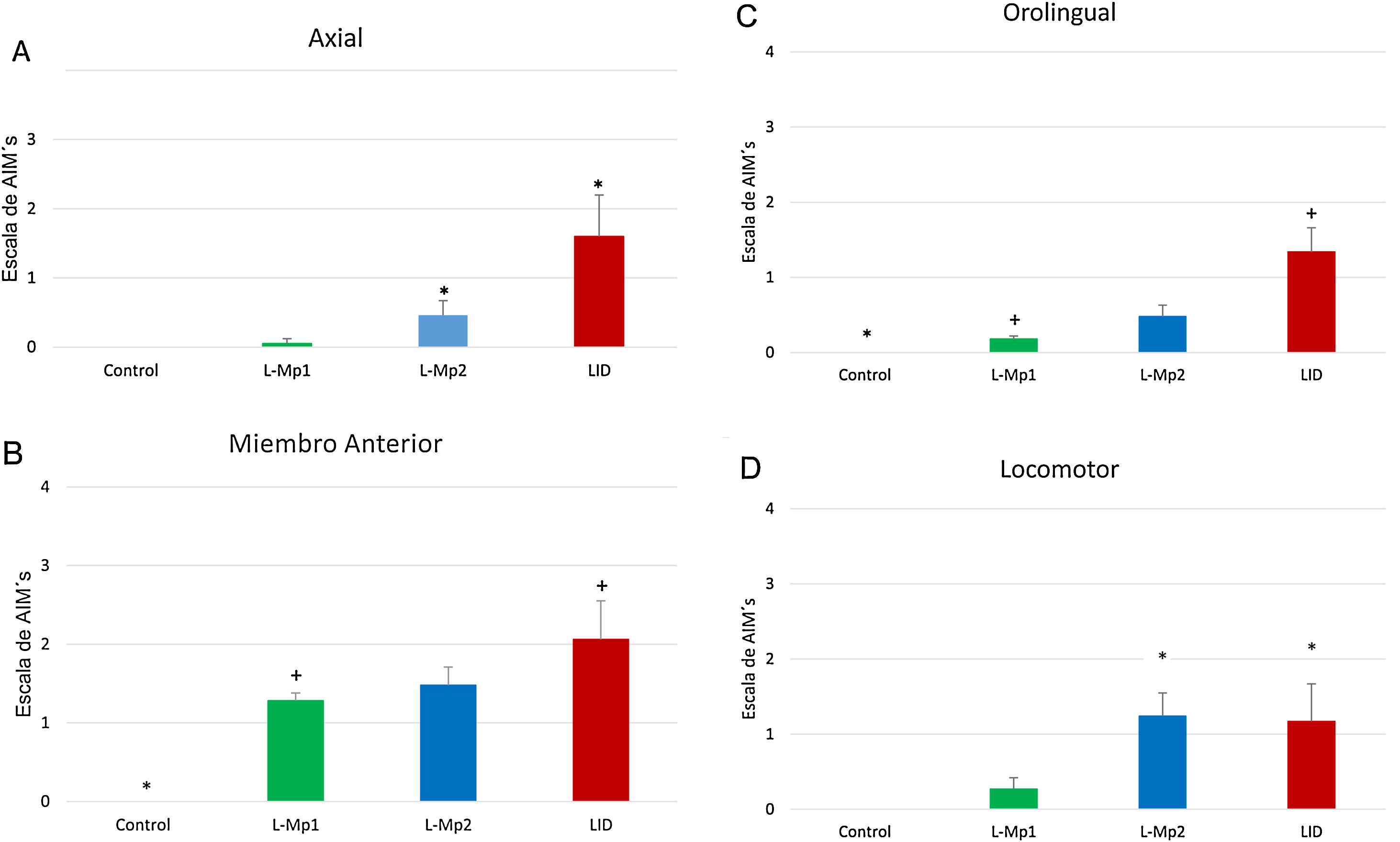
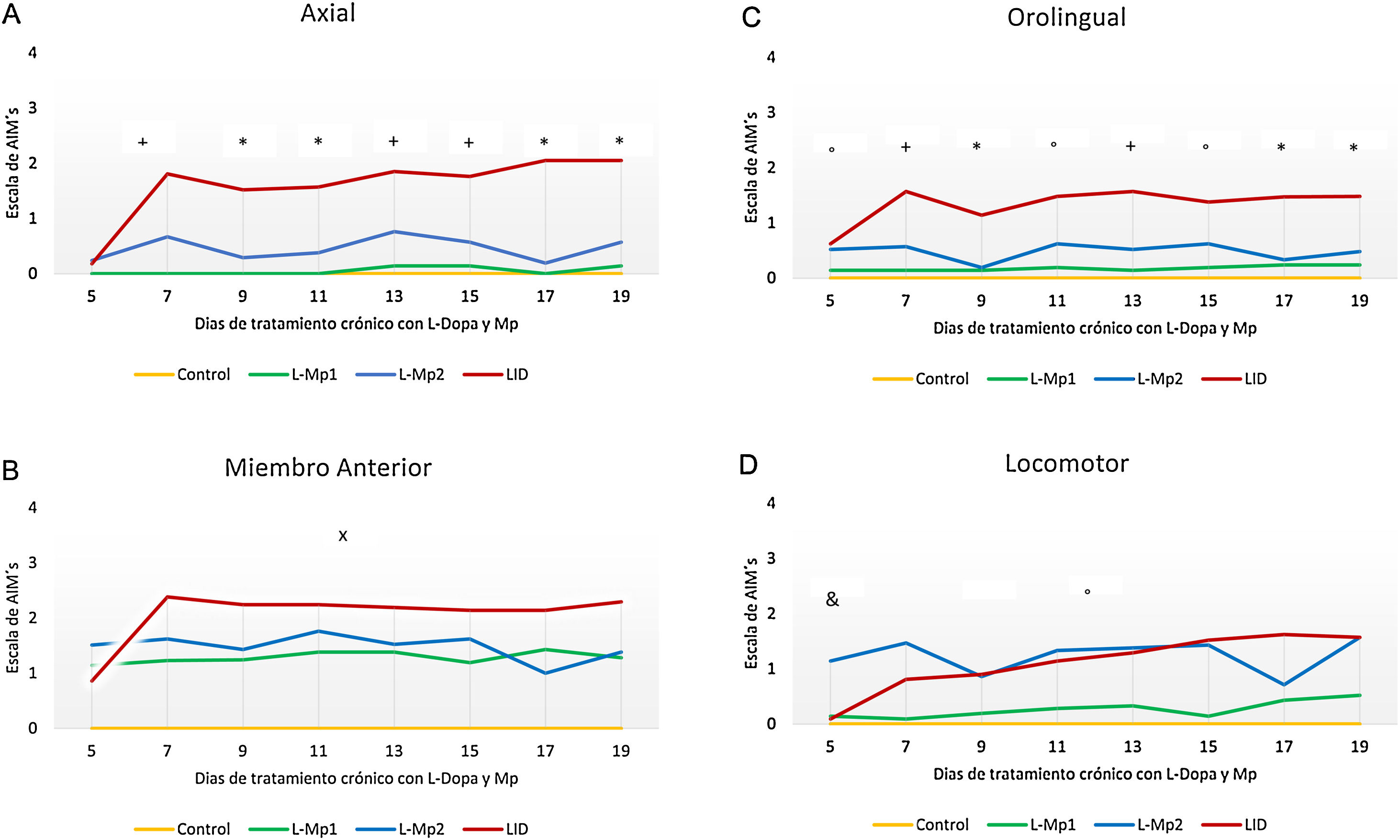
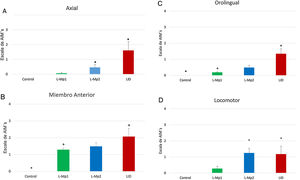
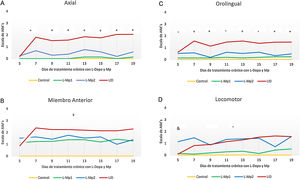
Los 4 grupos de tratamientos mostraron diferencias relevantes para cada tipo de MIA, en donde la discinesia axial fue la más frecuente, resaltando primordialmente las diferencias significativas que arrojó la prueba de Kruskal-Wallis y ANOVA junto con la prueba post-hoc de Tukey, p<0,0001, entre los grupos L-Mp1 y DIL para cada tipo de MIA con los siguientes valores: discinesia axial L-Mp1 x=0,05 y DIL x=1,60; miembro anterior L-Mp1 x=1,28 y DIL x=2,06; orolingual L-Mp1 x=0,18 y DIL x=1,34; locomotor L-Mp1 x=0,17 y DIL x=1,17 (fig. 2). Con respecto al tiempo, todos los MIA fueron evidentes a partir del día 5 y se estabilizaron en el día 11 en el grupo DIL, el cual tuvo diferencias significativas durante cada día de tratamiento evaluado y en cada tipo de MIA a excepción del miembro anterior con el grupo L-Mp1 (fig. 3). Cabe resaltar la frecuencia elevada del MIA locomotor (x=1,24) en el grupo L-Mp2 a partir del día 11 (fig. 3).
Evaluación de la frecuencia de los MIA en los cuatro grupos de estudio. A. Discinesia axial (Kruskal Wallis p < 0,0001). B. Discinesia de miembro anterior (Kruskal Wallis p < 0,0001). C. Discinesia orolingual (Prueba de Kruskal Wallis p < 0,0001). D. Discinesia locomotora (ANOVA p < 0,0001). *Diferencia significativa con los grupos Control y L-Mp1. Las columnas y símbolos representan la media ± SD (n=7).
Evolución en el tiempo de la presencia de MIA inducidos por tratamiento crónico con L-Dopa y Mp en ratas parkinsonizadas. A. Discinesia axial (Kruska Wallis P<0,05). B. Discinesia de miembro anterior (Kruska Wallis P<0,05). C. Discinesia orolingual (Kruska Wallis P<0,05). D. Discinesia locomotora (ANOVA P<0,05). *Diferencia significativa entre el grupo LID vs L-Mp1, L-Mp2 y Control. +Diferencia significativa del grupo DIL con el Control y L-Mp1. xDiferencia significativa entre el grupo Control y L-Mp1, L-Mp2, LID. ̊Diferencia significativa del grupo Control con L-Mp2 y Mp1 con LID. &Diferencia significativa entre el grupo Control y L-Mp2. Los puntos y símbolos representan la media ± SD (n=7).
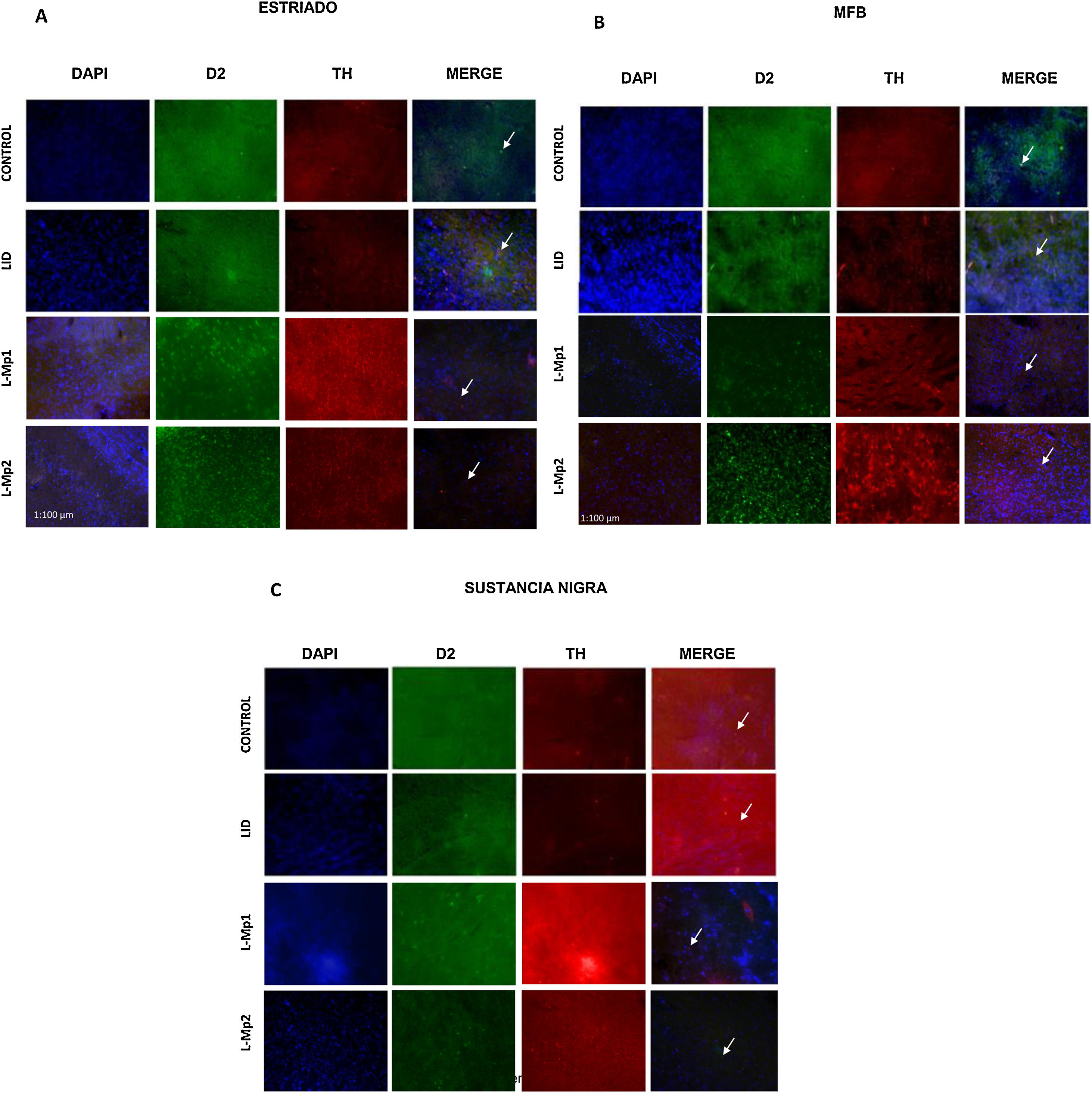
Determinación y distribución de la enzima tirosina hidroxilasa (TH). Los cortes de las 3 zonas de estudio (estriado, CAM y SNpc) en los animales de experimentación mostraron un número menor de células TH+(figs. 4 y 5); en comparación, el grupo control fue el que mostró el mayor número de células TH+ en cada área (estriado x=55,25, CAM x=62,5 y SNpc x=133,25). El ANOVA reveló que solo existen diferencias significativas de las 3 zonas del grupo control, con respecto a los demás grupos de experimentación (p<0,05, estriado F=19,99, CAM F=46,19, SNpc F=86,95).
Inmunofluorescencia de cada grupo con triple marcaje: DAPI, tirosina hidroxilasa (TH) y el marcador RD2 para cada una de las zonas de estudio. A. Estriado (ST) B. Haz medial del cerebro anterior (CAM). C. Sustancia nigra pars compacta (SNpc). *Las flechas indican las células con triple marcaje (neuronas dopaminérgicas con la expresión del receptor D2).
Comparación del número de células marcadas con tirosina hidroxilasa (TH) y receptores D2, en los grupos Control, L-Mp1, L-Mp2 y LID en el Estriado, haz medial del cerebro anterior y sustancia nigra pars compacta. (ANOVA p < 0,05). *Diferencia significativa presente con el grupo control. +Diferencia significativa con el grupo L-Mp1). Las columnas y símbolos representan la media ± SD.
Determinación y distribución del receptor D2. La zona con la expresión más baja de RD2 fue la SNpc; con respecto a los grupos, el control expresó la mayor cantidad de RD2 x=50 con diferencias significativas con L-Mp1 x=30,75, L-Mp2 x=31,75 y DIL x=34,5 (p<0,05 F=4,74), a diferencia del estriado y la CAM con la mayor expresión del RD2 en los grupos L-Mp1 x=212,5 L-Mp2 x=241,25 DIL x=241, L-Mp1 x=235,75 L-Mp2 x=253,25 DIL x=256,5 respectivamente, demostraron con la prueba de Tukey, diferencias significativas frente al grupo control x=110,25 y x=128,5 en el estriado y la CAM (p<0,05, F=86,86 y F=36,26 respectivamente) (figs. 4 y 5).
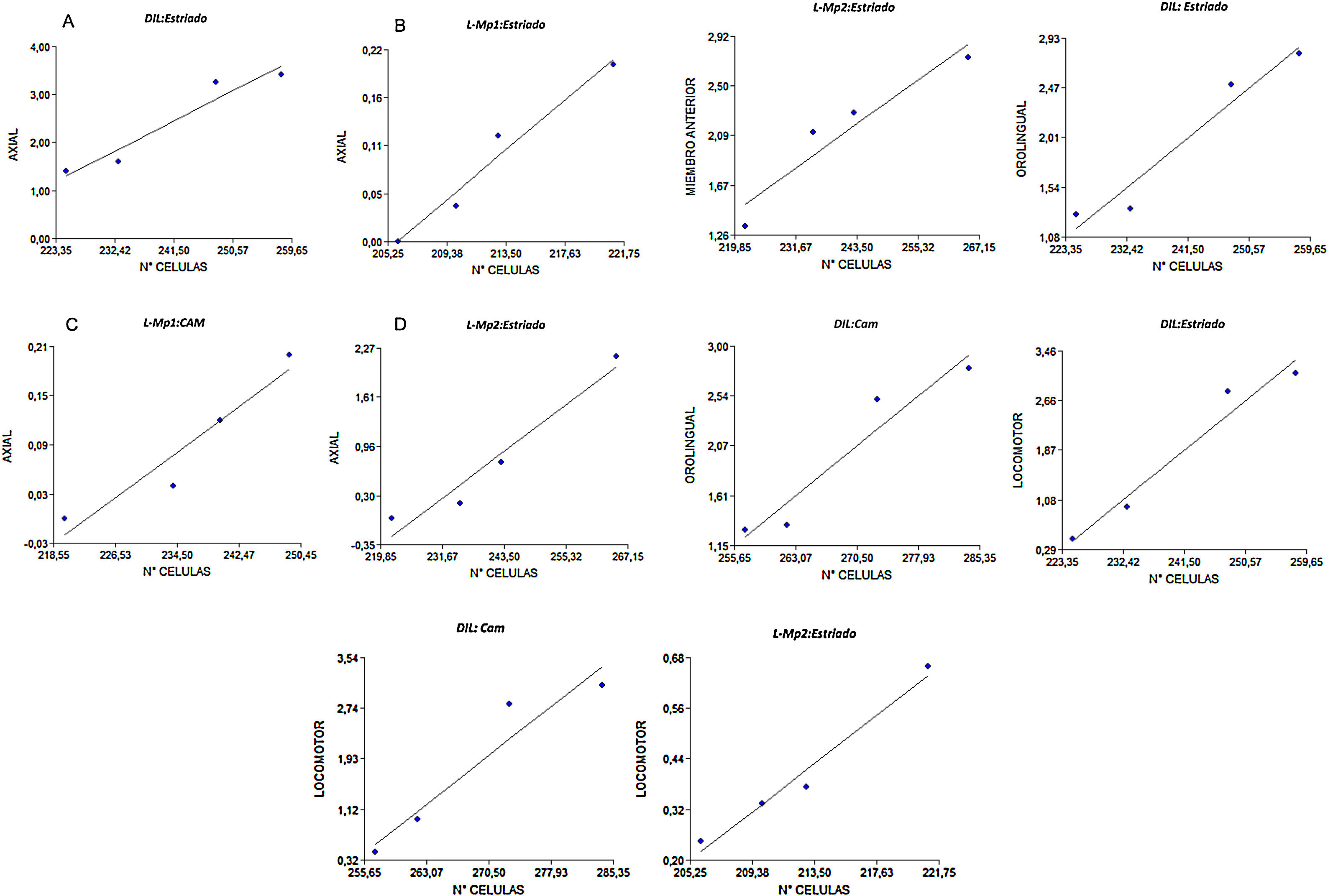
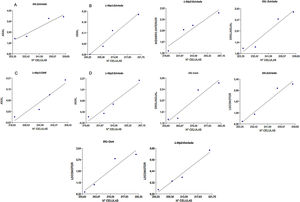
Correlación entre la expresión del receptor dopaminérgico D2 y manifestación de MIAEl MIA axial tuvo una correlación positiva en los grupos DIL (r2=0,97), L-Mp1(r2=0,98) y L-Mp2 (r2=0,97) con el estriado, y además el grupo L-Mp1 (r2=0,95) presentó correlación con la zona CAM; para el MIA de miembro anterior no se evidenció una correlación en el grupo DIL, pero sí se evidenció una correlación entre el grupo L-Mp1(r2=0,99) con la SNPc y del grupo L-Mp2 con el estriado (r2=0,95) y la SNpc (r2=0,99). En el caso del MIA orolingual solo se encontró correlación entre el grupo L-Mp2 (r2=0,96) con la SNPc y el grupo DIL con el estriado (r2=0,97) y la CAM (r2=0,96). Finalmente el MIA locomotor exhibió una correlación positiva para el grupo L-Mp2 con el estriado (r2=0,99) y el grupo DIL con la zona estriada (r2=0,98) y CAM (r2=0,96) (fig. 6).
DiscusiónLa EP se caracteriza por la destrucción progresiva y selectiva de las neuronas dopaminérgicas de la SNpc, lo que ocasiona fallas motoras3,4. La alternativa más eficaz en disminuir los déficits motores de la EP hasta el momento es el precursor dopaminérgico L-Dopa. Sin embargo, la L-Dopa ocasiona a largo plazo MIA conocidos como DIL8. Dependiendo del grado de degeneración de las neuronas dopaminérgicas21, la DIL puede aparecer en un 30% de los pacientes con EP a los 5 años de tratamiento y en el 59% tras 10 años con el fármaco22–24.
Por lo tanto, la DIL es un reto científico que surge a raíz del tratamiento para la EP, por esta razón en el presente estudio se realizó un tratamiento crónico con Mp y L-Dopa en uno de los modelos de rata parkinsonizada más usado, evaluado y estandarizado. El modelo de lesión con 6-OHDA en SNpc induce una lesión más grave y rápida25–29, reproduciendo muchas de las características fisiológicas desde el punto de vista experimental, por lo cual es muy valioso para la evaluación del efecto fisiológico de determinadas sustancias que puedan ser una alternativa para mejorar los síntomas parkinsonianos sin generar efectos secundarios. El modelo de párkinson con 6-OHDA induce cambios neuroquímicos y electrofisiológicos en el sistema nigroestriado que intentan compensar el déficit de DA inducido por la pérdida de neuronas dopaminérgicas. De hecho, se ha descrito un aumento en la cantidad de DA liberada en el estriado por las terminales dopaminérgicas existentes y un incremento en el número de receptores dopaminérgicos estriatales postsinápticos30. Este incremento aparece únicamente cuando la pérdida de neuronas dopaminérgicas es superior al 90% y tiene lugar 4 semanas tras la denervación dopaminérgica31,32. En general, la mayoría de los trabajos publicados demuestran que el fenómeno de hipersensibilidad por denervación, o «up-regulation», afecta preferentemente a los receptores dopaminérgicos estriatales D230,33, como se observa en los resultados obtenidos en este estudio (figs. 4 y 5), lo cual indica que los animales que fueron lesionados con 6-OHDA mostraron un deterioro motor severo que se comprobó mediante la prueba de rotación con apomorfina, presentando un número mayor a 7 vueltas/min, esta rotación se relaciona con el incremento del número de receptores dopaminérgicos que existe en el estriado homolateral a la lesión como consecuencia de la denervación34. Además, las zonas (SNpc, CAM y ST) analizadas evidencian una muerte del 80 al 90% en los cuerpos neuronales, de todos los grupos evaluados a excepción del grupo control. No se encontraron diferencias significativas entre los grupos DIL, Mp1 y Mp2 en relación con la restauración de las fibras neuronales.
Nuestros resultados evidencian que el tratamiento crónico con L-Dopa y Mp induce la aparición de una serie de MIA que afectaron cabeza, tronco y extremidades35. En esta investigación los MIA aparecieron en el momento de máxima efectividad del tratamiento (pico de dosis); en comparación los animales tratados con Mp también mostraron MIA pero con una frecuencia más baja, lo cual cambió según las dosis de Mp utilizadas en este estudio y la distribución topográfica de MIA36.
Es evidente en nuestros resultados que el tratamiento crónico con Mp induce discinesia más leve que L-Dopa11,36–38, pero no sabemos cuál es el efecto sobre la movilidad del animal, o si las dosis de L-Dopa más bajas tendrían un efecto similar. Las dosis son críticas para el desarrollo de discinesias. Deberíamos tener una equivalencia de dosis entre Mp y L-Dopa y correlacionarlos con el peso del animal. Sin embargo, otras hipótesis como la planteada por Lieu et al., 2010, proponen que la adición de benserazida a la Mp induce DIL severa. La explicación más probable para estos hallazgos es que el efecto inhibidor de benserazida en la enzima dopa-descarboxilasa (DDC) periférica permite el aumento del transporte brusco y rápido de L-Dopa natural contenida en el extracto de Mucuna pruriens (EMP) a través de la barrera hematoencefálica, sin ser inactivado en la sangre periférica. Este aumento de la disponibilidad de L-Dopa para el cerebro es la causa más probable de la gravedad de DIL en animales tratados con Mp+ benserazida. Una explicación alternativa es que la forma natural de L-Dopa contenida en Mp en combinación con uno o más agentes naturales protege la rápida descarboxilación por DDC y permite el transporte gradual a través de la barrera hematoencefálica. Una tercera posibilidad es que la Mp puede tener agentes antidiscinéticos naturales para evitar o mitigar DIL y que la adición de benserazida a la Mp niega estos compuestos anti-DIL beneficiosos. Sin embargo, otros estudios sugieren que el tratamiento crónico con Mp no tiene ningún efecto significativo sobre el contenido de L-Dopa o dopamina y sus metabolitos en el cuerpo estriado o SN39.
Adicionalmente se ha sugerido que el mecanismo de acción de Mp no se puede atribuir solo a la L-Dopa natural que contiene y que Mp tiene un mecanismo de acción único en la electrofisiología de los ganglios basales que es diferente de la L-Dopa cuando se prueba a dosis equivalentes40. En la actualidad se conoce que la Mp tiene más de 50 componentes identificados hasta la fecha39; no obstante, es muy complejo, largo y costoso identificar el componente individual, cantidad exacta o combinación de componentes de Mp responsable por la reducción de las discinesias40.
En el presente estudio, se confirma que la Mucuna pruriens en dosis específicas presenta una discinesia significativamente más baja en frecuencia; este efecto posiblemente se debe no solo al 5% de L-Dopa natural contenido en Mp sino a la sinergia de todos lo metabolitos presentes en Mp; también podemos reafirmar que el efecto reductor de las discinesias por parte de la Mp se puede dar fácilmente sin el uso de inhibidores de la Dopa descarboxilasa11,36–38,41,42.
Ahora bien, y a pesar de que los MIA son la consecuencia más evidente del tratamiento tanto con la L-Dopa como con la Mp, no es claro el mecanismo fisiológico que permita explicarlos; sin embargo, se cree que está relacionado con la estimulación no fisiológica de receptores dopaminérgicos crónicamente denervados, donde los receptores D1 (RD1) han sido más asociados; no obstante, se ha demostrado que los receptores D2 (RD2) cumplen un papel fundamental en el fenómeno discinético43.
Con base en lo planteado anteriormente y lo observado en los resultados obtenidos, podemos inferir que a pesar de que la Mp contiene L-Dopa de origen natural genera un efecto similar al causado por la L-Dopa de origen sintético en los RD2, ya que se observa una baja expresión en la SNpc y una elevada expresión del RD2 en el estriado y CAM. Lo cual se debe posiblemente a los bajos niveles de dopamina circundantes causados por la lesión, por ende, los receptores están hipersensibilizados para poder captar la poca dopamina disponible. Esta investigación soporta la idea de que agonistas de RD2 induzcan MIA en ratas, y el hecho de que los antagonistas disminuyan los MIA tiene que ver posiblemente con prevención de la estimulación de DA en un estriado denervado con receptores supersensibilizados a cualquier estimulación de DA44. Posiblemente esta sea la razón por la cual la Mp también está generando discinesia, pero en menor medida que la causada por L-Dopa (fig. 5).
Cabe mencionar que la densidad del RD2 aumenta en animales lesionados y discinéticos45 como se evidenció en este estudio. El RD2 está relacionado con movimientos estereotipados como la masticación en vacío y MIA orolinguales como mencionan Taylor et al.46 Recientemente, Caro et al.43 encontraron una relación del receptor D2 con movimientos de tipo locomotor, durante el uso de L-Dopa. En tanto que, en el presente estudio, el grupo L-mp2 evidenció correlación con el MIA locomotor, al igual que el grupo DIL, y no existe diferencia en la frecuencia del MIA locomotor para estos 2 grupos. Por tal razón se podría sugerir que RD2 podría estar involucrado en el desarrollo topográfico de las discinesias.
ConclusionesEs posible confirmar que la Mucuna pruriens sí disminuye la frecuencia de los MIA dependiendo de la dosis, ya que estas son críticas para el desarrollo de las discinesias; por tal motivo es importante realizar una curva dosis respuesta para poder confirmar si es este el factor principal que determina la presencia de los MIA en menor frecuencia que la generada por el tratamiento crónico con L-Dopa; pero aun así sigue siendo desconocido su mecanismo de acción, que posiblemente se debe no solo al 5% de L-Dopa natural contenido en Mp sino a la sinergia de todos lo metabolitos presentes en Mp. También podemos reafirmar que el efecto de Mp se puede dar fácilmente sin el uso de inhibidores de la Dopa descarboxilasa.
Se encontró una correlación positiva entre los MIA y el RD2 en algunas zonas de estudio, por lo tanto, se puede afirmar que la aparición, frecuencia y distribución somatotópica de MIA inducidos por el tratamiento con L-Dopa y Mp también está determinada por la estimulación del RD2. De igual forma se requiere conocer el papel específico de cada uno de los receptores en la generación de discinesias inducidas por L-Dopa y Mp.
FinanciaciónEl presente trabajo fue financiado por la Oficina de Investigaciones y Desarrollo de la Universidad del Tolima, Proyecto de código 250113.
Conflicto de interesesLos autores señalan que no tienen conflicto de intereses.
A la Universidad del Tolima y su Oficina de Investigaciones y Desarrollo científico y al Grupo de Modelos Experimentales para las Ciencias Zoohumanas por permitir el desarrollo del presente proyecto de investigación.