La gestión de los residuos generados por la oficina de farmacia es un tema de actualidad en los últimos tiempos. El presente artículo aborda las repercusiones medioambientales derivadas de la elaboración de fórmulas magistrales y preparados oficinales, así como las implicaciones legales derivadas de éstas.
La elaboración de fórmulas magistrales y preparados oficinales es posiblemente la actividad profesional más antigua y específica de las que el farmacéutico, hoy por hoy, realiza tanto en servicios de farmacia hospitalaria como en oficinas de farmacia comunitarias. Las fórmulas magistrales (FM) y los preparados oficinales (PO) son medicamentos legalmente reconocidos, cuya elaboración es un servicio básico que el farmacéutico de oficina de farmacia debe prestar a la población aplicando (a partir del 17 de marzo de 2003) las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales (NCE).
Centrándonos en esta última normativa, la preparación de FM y PO consta de varias operaciones que deben estar correctamente documentadas y realizadas según procedimientos normalizados de trabajo. Estas operaciones pueden resumirse en:
Recepción de materias primas y material de acondicionamiento (primario y secundario).
Almacenamiento.
Elaboración.
Acondicionamiento (envasado y etiquetado).
Control de calidad de producto terminado.
Dispensación.
Además, hay que tener en cuenta las normas relativas a la limpieza del local y del utillaje, la documentación y organización del trabajo y también formación, motivación, higiene, cualificación y responsabilidades del personal.
No obstante, es conveniente conocer la repercusión de la preparación de FM y PO sobre el medio ambiente, así como las implicaciones legales derivadas de éstas.
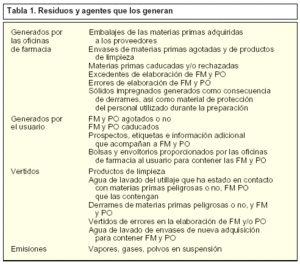
La problemática medioambiental de la preparación de estos medicamentos está relacionada con los siguientes aspectos (tabla 1):
Residuos. Dentro de este apartado hay que distinguir entre los generados por la oficina de farmacia y los generados por el usuario.
Vertidos. Dentro de este apartado nos referiremos únicamente a los generados por la oficina de farmacia.
Emisiones. Dentro de este apartado nos referiremos únicamente a los generados por la oficina de farmacia.
Entre los residuos generados por la oficina de farmacia se incluyen:
Embalajes de las materias primas adquiridas a los proveedores.
Envases de materias primas agotadas y de productos de limpieza.
Materias primas caducadas.
Excedentes de fabricación de FM y PO.
Errores de elaboración de FM y PO.
Sólidos impregnados consecuencia de derrames ocurridos durante la preparación, así como material fungible utilizado en la preparación (guantes, mascarillas).
Entre los residuos generados por el usuario, una vez dispensadas las FM y PO por la oficina de farmacia, se incluyen:
FM y PO agotados o no.
FM y PO caducados.
Prospectos, etiquetas e información adicional que acompañan a las FM y PO.
Bolsas y envoltorios proporcionados por las oficinas de farmacia al usuario para contener las FM y PO.
En cuanto a los vertidos generados por la oficina de farmacia, se hallan:
Agua de lavado de locales, utillaje y envases.
Vertido de materias primas, FM y PO por errores de elaboración.
Por último, en el apartado de emisiones generadas por la oficina de farmacia se encuentran la generación de vapores o polvos durante la preparación de FM y PO.
Residuos
Las materias primas (principios activos, excipientes, coadyuvantes) utilizadas en la elaboración de FM y PO, FM y PO ya elaborados y dispensados, los envases que las contengan o las hayan contenido son susceptibles de convertirse en residuos, ya que la Ley de Residuos 10/1998 los define como cualquier sustancia u objeto perteneciente a alguna de las categorías que figuran en el anejo de esta ley, del cual su poseedor se desprenda o del que tenga la intención u obligación de desprenderse. En cualquier caso, estas sustancias u objetos figurarán en el Catálogo Europeo de Residuos (CER) aprobado por las instituciones comunitarias.
En el referido anejo de la ley, no se encuentra referencia alguna a FM y PO; sin embargo, la categoría Q3 corresponde a los productos caducados, por tanto, FM y PO que estén caducados (al igual que cualquier otro producto caducado) tienen la categoría de residuo.
No obstante, dada la ausencia en este anejo de alusión expresa sobre FM y PO no caducados, o sobre los medicamentos en general, hay que acudir al CER para encontrar una referencia clara a los medicamentos.
La última revisión y actualización del CER recogida en nuestro ordenamiento jurídico a través de la Orden MAM/304/2002 de 8 de febrero, incluye los medicamentos, bajo dos tipos genéricos de residuos:
Residuos de servicios médicos o veterinarios o de investigación asociada
No se incluyen en este apartado los residuos de cocina y de restaurante no procedentes directamente de la prestación de cuidados sanitarios. Son los siguientes:
Residuos de maternidades, del diagnóstico, tratamiento o prevención de enfermedades humanas. 180106* (productos químicos que consisten en o contienen sustancias peligrosas), 180107 (productos químicos distintos de los especificados en el código 180106), 180108* (medicamentos citotóxicos y citostáticos) y 180109 (medicamentos distintos a los especificados en el código 180108).
Residuos de investigación, diagnóstico, tratamiento o prevención de enfermedades de animales. 180205* (productos químicos que consisten en o contienen sustancias peligrosas), 180206 (productos químicos distintos de los especificados en el código 180205), 180207* (medicamentos citotóxicos y citostáticos) y 180208 (medicamentos distintos de los especificados en el código 180207).
*Los residuos señalados con un asterisco se consideran residuos peligrosos según la directiva 91/689/CEE sobre esta materia. Sin embargo, según la Orden MAM/304/2002, cualquiera de ellos sólo se considerará peligroso si las concentraciones (porcentaje en peso) de las sustancias que le confieren la peligrosidad son suficientes para que el residuo presente una o más de las siguientes características: H3 (inflamable), H8 (corrosivo), H10 (tóxico para la reproducción) y H1 (mutagénico). Estas concentraciones están plasmadas en el apartado A del anexo 2 de la citada orden.
Residuos municipales
Son los residuos domésticos y asimilables procedentes de comercio, industrias e instituciones, incluidas las fracciones recogidas selectivamente. Entre estas fracciones figuran los códigos 200131* (medicamentos citotóxicos y citostáticos) y 200132 (medicamentos distintos de los especificados en el código 200131).
Una vez expuestas las distintas categorías de residuos en las que se recogen los medicamentos en general, y teniendo en cuenta las sustancias utilizadas en su elaboración, hemos de diferenciar, al igual que hace la Ley de Residuos, entre residuos peligrosos y residuos urbanos o municipales.
Residuos urbanos o municipales
Son los generados en los domicilios particulares, comercios, oficinas y servicios, así como todos aquellos que no tengan la calificación de peligrosos y que por su naturaleza o composición puedan asimilarse a los producidos en los anteriores lugares o actividades.
Residuos peligrosos
Son aquellos que figuren en la lista de residuos peligrosos, aprobada en el Real Decreto 952/1997, así como los recipientes y envases que los hayan contenido. Los que hayan sido calificados como peligrosos por la normativa comunitaria y los que pueda aprobar el gobierno de conformidad con lo establecido en la normativa europea o en convenios internacionales en los que España sea parte.
Según esta última definición, hemos de acudir al Real Decreto 952/97 por el que se modifica el reglamento para la ejecución de la ley Básica de Residuos Tóxicos y Peligrosos, que incorpora a nuestro ordenamiento legislativo la directiva 91/689/CE relativa a los residuos peligrosos, e incluye en su anejo 2, la decisión del Consejo 94/904/CE, que aprueba la lista comunitaria de residuos peligrosos. Esta última, ha sido recientemente sustituida y actualizada por la decisión de la Comisión 2000/532/CE.
La tabla 3 de este Real Decreto indica las categorías o tipos genéricos de residuos tóxicos y peligrosos presentados en forma líquida, sólida o de lodos, clasificados según su naturaleza o la actividad que los genera. Dado que los medicamentos están incluidos en la «parte a» de esta tabla, sólo tendrán la consideración de tóxicos y peligrosos cuando presenten alguna de las siguientes características: explosivo, comburente, fácilmente inflamable, inflamable, irritante, nocivo, tóxico, carcinógeno, corrosivo, infeccioso, tóxico para la reproducción, mutagénico, peligroso para el medio ambiente, sustancias o preparados que emiten gases tóxicos o muy tóxicos al entrar en contacto con el aire, agua o con un ácido, y sustancias o preparados que tras su eliminación pueden dar lugar a otra sustancia por un medio cualquiera.
Por otro lado, los envases de los medicamentos, al encontrarse incluidos en la «parte b» de la misma tabla, y al haber contenido alguna de las sustancias enumeradas en la tabla 4 (entre ellas, compuestos farmacéuticos o veterinarios), sólo tendrán la consideración de tóxicos y peligrosos cuando presenten alguna de las características ya mencionadas.
Es muy probable que muchos FM y PO comercializados (así como sus envases), debido a la gran variabilidad en su composición química, presenten alguna de las características ya citadas que les den la consideración de peligrosidad.
Sin embargo, según el CER, sólo los residuos de medicamentos citotóxicos y citostáticos y productos químicos que consisten en o contienen sustancias peligrosas se consideran residuos peligrosos. En consecuencia, los demás residuos de medicamentos quedarían englobados en la categoría de residuos no peligrosos, según el CER, y en la categoría de residuos urbanos o municipales, según la ley de residuos, a falta de una demostración de su peligrosidad.
En nuestra opinión, FM y PO, así como sus envases, en general no deberían calificarse a priori como no peligrosos sin haber determinado la presencia de alguna de las características ya mencionadas. Como es lógico, la presencia de estas características dependerá de la composición tanto cualitativa como cuantitativa de cada FM, PO o materia prima utilizada en su elaboración. De hecho, como ya se ha comentado anteriormente, según la Orden MAM/304/2002 cualquier residuo referido como peligroso sólo se considerará peligroso si las concentraciones (porcentaje en peso) de las sustancias que le confieren la peligrosidad son suficientes para que el residuo presente una o más de las características: H3 inflamable, H8 corrosivo, H10 tóxico para la reproducción y H1 mutagénico.
Asumiendo esta consideración, FM, PO, materias primas y sus envases podrían calificarse como residuos peligrosos o no peligrosos, según el caso. Otra evidencia que apoya la posible calificación de todos los residuos de FM y PO como residuos peligrosos es la exigencia en algunas comunidades autónomas de que la gestión de los mismos y sus envases sea llevada a cabo a través de gestores autorizados para la gestión de residuos peligrosos, entendiendo por gestión (según la Ley 10/1998) la recogida, el almacenamiento, el transporte, la valorización y la eliminación de los residuos (incluida la vigilancia de estas actividades, así como de los lugares de depósito o vertido después de su cierre).
Quizá el término medio entre ambas calificaciones de residuos está en la calificación que les otorga el Plan Nacional de Gestión de residuos Urbanos (PNRU) aprobado recientemente mediante Resolución de 13-1-2000, que incluye el Programa Nacional de Residuos de Envases y Envases usados (establecido por la Ley 10/1998) válido en toda España integra los programas elaborados por las comunidades autónomas. En su ámbito de aplicación, hay que destacar que por su naturaleza los medicamentos, así como los recipientes y envases que los hayan contenido, son considerados como residuos peligrosos de origen doméstico (categoría no contemplada por la Ley de Residuos) y quedan excluidos de los planes relativos a la eliminación de residuos urbanos (RU).
Además, indica que «para estos residuos peligrosos de origen doméstico, cuyas naturalezas física, química, toxicológica y jurídica justifiquen su separación del resto de RU, y su gestión a través de circuitos diferenciados, se articulará una normativa específica, cuando las disposiciones comunitarias, al amparo de lo establecido en el artículo 1.5 de la directiva 91/689/CEE, así lo prevean, que permitan aplicar a estos residuos los nuevos principios de filosofía ecológica recogidos en la ley 10/1998». También hace referencia expresa a los residuos de medicamentos (FM y PO) y sus envases indicando que «sin que ello afecte a la calificación jurídica que en cada caso proceda, el Plan impulsa la implantación de sistemas de gestión que garanticen la recogida selectiva y el tratamiento adecuado de forma separada del resto de los residuos urbanos de los siguientes residuos específicos domésticos, así como sus recipientes y materiales de envase: medicamentos y productos de uso terapéutico».
Además en su punto 7.2 dedicado al programa nacional de recuperación y reciclaje, incluye entre las actuaciones previstas la implantación de modelos de gestión que contemplen la recogida selectiva en origen de los distintos tipos de residuos, mediante el establecimiento de vías de acción tales como la entrega en los puntos de expedición para ciertos residuos, entre los cuales figuran los residuos de medicamentos (FM y PO).
Así pues, los residuos de medicamentos pueden ser calificados con distinto criterio, ya que según el CER sólo los residuos de medicamentos citotóxicos y citostáticos son residuos tóxicos y peligrosos, mientras que el PNRU califica a todos los residuos de medicamentos como residuos peligrosos de origen doméstico, y por otro lado, la Ley de Residuos dice que los residuos de medicamentos son residuos peligrosos cuando presenten alguna de las características de peligrosidad (extremo que hay que comprobar previamente).
Otra normativa a destacar por su repercusión en la elaboración de FM y PO es la Ley 11/1997 de Envases y Residuos de Envases. Esta ley, para conseguir los objetivos de reciclado y valorización previstos en la directiva 94/62/CE del Parlamento Europeo y del Consejo relativa a los envases y los residuos de envases, además de imponer a los fabricantes de envases la obligación de utilizar en sus procesos de fabricación material procedente de residuos de envases, en su capítulo cuarto, regula dos procedimientos diferentes. Por un lado el Sistema de Depósito, Devolución y Retorno (en adelante SDDR) y por otro, el Sistema Integrado de Gestión (en adelante SIG) de residuos de envases y envases usados.
El SDDR implicaría la reutilización de los envases de FM y PO, el cobro al usuario de una cantidad por envase no incluida en el precio de éste y que se devolvería al usuario al retornar el envase utilizado, así como que las oficinas de farmacia dispusieran de sus propios contenedores para recoger los residuos, seleccionarlos y, si procede, reintroducirlos en la red de distribución para su posterior reutilización. A la vista de sus implicaciones, este sistema ha sido descartado por el sector farmacéutico industrial, pues tanto en el caso de las especialidades farmacéuticas como de FM y PO su adopción implicaría:
Ser sanitariamente cuestionable.
Un elevado coste, ya que entre otros motivos supondría que el personal de las oficinas de farmacia dedicara parte de su tiempo a recoger el envase usado y devolver el depósito cobrado.
Una gran complejidad, ya que el flujo de mercancías desde el fabricante hasta el minorista se vería complementado con un flujo de residuos de envases en sentido contrario (logística inversa). Los vehículos y medios utilizados en el primer caso, salvo excepciones, no son válidos para el segundo.
El SIG parece una opción más viable, dadas las grandes similitudes existentes entre las especialidades farmacéuticas y FM y PO y el hecho de que actualmente el único SIG operativo del sector farmacéutico es el llamado SIGRE, que se encarga de la recogida de envases (vacíos o no) de las especialidades farmacéuticas (caducados o no) o de sus restos. En la actualidad, el SIGRE se encuentra ya presente en las oficinas de farmacia adheridas a este sistema de todas las comunidades autónomas españolas, excepto la Comunidad Foral de Navarra y las dos comunidades autónomas insulares (Baleares y Canarias). Su símbolo o isotipo consiste en una cruz rodeada por el símbolo del reciclado de color verde oscuro (fig. 1).
Fig. 1. Símbolo del punto SIGRE.
Además del SIGRE, los únicos SIG autorizados actualmente en España son Ecoembes y Ecovidrio, y el isotipo que han adoptado ambos es el llamado «punto verde» (fig. 2).
Fig. 2. Símbolo del punto verde.
Independientemente del sistema al que se acoja (SDDR o SIG), la ley obliga al marcado del envase mediante un método de identificación indicativo del sistema. Este símbolo deberá figurar de forma visible en cada unidad de venta que pueda ser adquirida por el consumidor o usuario con independencia del carácter primario, secundario o terciario del envase. Por ello, los envases que contengan FM y PO deberían estar acogidos a alguno de estos sistemas e incorporar, por tanto, el símbolo de identificación correspondiente.
Residuos generados por la oficina de farmacia
Antes de comenzar a describir los distintos residuos es conveniente tener en cuenta que la oficina de farmacia, una vez genera un residuo, se convierte en productor (del residuo), lo que implica, entre otras cosas, que no puede almacenar estos residuos por un período superior a 2 años en caso de que el residuo no sea peligroso y a 6 meses en caso de que lo sea (a no ser que disponga en este último caso de una autorización expresa de la administración competente para este almacenamiento). Por ello, la oficina de farmacia debe cederlos a un gestor de residuos (peligrosos o no dependiendo del caso) autorizado por esta administración para ese residuo, antes de la finalización de este período, quien se encargará de su eliminación. Esta norma entra en contradicción con las indicaciones que dan las NCE sobre la eliminación de materias primas rechazadas y material de acondicionamiento caducado u obsoleto. Los autores recomiendan el cumplimiento de la normativa sobre residuos frente a las NCE. Además, cabe destacar que incluida en la documentación básica de la que hay que disponer en la oficina de farmacia cuando se elaboren FM y PO, según las NCE, está la relativa a las materias primas y material de acondicionamiento. Dentro de ésta se hallan sus especificaciones, en las que están las características específicas de peligrosidad y toxicidad (pictogramas) y las precauciones a tomar durante su manipulación (frases R y S), por lo que esta información, además de servir para prevenir sobre las medidas de seguridad que hay que tomar cuando se manipulen, nos indica su naturaleza de peligrosidad a efectos de su gestión (almacenamiento y eliminación).
Embalajes de las materias primas adquiridas a los proveedores
Normalmente, cuando se reciben las materias primas, tanto los envases como los productos químicos utilizados en la elaboración de FM y PO vienen embalados con distintos materiales, pero la ley de envases no obliga a los envases industriales o comerciales (aquellos que sean de uso y consumo exclusivo en las industrias, comercios, servicios o explotaciones agrícolas y ganaderas y que, por tanto, no sean susceptibles de uso y consumo ordinario en los domicilios particulares). Por tanto, como ni los envases de las materias primas ni sus embalajes van destinados al consumidor final, se consideran envases industriales. Sin embargo, al estar afectados por la ley de residuos, estas bolsas deben gestionarse según indica la Ley 10/1998 de residuos (artículo 12.2 y 20.1); es decir, se debe realizar una recogida selectiva para su posterior valorización. En la práctica, esta recogida puede realizarse mediante una empresa autorizada o mediante los contenedores de recogida selectiva de residuos que ponen a disposición del usuario los servicios municipales.
Independientemente del sistema al que se acoja (SDDR o SIG), la ley obliga al marcado del envase mediante un método de identificación indicativo del sistema
Envases de materias primas agotados y de productos de limpieza
Una vez se terminan las sustancias empleadas como materias primas (principios activos, excipientes) en la elaboración de FM y PO, quedan los envases vacíos o que contienen aún restos de estas materias primas. Además, las NCE indican que se debe destruir el material de acondicionamiento primario (que está en contacto con el medicamento) o impreso que haya quedado obsoleto o caducado y registrar esta eliminación (no teniendo en cuenta la normativa sobre residuos).
En cualquier caso, se gestionan de manera conjunta tanto el envase como la sustancia que contiene y, dependiendo de si estos envases han contenido o no una sustancia peligrosa, deberán ser gestionados también de diferente forma. Si no la han contenido, se gestionarán de igual forma que el caso anterior (primer apartado), pero si la han contenido, habrá que gestionarlos como un residuo peligroso mediante de una empresa autorizada por la administración competente en materia de medio ambiente (artículo 11 de la Ley 10/1998).
Materias primas caducadas rechazadas
Se gestionan de manera conjunta tanto el envase como la sustancia que contiene. Dependiendo de si estas materias primas son o no una sustancia peligrosa, deberán ser gestionadas de diferente manera, tal y como se indica en el segundo apartado.
Las NCE indican, en lo referente a las materias primas rechazadas, que se podrá devolverlas al proveedor o eliminarlas por un método adecuado a sus características de peligrosidad lo más rápidamente posible, quedando separadas del resto de materias primas debidamente etiquetadas y registrando en su caso su eliminación (no teniendo en cuenta la normativa sobre residuos).
Excedentes de elaboración
Dependiendo de si el excedente de elaboración es o contiene o no una sustancia peligrosa, deberán gestionarse de diferente forma, tal y como se indica en el segundo apartado. Un ejemplo de residuo de este tipo, generado además por obligación, está descrito en las NCE. Es el caso de las muestras que han de guardarse y conservarse hasta un año después de la fecha de caducidad de cada lote de PO que se elabore.
Errores de elaboración
Dependiendo de si el error de elaboración es o contiene o no una sustancia peligrosa, deberán ser gestionadas de diferente manera, tal y como se indica en el segundo apartado. Ejemplo de este tipo de residuo son (aunque las NCE no lo indiquen literalmente) FM y PO ya preparados que sean rechazados al realizar los controles de calidad de producto terminado. En caso de rechazo nos encontraremos con una FM o un PO no aptos para su dispensación, por lo que deberán ser eliminados o almacenado hasta su caducidad o su eliminación (no teniendo en cuenta la normativa sobre residuos).
Sólidos impregnados generadoscomo consecuencia de derrames
También se incluye en este subgrupo el material utilizado en la preparación (guantes, mascarillas). Durante la preparación de FM y PO pueden producirse, y de hecho se producen frecuentemente, derrames de distintas materias primas sobre las superficies y elementos que se utilizan en su elaboración (utillaje, indumentaria, material de protección desechable de un solo uso); dependiendo de si el derrame es o contiene una sustancia peligrosa, deberán ser gestionadas de diferente manera, tal y como se indica en el segundo apartado.
Residuos generados por el usuario
Son FM y PO agotados, no agotadas y caducados. En ambos casos podría suponerse que, una vez dispensadas las FM y los PO por la oficina de farmacia, ésta ya no tiene ninguna responsabilidad medioambiental sobre estos medicamentos (desde el punto de vista de su capacidad de convertirse en residuo) y que es el usuario, como particular, el responsable de su correcta eliminación.
Sin embargo, paradójicamente, el usuario no tiene ninguna obligación según las leyes medioambientales de residuos, mientras que la oficina de farmacia, a través de sus titulares, sí. Para entenderlo basta con un simple paralelismo con otro tipo de medicamento, las especialidades farmacéuticas. Una vez las especialidades farmacéuticas son dispensadas por las oficinas de farmacia al usuario, éstos pueden, si quieren, deshacerse de ellas a través de puntos de recogida selectiva situados en las oficinas de farmacias, adheridas al SIGRE. Así, la industria farmacéutica es la encargada de asumir su recogida y gestión para su eliminación a través del sistema integrado de gestión SIGRE. De igual forma, es la oficina de farmacia la que elabora y pone en el mercado FM y PO (futuros residuos), por lo que está afectada también por la Ley 11/1997 de Envases y Residuos de Envases. En consecuencia para aquellos envases que pone en el mercado también deberían acogerse según la Ley 11/1997 a uno de los dos sistemas existentes (SIG o SDDR), asumiendo de este modo, la gestión de los envases que proporciona al consumidor final en la dispensación de FM y PO. Analizando el problema, es posible que la solución más sencilla fuera que las oficinas de farmacia asumieran a través del SIGRE la gestión de estos residuos con su coste correspondiente, ya que hay que recordar que éstas ya forman parte del SIGRE (en un 20% de su capital social). Además, hay que tener en cuenta que:
Para saber si el vertido es susceptible de contaminar al medio ambiente, hay que comprobar mediante su análisis si los limites de contaminantes sobrepasan los valores establecidos en la legislación
El volumen de FM y PO generado por las oficinas de farmacia es muy bajo respecto al de especialidades farmacéuticas.
Las FM y los PO son también medicamentos, por lo que es posible que no se entienda la necesidad de un sistema de gestión distinto para otros medicamentos, habiendo uno ya efuncionando.
El SIGRE está ya extendido y funcionando por casi la totalidad del territorio español.
El SIGRE es conocido por las autoridades competentes en materia de medio ambiente de casi todas las comunidades autónomas, pues éstas lo han autorizado en sus respectivos ámbitos territoriales.
Si esto fuera así y el SIGRE asumiera también la gestión de FM y PO elaboradas en las oficinas de farmacia, éstas deberían indicar en todos los envases de FM y PO que pusieran en el mercado el isotipo del SIGRE.
Si esta opción no fuera viable, las oficinas de farmacia deberían acogerse a otro sistema integrado de los ya existentes o bien incentivar a los colegios profesionales u otras asociaciones u organizaciones profesionales a la creación de un nuevo SIG.
Prospectos, etiquetas e información adicional
Las etiquetas que van adheridas al envase se consideran también envases.
Los prospectos o información por escrito al paciente que acompañen a FM y PO en sus envases no tienen la consideración de envases, pero sí de residuos, por lo que el usuario debería separarlos del medicamento y depositarlo en los contenedores de recogida selectiva. Sin embargo, en la práctica, lo más normal es que los usuarios se desprendan de los envases de FM y PO con sus prospectos y muy probablemente con restos de FM y PO, por lo que el sistema elegido por las oficinas de farmacia (SDDR o el SIG) debería asumir también su gestión.
Bolsas y envoltorios que contengan las FM y PO
Las bolsas de un solo uso, entregadas por las oficinas de farmacia en la dispensación al consumidor para facilitar el transporte de FM y PO, tienen la consideración de envase, a diferencia de los envoltorios, que no la tienen. Por tanto, cuando se dispensan FM y PO y se envasan en bolsas se está introduciendo en el mercado por primera vez, junto a FM y PO, un envase (estas bolsas) que se convertirá en un residuo. En este caso, a los titulares de oficina de farmacia se les considera envasadores y, por tanto, tienen la obligación de adherirse a uno de los dos sistemas de gestión que la Ley de envases y residuos de envase establece (SDDR o SIG). En la práctica, lo más cómodo para la oficina de farmacia es acogerse a un SIG ya existente como Ecoembes. Para ello, deberá aportar una cantidad estipulada por cada envase (bolsa) que ponga en el mercado (como hacen los laboratorios farmacéuticos con los envases de especialidades farmacéuticas en el SIGRE). Esta cantidad estará en función del material y del tamaño del envase de que se trate y dará derecho a utilizar un símbolo acreditativo (punto verde). Además esta cantidad está gravada con el IVA en el mismo porcentaje que el envase (bolsa). Por tanto, en la factura de compra de estas bolsas deberá figurar desglosada la cantidad que se está pagando por este concepto (punto verde).
Otras obligaciones derivadas de ser envasador acogido a un sistema integrado de gestión, además de estar lógicamente adherido a este sistema, son las siguientes:
Enviar la información de la cantidad total de envases y productos envasados puestos en el mercado anualmente (antes del 28 de febrero del año siguiente) a la entidad responsable de su gestión, que a su vez lo remitirá a las distintas comunidades autónomas donde esté autorizado este sistema.
Marcado e identificación de los envases (bolsas). Todas las bolsas puestas en el mercado deberán llevar el símbolo acreditativo del sistema integrado de gestión al que se hayan acogido (punto verde u otros símbolos en su caso).
Vertidos
Como consecuencia de las operaciones de limpieza, tanto del local como del utillaje, se generan vertidos al alcantarillado público de distinta naturaleza que dependen de gran cantidad de factores. Los vertidos más comunes son:
Productos de limpieza.
Agua de lavado del utillaje que ha estado en contacto con materias primas, peligrosas o no, FM y PO que las contengan.
Derrames de materias primas peligrosas o no, FM y PO.
Vertidos de errores en la elaboración de FM y PO.
Agua de lavado de envases de nueva adquisición para contener FM y PO.
Para saber si el vertido es susceptible de contaminar al medio ambiente, hay que comprobar mediante su análisis si los limites de contaminantes sobrepasan los valores establecidos en la legislación. Dado que las oficinas de farmacia suelen estar ubicadas en núcleos urbanos, acostumbran dirigir sus vertidos a la red de saneamiento municipal, por lo que son las ordenanzas municipales las que fijan los límites establecidos para los parámetros a analizar. Si el ayuntamiento carece de esta información en sus ordenanzas, habrá que regirse por los límites establecidos por la entidad competente en la materia. Si el resultado de estos análisis supera los límites legales establecidos, habrá que depurar los vertidos o bien encargarse de gestionarlos mediante un gestor autorizado.
Emisiones
Durante las operaciones de preparación de FM y PO es posible que se produzcan emisiones, por muy distintas causas, desde las técnicas derivadas del proceso de elaboración, hasta las indeseables o peregrinas como los accidentes y errores. Las más frecuentes se producen como consecuencia del manejo de polvos, sobre todo en las operaciones de mezclado. Además de la peligrosidad que estas emisiones puedan conllevar (que deberían ser conocidas, prevenidas y asumidas, a partir de la documentación general de las materias primas, en concreto de sus especificaciones), las emisiones generadas pasan al medio ambiente y deben ser controladas para cumplir los límites establecidos por la legislación vigente.
Los valores de emisión de cualquier actividad potencialmente contaminante de la atmósfera vienen reguladas por el Decreto 833/1975 que desarrolla la Ley 38/1972 de Protección del Ambiente Atmosférico.
Este decreto define las actividades potencialmente contaminadoras de la atmósfera, como aquellas que por su propia naturaleza o por los procesos tecnológicos convencionales utilizados constituyen o pueden constituir un foco de contaminación atmosférica.
Puesto que la actividad en cuestión no es mencionada ni en el anexo III ni en el anexo IV de este decreto, debemos incluirla en el apartado 27 del anexo III denominado «Actividades industriales diversas no especificadas en este anexo». Por tanto, para conocer los límites legales de sus emisiones debemos acudir al artículo 46 del citado decreto: «las emisiones de aquellos contaminantes no especificados en el Anexo III serán tales que los valores de inmisión resultantes no deberán rebasar la treintava parte de las concentraciones máximas permitidas en el ambiente interior de las explotaciones industriales que señala el Reglamento de Actividades Molestas, Insalubres y Peligrosas, aprobado por Decreto de 30 de noviembre de 1961».
Por todo ello, aunque a priori la elaboración de FM y PO pudiera parecer una actividad no potencialmente contaminadora de la atmósfera, dependiendo de las distintas materias primas empleadas así como de la cantidad de FM y PO a preparar, podría llegar a serlo, por lo que cada oficina de farmacia debería identificar y evaluar sus focos emisores y, en caso de ser necesario, implantar la medidas correctoras oportunas.
Conclusiones
Es necesario que, al menos, el farmacéutico responsable de la elaboración y control de las FM y PO que sean realizadas por él mismo o bajo su supervisión conozca las implicaciones medioambientales que afectan a su preparación.
Las peculiaridades en cuanto a la composición de las FM y PO, a su cantidad, número de unidades, aparataje o formación del personal, hacen complicado el cumplimiento, si procede, de la normativa de residuos, vertidos y emisiones. Habrá que esperar a la publicación del Formulario Nacional, en el que se indicarán, además de las FM tipificadas, los PO y los lotes que se permite elaborar para poder establecer la necesidad o no de aplicar algunas de las medidas indicadas en este artículo.
Puesto que la actividad de formulación magistral no es hoy día una actividad primordial en la mayoría de las oficinas de farmacia, cabe suponer que su repercusión medioambiental sea limitada, aunque no por ello se les exime del cumplimiento de la legislación aplicable.
Es patente la necesidad de solucionar urgentemente la problemática medioambiental en el ámbito de los residuos, tanto de los envases mediante la adhesión a un SIG (ya existente o no) como de los peligrosos, mediante su gestión por empresas autorizadas.
El cumplimiento de las NCE de las FM y PO en relación con la documentación, y en especial en lo referente a las características específicas de peligrosidad y toxicidad (pictogramas) que deben estar incluidas en las especificaciones de las materias primas, puede ayudar a mejorar sensiblemente la situación actual en relación con la gestión de los residuos por las oficinas de farmacia.
Es deseable, tanto para el adecuado cumplimiento de la legislación medioambiental como para la mejora continua, la implantación de un sistema de gestión medioambiental en la oficina de farmacia.
Bibliografía general
El SIGRE estudia comenzar a recoger los residuos de la formulación magistral. El Gobal 2002;3(125):18.
Entrevista con Juan Carlos Mampaso, director general del SIGRE. Boletín Informativo de Hefame 2002;218:157.
Lewicky KT. Envases farmacéuticos y sus residuos. Farmacéuticos 1999;230:40-1.
Más de 15.000 farmacias de toda España participan ya en el sistema SIGRE. El Farmacéutico 2002;284:54.
Pérez Torres A, Baixauli Fernández VJ. Tratamiento Residual de los medicamentos (I). Envases y residuos. Offarm 2001;20(4):114.
Pérez Torres A, Baixauli Fernández VJ. Tratamiento Residual de los medicamentos (II). Donaciones y caducidad. Offarm 2001;20(5):122.
Sistema Integrado de Gestión y Recogida de Envases. La Revista de Farmacia (COF de Alicante) 2002;40:12.