El diseño molecular de la vida
Sin lugar a dudas, el Proyecto Genoma Humano es uno de los acontecimientos científicos más destacados de este nuevo siglo. Pero la descodificación del genoma humano es sólo la punta del iceberg. Lo más complicado e importante será conocer el papel biológico de las proteínas. La proteómica es una tecnología en desarrollo que investiga la estructura y función del conjunto de proteínas que conforman el proteoma.
El término proteoma apareció en 1994 como un equivalente lingüístico del concepto de genoma. Describe el conjunto completo de proteínas que se expresan, según el genoma, y factores externos, durante la vida de una célula.
El interés de la proteómica se centra en el conocimiento del conjunto de las interacciones entre proteínas para constituir la red de interacciones, que caracteriza el funcionamiento de los organismos vivos. En otras palabras, la proteómica es el estudio del proteoma.
Una de las diferencias fundamentales entre la proteómica y el estudio clásico de las proteínas es su carácter global. No se centra en el estudio de una determinada proteína, sino que consiste en un estudio de aproximación al funcionamiento del conjunto de proteínas.
Hoy día, la investigación del proteoma se centra, principalmente, en la puesta a punto de métodos exactos y relativamente rápidos para identificar y caracterizar el conjunto de proteínas.
Entre las tecnologías clásicas que se utilizan se encuentran la electroforesis bidimensional y la espectrometría de masas (fig. 1). Otra técnica más novedosa que ya ha proporcionado buenos resultados son los «chips de proteínas» que, al igual que los «chips de ADN», permiten el análisis simultáneo de miles de proteínas. Además, gracias a la bioinformática, existen programas capaces de determinar las reacciones metabólicas que tiene una determinada proteína con el resto del proteoma. Y también se puede modelar por computador distintas formas mutantes de una proteína (fig. 2), e incluso determinar cómo interactúa una proteína con sus respectivos sustratos.
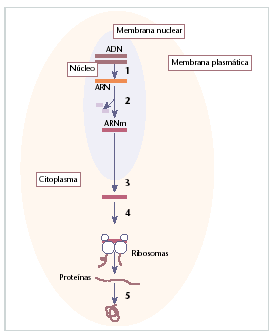
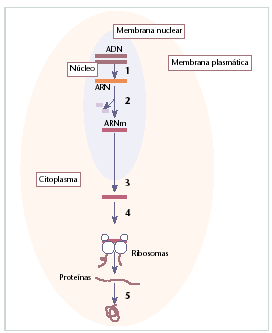
Fig. 1. Resumen del proceso de síntesis proteica: el ADN (1) se transcribe a un ARN (2) precursor; una vez eliminadas las secuencias intrónicas por el proceso de splicing, el ARN maduro o mensajero abandona el núcleo de la célula (3) y en el citoplasma es traducido por los ribosomas en una cadena polipeptídica (estructura primaria de la proteína) (4); a partir de aquí la proteína sufre varias modificaciones postraduccionales y acaba plegándose para adoptar la conformación biológica funcional (5).
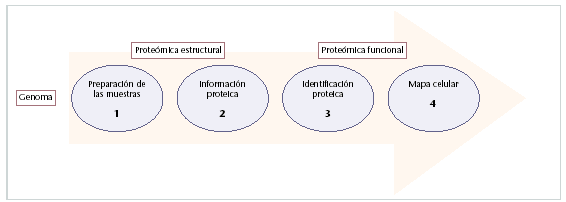
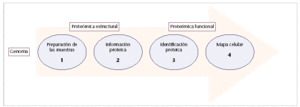
Fig. 2. Pasos estratégicos para el análisis del protemoa. La proteómica pretende crear un puente entre los genes y sus productos, las proteínas. Para ello, se realiza el siguiente proceso: preparación de la muestra mediante técnicas de electroforesis en 2D, y cromatrografía (1), determinación parcial de la secuencia de aminoácidos (2), identificación y cuantificación de las proteínas mediante técnicas biocomputación (3) y estudio de las interacciones proteicas, estructura, y localización celular (4).
Las potenciales aplicaciones de la investigación proteómica son muchas y variadas. Además de ampliar el conocimiento científico básico y conocer mejor nuestro organismo, también tendrá aplicaciones biomédicas muy interesantes.
Encontrar la causa de determinadas enfermedades genéticas o infecciosas y contribuir en nuevas estrategias para el desarrollo de fármacos nuevos será una tarea difícil, pero sin duda provechosa para los investigadores que se dediquen a la proteómica durante las próximas décadas.
Síntesis proteica: un proceso clave
Las proteínas constituyen más de la mitad del peso seco de la célula. Mientras que el ADN (ácido desoxirribonucleico) contiene la información necesaria para el desarrollo de la célula, las proteínas son las moléculas básicas para su ejecución. Es decir, las proteínas determinan la forma y estructura de la célula, además de actuar como instrumentos de reconocimiento molecular y como herramientas de catálisis. Es cierto que el ADN contiene la información suficiente para generar una célula, pero tiene poca influencia directa sobre los procesos celulares. Por ejemplo, el gen de la hemoglobina no puede transportar oxígeno, esta propiedad es específica de la proteína codificada por el gen.
La síntesis de proteínas es un proceso extraordinariamente complejo, en el que la información genética codificada en los ácidos nucleicos se traduce en el alfabeto de 20 aminoácidos.
De forma resumida, el proceso de síntesis proteica se caracteriza por un primer paso, en el que el ADN se traduce a ARN (ácido ribonucleico) precursor. Una vez realizado el proceso de splicing, en el que se eliminan las secuencias intrónicas (secuencia no codificadora del ARN) por un proceso de corte y empalme, el ARN maduro o ARN mensajero abandona el núcleo de la célula y, en el citoplasma, es traducido por los ribosomas en la cadena primaria de aminoácidos que conforman las proteínas.
Durante la fase de traducción de la síntesis de proteínas, la incorporación de cada aminoácido está especificada por uno o varios tripletes de nucleótidos que se denominan codones.
En la traducción intervienen también los ARN transportadores (ARNt), un conjunto de moléculas que actúan como transportadoras de los aminoácidos. Las interacciones de apareamiento de bases entre codones y la secuencia de bases de los anticodones de los ARNt da lugar a la traducción exacta, de los mensajeros genéticos, en una cadena polipeptídica que conforma la estructura primaria de una proteína.
La síntesis proteica implica también un conjunto de modificaciones, posteriores a la traducción, que preparan a las proteínas para su función, la ayudan en su «plegamiento» y la dirigen a su destino específico. Estas alteraciones covalentes son el procesamiento proteolítico, la modificación de determinadas cadenas laterales de los aminoácidos y la inserción de cofactores.
Finalmente, uno de los aspectos más importantes de la síntesis de proteínas es el plegamiento de su estructura primaria (cadena simple de aminoácidos) en sus conformaciones biológicamente activas (estructura secundaria, terciaria y cuaternaria). A pesar de décadas de investigación sobre las propiedades físicas y químicas de las cadenas polipeptídicas, permanece sin resolver el mecanismo por el que la secuencia primaria dicta la conformación final de la molécula.
En conjunto, más de 100 moléculas distintas participan en la síntesis de proteínas. Entre las más importantes se encuentran las componentes de los ribosomas (estructuras supramoleculares formadas por ARN y proteínas que descodifican de forma rápida y precisa los mensajes genéticos).
Es importante destacar que la síntesis proteica es un proceso complejo, en el que se suceden numerosas y distintas etapas --iniciación, elongación, terminación y modificación postraduccional--; este proceso debe realizarse con rapidez, puesto que los organismos deben responder de forma rápida a las condiciones del entorno constantemente cambiantes.
La precisión de la traducción es esencial, debido a que el plegamiento exacto (por tanto, el funcionamiento adecuado de cada proteína) viene determinado por su secuencia primaria.
En definitiva, la función biológica de una proteína viene determinada por su composición química (a su vez, determinada por una secuencia de aminoácidos) y por su estructura tridimensional. Ambas características le dan una precisión atómica extraordinaria para realizar su función.
Por tanto, uno de los retos de la proteómica es descubrir las leyes que rigen las relaciones de estos tres planos; secuencia, estructura y función.
Electroforesis bidimensional
La electroforesis bidimensional (2D) es una técnica comúnmente utilizada para el análisis de proteínas. Se basa en separar las proteínas de una mezcla en dos dimensiones según sus propiedades moleculares. Se separan mediante su carga eléctrica, en una primera dimensión (mediante isoelectroenfoque), y según su peso molecular en una segunda dimensión (mediante electroforesis en poliacrilamida-SDS).
Uno de los mayores problemas de las electroforesis 2D es el análisis y comparación de mezclas de proteínas. Actualmente, existen bases de datos de geles bidimensionales capaces de comparar patrones. Estos sistemas permiten la comparación automática de manchas (spots) para realizar un análisis cuantitativo de las proteínas a estudiar.
*Disponible en: http://www.ub.es/biocel/wbc/tecnicas/page.htm
Genoma frente a proteoma
La capacidad de las células para mantener un grado de orden relativamente elevado dentro del universo caótico de una célula deriva de la información genética que es expresada, mantenida y, a veces, mejorada, gracias a cuatro procesos genéticos básicos: la síntesis de proteínas y de ARN; la reparación del ADN; la replicación del ADN, y la recombinación génica. Estos procesos son los responsables de producir y mantener las proteínas y los ácidos nucleicos de una célula y son unidimensonales, es decir, la información lineal de una secuencia de nucleótidos se utiliza para codificar otra cadena lineal de nucleótidos (ADN o ARN) o una cadena lineal de aminoácidos (estructura primaria de la proteína).
Los procesos genéticos son conceptualmente más sencillos de entender, comparados con el resto de procesos celulares, que son el resultado de la información contenida en las complejas estructuras tridimensionales de las moléculas proteicas. Ésta parece ser la razón por la que los investigadores comprenden y conocen, por ahora, mejor los mecanismos genéticos que los mecanismos biológicos de las proteínas.
Actualmente se sabe que la estructura tridimensional de una proteína está codificada en su secuencia de aminoácidos, pero por ahora, los científicos aún no han logrado descifrar este código; es decir, conociendo la secuencia polipeptídica de una proteína no se puede determinar su estructura y sus pautas de interacción.
En definitiva, hasta que no se pueda predecir la estructura y función de una proteína, a partir de su secuencia polipeptídica, no se podrán diseñar pautas para la modulación de las posibles actividades anómalas de una proteína, lo que abriría nuevos caminos en el campo de la biomedicina.
El Alzheimer, una enfermedad conformacional
La EA es una enfermedad progresiva y mortal, que se caracteriza por un deterioro grave de las funciones mentales producido por la muerte neuronal de las regiones del cerebro relacionadas con la memoria y el conocimiento.
En las autopsias, se observa la presencia de agregados insolubles de restos proteicos extracelulares, que se denominan depósitos amieloides (o placas seniles), junto con otras señales anatómicas características.
El centro de los depósitos de amioloide está compuesto principalmente por un péptido de 30-42 residuos, denominados beta-amieloides, que se agregan por la rotura proteolítica precursora del amieloide (APP), una glucopreteína transmembrana cuya función aún se desconoce.
Las mutaciones del gen de la APP (en el cromosoma 21) producen casos hereditarios de la EA. Por razones que aún no están claras, el beta-amieloide, un péptido soluble que se produce en la mayoría de las células debido a una alteración conformacional, se agrega para formar las fibrillas, virtualmente insolubles, que caracterizan la enfermedad.
Plegamiento proteico y enfermedad
A pesar de que la mayoría de las cadenas proteicas muestran una elevada proporción de éxito en el plegamiento correcto dentro de las células, algunas proteínas eluden los mecanismos de plegamiento y provocan enfermedades.
Se trata de enfermedades que se caracterizan por plegamientos y agregaciones erróneas de determinados grupos de proteínas. Se denominan enfermedades conformacionales.
Patologías sin aparente relación, como la enfermedad de Alzheimer (EA), la fibrosis quística, la encefalopatía espongiforme (enfermedad de las vacas locas) y numerosos tumores, resultan del plegamiento incorrecto de proteínas.
El autoensamblaje anormal comporta deposición de material proteico en agregados insolubles ordenados y fibras amieloides, en el caso de la EA. Se sospecha que en intermediarios desplegados, o parcialmente plegados, podría encerrarse la causa común de los desórdenes asociados a proteínas amieloides.
La identificación de la estructura primaria de una proteína, a través de la secuencia de ADN, es inmediata, pero la adquisición de datos tridimensionales resulta todavía lenta y dificultosa. Se requieren, pues, algoritmos que traduzcan la información lineal en espacial.
Por ahora, los investigadores buscan un modelo que permita cuantificar las predicciones acerca de la secuencia de aminoácidos, la topología de la cadena, el pH, la concentración de sal y la temperatura en la cinética y termodinámica del proceso de plegamiento proteico.
En definitiva, la preedición de la estructura tridimensional de una proteína desde su estructura primaria abarca un doble aspecto, describir el estado nativo y conocer la trayectoria de plegamiento, pero ambas tareas, superan por ahora las posibilidades de las técnicas actuales de investigación.
Biocomputación*
Mediante la simulación por ordenador, a partir de la estructura de una proteína se pueden mimetizar los diferentes modos en que las cadenas de aminoácidos se enrollan entre sí.
*Disponible en: http://cultura.terra.es/cac/ciencia/consulta/portada.cfm?consulta_id=438
Proteómica, una tecnología en desarrollo
La secuenciación de numerosos genomas, incluyendo el genoma humano, ha proporcionado información de la secuencia primaria de miles de proteínas. Sin embargo, se desconoce la identidad y la función de muchas de estas moléculas.
Además, tal como hemos contado, las alteraciones estructurales de muchas proteínas, por ahora, no pueden predecirse sólo con la secuencia del ADN o en ARN, debido al corte y el empalme alternativo de los ARNm o a las modificaciones químicas que se producen después de la traducción.
De este modo, la atención de algunos bioquímicos y biólogos moleculares se centra en intentar comprender la complejidad de estos procesos, y así aproximarse al conocimiento de la estructura y función del conjunto de proteínas que conforman el proteoma.
Los objetivos de la proteómica son, básicamente, dos:
* El estudio de los cambios globales de la expresión de las proteínas celulares en el tiempo.
* La determinación de la identidad y las funciones de todas las proteínas producidas por los organismos.
La investigación de los proteomas se centra, actualmente, en la puesta a punto de métodos exactos, y relativamente rápidos, para identificar y caracterizar las proteínas. Las técnicas clásicas más extendidas son la electroforesis bideimensional en gel y la espectrometría de masas. Además, los expertos también cuentan con las novedosas técnicas de bioinformática y biocomputación, capaces de analizar millones de datos simultáneamente.
A pesar de los extraordinarios avances en las técnicas de investigación del proteoma, existen, por ahora, diversos problemas que suponen un serio obstáculo para llevar a cabo la enorme tarea de caracterizar el proteoma completo.
Por ejemplo, uno de las mayores dificultades es encontrar una técnica, equivalente a la proteína C reactiva (PCR) (técnica que permite amplificar los genes), para amplificar aquellas proteínas que se encuentran en cantidades pequeñas.
En resumen, hoy día los investigadores son capaces de descifrar un genoma completo, pero aún no comprenden la función e interacciones globales de la mayoría de las proteínas. Aun así, puesto que actualmente las nuevas técnicas crecen de forma exponencial, tal vez no estemos tan lejos de empezar a comprender el complejo y extraordinario mundo de las proteínas, responsables en gran parte del diseño molecular de la vida.
Bibliografía general
Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD. Biología molecular de la célula. Barcelona: Edicions Omega, 1994; p. 111-29.
Institut de bioquímica Clínica. Del Cromosoma al Gen. Barcelona: Diputación de Barcelona, 1995; p. 43-53.
McKee T, Mckee JR. Bioquímica. La base molecular de la vida. Madrid: Mc Graw Hill, 2003; p. 661-90.
Orozco M. La determinación de la estructura de proteínas en la era genómica [consultado 2/02/04]. Disponible en: Biomedia.
Simpson RJ. Protein and Proteomics. A laboratory manual. New York: Cold Spring Harbor Laboratory Press, 2003; p. 1-29.
Vigera AR. Estructura y estabilidad de las proteínas. Investigación y Ciencia. Madrid, 2003;70-7.