El desarrollo del soporte respiratorio mecánico ha permitido un incremento en la supervivencia de niños prematuros con menos edad de gestación. Sin embargo, se relaciona con mayor lesión pulmonar y aumento en la incidencia de displasia broncopulmonar.
Materiales y métodosPara determinar los factores de riesgo de displasia broncopulmonar en neonatos menores de 34 semanas, se diseñó un estudio de casos y controles, en el cual se compararon 36 neonatos con displasia broncopulmonar con 108 controles. Se creó un modelo de regresión logística.
ResultadosEn el análisis univariado, los factores asociados a displasia broncopulmonar fueron: FiO2 mayor de 35% por más de tres días, enfermedad de membranas hialinas, sepsis precoz, neumotórax o enfisema pulmonar intersticial, persistencia del conducto arterioso, cuatro o más transfusiones de hematíes e hipertensión arterial sistémica inducida por el embarazo. Mediante regresión logística binaria, se identificaron como factores predictores independientes asociados con displasia broncopulmonar en la población de estudio, el neumotórax o enfisema pulmonar intersticial (odds ratio, OR=1,7; IC95% 1,3-9,1; p=0,039) y cuatro o más transfusiones de hematíes (OR=2,1; IC95% 1,6-8,1; p=0,025). La mortalidad fue mayor en el grupo con displasia broncopulmonar (41,7% Vs. 22,2%; p=0,023).
ConclusiónEl neumotórax o el enfisema pulmonar intersticial y cuatro o más transfusiones de hematíes, son factores predictores fiables para predecir la displasia broncopulmonar en neonatos menores de 34 semanas. Al corregir precozmente el barotrauma, optimizar las indicaciones de transfusión y mejorar el soporte respiratorio mecánico, se podría disminuir la frecuencia de la displasia broncopulmonar y la mortalidad en este grupo de pacientes.
The development of ventilator support is one of the main factors contributing to the survival of premature infants. However, this has led to lung injury and an increase in the incidence of bronchopulmonary dysplasia.
MethodologyIn order to determine risk factors for the development of bronchopulmonary dysplasia in preterm infants, a cases and controls study was designed that included 36 infants with bronchopulmonary dysplasia and compared with 108 controls. A logistic regression model was created to evaluate the effect on the risk of bronchopulmonary dysplasia.
ResultsIn univariate analysis, the factors associated with bronchopulmonary dysplasia were: FiO2>35% for more than 3 days, hyaline membrane disease, early sepsis, pneumothorax/pulmonary interstitial emphysema, patent ductus arteriosus, 4 or more red blood cell transfusions, and pregnancy induced hypertension. The predictors for the development of bronchopulmonary dysplasia in preterm infants less than 34 weeks were identified using binary logistic regression analysis. These were found to be: pneumothorax or pulmonary interstitial emphysema (odds ratio, OR=1.7; 95% CI; 1.3-9.1; p=.039), and 4 or more red blood cell transfusions (OR=2.1; 95% CI; 1.6-8.1; p=.025). Mortality was higher in the group with bronchopulmonary dysplasia (41.7% vs. 22.2%, p=.023).
ConclusionPneumothorax or pulmonary interstitial emphysema, and 4 or more red blood cell transfusions are reliable tools to predict development of bronchopulmonary dysplasia in preterm infants less than 34 weeks. Early diagnosis, corrected air leak syndrome, optimising indications for transfusion, as well as, improving the mechanical ventilatory support may decrease mortality and frequency of bronchopulmonary dysplasia in this patient group.
Los avances en el cuidado neonatal en las últimas décadas han permitido un incremento en el número de prematuros que sobreviven más que en el pasado. Uno de los factores que han contribuido a esta supervivencia es el desarrollo del soporte respiratorio mecánico. Sin embargo, esto se relaciona con lesión pulmonar y aumento en la incidencia de displasia broncopulmonar1.
Anteriormente, la displasia broncopulmonar se describía en neonatos prematuros como resultado de la exposición al oxígeno medicinal y a la asistencia respiratoria mecánica, pero, con el desarrollo médico actual, ahora se presenta en recién nacidos de muy bajo peso al nacer, quienes inicialmente no tienen o tienen una lesión pulmonar mínima y, posteriormente, requieren más oxígeno y asistencia respiratoria mecánica en las primeras semanas de vida2.
Aunque solo un pequeño número de prematuros presenta el curso clínico clásico, en los estudios recientes de neonatos con edad de gestación de menos de 32 semanas, se observa un aumento considerable (entre 30 y 40%) en la incidencia de displasia broncopulmonar. Se ha reportado una mortalidad de 20% a 30% por esta enfermedad y aquellos pacientes que sobreviven el primer mes de vida, tienen un 30% más de riesgo de morir en el primer año de vida3.
El mecanismo exacto responsable del desarrollo de la displasia broncopulmonar es aún desconocido. Hay muchos factores, solos o en combinación, que han sido implicados en su patogénesis, como el trauma mecánico por la respiración artificial y la toxicidad por oxígeno y, también, infecciones, corioamnionitis, edema pulmonar y sobrecarga de fluidos.
El objetivo primario de este estudio fue identificar los factores de riesgo asociados con la displasia broncopulmonar.
MétodoSe trata de un estudio de casos y controles, de pacientes admitidos en los servicios de neonatología, trauma o choque y en la unidad de cuidados intensivos pediátricos del Hospital Universitario de Pediatría “Dr. Agustín Zubillaga” (Estado Lara, Venezuela), entre el 5 de julio de 2010 y el 5 de diciembre 2014. Como casos se incluyeron recién nacidos de menos de 34 semanas de edad de gestación, que requirieron asistencia respiratoria mecánica en la primera semana de vida y con diagnóstico posterior de displasia broncopulmonar. A cada caso con displasia broncopulmonar se le asignaron tres controles sin displasia broncopulmonar y sin dependencia de oxígeno a los 28 días de edad, cuya edad de gestación y fecha de nacimiento correspondían con las del caso, con, máximo, una semana de diferencia.
Se excluyeron aquellos neonatos con síndrome dismórfico, enfermedades hematológicas, anormalidades abdominales o torácicas, cardiopatías congénitas cianógenas, enfermedades quirúrgicas, con sospecha de fibrosis quística o tumor pulmonar, o muerte antes de los 28 días de vida y, además, aquellos que recibieron eritropoyetina humana recombinante. Se creó una base de datos codificados para proteger la confidencialidad. El estudio fue aprobado por el Comité de Bioética y hubo consentimiento informado.
De acuerdo con la literatura revisada4, asumiendo una proporción de 30% de casos expuestos, una proporción de controles expuestos de 9,7%, una razón de momios (odds ratio, OR) esperada de 4,0, un intervalo de confianza del 95%, una potencia de 80% y un número de tres controles por cada caso, en este estudio de casos y controles el tamaño de la muestra para detectar un OR significativamente diferente de 1, se estableció en 36 casos y 108 controles. El programa estadístico utilizado para el cálculo de la muestra fue EpiDat 3.1.
Para el desarrollo del estudio se registró de cada neonato: edad gestacional, sexo, peso al nacer, puntuación del test de Apgar a los 5 minutos, el SNAP-PE II (Score for Neonatal Acute Physiology - Perinatal Extension), días de ventilación mecánica, los valores máximos registrados de presión inspiratoria pico (PIPmax), de presión positiva al final de la espiración (PEEPmax) y de la fracción inspiratoria de oxígeno (FiO2max) durante la primera semana de soporte respiratorio mecánico; días de FiO2 mayor de 35% (tanto con ventilación mecánica, como con otras técnicas de oxigenoterapia); administración de surfactante sintético (Exosurf® o Survanta®, 100mg/kg/dosis) como terapia de rescate en infantes con síndrome de distres respiratorio, patologías principales (enfermedad de membranas hialinas, sepsis precoz y tardía, neumotórax o enfisema intersticial pulmonar, neumonía y persistencia del conducto arterioso), transfusión de glóbulos rojos y muerte.
La variable primaria del resultado fue el desarrollo de displasia broncopulmonar. En los antecedentes perinatales se registraron: edad materna; ruptura prolongada de membranas ovulares (mayor de 24 horas); corioamnionitis (clínica o comprobada); hipertensión arterial sistémica inducida por el embarazo; uso prenatal de esteroides (dexametasona, dos o más dosis intramusculares), y tipo de parto (por cesárea o vaginal).
La displasia broncopulmonar se consideró leve en neonatos menores de 32 semanas de gestación cuando fue posible suspender el oxígeno suplementario antes de la semana 36 de gestación y, en recién nacidos con 32 o más semanas de gestación, cuando se pudo suspender antes de los 56 días de nacidos o antes de su egreso, habiéndolo utilizado con una FiO2 mayor de 0,21 por 28 días o más. La displasia broncopulmonar se consideró moderada a grave, en neonatos de menos de 32 semanas de gestación, cuando se requirió oxígeno suplementario a las 36 semanas de gestación y, en recién nacidos de 32 o más semanas de gestación, cuando se necesitó oxígeno suplementario a los 56 días de nacidos, habiéndolo utilizado con una FiO2 mayor de 0,21 por 28 días o más5. Los cambios radiológicos crónicos observados coincidieron con los descritos por Edwards y Northway6.
La sepsis se consideró precoz cuando se presentó antes de las 72 horas de vida posnatal y, tardía, cuando se presentó después de este tiempo. La persistencia del conducto arterioso se diagnosticó mediante ecocardiograma 2D. Para establecer la gravedad de la enfermedad se utilizó la SNAP-PE II, con datos obtenidos en las evaluaciones del recién nacido en las primeras 24 horas de hospitalización. También, se registró el número de transfusiones de glóbulos rojos durante el seguimiento en los primeros 28 días de edad posnatal o hasta el egreso del paciente. Durante el tiempo de transfusión y hasta una hora después, los recién nacidos no recibieron alimentación. Todas las variables registradas en el grupo de control fueron tomadas hasta el momento del diagnóstico de displasia broncopulmonar correspondiente al caso índice.
Análisis estadísticoEl programa SPSS Statistics®, versión 17.0, se utilizó en el análisis estadístico de los datos. Las diferencias entre medias de variables con distribución no normal, se analizaron mediante la prueba U de Mann-Whitney, aquellas con distribución normal, con la prueba t de Student, y las diferencias en la distribución de variables categóricas se analizaron con la de ji al cuadrado. La significación estadística fue establecida como p<0,05.
Todas las pruebas estadísticas fueron de dos colas. La fuerza de asociación se informó como razón de momios (odds ratios, OR) con un intervalo de confianza de 95%. Las variables clínicamente relevantes y asociadas a la enfermedad en el análisis de datos univariado, se utilizaron para crear un modelo de regresión logística con un valor de p menor de 0,05, como criterio de entrada. En función de un principio jerárquico en la regresión logística, se utilizó un procedimiento de “introducir”. Con la prueba de bondad de ajuste de Hosmer y Lemeshow se evaluó la significación del modelo final, considerando significativa p>0,05. También, se calculó el R2 de Nagelkerke.
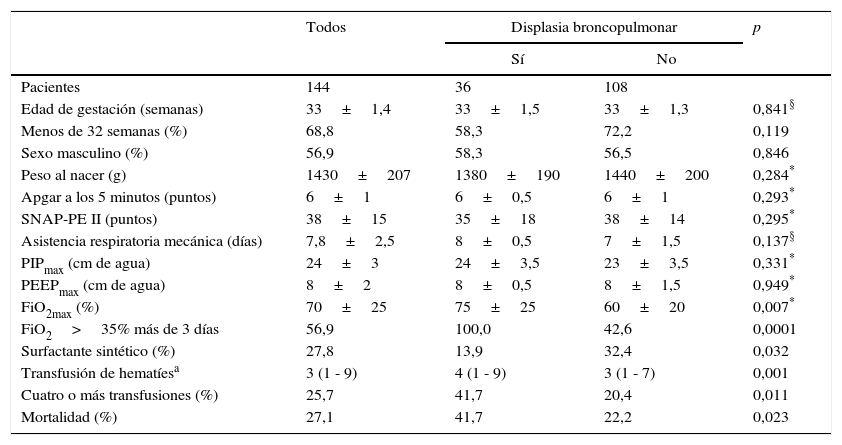
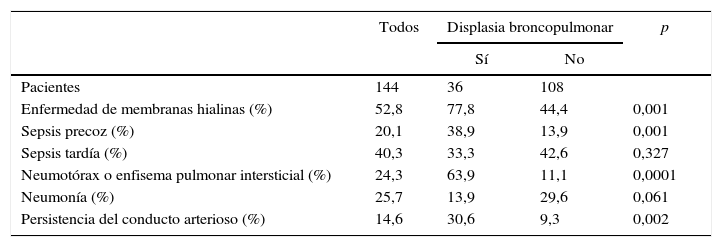
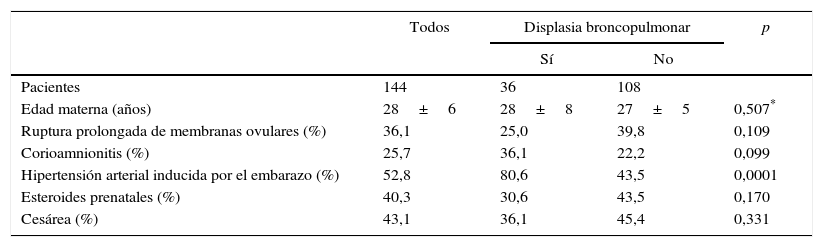
ResultadosSe incluyeron 144 neonatos en el estudio, 36 casos y 108 controles. La edad promedio de gestación fue de 33±1,4 semanas, 68,8% eran menores de 32 semanas y el promedio de peso al nacer fue de 1.430±207g. El promedio del puntaje de Apgar a los cinco minutos fue de 6±1 puntos, el de la SNAP-PE II fue de 38±15 puntos, y el de duración de la asistencia respiratoria mecánica fue de 7,8±2,5 días; 56,9% de los pacientes permanecieron más de tres días con una FiO2 mayor de 35%, el 27,8% recibió surfactante sintético, la mediana del número de transfusiones de glóbulos rojos fue de 3 (rango de 1 a 9) y la mortalidad general fue de 27,1% (tabla 1). El 52,8% de los neonatos presentaron enfermedad de membranas hialinas; 20,1%, sepsis precoz; 24,3%, neumotórax o enfisema intersticial pulmonar, y 14,6%, persistencia del conducto arterioso (tabla 2). El 25,7% de las madres presentaron corioamnionitis y, el 52,8%, hipertensión arterial sistémica inducida por el embarazo; el resto de los antecedentes se resumen en la tabla 3.
Características generales de la población de estudio
| Todos | Displasia broncopulmonar | p | ||
|---|---|---|---|---|
| Sí | No | |||
| Pacientes | 144 | 36 | 108 | |
| Edad de gestación (semanas) | 33±1,4 | 33±1,5 | 33±1,3 | 0,841§ |
| Menos de 32 semanas (%) | 68,8 | 58,3 | 72,2 | 0,119 |
| Sexo masculino (%) | 56,9 | 58,3 | 56,5 | 0,846 |
| Peso al nacer (g) | 1430±207 | 1380±190 | 1440±200 | 0,284* |
| Apgar a los 5 minutos (puntos) | 6±1 | 6±0,5 | 6±1 | 0,293* |
| SNAP-PE II (puntos) | 38±15 | 35±18 | 38±14 | 0,295* |
| Asistencia respiratoria mecánica (días) | 7,8±2,5 | 8±0,5 | 7±1,5 | 0,137§ |
| PIPmax (cm de agua) | 24±3 | 24±3,5 | 23±3,5 | 0,331* |
| PEEPmax (cm de agua) | 8±2 | 8±0,5 | 8±1,5 | 0,949* |
| FiO2max (%) | 70±25 | 75±25 | 60±20 | 0,007* |
| FiO2>35% más de 3 días | 56,9 | 100,0 | 42,6 | 0,0001 |
| Surfactante sintético (%) | 27,8 | 13,9 | 32,4 | 0,032 |
| Transfusión de hematíesa | 3 (1 - 9) | 4 (1 - 9) | 3 (1 - 7) | 0,001 |
| Cuatro o más transfusiones (%) | 25,7 | 41,7 | 20,4 | 0,011 |
| Mortalidad (%) | 27,1 | 41,7 | 22,2 | 0,023 |
SNAP-PE II: Score for Neonatal Acute Physiology - Perinatal Extension
PIPmax: presión inspiratoria pico, máxima.
PEEPmax: presión positiva al final de la espiración, máxima.
FiO2max: fracción inspiratoria de oxígeno, máxima.
Enfermedades principales de la población de estudio
| Todos | Displasia broncopulmonar | p | ||
|---|---|---|---|---|
| Sí | No | |||
| Pacientes | 144 | 36 | 108 | |
| Enfermedad de membranas hialinas (%) | 52,8 | 77,8 | 44,4 | 0,001 |
| Sepsis precoz (%) | 20,1 | 38,9 | 13,9 | 0,001 |
| Sepsis tardía (%) | 40,3 | 33,3 | 42,6 | 0,327 |
| Neumotórax o enfisema pulmonar intersticial (%) | 24,3 | 63,9 | 11,1 | 0,0001 |
| Neumonía (%) | 25,7 | 13,9 | 29,6 | 0,061 |
| Persistencia del conducto arterioso (%) | 14,6 | 30,6 | 9,3 | 0,002 |
Antecedentes perinatales de la población de estudio
| Todos | Displasia broncopulmonar | p | ||
|---|---|---|---|---|
| Sí | No | |||
| Pacientes | 144 | 36 | 108 | |
| Edad materna (años) | 28±6 | 28±8 | 27±5 | 0,507* |
| Ruptura prolongada de membranas ovulares (%) | 36,1 | 25,0 | 39,8 | 0,109 |
| Corioamnionitis (%) | 25,7 | 36,1 | 22,2 | 0,099 |
| Hipertensión arterial inducida por el embarazo (%) | 52,8 | 80,6 | 43,5 | 0,0001 |
| Esteroides prenatales (%) | 40,3 | 30,6 | 43,5 | 0,170 |
| Cesárea (%) | 43,1 | 36,1 | 45,4 | 0,331 |
En el grupo con displasia broncopulmonar, las características que mostraron diferencias significativas en el análisis univariado, fueron: mayor FiO2 máxima (75±25% Vs. 60±20%; p=0,007), con mayor proporción de más de tres días con FiO2 mayor de 35% (100,0% Vs. 42,6%, p=0,0001), mayor cantidad de transfusiones de hematíes [4 (1 a 9) Vs. 3 (1 a 7); p=0,001], y mayor proporción de cuatro o más transfusiones de hematíes (41,7% Vs. 20,4%; p=0,011). Además, se observó mayor proporción de administración de surfactante sintético en el grupo control (32,4% Vs. 13,9%, p=0,032) y mayor mortalidad en el grupo con displasia broncopulmonar (41,7% Vs. 22,2%; p=0,023). El resto de las variaciones se muestran en la tabla 1.
En el grupo con displasia broncopulmonar, hubo mayor proporción de enfermedad de membranas hialinas (77,8%Vs. 44,4%; p=0,001), de sepsis precoz (38,9%Vs. 13,9%; p=0,001), de neumotórax o enfisema intersticial pulmonar (63,9% Vs. 11,1%; p=0,0001) y de persistencia del conducto arterioso (30,6% Vs. 9,3%; p=0,002) (tabla 2). También, hubo mayor proporción de madres con hipertensión arterial sistémica inducida por el embarazo (80,6% Vs. 43,5%, p=0,0001) (tabla 3).
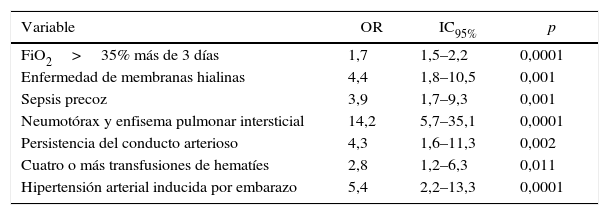
En el análisis univariado se incluyeron los factores de riesgo conocidos de displasia broncopulmonar: FiO2 mayor de 35% por más de tres días (OR=1,7; IC95% 1,5-2,2; p=0,0001), enfermedad de membranas hialinas (OR=4,4; IC95% 1,8-10,5; p=0,001), sepsis precoz (OR=3,9; IC95% 1,7-9,3; p=0,001), neumotórax o enfisema intersticial pulmonar (OR=14,2; IC95% 5,7-35,1; p=0,0001) y persistencia del conducto arterioso (OR=4.3; IC95% 1,6-11,3; p=0,002). Además, se incluyeron: cuatro o más transfusiones de hematíes (OR=2,8; IC95% 1,2-6,3; p=0,011) e hipertensión arterial sistémica inducida por el embarazo (OR=5,4; IC95% 2,2-13,3; p=0,0001) (tabla 4).
Análisis univariado: población según desarrollo de displasia broncopulmonar
| Variable | OR | IC95% | p |
|---|---|---|---|
| FiO2>35% más de 3 días | 1,7 | 1,5–2,2 | 0,0001 |
| Enfermedad de membranas hialinas | 4,4 | 1,8–10,5 | 0,001 |
| Sepsis precoz | 3,9 | 1,7–9,3 | 0,001 |
| Neumotórax y enfisema pulmonar intersticial | 14,2 | 5,7–35,1 | 0,0001 |
| Persistencia del conducto arterioso | 4,3 | 1,6–11,3 | 0,002 |
| Cuatro o más transfusiones de hematíes | 2,8 | 1,2–6,3 | 0,011 |
| Hipertensión arterial inducida por embarazo | 5,4 | 2,2–13,3 | 0,0001 |
OR: odds ratio.
IC95%: intervalo de confianza del 95%.
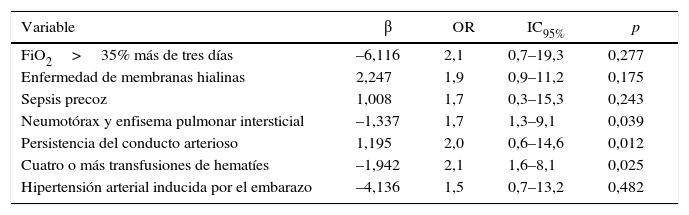
Posteriormente, se hizo el análisis de regresión logística binaria multivariado (tabla 5), considerando las variables potencialmente predictoras (variables independientes) que resultaron significativas como factores asociados en el análisis univariado. Ajustando el modelo de regresión logística con displasia broncopulmonar como variable de resultado (variable dependiente), los factores predictores independientes asociados al desarrollo de displasia broncopulmonar en neonatos menores de 34 semanas, fueron: neumotórax o enfisema intersticial pulmonar (OR=1,7; IC95% 1,3-9,1; p=0,039) y cuatro o más transfusiones de hematíes (OR=2,1; IC95% 1,6-8,1; p=0,025). No resultaron asociados en la regresión la FiO2 mayor de 35% por más de tres días, la enfermedad de membranas hialinas, la sepsis precoz, la persistencia del conducto arterioso, ni la hipertensión arterial sistémica inducida por el embarazo. El modelo clasifica correctamente al 83% de los casos. La R2 de Nagelkerke fue de 0,811, lo cual indica que el 81,1% de la variación observada en los prematuros con displasia broncopulmonar se explica por las variables incluidas en el modelo. La prueba de bondad de ajuste de Hosmer y Lemeshow mostró un valor p de 0,167, lo que permite definir un modelo útil con buena capacidad para predecir displasia broncopulmonar en neonatos menores de 34 semanas de gestación.
Análisis de regresión logística multivariado
| Variable | β | OR | IC95% | p |
|---|---|---|---|---|
| FiO2>35% más de tres días | –6,116 | 2,1 | 0,7–19,3 | 0,277 |
| Enfermedad de membranas hialinas | 2,247 | 1,9 | 0,9–11,2 | 0,175 |
| Sepsis precoz | 1,008 | 1,7 | 0,3–15,3 | 0,243 |
| Neumotórax y enfisema pulmonar intersticial | –1,337 | 1,7 | 1,3–9,1 | 0,039 |
| Persistencia del conducto arterioso | 1,195 | 2,0 | 0,6–14,6 | 0,012 |
| Cuatro o más transfusiones de hematíes | –1,942 | 2,1 | 1,6–8,1 | 0,025 |
| Hipertensión arterial inducida por el embarazo | –4,136 | 1,5 | 0,7–13,2 | 0,482 |
β: coeficiente β.
OR: odds ratio.
IC95%: intervalo de confianza del 95%.
El modelo clasifica correctamente al 83% de los casos.
Prueba de Hosmer y Lemeshow=0,167.
R2 de Nagelkerke=0,811.
La displasia broncopulmonar sigue siendo la secuela más frecuente relacionada con los recién nacidos prematuros y de muy bajo peso al nacer. A pesar de los avances en la prevención y los cuidados de la insuficiencia respiratoria asociada a la prematuridad, no ha ocurrido un descenso en su incidencia, aunque se ha observado en los últimos años un cambio en su expresión clínica y en su gravedad.
La prematuridad, el barotrauma o el volutrauma, las infecciones neonatales, persistencia del conducto arterioso y la toxicidad del oxígeno, se han considerado clásicamente como los principales factores de riesgo para el desarrollo de displasia broncopulmonar. Sin embargo, estos factores no explican por sí solos el desarrollo de displasia broncopulmonar en los recién nacidos que sólo muestran dificultad respiratoria leve o en los que precisan asistencia respiratoria mecánica con parámetros respiratorios bajos y por poco tiempo7.
En la serie estudiada, la tasa de mortalidad de recién nacidos prematuros con displasia broncopulmonar fue de 41,7%, similar a lo reportado en otros estudios8. La asociación de soporte respiratorio mecánico y displasia broncopulmonar está extensamente estudiada; es uno de los factores de riesgo para esta enfermedad más antiguos descritos en la literatura científica9. Recientemente, el concepto de barotrauma se ha relacionado con el excesivo volumen corriente o volutrauma, considerándose este el responsable último del daño pulmonar10. De acuerdo con la regresión logística, el neumotórax o el enfisema intersticial pulmonar se asociaron significativamente con el desarrollo de displasia broncopulmonar. Un aspecto que se debe tomar en cuenta, fueron los niveles de presión inspiratoria máxima (PIM) y presión positiva al final de la espiración (PEEP) máximos descritos, relacionados con la gravedad de las principales enfermedades, que podrían enmascarar una ‘sobredistensión’ pulmonar. Sin embargo, estos resultaron fueron similares en los grupos comparados; además, las estrategias de asistencia respiratoria mecánica empleadas se orientaron para evitar esta complicación, usándola con un volumen garantizado.
Uno de los avances en la prevención del barotrauma o el volutrauma, ha sido el tratamiento sustitutivo con surfactante sintético exógeno, al permitir una distribución homogénea de la presión de respiración en toda la superficie alveolar, evitando la ‘sobredistensión’ pulmonar, estabilizando la vía aérea y, consecuentemente, disminuyendo las presiones respiratorias y los escapes aéreos; esto coincide con los datos observados en esta serie, en la cual la administración de surfactante sintético se asoció con una menor proporción de displasia broncopulmonar11.
El número de transfusiones de hematíes también ha sido considerado como un factor importante de riesgo, que se asoció a displasia broncopulmonar en esta serie en la regresión; sin embargo, es muy probable que esta observación sea solo un marcador para la gravedad de la enfermedad. Los neonatos con displasia broncopulmonar presentaron mayor proporción de enfermedad de membrana hialina, sepsis precoz, neumotórax o enfisema intersticial pulmonar y persistencia del conducto arterioso, por lo que requirieron más sangre en la toma de muestra para análisis de laboratorio y, por tanto, presentaron mayor anemia iatrogénica12,13. Sin embargo, el aumento del volumen de sangre circulatoria por la transfusión, también podría aumentar el flujo pulmonar de sangre, incrementando el riesgo de displasia broncopulmonar. Otra posible explicación para el daño ocasionado por las transfusiones es el aumento en la carga de hierro libre, que cataliza la reacción entre el anión superóxido y el peróxido de hidrógeno, dando lugar a la formación de radicales libres de oxígeno, lo que podría resultar en displasia broncopulmonar14,15.
Un aspecto importante que se debe mencionar es que en múltiples estudios se ha demostrado que el tiempo de asistencia respiratoria mecánica, la corioamnionitis y el menor peso al nacer, se asocian con displasia broncopulmonar, y el uso prenatal de esteroides puede disminuir este riesgo16–18. Sin embargo, en contraste con estos resultados, se observó que dichos esteroides no afectaron la proporción de neonatos con displasia broncopulmonar en forma significativa, al igual que no lo hicieron los días de asistencia respiratoria mecánica, el menor peso al nacer, ni la corioamnionitis. Las razones podrían ser varias: un uso similar de protocolos de ventilación mecánica, promedio de peso semejante en ambos grupos o la intervención de factores no determinados en este estudio; además, las puntuaciones de la SNAP-PE II fueron similares, lo que podría interpretarse como que ambos grupos resultaron homogéneos en el nivel de gravedad de las enfermedades que presentaron. Por otro lado, los porcentajes de madres con corioamnionitis y de uso prenatal de esteroides, fueron iguales o mayores a la proporción de neonatos con displasia broncopulmonar en el grupo total, lo que puede introducir un sesgo en el análisis estadístico.
En cuanto a las limitaciones del estudio, es importante destacar que con los resultados obtenidos mediante un estudio de casos y controles, no es posible esclarecer los mecanismos exactos que explicarían la asociación entre transfusiones de hematíes o síndrome de fuga de aire con displasia broncopulmonar. Los aspectos que se deben tener en cuenta son: una muestra poblacional pequeña, falta de conocimiento sobre la fisiopatología exacta de la enfermedad, predisposición genética, estudios de reacción inmunitaria e inflamatoria, medición de la sobrecarga de líquidos, déficit de vitamina A, insuficiencia suprarrenal precoz y colonización bacteriana por Ureaplasma urealyticum.
ConclusiónLa displasia broncopulmonar continúa siendo una enfermedad crónica con alta mortalidad. El neumotórax o el enfisema pulmonar intersticial y más de cuatro transfusiones de hematíes, podrían constituir elementos predictores fiables para la displasia broncopulmonar en neonatos menores de 34 semanas de gestación.
El diagnosticar y corregir precozmente el síndrome de fuga de aire pulmonar y la optimización de las indicaciones de transfusión en neonatos prematuros, así como también, mejorar las estrategias de soporte respiratorio mecánico y utilizar oportunamente el surfactante sintético, podrían disminuir la mortalidad y la frecuencia de la displasia broncopulmonar en este grupo de pacientes.
La detección y el tratamiento adecuado y precoz de la hipertensión arterial sistémica inducida por el embarazo, las infecciones neonatales y la persistencia del conducto arterioso, puede disminuir algunos factores de riesgo de displasia broncopulmonar.
La mejor opción continúa siendo evitar la prematuridad.
Además de las medidas y estrategias conocidas para prevenir la displasia broncopulmonar (esteroides prenatales, N-CPAP –Nasal Continuous Positive Airway Pressure– y administración precoz de surfactante), se sugiere hacer investigaciones en las áreas asociadas con el desarrollo de la displasia broncopulmonar: reanimación de los recién nacidos prematuros, reducción del tiempo de asistencia respiratoria mecánica, estrategias alternativas de asistencia respiratoria, además del seguimiento y el tratamiento del estrés oxidativo durante la asistencia respiratoria mecánica.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.