El ictus isquémico infantil incluye tanto el ictus isquémico arterial como la trombosis de los senos venosos durales y se produce en Estados Unidos con una frecuencia anual de 2-3 por 100.000 niños1. Aunque el ictus infantil es raro, puede conducir a devastadoras consecuencias a largo plazo y, ocasionalmente, a la muerte. Un estudio prospectivo de cohorte sobre 163 niños que sobrevivieron a un ictus isquémico demostró que más del 40% tuvo un déficit neurológico moderado o intenso2. En los últimos años, la tasa de fatalidad se ha estimado entre el 10% y el 20%3-6.
Los estudios de grandes cohortes de niños con ictus han informado constantemente de varios factores de riesgo de ictus isquémico infantil. Consisten en drepanocitosis, lesiones estructurales cardíacas, enfermedad sistémica crónica, arteriopatía cerebral, trastornos de la coagulación, traumatismo craneal e infección subaguda por varicela zóster1,3,6-8.
Varios casos clínicos y una serie de casos de seis niños han sugerido la asociación entre la anemia ferropénica (AF) en los niños sanos y el ictus isquémico9-13. Un gran estudio de cohorte encontró anemia en el 24% de 115 niños anteriormente sanos con ictus isquémico arterial8. No se ha publicado con anterioridad la fortaleza y la magnitud de esta asociación.
La AF es un trastorno relativamente habitual en los países desarrollados, como Canadá, Reino Unido y Estados Unidos, y muestra un pico de prevalencia del 4% al 8% entre los 12 y 36 meses de edad14-16. Las consecuencias sanitarias de la AF consisten en retraso del desarrollo cognitivo y motor, que no puede mejorar con tratamiento marcial17,18.
El objetivo de este estudio fue investigar si la AF es un factor de riesgo de ictus isquémico infantil. Realizamos un estudio de casos y controles para comparar la prevalencia de la AF en niños pequeños por lo demás sanos en el momento del ictus con la prevalencia en niños sanos de la misma edad.
MÉTODOSEl grupo de toma de muestras del estudio estuvo formado por niños anteriormente sanos de 12 a 38 meses de edad, porque este grupo tiene una gran prevalencia de AF nutricional. Se utilizó un diseño de casos y controles, seleccionando tanto a los casos como a los controles de los sujetos incluidos prospectivamente en dos bases de datos.
Los casos fueron seleccionados del Canadian Pediatric Ischemic Stroke Registry. Los niños que acudieron al Hospital for Sick Children (HSC), Toronto, Canadá, entre enero de 1992 y diciembre de 2004, con un ictus arterial isquémico (IAI) o una trombosis de los senos venosos (SVT), fueron considerados respecto a la selección. El IAI fue definido como un déficit neurológico focal o un infarto arterial focal en un territorio vascular congruente con la presentación neurológica. La SVT fue definida como cefalea, alteración del grado de consciencia, convulsión o déficit neurológico focal con flebografía (TC o RM) que muestra oclusión o reducción focal del flujo en los senos venosos cerebrales o en las venas cerebrales. Para evaluar la selección para el estudio se realizó la revisión manual de los registros hospitalarios de cada sujeto que cumplió los criterios anteriores. Sólo fueron incluidos como casos los niños sin drepanocitosis, enfermedad sistémica crónica (excepto AF), neoplasia, arteriopatía cerebral, meningitis, encefalitis, traumatismo craneal, cirugía reciente o catéteres permanentes. Todos los sujetos incluidos en el Stroke Registry fueron estudiados respecto a los factores protrombóticos, lo que consistió en determinaciones de antitrombina, proteína C, proteína S y anticoagulante lúdico, así como determinaciones inmunológicas de los anticuerpos anticardiolipina y pruebas moleculares de la presencia de factor V de Leiden y la mutación G20210A en el gen de protrombina. No fueron excluidos los niños con cualquiera de estos factores identificados tras el ictus, ni los casos con infecciones agudas menores.
Los controles fueron seleccionados de una base de datos de niños incluidos prospectivamente en un estudio de observación de ferropenia19. Los niños fueron captados en una consulta pediátrica comunitaria universitaria de Toronto, Canadá, entre noviembre de 2002 y marzo de 2004, tras acudir a una visita de puericultura. Los criterios de exclusión fueron: enfermedad febril aguda a la inclusión (que puede aumentar falsamente la ferritina sérica, que fue la medida del resultado principal del estudio); antecedente de enfermedad o recepción de medicamentos asociada con la ferropenia o la anemia; diagnóstico anterior de ferropenia o anemia; empleo actual de suplementos de hierro; leche materna o fórmula como fuente principal de leche a la inclusión o durante las 8 semanas anteriores (que ofrecen mayor disponibilidad de hierro). Para el presente estudio se incluyó a los niños que se habían sometido a un análisis de sangre.
Se tomaron las siguientes variables, tanto en los casos como en los controles: edad, sexo, hemoglobina (Hb), volumen corpuscular medio (VCM), recuento plaquetario y ferritina sérica. Los parámetros hematológicos de los casos, obtenidos antes de la primera administración de líquidos o medicamentos intravenosos, en el HSC o en el hospital emisor del niño, se tomaron de los registros hospitalarios. Las variables de los controles se tomaron en el momento de la inclusión en el volumen de observación. La anemia ferropénica (AF) fue definida como una ferritina < 12 µg/l, un VCM < 73 fl y una Hb < 110 g/l20-23. La trombocitosis fue definida como un recuento de plaquetas > 450 µ 109/l24.
Las características basales de los dos grupos se compararon mediante la prueba de µ2 de Pearson y la prueba U de Mann-Whitney para el sexo y la edad, respectivamente. La Hb, el VCM y las plaquetas se compararon como variables continuas mediante la prueba U de Mann-Whitney. La asociación entre ictus y AF y trombocitosis se calculó mediante las proporciones de posibilidades (OR) y los intervalos de confianza del 95% (IC). La Hb, el VCM y las plaquetas se compararon como variables continuas mediante la prueba U de Mann-Whitney. La significación fue definida como un valor de p µ 0,05. Se utilizó la regresión logística binomial para examinar la interacción entre las variables. El análisis de datos se realizó mediante SPSS 13, SPSS Inc.
La recogida de datos del Stroke Registry y el estudio de la cohorte de la comunidad fueron aprobados por el Hospital for Sick Children Research Ethics Board y se obtuvo el consentimiento informado de los padres.
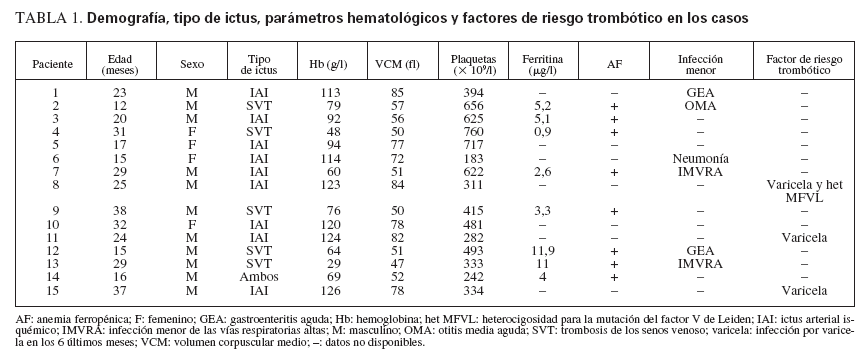
RESULTADOSCincuenta y seis niños previamente sanos, de 12 a 38 meses de edad, acudieron con ictus al HSC entre enero de 1992 y diciembre de 2004. Quince de estos niños (27%) gozaban de buena salud antes del ictus y fueron incluidos como casos (tabla 1). Las razones de exclusión fueron: cardiopatía (n = 15), meningitis (n = 5), neoplasia (n = 5), traumatismo craneal (n = 5), arteriopatía cerebral (n = 3), síndrome nefrótico (n = 2), mastoiditis (n = 2) y otras (n = 4). Se dispuso del valor inicial de Hb, VCM y plaquetas en todos los casos. Se dispuso de la ferritina sérica en todos los casos de Hb < 110 g/l y VCM < 73 fl.
TABLA 1. Demografía, tipo de ictus, parámetros hematológicos y factores de riesgo trombótico en los casos
Trescientos treinta y dos niños que acudieron a una visita de puericultura en la consulta comunitaria cumplieron todos los criterios de selección, de los que 143 tenían un análisis de sangre y fueron incluidos como controles. Faltaron los datos del recuento plaquetario de 10 pacientes de control.
No hubo diferencias significativas en la mediana de edad (24 frente a 21 meses) ni en el porcentaje de varones (73% frente a 65%) entre los casos y los controles. La media y la mediana de Hb fueron significativamente menores en los casos respecto a los controles, 88 y 92 g/l frente a 116 y 120 g/l, respectivamente (p < 0,01). La media y la mediana del VCM también fueron significativamente menores en los casos respecto a los controles, 65 y 57 fl frente a 76 y 77 fl, respectivamente (p < 0,01). La media y la mediana de las plaquetas fueron significativamente mayores en los casos respecto a los controles, 458 µ 109/l y 415 µ 109/l frente a 358 µ 109/l y 351 µ 109/l, respectivamente (p = 0,05). La AF fue significativamente más habitual entre los casos (8/15, 53%) que entre los controles (13/143, 9%) (OR 12, IC 95%: 4-37). La trombocitosis también fue más frecuente entre los casos (7/15, 47%) que entre los controles (21/133, 16%) (OR 5, IC 95%: 2-14). Tras aplicar la regresión logística para controlar respecto a las plaquetas, la asociación entre AF e ictus se mantuvo significativa (OR ajustada, IC 95%: 3-33). No hubo interacción estadísticamente significativa entre la AF y la trombocitosis.
Se observaron 3 casos con ictus con los factores protrombóticos de riesgo anteriormente descritos. Todos tenían infección subaguda por varicela, y uno de ellos también era heterocigoto respecto a la mutación del factor V de Leiden, y ninguno tenía AF. Seis casos con ictus mostraron una infección aguda menor (otitis media aguda, neumonía, gastroenteritis aguda, infección de las vías respiratorias altas), 4 con AF y 2 sin AF. Cinco casos con ictus y AF tuvieron SVT, dos IAI y uno ambos problemas. Los 7 casos con ictus sin AF tenían IAI (tabla 1).
DISCUSIÓNLos resultados de este estudio de casos y controles indican que los niños previamente sanos que desarrollan un ictus vasooclusivo tienen una probabilidad de mostrar una anemia ferropénica 10 veces mayor que la de los niños sanos que no desarrollan ictus. Además, los niños con AF abarcaron más de la mitad de los casos de ictus en los niños con una enfermedad médica subyacente, lo que señala a AF como significativo factor de riesgo de ictus en niños por lo demás sanos.
Cabe destacar que la SVT mostró una asociación más estrecha con la AF que con el IAI. Aunque una serie de casos, anteriormente mencionada, de seis niños con AF e ictus mostró iguales números de niños con IAI y con SVT13, nuestros datos pueden indicar que la AF es un factor de riesgo de SVT mayor que para IAI.
Se ha identificado la potencia y la magnitud de otros factores de riesgo de ictus. Como indica la bibliografía, son la resistencia a la proteína C activada (OR 9,4, IC 2-44,6), lipoproteína (a) elevada (OR 7,2, IC 3,8-13,8), anticuerpos antifosfolípidos (OR 6,08, IC 1,5-24,3), variante del gen de protrombina (OR 4,7, IC 1,4-14,6), mutación del factor V de Leiden (OR 4,3, IC 2,8-6,5), infección subaguda por varicela (OR estimada 3) y mutación MTHFR8,25,26 (OR 2,64, IC 1,53-4,5). La AF, con una OR de 10 (IC 95% 3-33) para el ictus, es un factor de riesgo al menos tan potente como los demás. Además, la AF fue más habitual que otros factores protrombóticos de riesgo en esta población de niños con ictus (8/15, 53% frente a 3/15, 20%). No pudimos valorar si la AF es un factor de riesgo independiente o aditivo.
Se han sugerido 3 mecanismos para explicar la asociación entre AF e ictus isquémico infantil: un estado de hipercoagulación relacionado directamente con la deficiencia de hierro, la anemia, o ambas, la trombocitosis secundaria a la AF y la anemia hipóxica, en la que la disparidad entre el abastecimiento de oxígeno y la demanda de oxígeno en la arteria terminal conduce a isquemia e infarto13. Nuestros datos apoyan una asociación entre la trombocitosis y el ictus. Los niños sanos que desarrollan ictus pueden tener una probabilidad de padecer trombocitosis 5 veces mayor que los niños que no desarrollan ictus. Sin embargo, no se encontró una interacción estadísticamente significativa entre AF y trombocitosis. La AF parece ser un factor independiente de riesgo de ictus.
Este estudio tiene varias limitaciones. Puede haber diferencias, distintas al ictus, entre los casos y los controles. En primer lugar, los niños fueron excluidos como controles si tenían antecedente de ingestión de leche materna o de fórmula en las 8 semanas anteriores o una enfermedad febril aguda, pero estas razones no los excluyeron como casos. La leche materna y la fórmula enriquecida en hierro se consideran protectoras frente a la AF, y la enfermedad febril puede aumentar falsamente la ferritina sérica. Así pues, es más probable que estos sesgos llevasen a una infravaloración de la magnitud de la asociación entre AF e ictus. Los datos sobre las prácticas de nutrición de los casos no fueron disponibles, y no pudimos explorar los mecanismos causales para el desarrollo de la AF. En segundo lugar, dada la rareza del ictus isquémico infantil, la ventana temporal para la inclusión de casos fue obligatoriamente más prolongada que para la inclusión de controles (enero de 1992 a diciembre de 2004 frente a noviembre de 2002 a marzo de 2004). Un cambio de la frecuencia de AF entre 1992 y 2002 podría haber introducido un sesgo. Sin embargo, creemos que no es probable, ya que la tasa publicada de ferropenia y AF en los preescolares de Canadá y Estados Unidos no ha cambiado apreciablemente durante este intervalo14,20,27. Finalmente, los resultados de este estudio pertenecen, como mucho, a los niños del intervalo de edad explorado, es decir, 12 a 38 meses, y este estudio no pudo determinar la proporción de niños jóvenes con AF en riesgo de ictus.
CONCLUSIONESAunque la AF se considera una enfermedad indolente con consecuencias insidiosas a largo plazo, puede aumentar 10 veces el riesgo de ictus agudo en los preescolares sanos y abarcar la mitad de los ictus en los niños por lo demás sanos de este intervalo de edad. Esta investigación apoya el nuevo desarrollo de estrategias dirigidas a la prevención primaria y a la detección temprana de la AF en los niños pequeños.
AGRADECIMIENTOSEste estudio fue financiado por una beca de ayuda de Danone Institute of Canada (cohorte comunitaria) y becas de la Heart and Stroke Foundation of Ontario y la Bloorview Children’s Hospital Foundation (registro de ictus). El Pediatric Outcomes Research Team está financiado por una beca de la Hospital for Sick Children Foundation. La Dra. deVeber ha recibido el Stroke Investigador Award de la Heart and Stroke Foundation de Ontario. Los organismos de financiación no han participado en el diseño ni la realización del estudio, la recogida, el manejo, el análisis y la interpretación de los datos, ni la preparación, revisión o aprobación del manuscrito.
Damos las gracias a Trenna Sutcliffe MD, Sheila Jacobson MD, Michael Peer, MD, y Shelley Westergard, RN, por la inclusión de los sujetos de control.
Correspondencia: Patricia C. Parkin, MD, Division of Pediatric Medicine and the Pediatrics Outcomes Research Team, Hospital for Sick Children, 555 University Ave, Toronto, Ontario, Canadá M5G 1X8.
Correo electrónico: patricia.parkin@sickkids.ca