La vitamina D es una prohormona esencial para la normal absorción del calcio en el intestino, y su deficiencia se asocia con raquitismo en los niños en crecimiento y con osteomalacia en los adultos. El raquitismo consiste en la falta de mineralización del hueso y el cartílago en crecimiento. Las primeras descripciones del raquitismo se deben a los ingleses Daniel Whistler y Francis Glisson, ya en el siglo XVII. Con la industrialización de principios del siglo XX, esta enfermedad se hizo endémica hasta que se descubrió que tanto la exposición a la luz solar como la ingestión de aceite de hígado de bacalao podían prevenir y tratar el raquitismo1,2. Una vez identificada la vitamina D y desarrollados métodos sencillos para suplementar a los alimentos, el raquitismo nutricional prácticamente desapareció de los países industrializados1-3 Sin embargo, en las últimas décadas ha reaparecido el raquitismo por deficiencia de vitamina D a causa de numerosos factores, que analizaremos durante esta revisión. Los lactantes de piel oscura con lactancia materna exclusiva e hijos de madre con deficiencia de vitamina D durante el embarazo parecen correr un riesgo especialmente elevado. Sin embargo, también se informa del raquitismo en los niños mayores. En Estados Unidos y Reino Unido no existen estimaciones actuales precisas de la prevalencia de raquitismo por deficiencia de vitamina D. Ello se debe a que las publicaciones recientes son principalmente casos clínicos o series de casos obtenidas a partir de los registros de ingreso hospitalario. Las dos series de mayor tamaño informan de 126 casos durante un período de diez años en Australia4 y de 104 casos durante dos años en Canadá5. Los casos notificados y publicados de raquitismo nutricional en Estados Unidos aumentaron desde 65 casos en 1975-1985 a 166 casos en 1986-20036. Desde entonces, tres informes añadieron 62 casos a la bibliografía estadounidense7- 9. También debemos reconocer que, en otras partes del mundo, el raquitismo sigue siendo un problema de salud pública10-13. En 2003, la American Academy of Pediatrics (AAP) recomendó el suplemento de vitamina D a: 1) los lactantes con lactancia materna que no consuman al menos 500 ml de una fórmula/bebida reforzada en vitamina D14 y 2) los lactantes sin lactancia materna que no consuman > 500 ml de bebidas reforzadas en vitamina D. El suplemento se debe instaurar durante los dos primeros meses de vida y mantenerse durante la infancia y la adolescencia. La razón de esta cronología es que los depósitos de vitamina D en el neonato, que se obtienen mediante el paso transplacentario desde la madre con buena cantidad de vitamina D, deben durar durante al menos ocho semanas después del parto, ya que la semivida de la 25(OH)-vitamina D (25(OH)-D) sérica es de unas dos a tres semanas15. En el recién nacido a término hijo de una madre con buena cantidad de vitamina D, el abastecimiento de vitamina D puede durar incluso más (8-12 semanas) dado el depósito de vitamina D en la grasa. En Estados Unidos, todas las fórmulas infantiles están obligadas a contener 40-100 UI de vitamina D/ 100 kcal de fórmula (258-666 UI de vitamina D/l de una fórmula de 70 kcal/100 ml14,16) y, en realidad, todas contienen al menos 400 UI de vitamina D/l17. Así, la ingestión diaria de al menos 500 ml de fórmula reforzada en vitamina D garantizaría la ingestión mínima diaria exigida de vitamina D, 200 UI/día. Sin embargo, pese a las actuales pautas de suplementación con vitamina D, persisten las notificaciones de raquitismo. Es importante recordar que la vitamina D se elabora principalmente en la piel tras la exposición a la radiación ultravioleta (RUV), y que menos del 10% deriva de orígenes dietéticos18. Las modernas condiciones de vestido, estilo de vida y las recomendaciones respecto a la evitación del sol para disminuir los riesgos del cáncer de piel pueden impedir que una gran proporción de la población elabore cantidades saludables de esta vitamina. Durante las dos últimas décadas, nuestro conocimiento de la síntesis de vitamina D y sus funciones ha aumentado mucho. Este mayor conocimiento y los muchos informes de raquitismo por deficiencia de vitamina D nos obligan a replantear los conceptos tradicionales y las recomendaciones actuales del suplemento con vitamina D y la exposición al sol, y a desarrollar estrategias de tratamiento revisadas. Esta revisión analiza las causas de la deficiencia de vitamina D, especialmente en relación con los protectores solares naturales y artificiales y el estado materno en vitamina D, y el actual conocimiento acerca de la prevención y el tratamiento de la deficiencia de vitamina D.
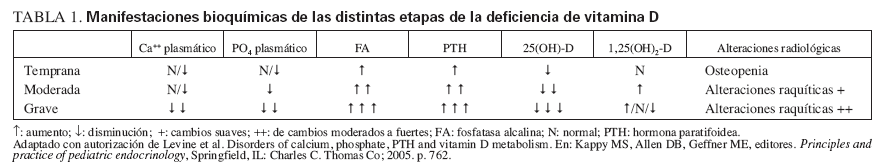
EFECTO DE LA DEFICIENCIA DE VITAMINA DMetabolismo del calcio y del fósforo y el huesoEn un estado suficiente en vitamina D (valores de 25(OH)-D > 50 nmol/l [20 ng/ml]), la absorción intestinal neta de calcio alcanza el 30%, aunque la absorción de calcio puede llegar al 60-80% durante los períodos de crecimiento activo. En un estado de deficiencia en vitamina D, la absorción intestinal de calcio es de sólo el 10-15%, y disminuye la reabsorción máxima total de fosfato. En condiciones de deficiencia de vitamina D19, los valores de calcio ionizado estimulan la secreción de hormona paratifoidea (PTH), lo que 1) aumenta la reabsorción de calcio en los túbulos renales y 2) aumenta la actividad de la 1- alpha;-hidroxilasa, lo que incrementa la síntesis de 1,25-dihidroxivitamina D (1,25(OH)2-D). El aumento de PTH también provoca pérdida de fósforo por la orina. Los menores valores de fósforo (y también de calcio), y la disminución del producto calcio*fósforo provoca la disminución de la mineralización ósea. Además, los bajos valores de fósforo hacen fracasar la esperada apoptosis de los condrocitos hipertrofiados, con “hinchazón†y desorganización de la placa de crecimiento. El fracaso, o el retraso, de la calcificación de la osteoide conducen a la osteomalacia en los huesos maduros. La osteomalacia en los huesos inmaduros se denomina raquitismo. La expresión raquitismo también describe la anormal organización de la placa cartilaginosa de crecimiento y la consiguiente alteración de la mineralización del cartílago. La presentación clínica del raquitismo por deficiencia de vitamina D incluye los síntomas y signos de deformidad ósea, dolor, o ambos, y puede estar asociada con hipocalcemia y rasgos clínicos asociados20. La enfermedad se puede dividir en tres etapas (tabla 1).
TABLA 1. Manifestaciones bioquímicas de las distintas etapas de la deficiencia de vitamina D
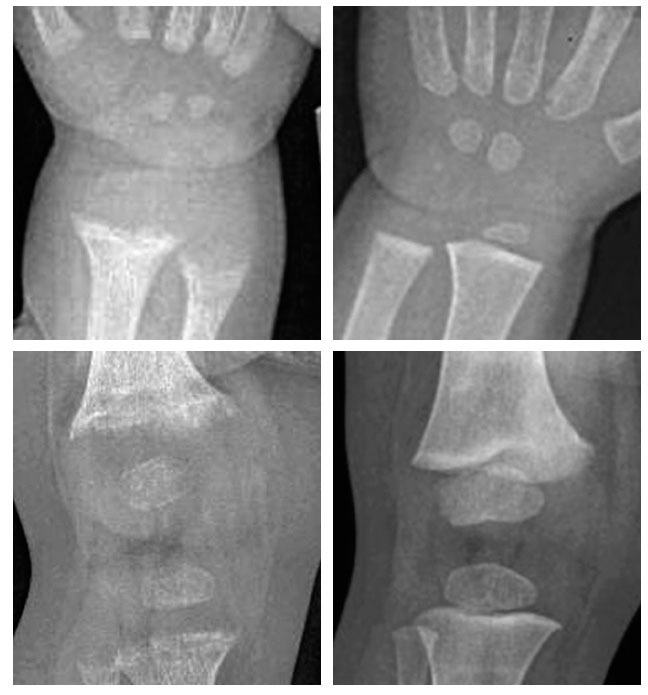
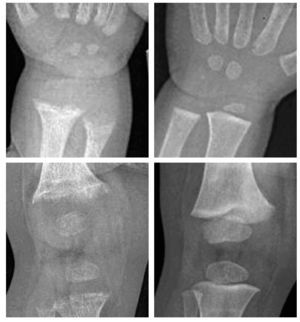
La primera etapa se caracteriza por osteopenia e hipocalcemia subclínica o evidente (por lo general muy transitoria y, por ello, no documentada), que se sigue en la segunda etapa por valores crecientes de PTH. Los aumentos de PTH provocan la movilización del calcio del hueso y la corrección de la hipocalcemia. La matriz de colágeno desmineralizada es propensa a la hidratación y la tumefacción, lo que causa que la cobertura perióstica se expanda hacia fuera, y provoque dolor óseo mediado por las fibras sensoriales periósticas del dolor. En la última etapa, las alteraciones óseas se hacen más intensas y la hipocalcemia vuelve a ser evidente. Los síntomas de raquitismo pueden oscilar de ninguno a grados variables de irritabilidad, retraso del desarrollo motor grosero y dolor óseo. Los signos incluyen el ensanchamiento de las muñecas y los tobillos, el genu varo o valgo, la prominencia de las uniones condrocostales (rosario raquítico), el retraso del cierre de las fontanelas, la craneotabes y el abombamiento frontal. La erupción dentaria puede ser tardía, y el esmalte puede ser de mala calidad, la deficiencia de vitamina D se produce in utero o al principio de la lactancia, lo que aumenta el riesgo de caries. El raquitismo también puede asociarse con un mal crecimiento (manifestación de la enfermedad ósea asociada) y una mayor susceptibilidad a las infecciones. La deficiencia de vitamina D que se presenta como convulsiones hipocalcémicas o tetania se notifica con mayor frecuencia en la lactancia y la adolescencia que en la infancia. En estos períodos de mayor velocidad de crecimiento, la mayor demanda de calcio no puede cubrirse de forma adecuada, y el paciente puede presentar una hipocalcemia incluso antes de la aparición de desmineralización ósea o de signos radiológicos de raquitismo21,22. Durante la infancia, las menores demandas metabólicas permiten que el organismo evite la hipocalcemia sintomática recurriendo a los depósitos óseos de calcio secundarios al hiperparatiroidismo en la segunda etapa de la enfermedad. No obstante, se produce a expensas de vaciar de calcio al hueso, provocando signos de desmineralización y posterior deformidad ósea22. Los niños hipocalcémicos con deficiencia de vitamina D pueden presentar rasgos clínicos asociados con la propia hipocalcemia, como episodios de apnea, estridor o sibilancias, hipotonía, debilidad muscular e hiperreflexia. La intensa deficiencia de vitamina D también puede estar asociada con una miocardiopatía relacionada con la hipocalcemia, que se normaliza con el tratamiento23. El diagnóstico de raquitismo depende de la presencia de los rasgos clínicos antes mencionados y de aspectos radiológicos y de laboratorio. Las imágenes radiológicas pueden indicar osteopenia y adelgazamiento cortical de los huesos largos, fracturas de estrés y ensanchamiento y desflecado metafisario. El signo más temprano suele ser la osteopenia, seguida del ensanchamiento de la placa de crecimiento por la proliferación de cartílago y osteoide no calcificados, seguidos del ensanchamiento, la separación, el acopamiento y el desflecado metafisario (fig. 1). Se observa un basto patrón trabecular de la metáfisis. La alteración raquítica más temprana es la pérdida de separación entre la metáfisis y la placa de crecimiento, así como la pérdida de la zona provisional de calcificación20. Se ha desarrollado un índice radiológico de diez puntos como ayuda para valorar la gravedad del raquitismo, basado en los hallazgos en la rodilla y la muñeca24 (tabla 2). Los hallazgos de laboratorio consisten en hipofosfatemia, grados variables de hipocalcemia, aumento de las fosfatasas alcalinas y aumento de los valores de PTH. Los bajos valores de 25(OH)-D confirman el diagnóstico, pero pueden no ser necesarios cuando los demás hallazgos clínicos, radiológicos y de laboratorio son inequívocos. Los valores de 1,25(OH)2- D pueden aumentar conforme se elevan los valores de PTH con incremento concomitante de la actividad de la 1- alpha;-hidroxilasa. La tabla 1 resume los hallazgos de laboratorio en las tres etapas del raquitismo por deficiencia de vitamina D25.
TABLA 2. Aspectos radiológicos del raquitismo (en un sistema de valoración de 10 puntos)
Fig. 1. Raquitismo por deficiencia de vitamina D a la presentación (arriba) y tres meses después del tratamiento con vitamina D y calcio (abajo) en un niño de raza negra de un año de edad. A la presentación, las radiografías de la muñeca (izquierda) y la rodilla (derecha) mostraron separación, acopamiento desflecado y desmineralización de las metáfisis distales del cúbito y el radio, la metáfisis distal del fémur y las proximales de la tibia y el peroné. Después del tratamiento, el niño mostró la resolución casi completa del desflecado metafisario con desarrollo de una densa zona provisional de calcificación en la metáfisis, compatible con la curación del raquitismo.
Efectos extraesqueléticos de la vitamina DEl receptor de vitamina D se encuentra en el intestino delgado, el colon, los osteoblastos, los linfocitos T y B activados, las células beta de los islotes y la mayoría de los órganos del cuerpo, como el cerebro, el corazón, la piel, las gónadas, la próstata, la mama y las células mononucleares. Los estudios epidemiológicos de las dos últimas décadas han sugerido importantes efectos de la vitamina D sobre el sistema inmunitario y en la prevención de determinados cánceres, que se resumen a continuación. Aunque estos hallazgos han generado un gran interés, es necesario tener en cuenta la posibilidad de la existencia de variables de confusión. Vale la pena destacar que el riesgo ajustado atribuible calculado mediante los modelos multivariados sigue siendo considerable para muchos cánceres en condiciones de deficiencia de vitamina D26. Se aguarda a estudios prospectivos a largo plazo que examinen los efectos del suplemento con vitamina D en la prevención de las alteraciones de la inmunidad y los cánceres mediados por ella y puedan estar relacionados con la deficiencia de vitamina D.
PielLos queratinocitos expresan el receptor de la vitamina D, y cuando estas células se exponen a la vitamina D, se inhibe el crecimiento y son estimuladas para su diferenciación27. Esto ha conducido al empleo de análogos tópicos de la vitamina D para tratar la psoriasis28.
Efectos inmunitariosLa vitamina D modula la función de los linfocitos B y T29,30. Hay pruebas epidemiológicas de la asociación de la deficiencia de vitamina D con las enfermedades autoinmunes, como la diabetes de tipo I y la esclerosis múltiple31,32. Se dice que los niños de un año de edad deficientes en vitamina D tienen un riesgo de desarrollar diabetes de tipo I cuatro veces mayor que los niños suficientes en vitamina D33. Además, el riesgo de esclerosis múltiple de las personas que viven en una latitud superior a los 35 grados es mayor que el de los que viven en una latitud menor34, y se ha publicado una relación inversa entre las concentraciones de vitamina D y el riesgo de esclerosis múltiple35. Los datos indican que los estados suficientes en vitamina D en la madre y el recién nacido pueden proteger contra la diabetes de tipo I36 y la esclerosis múltiple37. También se han demostrado los efectos protectores del suplemento con vitamina D contra la artritis reumatoide38 y la enteropatía inflamatoria39.
CáncerLas concentraciones de vitamina D > 75 nmol/l (30 ng/ml) mantienen controlado el crecimiento celular e impiden que las células se independicen y desarrollen un cáncer no regulado40-42, y la deficiencia de vitamina D se ha relacionado con el cáncer de mama, de próstata y de colon43-48.
Alteraciones psiquiátricasLos valores adecuados de vitamina D en el embarazo se asocian con un menor riesgo de esquizofrenia49 y, a la inversa, niveles bajos de exposición solar se asocian con un trastorno afectivo estacional50 y alteraciones del estado de ánimo51. Sin embargo, no está claro si lo relacionado con estas últimas alteraciones es la disminución de la exposición al sol o la deficiencia de vitamina D. Se cree que los estados suficientes en vitamina D en la madre y el lactante están asociados con un menor riesgo de trastorno bipolar52. La escasa vitamina D materna puede ejercer un impacto sobre la maduración del cerebro fetal, dado que la vitamina D también interviene en el desarrollo y el funcionamiento del sistema nervioso53.
FUENTES DE VITAMINA DLa mayor parte de la vitamina D se sintetiza a partir de la exposición de la piel a la radiación ultravioleta B (UVB).
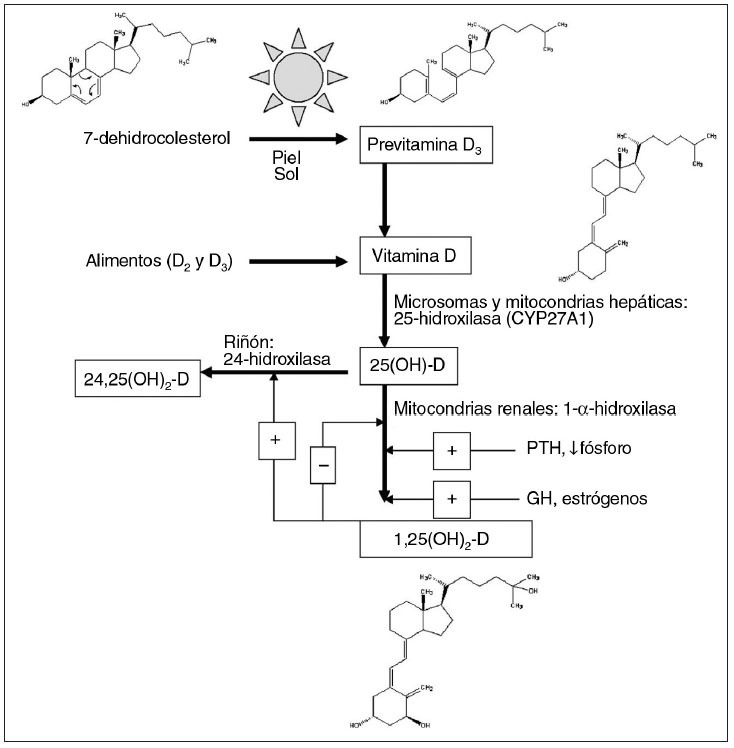
Síntesis cutánea de la vitamina DLa síntesis de vitamina D por la piel es la principal fuente de esta prohormona para la mayoría de las personas. La vitamina D2 (ergocalciferol) es un derivado vegetal, mientras que los animales sintetizan la vitamina D3 (colecalciferol). La figura 2 muestra el proceso de la síntesis de la vitamina D. El 7-dehidrocolesterol (provitamina D) es una estructura relativamente rígida de cuatro anillos presente en la bicapa lipídica de la membrana plasmática de los queratinocitos epidérmicos y de los fibroblastos dérmicos54. Las máximas concentraciones de 7-dehidrocolesterol se encuentran en el estrato basal y el espinoso de la epidermis, por lo que estas capas tienen la máxima capacidad de sintetizar la previtamina D55. La exposición a los UVB de una longitud de onda entre 290 y 315 nm inicia la síntesis de la vitamina D mediante la redisposición de los dobles enlaces del anillo B de la provitamina D, lo que provoca la abertura del anillo B, convirtiéndose en la menos rígida previtamina D. La previtamina D se isomeriza a vitamina D y se transfiere al espacio extracelular y a los capilares dérmicos, donde se une a la proteína de fijación de la vitamina D (PFVD). Esta unión garantiza la eficaz conversión de la previtamina D a vitamina D al desviar el equilibrio hacia la vitamina D. El complejo de PFVD con vitamina D se transporta al hígado para su 25-hidroxilación a 25(OH)-D (calcidiol). Aunque 25(OH)-D es de 2 a 5 veces más potente que la vitamina D, no es biológicamente activa a concentraciones fisiológicas. La 25(OH)-D se libera a la circulación y se transporta al riñón unida a la PFVD para su 1- alpha;-hidroxilación a 1,25-dihidroxivitamina D (1,25(OH)2-D), y la 24-hidroxilación a 24,25-dihidroxivitamina D56 (24,25(OH)2-D). 1,25(OH)2-D (calcitriol) es la forma activa de la vitamina D, mientras que la 24,25(OH)2-D tiene una actividad fisiológica limitada o nula.
Fig. 2. Síntesis y procesamiento de la vitamina D (adaptado con autorización de Levine et al. Disorders of calcium, phosphate, PTH and vitamin D metabolism. En: Kappy MS, Allen DB, Geffner ME, editores. Principles and practice of pediatric endocrinology. Springfield, IL: Charles C. Thomas Co; 2005: p. 716, 719). PTH: hormona paratifoidea.
Los receptores nucleares de 1,25(OH)2-D se encuentran en más de 30 tejidos. Aunque se han identificado proteínas específicas de unión intracelular a 24,25(OH)2-D en el tejido óseo y cartilaginoso cicatricial en los asientos de fracturas, todavía no se ha demostrado un papel en la curación de las fracturas57. Los estudios indican que la 1- alpha;-hidroxilación también puede ocurrir en lugares distintos al riñón, como los macrófagos alveolares y los queratinocitos, lo que sugiere un papel autocrino-paracrino de 1,25(OH)2-D. La melanina epidérmica es un protector solar natural que regula el color de la piel, y se sintetiza a partir de la tirosina por la enzima tirosinasa. Tras la exposición a la radiación UVB, los gránulos de melanina se transfieren de los melanocitos de la epidermis a las células epidérmicas adyacentes, que emigran a la superficie celular produciendo el oscurecimiento de la piel. La migración de una célula desde el estrato basal a la capa córnea dura unas dos semanas, y la descamación de las células de la capa córnea otras dos semanas. La concentración de melanina en la piel regula la cantidad de UVB que penetra hasta alcanzar las capas epidérmicas con la máxima concentración de 7-dehidrocolesterol, es decir, el estrato basal y el espinoso55. Por lo tanto, la melanina 1) protege contra el riesgo de cáncer de piel inducido por la excesiva exposición a la radiación ultravioleta (RUV) y 2) también evita la fotolisis del folato inducida por la RUV, metabolito necesario para el normal desarrollo del tubo neural embrionario y la espermatogénesis. Así pues, confiere una ventaja evolutiva a las personas de piel oscura que viven en áreas con una excesiva exposición solar58. Sin embargo, una elevada concentración de melanina puede causar una disminución de la síntesis de vitamina D al impedir que UVB alcance el estrato basal y el espinoso de la epidermis, riesgo que se manifiesta en situaciones de exposición inadecuada a la luz solar. Vale la pena destacar que, en todas las poblaciones, las mujeres tienen la piel más clara que los varones, presumiblemente para abastecer el aumento de las necesidades de vitamina D y de calcio durante el embarazo y la lactancia59. La exposición de la piel a la RUV se mide por la dosis eritematosa mínima (DEM), que es la cantidad de exposición a la RUV que provocará un eritema mínimo (ligeramente sonrosado) de la piel. La cantidad de exposición a la RUV equivalente a una DEM depende de la pigmentación de la piel, y la duración de la exposició es un factor de la DEM. Se estima que la exposición de todo el cuerpo a una DEM produce la liberación de 10.000 a 20.000 UI de vitamina D a la circulación en 24 h60,61 (revisado en 56). La exposición del 40% del cuerpo a un cuarto de la DEM resultará en la generación de Ëœ 1.000 UI de vitamina D/día, la cantidad mínima de síntesis de vitamina D necesaria para mantener las concentraciones en la gama normal56. Los UVB (290-315 nm) tienen una longitud de onda menor que los UVA (320-400 nm), y son propensos a la dispersión con los rayos oblicuos del inicio o el final del día, por lo que a estas horas se produce poca vitamina D en la piel, incluso en los meses de verano62. Al mediodía solar (cuando el sol está en su cenit), la proporción de luz UVB a UVA es la máxima, y el único momento en que el número de fotones UVB que alcanzan la superficie terrestre es suficiente para producir vitamina D en la piel es entre las 10 de la mañana y las 3 de la tarde en primavera, verano y otoño. Por ello es importante la segura exposición al sol a estas horas. En el sur de Estados Unidos, el tiempo de exposición para conseguir 1 DEM al mediodía solar en los meses de verano es de 4-10 min para la piel clara y de 60-80 min para la piel oscura56. Vale la pena destacar que los niños, y especialmente los lactantes, pueden necesitar una menor exposición solar para producir cantidades suficientes de vitamina D por la mayor área superficial respecto al tamaño y la mayor capacidad de producir vitamina D que las personas mayores63. En 1985, Specker et al informaron que 30 min semanales de exposición solar de lactantes en pañales, y dos horas semanales de exposición solar de lactantes totalmente vestidos, sin gorro, mantenían unos valores de vitamina D > 27,5 nmol/l (11 ng/ml) en Cincinnati, Ohio64. Sin embargo, en los lactantes y niños, la duración de la exposición a la RUV necesaria para mantener los valores de vitamina D > 50 nmol/l (20 ng/ml), el valor actualmente aceptado como suficiencia en vitamina D para los niños, especialmente en relación con el momento del día, la estación o la pigmentación cutánea queda por determinar. Los efectos de los filtros solares naturales, como la pigmentación de la piel, y los factores geográficos, como la latitud, la estación, el momento del día, la sombra y la contaminación atmosférica, sobre la síntesis cutánea de vitamina D se describirán con mayor detalle en las causas del raquitismo, igual que los efectos de los protectores solares artificiales, como la vestimenta y los filtros solares. Se debe señalar que la excesiva exposición a la luz solar no aumenta la producción de vitamina D. Antes bien, la previtamina D se degrada a productos inertes, como lumisterol-3 y taquisterol-3, la vitamina D3 se fotoisomeriza a suprasterol y otros productos inertes, sin efectos sobre el metabolismo del calcio. La acumulación de previtamina D3 se limita al 10-15% de las concentraciones originales de 7-dehidrocolesterol a causa de esta fotoisomerización durante la prolongada exposición solar. La desventaja de la exposición a la RUV para la generación de vitamina D es la inducción de determinados cánceres y otras alteraciones de la salud. El riesgo de cáncer de piel aumenta con la excesiva exposición al sol65-69, y la American Academy of Pediatrics recomienda que los niños menores de seis meses de edad no sean expuestos a la luz solar directa para disminuir los riesgos de cáncer de piel70. Es importante indicar que el melanoma maligno y el carcinoma basocelular de la piel tienen más probabilidades de producirse tras una exposición excesiva a los UVA, respecto a los UVB71-73. Por lo tanto, al contrario que la creencia general, es menos probable que la exposición al sol de mediodía cause estos cánceres de piel que una exposición similar al sol antes o después de ese período. A la inversa, la queratosis actínica y el carcinoma espinocelular están relacionados con la exposición de por vida a UVB. La protección de los filtros solares contra UVB es mayor que contra UVA, por lo que protegen más contra las últimas alteraciones cutáneas que contra las primeras74. La exposición crónica al sol también daña la estructura elástica de la piel, aumentando el riesgo de aparición de arrugas75. De la carga total de la enfermedad, el 0,1% es atribuible a la muerte y la discapacidad por el cáncer de piel, las cataratas, los cánceres y pterigios oculares, la quemadura solar y la reactivación de las infecciones virales inducidos por la RUV76, y provoca una carga económica de 5.000- 7.000 millones de dólares anuales. No obstante, la carga económica de la deficiencia de vitamina D se estima en unos 40.000-53.000 millones de dólares anuales en Estados Unidos77. En ello se incluye la carga de enfermedad por el raquitismo y la osteomalacia, las deformidades asociadas, las fracturas óseas, la debilidad muscular y la neumonía, así como la esclerosis múltiple y los cánceres comunes asociados epidemiológicamente con la deficiencia de vitamina D, como el cáncer de próstata, de colon y de mama76. Un trabajo estima que de 50.000 a 70.000 ciudadanos estadounidenses mueren de forma prematura cada año por un cáncer relacionado con la insuficiencia en vitamina D77. Los costes económicos relacionados con la deficiencia de vitamina D en todo el mundo pueden ser, por lo tanto, fenomenales. Los bien conocidos riesgos de la RUV deben sopesarse contra muchos posibles beneficios.
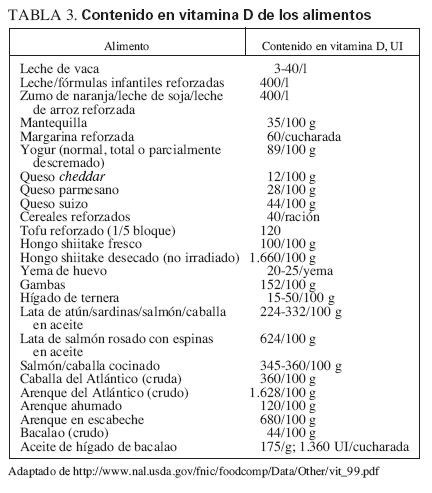
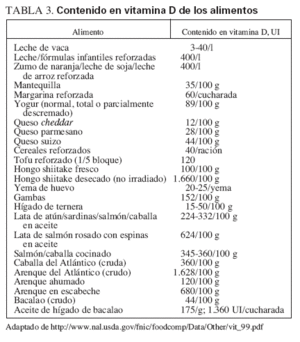
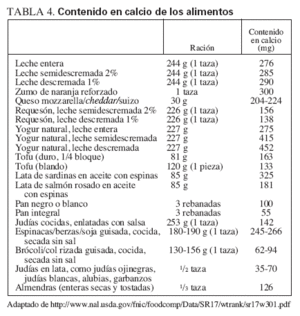
Fuentes dietéticas de la vitamina DFuentes naturalesIncluyen el pescado graso, como el salmón, la caballa y las sardinas, el aceite de hígado de bacalao, el hígado y las vísceras (que, sin embargo, tienen un gran contenido en colesterol) y la yema de huevo (que tiene una cantidad variable de vitamina D). Cabe destacar que el método utilizado para cocinar los alimentos puede ejercer unos importantes efectos sobre su contenido en vitamina D. Por ejemplo, freír el pescado disminuye el contenido activo en vitamina D en cerca del 50%, mientras que asarlo no modifica el contenido en vitamina D del pescado. Además, respecto al pescado, el de piscifactoría puede tener mayor contenido en vitamina D que el crecido en libertad. La tabla 3 describe la cantidad de vitamina D de distintos alimentos. Además, la tabla 4 muestra las fuentes dietéticas de calcio. Por desgracia, los niños no suelen consumir las fuentes más naturales (no reforzadas) de vitamina D, por lo que el refuerzo de los alimentos con vitamina D se hace importante si existe una exposición solar inadecuada.
TABLA 3. Contenido en vitamina D de los alimentos
Vitamina D en la leche maternaAunque la leche materna constituye la mejor nutrición para el neonato a término, el contenido en vitamina D de la leche materna no es suficiente para cubrir la ingestión recomendada de vitamina D. El contenido en vitamina D de la leche materna promedia alpha; 22 UI/l (límites, 15 a 50 UI/l) en una madre suficiente en vitamina D78. Suponiendo un consumo medio de 750 ml/día79, la lactancia materna exclusiva sin exposición al sol ofrecería sólo 11-38 UI de vitamina D/día, cantidad muy inferior a la ingestión mínima recomendada de 200 UI/día14.
Alimentos reforzados en vitamina DLas prácticas de refuerzo de los alimentos varían en todo el mundo. Las fórmulas infantiles estadounidenses están obligadas a contener 40-100 UI de vitamina D/ 100 kcal porque este contenido en vitamina D sería suficiente para cubrir la ingestión diaria recomendada de vitamina D en la mayoría de los lactantes80. En Canadá, es obligatorio el refuerzo en vitamina D de determinados alimentos, como la leche y la margarina. Sin embargo, en Estados Unidos, el refuerzo de los alimentos en vitamina D no suele ser obligatorio, pero es necesario si la etiqueta indica que el alimento está reforzado. Por lo tanto, mientras que Canadá exige que toda la leche sea reforzada en vitamina D, en Estados Unidos sólo es obligatorio que contenga vitamina D la leche con la etiqueta “reforzado en vitamina Dâ€. Respecto a la leche y al zumo de naranja, el contenido en vitamina D tras el refuerzo debería consistir en 400 UI/l. Por desgracia, 1) la leche no tiene un consumo uniforme en Estados Unidos, 2) dado el actual, y oportuno, énfasis en la lactancia materna, no se consume de manera uniforme las fórmulas infantiles y 3) el impulso para disminuir el consumo de zumos como medida contra la creciente prevalencia de obesidad significa que el zumo de naranja no se consume de manera tan uniforme como antes. Por lo tanto, el refuerzo de la leche y el zumo de naranja no implica necesariamente el adecuado suplemento de vitamina D para la población en su conjunto. Calvo et al revisaron el refuerzo de los alimentos con vitamina D en Estados Unidos y demostraron que muchos artículos alimenticios, incluyendo muchos productos lácteos conocidos por su refuerzo en vitamina D, en realidad no están reforzados81. Otras circunstancias que aumentan la variabilidad del contenido en vitamina D de los alimentos son: 1) la variación natural de la vitamina D según la estación y las condiciones atmosféricas, 2) el estado del flujo de refuerzo de los alimentos en el mercado y 3) las variaciones de los procedimientos aplicados para reforzar la leche82 (condiciones de almacenamiento para la preparación de la vitamina, método aplicado para añadir la vitamina D a la leche, momento del proceso en que se añade la vitamina D). Las revisiones del cumplimiento de diversos productos lácteos sujetos a la normativa de refuerzo en vitamina D en Estados Unidos indican que muchas muestras no la cumplen, principalmente por no alcanzar el valor del refuerzo24,82-84. En Europa, la margarina y algunos cereales también están reforzados con vitamina D y en Estados Unidos se está considerando la obligatoriedad del refuerzo uniforme del queso, el pan y los cereales.
SuplementosSe dispone de suplementos de vitamina D con 200- 1.000 UI/píldora, y de presentaciones con dosis muy superiores. Los suplementos utilizan tanto vitamina D2 (ergocalciferol: derivado de las plantas) como D3 (colecalciferol: derivado de los animales). Aunque tradicionalmente D2 y D3 se han considerado equipolentes, al menos dos estudios señalan alguna diferencia en su potencia. En un estudio en el que los pacientes recibieron 4.000 UI de vitamina D2 o D3 durante 14 días, los valores de 25(OH)-D tras la administración de D3 fueron 1,7 veces mayores que tras la administración de D2 85. Otro estudio reciente demostró mayores períodos de valores sostenidos de 25(OH)-D tras una sola gran dosis (50.000 UI) de vitamina D3 que tras la de vitamina D2, debido en gran medida a la mayor afinidad de la PFVD por 25(OH)-D3 respecto a 25(OH)-D2. Por estos datos, los autores indicaron que la vitamina D3 puede ser al menos tres veces más potente que la vitamina D2 86. Aunque la mayor parte de los preparados polivitamínicos comerciales contienen vitamina D2 (Drisdol, la mayoría de los polivitamínicos infantiles masticables, incluyendo Flintstones y Garfield, los polivitamínicos Prenatal y Women’s), algunos, como Poly-Vi-Sol, contienen vitamina D3. Los suplementos que contienen colecalciferol pueden ser preferibles a los que contienen ergocalciferol, especialmente cuando se utilizan como gran dosis aislada.
LíMITES DE LA CONCENTRACIóN SANGUíNEA NORMAL Y ANORMAL DE VITAMINA DLa escasa fiabilidad de las determinaciones de vitamina D habitualmente utilizadas, y la falta de concordancia de la definición de población normal ha provocado cierta dificultad para establecer los límites normales de la concentración sérica de 25(OH)-D. ésta es la forma circulante principal de la vitamina D, y sus valores son el mejor indicador del estado corporal total en vitamina D. La semivida de 25(OH)-D es de dos a tres semanas, mucho mayor que la del metabolito activo, 1,25(OH)2-D, cuya semivida es de sólo cuatro horas. Esta última no es un buen indicador de los depósitos de vitamina D, al contrario que 25(OH)-D, porque: 1) sutiles disminuciones de la concentración de calcio en la deficiencia de vitamina D provocan aumentos de PTH que pueden inducir un incremento de la actividad de 1- alpha;-hidroxilasa, resultando en unos valores normales o elevados de 1,25(OH)2-D, y 2) circula normalmente a concentraciones que son 100- 1.000 veces menores que las de 25(OH)-D.
Dificultades para el empleo de límites estándar de referencia con las determinaciones actuales de vitamina DPara que los límites de referencia recomendados sean universalmente aplicables es necesario que las determinaciones de 25(OH)-D sean exactas, reproducibles y normalizadas internacionalmente. También es importante interpretar correctamente las concentraciones de 25(OH)-D notificadas. La descripción completa de las determinaciones de 25(OH)-D escapa al ámbito de esta revisión, y aquí sólo mencionaremos los aspectos principales. La vitamina D cutánea y la mayoría de las fuentes naturales de vitamina D derivan del colecalciferol o vitamina D3. A la inversa, la vitamina D generada al irradiar levaduras es el ergocalciferol (vitamina D2), igual que la vitamina D obtenida de la mayoría de los suplementos en Estados Unidos. Ambas presentaciones se utilizan para reforzar los alimentos. Por lo tanto, los estudios empleados para determinar los valores de 25(OH)-D deben poder medir los derivados tanto de D2 como de D3. Si el estudio sólo mide el derivado natural de D3 se puede diagnosticar incorrectamente la deficiencia y, por ello, administrar un tratamiento excesivo. Esto es particularmente cierto porque la vitamina D medicamentosa suele adoptar (pero no siempre) la forma de D2. Las inmunodeterminaciones actualmente utilizadas con anticuerpos monoclonales muy específicos (m-AB) a 25(OH)-D se han mostrado más exactas que las antiguas determinaciones competitivas de fijación de proteínas, que tenían problemas con la interferencia y la capacidad de reacción cruzada (revisadas en 87 y 88). Los distintos estudios competitivos de fijación proteica utilizan diferentes fuentes de proteínas de fijación de la vitamina D, una extracción y procedimientos preliminares de purificación variables, y un período de incubación distinto, lo que condujo a resultados variables. Estos estudios resultaron a menudo en valores de 25(OH)-D mayores que los de otros métodos, probablemente por la carencia de un paso de separación cromatográfica89,90. El estudio de fijación proteica quimioluminiscente utiliza un reactivo para separar a la vitamina D de sus proteínas de fijación, y de forma similar a los antiguos estudios de fijación proteica, carece de paso de separación cromatográfica91. Como muchos de los estudios de fijación proteica, esta determinación produjo valores de 25(OH)-D mayores que el RIA y la HPLC en un estudio88. Los RIA que utilizan m-AB tuvieron unos resultados inicialmente parecidos a los de la HPLC, aunque se ha demostrado que muestran cierta variabilidad88, probablemente porque algunos anticuerpos detectan los metabolitos tanto de 25(OH)-D2 como los de 25(OH)-D3, mientras que otros infravaloran el metabolito de D2 92. Con los estudios típicos de laboratorio se informa una variabilidad superior al 30-50% en la detección de los metabolitos 25(OH)-D2 y D3. La HPLC o la espectroscopia de masas en tándem se propugnan como la referencia para las determinaciones de los metabolitos de la vitamina D. Mientras que los estudios con m-AB tienen una importante afinidad preferente por los analitos D2 o D3, y pueden causar una grosera sobre o infravaloración de los valores totales, según los patrones utilizados, la HPLC y la espectroscopia de masas tienen la ventaja de poder separar los metabolitos de D2 y D3. Sin embargo, la HPLC es lenta y tiene una aplicabilidad clínica limitada, y ni la HPLC ni la espectroscopia de masa son universalmente accesibles. La tabla 5 clasifica los estados de deficiencia, suficiencia y exceso de vitamina D según los valores de 25(OH)-D. Los datos considerados para determinar los límites normales de los valores de 25(OH)-D incluyen marcadores biológicos, como los cambios en la fosfatasa alcalina (FA), la densidad ósea y la absorción de calcio a distintas concentraciones de 25(OH)-D, así como la evidencia de raquitismo.
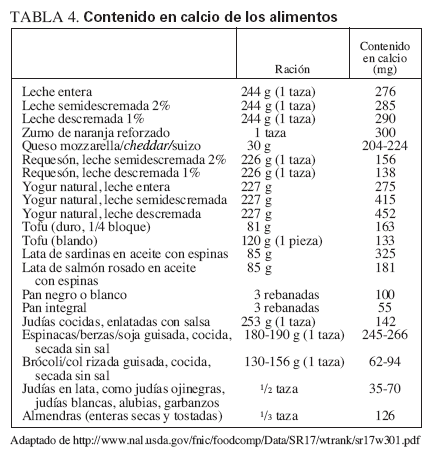
TABLA 4. Contenido en calcio de los alimentos
TABLA 5. Estado de vitamina D en relación con los valores de 25(OH)-D
Deficiencia intensa de vitamina DEn la actualidad, la deficiencia intensa se define, de forma algo arbitraria, como una 25(OH)-D 12,5 nmol/l63 (5 ng/ml). Un estudio indica que el 86% de los niños con valores de 25(OH)-D < 20 nmol/l (8 ng/ml) sufre raquitismo, y el 94% de los niños hipocalcémicos con deficiencia de vitamina D tiene valores < 20 nmol/l4 (8 ng/ml). Presumiblemente, estas proporciones serían mayores con un límite de 12,5 nmol/l (5 ng/ml).
Deficiencia e insuficiencia de vitamina DEn los niños se ha recomendado que una 25(OH)-D sérica 37,5 nmol/l (15 ng/ml) se considere indicativa de deficiencia y la > 50 nmol/l (20 ng/ml) de suficiencia en vitamina D93. La descripción detallada de los estudios que constituyen la base de estas recomendaciones escapa al ámbito de esta revisión, y aquí sólo se describen algunos. En un estudio sobre chicas finlandesas de 14-16 años de edad, la densidad ósea en el antebrazo de las chicas con valores de 25(OH)-D 40 nmol/ml (16 ng/ml) fue baja94. Sin embargo, se observa un raquitismo nutricional con alteraciones radiológicas demostradas en los lactantes de raza negra con lactancia materna y valores de 25(OH)- D de hasta 40-45 nmol/l95,96 (16-18 ng/ml), y se observa un aumento de los valores de FA con valores séricos de 25(OH)-D < 50 nmol/l97,98 (20 ng/ml).
Suficiencia de vitamina DAunque el límite inferior de 40 nmol/l (20 ng/ml) para los valores de 25(OH)-D sigue considerándose indicador de la suficiencia en vitamina D, los datos sobre adultos indican un límite algo superior, basado en estudios que informan de una alteración de la absorción del calcio99 y una menor densidad ósea (100) a valores de 25(OH)-D < 80 nmol/l60,99-101 (32 ng/ml). Según éstos y otros datos, se acepta cada vez más un límite inferior de 80 nmol/l (32 ng/ml) como límite inferior de la normalidad para los valores de 25(OH)-D en los adultos. Es necesario realizar más estudios que examinaron las asociaciones de FA, absorción de calcio y de densidad mineral ósea con valores de 25(OH)-D en los lactantes y los niños para determinar si el mayor límite de suficiencia utilizado actualmente en los adultos debería aplicarse también a los niños. También es importante identificar otros marcadores biológicos que pueden indicar un estado de insuficiencia o deficiencia de la vitamina D en los niños. Son esenciales mejores y más normalizados estudios dada la gran variabilidad de los utilizados actualmente88.
Exceso e intoxicación de vitamina DEn el otro extremo del espectro, las personas con valores de 25(OH)-D > 250 nmol/l (100 ng/ml) se han calificado, de forma arbitraria, como con exceso de vitamina D y de estar en riesgo de intoxicación por vitamina D102. Algunos laboratorios utilizan un límite superior de la normalidad de 200 nmol/l (80 ng/ml). Sin embargo, los que toman baños de sol y los socorristas alcanzan valores de 25(OH)-D > 250 nmol/l (100 ng/ml) sin mostrar intoxicación por vitamina D, y la administración de suplementos de vitamina D que provocan valores de 25(OH)-D de 250 nmol/l (100 ng/ml) no se asocia con efectos nocivos103. A la inversa, la hipercalcemia se asocia claramente con unos valores de 25(OH)-D > 325 nmol/l104 (150 ng/ml).
CAUSAS DE LA DEFICIENCIA DE VITAMINA DLa tabla 6 describe distintas causas de la deficiencia de vitamina D.
TABLA 6. Causas de deficiencia de vitamina D
Disminución de la síntesis de vitamina DEl importante papel de la luz ultravioleta en la gama UVB sobre la síntesis cutánea de vitamina D se ha descrito anteriormente en esta revisión. La reaparición del raquitismo por deficiencia de vitamina D en Europa del norte y Norteamérica se asocia principalmente con los niños de piel oscura con dietas vegetarianas estrictas, dietas culturales o de moda, lactantes de piel oscura con lactancia materna exclusiva durante más de 3-6 meses de edad, neonatos prematuros e hijos de madres con deficiencia de vitamina D. El empleo excesivo de filtros solares también puede contribuir a la disminución de la síntesis cutánea de vitamina D. En todo el mundo, el raquitismo persiste en los lactantes con lactancia materna durante un prolongado período de tiempo o alejados de la luz solar durante períodos prolongados, como en India, China y Oriente Medio. Los fetos de embarazadas con intensa deficiencia de vitamina D por el empleo del velo tradicional pueden desarrollar un raquitismo intrauterino, y presentar hipocalcemia y tetania al nacimiento (raquitismo congénito). Todo esto ha fomentado un estudio detenido de los factores que afectan a la síntesis de vitamina D, como la pigmentación cutánea, la exposición a la luz solar, la geografía y los patrones de alimentación infantil. Los beneficios de una sensata exposición a la RUV deben sopesarse frente a los riesgos de la deficiencia de vitamina D, al menos en ciertas poblaciones. En este apartado revisaremos los factores que afectan a la síntesis de vitamina D en la piel.
Deficiencia de vitamina D en relación con la pigmentación cutáneaLa pigmentación cutánea determina la duración necesaria de la exposición solar para conseguir una determinada concentración de vitamina D. Sin embargo, cuando la exposición a UVB no se limita a una cantidad fija de energía (de radiación UVB), sino que se expresa en DEM (dosis eritematosa mínima o cantidad de UVB necesaria para producir un color ligeramente sonrosado de la piel), la exposición de todo el cuerpo a UVB hasta una DEM equivalente resulta en valores similares de vitamina D. Vale la pena destacar que es necesaria más UVB para producir una DEM en los individuos de piel más oscura, por lo que estas personas necesitan una mayor duración de la exposición al sol que las personas de piel clara para conseguir una respuesta similar105. En concreto, se cree que un hindú asiático necesita una exposición a UVB triple, y un afroestadounidense de seis a diez veces mayor, que una persona de piel clara para conseguir unas concentraciones equivalentes de vitamina D60,106. Se ha informado de menores valores de 25(OH)-D en las personas de raza negra respecto a las de raza blanca en 1) los lactantes < 6 meses de edad en Cincinnati64, 2) las niñas prepuberales del sudeste de Estados Unidos107 y 3) las chicas adolescentes posmenárquicas108, especialmente en los meses de invierno. En un estudio de Boston, el 36% de los adolescentes de raza negra tuvo valores de 25(OH)-D < 37,5 nmol/l o 15 ng/ml93. En dos estudios sobre niños con raquitismo, el 83-91% de los niños con raquitismo de 2-45 meses de edad109 y 4-54 meses6 eran de raza negra, y los nueve niños con raquitismo de un informe de Texas eran de piel oscura7. Este último estudio indica que vivir en un área geográfica con abundante luz solar no garantiza la protección contra el desarrollo de un raquitismo nutricional en los niños de piel oscura. La deficiencia de vitamina D también se notifica fuera de Estados Unidos en relación con la pigmentación de la piel. En un estudio prospectivo de Reino Unido sobre niños de 0-5 años de edad110, el raquitismo por deficiencia de vitamina D fue muy habitual en los niños de ancestros en el áfrica negra o afrocaribeñas, seguido por los niños de ancestros del sudeste asiático y los de origen étnico blanco. Doce de los 17 casos de raquitismo remitidos a un hospital infantil de Toronto entre 1988 y 1993 eran hijos de padres de piel oscura111.
Deficiencia de vitamina D en relación con los agentes físicos que bloquean la exposición a la RUVVestimentaEs importante la cantidad de piel expuesta al sol. La exposición de todo el cuerpo, frente a la de sólo la cara, los brazos y las manos, se asocia con notables diferencias de la síntesis de vitamina D60. Por ejemplo, un lactante totalmente vestido sin gorra necesita una exposición solar cuádruple que la de un lactante en pañales para conseguir unas concentraciones similares de 25(OH)-D64. Para que aumenten las concentraciones sanguíneas de vitamina D se debe exponer a los UVB al menos el 20% de la superficie corporal. Por lo tanto, las mujeres y los niños de Arabia Saudí portadores de vestimentas tradicionales corren grave riesgo de deficiencia de vitamina D. La deficiencia subclínica de vitamina D también es habitual en las mujeres kuwaitíes con velo, y algunas presentan una franca osteomalacia112. La naturaleza del vestido es importante, de forma que la lana negra absorbe, y por ello evita la transmisión de la radiación UVB a la piel, con una eficacia doble que el algodón blanco113. Además, la lana más tupida provoca una mayor atenuación de UVB114. Aparte de la vestimenta, el calor de los meses veraniegos en determinadas partes del mundo lleva a evitar el sol y, por ello, a una exposición inadecuada a la luz solar115,116.
Filtros solaresLos filtros solares absorben la luz UVB y parte de la UVA e impide que lleguen a y penetren en la piel. Un filtro solar con factor de protección solar (FPS) 8 puede disminuir la capacidad sintética de vitamina D3 en un 95%, y con FPS 15 en un 98%117 (revisado en 56). En los adultos que se aplican correctamente un filtro solar (2 mg/cm2), la cantidad de vitamina D3 producida disminuye en un 95%. Sin embargo, el efecto de los filtros solares sobre la producción de vitamina D también puede verse afectado por la geografía, con una adecuada producción de vitamina D pese a la aplicación de filtros solares en áreas de excesiva exposición a la luz solar118. Farrerons et al demostraron menores valores de vitamina D en las personas que utilizaron FPS 15 que en las que no utilizaron filtro solar, aunque esta disminución de valores no fue suficiente para provocar aumentos de PTH119. La exposición al sol de mediodía (entre las 10 de la mañana y las 3 de la tarde) durante diez a quince minutos en la primavera, el verano y el otoño se considera suficiente para conseguir una adecuada síntesis de vitamina D en los individuos de piel clara, ya que aporta cerca del 25% de la DEM. Tras esta exposición se recomienda la aplicación de un filtro solar con FPS 15 para impedir los efectos nocivos de la excesiva exposición crónica a la luz del sol62,120-123. Vale la pena destacar que el 48% de las niñas de raza blanca de 9-11 años de edad que viven en Maine tiene valores de 25(OH)-D < 50 nmol/l (20 ng/ml) al final del invierno y el 17% sigue con una insuficiencia de vitamina D al final del verano por el empleo de filtros solares y la práctica de la protección solar completa124.
SombraEl aumento de la urbanización y el mayor tiempo pasado en interiores en el trabajo en estos lugares puede conducir a una disminución del tiempo pasado en el exterior y, por ello, a una disminución de la síntesis de vitamina D, incluso en las poblaciones de piel clara. La sombra disminuye la cantidad de radiación solar en un 60%, y el vidrio de la ventana bloquea la radiación UV125. La tercera parte de los estudiantes de la Boston University que permanecen en interiores durante períodos prolongados y siempre utilizan protección solar es insuficiente en vitamina D (valores de 25(OH)-D 50 nmol/l [20 ng/ml]) al final del invierno126. De forma similar, los niños discapacitados y los que permanecen en interiores pueden no recibir el refuerzo estival de vitamina D127.
Deficiencia de vitamina D en relación con la geografíaLatitud y estaciónEl raquitismo por deficiencia de vitamina D se notifica en los niños de raza blanca de los estados del norte con mayor frecuencia que en los del sur6. Esto se atribuye a una disminución de la RUV incidente al aumentar la latitud porque el ángulo oblicuo al que la luz solar alcanza la atmósfera obliga a recorrer un mayor trayecto a través de la atmósfera y la capa de ozono, con la consiguiente mayor dispersión y absorción de la RUV128. De forma similar, en los meses de invierno, los rayos del sol entran en la atmósfera en un ángulo oblicuo, los fotones UVB deben recorrer mayor distancia por la atmósfera y el número de fotones UVB absorbidos por el ozono es mayor. Por ello, el número de fotones por unidad de área que golpean la tierra es menor. Hacia los 37º de latitud norte, el número de fotones UVB que alcanza la atmósfera de la tierra en los meses invernales disminuye en un 80-100%, y en consecuencia se produce poca vitamina D en la piel56. Para la producción de vitamina D es necesaria una cantidad mínima de UVB, que puede no alcanzarse a una latitud > 40º en invierno, incluso con una prolongada exposición al sol129. Por lo tanto, existen cuatro o cinco meses en invierno en los que UVB no puede producir vitamina D en lugares como Boston130 (42,5º norte). Los valores de vitamina D en el hemisferio norte alcanzan su nadir en febrero y marzo130. Los niños de cualquier edad son más susceptibles a los bajos valores de vitamina D durante el invierno, comparado con los meses de verano. Un informe de Iowa (41º norte) indicó que, durante el invierno, el 78% de los lactantes con lactancia materna no suplementada de distintas pigmentaciones cutáneas tenía unos valores de 25(OH)-D < 27,5 nmol/l (11 ng/ml), frente a sólo el 1% de estos lactantes durante el verano131. Los lactantes con raquitismo florido se presentan por primera vez a finales de invierno o principios de primavera, a los 6-12 meses de edad, con hipocalcemia y rasgos clínicos asociados, a menudo con tetania franca o convulsiones, también conocidas como “tetania primaveralâ€. En Edmonton, Canadá (52º norte), la prevalencia de valores de 25(OH)-D inferiores a 40 nmol/l (18 ng/ml) al final del invierno fue del 22% y del 8% en los niños y niñas de 2-8 años de edad, y del 69% y 35% en los chicos y chicas de 9-16 años de edad132. Los valores estivales de vitamina D suelen ser adecuados, y se plantea la duda de si la suficiente exposición al sol durante la primavera, el verano y el otoño basta para mantener unas concentraciones normales de vitamina D durante el invierno. En otras palabras, ¿podría la vitamina D producida en el verano y otros meses quedar almacenada en la grasa corporal y liberarse para ser utilizada en el invierno? Los estudios han demostrado asociaciones inversas entre la grasa corporal y los valores circulantes de 25(OH)-D, lo que sugiere que el secuestro de vitamina D en el tejido adiposo en los individuos obesos o la mayor capacidad de almacenamiento de vitamina D en la grasa podría prevenir la adecuada liberación de vitamina D, lo que conduce a estados de deficiencia133,134. Por lo tanto, en las latitudes septentrionales, pese a la exposición al sol durante el verano, puede ser necesario el suplemento con vitamina D para mantener unos valores óptimos de vitamina D durante el invierno.
Tiempo nublado, contaminación atmosférica y altitudEl tiempo nublado, el aumento del vapor de agua y de la contaminación industrial puede disminuir la cantidad de UVB que alcanza la superficie de la tierra, lo que se ha asociado con una mayor prevalencia de raquitismo por deficiencia de vitamina D135. Por el contrario, las mayores altitudes (como en las Montañas Rocosas) se asocian con una mayor RUV a causa del menor grosor de la atmósfera y la menor cantidad de ozono atmosférico, lo que protege contra la deficiencia de vitamina D, incluso en las latitudes septentrionales.
Disminución de la ingestión nutricional de vitamina DLa menor ingestión de los alimentos reforzados en vitamina D, especialmente la leche y los cereales reforzados, puede resultar en un raquitismo por deficiencia de vitamina D en determinadas poblaciones, especialmente en los individuos de piel oscura que viven a mayor latitud durante los meses invernales. La disminución de la ingestión puede ser voluntaria o por necesidad en las sociedades pobres e incapaces de comprar estos alimentos. La disminución de la ingestión de leche reforzada es frecuente en los adolescentes y las mujeres jóvenes en edad fértil, lo que resulta en una disminución de la concentración sanguínea de vitamina D.
Estado materno en vitamina D, prematuridad y lactancia materna exclusivaDeficiencia de vitamina D por mal estado materno en vitamina DEn Estados Unidos, el 12% de las mujeres de 20- 29 años de edad (años de máxima fecundidad) tienen un valor sérico de 25(OH)-D inferior al umbral aceptado de la deficiencia de vitamina D136 (37,5 nmol/l o 15 ng/ml), deficiencia más frecuente en las mujeres de raza negra (42%) que en las de raza blanca137 (4%). Se han notificado grandes tasas de deficiencia de vitamina D en las mujeres embarazadas de piel más oscura138,139, especialmente en los meses invernales y en las mayores latitudes140, y los bajos valores de vitamina D durante el embarazo se han asociado con RCIU, trabajo de parto prematuro e hipertensión, todo lo cual aumenta el riesgo de bajo peso al nacimiento141-143. Desde luego, las madres de raza negra y las de ascendencia asiática tienen mayores tasas de neonatos de bajo peso al nacimiento en Estados Unidos que las estadounidenses de ascendencia europea o las hispanoamericanas144-146. Los menores valores de vitamina D en la madre resultan en una disminución de la transferencia transplacentaria de la vitamina D y de menores depósitos al nacimiento. La concentración sérica de 25(OH)-D en los neonatos está relacionada con la 25(OH)-D en el suero materno64.
Deficiencia de vitamina D por la prematuridadLos neonatos prematuros tienen menos tiempo para acumular los depósitos de vitamina D por la transferencia transplacentaria de la madre, y también necesitan más vitamina D que los neonatos a término147. Por lo tanto, tienen más probabilidades de ser deficientes en vitamina D. Se ha publicado que tienen más probabilidades de presentar defectos del esmalte en los dientes, tanto deciduales como definitivos, porque es necesaria la suficiencia en vitamina D para un desarrollo fetal normal de los dientes148,149.
Deficiencia de vitamina D por lactancia materna exclusivaPreviamente hemos descrito que, suponiendo un consumo medio de 750 ml/día79, la lactancia materna exclusiva sin exposición al sol ofrecería sólo 11-38 UI de vitamina D/día14. Es importante recordar que el contenido en vitamina D de la leche varía según el color de la piel, con menores concentraciones de vitamina D en la leche materna de las mujeres de raza negra, comparadas con las de raza blanca150. Por lo tanto, los lactantes con lactancia materna necesitan obtener vitamina D adicional mediante la exposición al sol o el suplemento. La cantidad de exposición al sol de los lactantes y los niños pequeños descrita anteriormente en esta revisión, siguiendo las recomendaciones de Specker et al64, es suficiente para mantener la concentración sérica de 25(OH)-D por encima de 27,5 nmol/l (11 ng/ml). Sin embargo, esta recomendación tiene sus limitaciones, especialmente porque, según las recomendaciones actuales, los valores de 25(OH)-D deben ser > 50 nmol/l (20 ng/ml), y algunos podrían defender incluso que un límite inferior de 80 nmol/l (32 ng/ml) es más fisiológico. Aunque la síntesis de vitamina D en la piel es una importante fuente de vitamina D en los lactantes y los niños, las actuales recomendaciones de la American Academy of Pediatrics, que limitan la exposición al sol en los lactantes menores de seis meses de edad por los nocivos efectos sobre la piel de UVB151, hacen a los lactantes con lactancia materna más vulnerables al desarrollo de una deficiencia de vitamina D. La lactancia materna exclusiva sin la adecuada exposición al sol o suplemento de vitamina D es un importante factor de riesgo de deficiencia de vitamina D95,152-156. En una revisión de 65 casos clínicos de raquitismo en niños de 2-45 meses de edad, notificados entre 1975 y 1985 en once publicaciones, Cosgrove y Dietrich observaron que, en el momento del diagnóstico, los niños seguían con lactancia materna o recibían una dieta vegetariana sin leche109. Weisberg et al publicaron hace poco 166 casos de raquitismo en niños de 4-54 meses de edad entre 1986-2003 en 22 publicaciones6, e informaron que el 96% recibía lactancia materna. De los lactantes con lactancia materna, sólo el 5% estaba recibiendo suplementos de vitamina D. Los lactantes con lactancia materna exclusiva nacidos en invierno en Wisconsin tuvieron unos valores medios de 25(OH)-D < 25 nmol/l (10 ng/ ml) a los seis meses de edad si no recibían suplementos157, y el 98% de los lactantes de Alaska con unos valores de 25(OH)-D < 62,5 nmol/l (25 ng/ml) recibían lactancia materna exclusiva158. Así pues, los lactantes con lactancia materna necesitan obtener vitamina D adicional mediante el suplemento159,160 (infantil o materno) o la adecuada exposición al sol. Deficiencia de vitamina D en los niños alimentados con fórmula Aunque la deficiencia de vitamina D es habitual en los niños con lactancia materna exclusiva, también puede observarse en los lactantes alimentados con fórmula. En un estudio británico prospectivo sobre niños de 0- 5 años de edad, el 50% de los niños con raquitismo que presentan convulsiones hipocalcémicas recibía lactancia artificial110. El contenido en vitamina D de las fórmulas puede no ser suficiente para compensar el impacto de la deficiencia prenatal de vitamina D.
La malabsorción puede causar raquitismo al disminuir la absorción de vitamina D, calcio, fosfato, o alguno de ellos.
La absorción de vitamina D depende de los quilomicrones y, por consiguiente, los niños con enfermedades que interfieren con la absorción de grasa corren riesgo de desarrollar deficiencia de vitamina D. El raquitismo debido a la malabsorción se puede encontrar en los niños con enfermedad celíaca161, alergias alimentarias162, tras la resección gástrica y del intestino delgado, en la insuficiencia pancreática incluyendo la fibrosis quística, la enfermedad de Crohn y las hepatopatías colestáticas. El análisis completo de la deficiencia de vitamina D debida a la malabsorción escapa al ámbito de esta revisión. Tampoco analizaremos la deficiencia de vitamina D debida al consumo crónico de medicamentos, como los anticonvulsivantes o los glucocorticoides.
LIMITACIONES DE LAS ACTUALES RECOMENDACIONES PARA LA INGESTIóN DE VITAMINA DEs muy dudoso que la ingestión recomendada de vitamina D (200 UI/día según las pautas de 2003 de la American Academy of Pediatrics) sea suficiente para todos los lactantes con lactancia materna, sea cual sea el estado en vitamina D de las madres durante el embarazo, la pigmentación cutánea, el empleo de filtros solares, la latitud geográfica, los hábitos de vestimenta y la ingestión dietética de calcio. La premisa de esta recomendación es que la ingestión diaria de 200 UI de vitamina D es suficiente para mantener la concentración sérica de 25(OH)-D por encima de 27,5 nmol/l (11 ng/ml) para prevenir el raquitismo. Sin embargo, un valor de 27,5 nmol/l (11 ng/ml) no es suficiente para prevenir todos los casos de raquitismo florido95,96,163, y el raquitismo puede aparecer a concentraciones de 25(OH)-D entre 25 y 50 nmol/l95,96 (10-20 ng/ml). En los lactantes de 7-12 meses de edad, la ingestión de 200 UI de vitamina D permite mantener unos valores de 25(OH)-D > 25 nmol/l (10 ng/ml), aunque estas concentraciones son inferiores a las alcanzadas en los lactantes sin suplemento en el verano164. Como estudiamos anteriormente, se debe pretender alcanzar unos valores de 25(OH)-D superiores a 50 nmol/l165,166 (20 ng/ml) (suficiencia en vitamina D) para prevenir los aumentos de los valores de FA97,98, y los datos históricos indican que la ingestión diaria de 400 UI de vitamina D en forma de aceite de hígado de bacalao es suficiente para prevenir el raquitismo manteniendo los valores de 25(OH)-D por encima de este límite, y no es nociva167,168. En 1998, la American Academy of Pediatrics ha recomendado la suplementación con 400 UI diarias de vitamina D en los lactantes intensamente pigmentados con lactancia materna169; sin embargo, esto no se reafirmó en las pautas de la American Academy of Pediatrics de 2003. Las recomendaciones actuales de la ingestión de vitamina D no tienen en cuenta la pigmentación cutánea ni los efectos de la geografía. Vale la pena destacar que la Canadian Paediatric Society recomienda 800 UI diarias de vitamina D para los lactantes con lactancia materna durante los meses invernales5,170, dada la gran prevalencia de la deficiencia de vitamina D en las madres canadienses y sus hijos171 (46% y 36%, respectivamente). Así pues, las necesidades dietéticas de vitamina D pueden ser mayores en las latitudes septentrionales, especialmente en invierno, quizá más cercanas a la ingestión de vitamina D recomendada por la Canadian Paediatric Society.
PREVENCIóN Y TRATAMIENTO DEL RAQUITISMO POR LA DEFICIENCIA NUTRICIONAL DE VITAMINA DPrevenciónExposición a la luz solar (síntesis cutánea de vitamina D por la exposición a UVB solar)La exposición a la luz solar es la principal fuente de vitamina D de la mayoría de los niños y los adolescentes. Sin embargo, la limitada capacidad de la piel para sintetizar vitamina D en los meses invernales, especialmente a latitudes superiores a 37,5º y en los individuos de piel oscura, hace necesario el suplemento con vitamina D. Por ello, es necesario un equilibrio entre la limitación de la exposición al sol para evitar los riesgos de cáncer de piel y permitir una exposición suficiente para optimizar los valores de vitamina D y prevenir el raquitismo, así como el desarrollo de enfermedades inmunitarias y el futuro cáncer. Es necesario realizar nuevos estudios para volver a evaluar los riesgos y los beneficios de la RUV respecto no sólo a los costes de la asistencia sanitaria, sino también del sufrimiento humano, y para desarrollar nuevas recomendaciones para una exposición segura al sol de los lactantes, los niños y los adolescentes según el color de la piel, la geografía, la cultura y las prácticas de lactancia materna. Las actuales recomendaciones de la AAP consisten en mantener alejados de la luz solar directa a los lactantes menores de seis meses de edad, seleccionar actividades infantiles que reduzcan al mínimo la exposición a la luz solar y emplear vestimenta protectora y filtros solares70. Estas recomendaciones pueden mantenerse para los niños de piel clara en las menores latitudes, especialmente en los meses estivales. Sin embargo, es necesario explorar los efectos de la exposición a UVB en los lactantes, niños y adolescentes de piel oscura que viven en latitudes mayores, así como estudios para determinar la duración de la exposición segura al sol que permita la suficiente generación de vitamina D para mantener unos valores de 25(OH)-D > 50 nmol/l (20 ng/ml) a estas mayores latitudes y en los lactantes y los niños con pigmentación cutánea más oscura.
Refuerzo del alimento con vitamina DSon pocos los alimentos que contienen vitamina D natural, y por estar la mayoría basados en la carne o el pescado, pueden no ser aceptables para las culturas que fomentan la dieta vegetariana. En la actualidad, pocos alimentos están reforzados en vitamina D. Se debe considerar el refuerzo rutinario en vitamina D de la leche y otros productos alimentarios, especialmente en las mayores latitudes. Las actuales estrategias de refuerzo de alimentos pueden no ser suficientes para prevenir la deficiencia de vitamina D en los individuos de piel oscura, especialmente en los meses invernales y a mayor latitud. Como el consumo de leche y de cereales “preparados†de la población de raza negra es menor que el de la raza blanca en Estados Unidos, también se debe considerar las prácticas dietéticas para determinar la idoneidad de las prácticas de refuerzo. Resultaría útil un plan de refuerzo de los alimentos basado en la pigmentación cutánea y la geografía y, teniendo en cuenta las normas culturales, sería útil, ya que los requisitos del suplemento dietético con vitamina D son mayores para las poblaciones de piel oscura y en las mayores latitudes. Mientras no se disponga de este plan, avalamos la obligación actual de que las fórmulas infantiles contengan 40-100 UI de vitamina D/100 kcal de fórmula. Es necesario considerar la monitorización durante el embarazo del estado en vitamina D de las mujeres de piel oscura que residan a gran latitud y recomendar el suplemento con vitamina D a las mujeres deficientes en ella. Durante los períodos de rápido crecimiento, como la lactancia y la adolescencia, es importante garantizar el suplemento de vitamina D14,172, especialmente para los niños de piel oscura y los niños que viven a gran latitud.
Empleo de suplementosDado que: 1) 200 UI de vitamina D no son suficientes para mantener los valores de 25(OH)-D por encima de 50 nmol/l (20 ng/ml), el límite de la insuficiencia en vitamina D, y 400 UI de vitamina D son suficientes para prevenir el raquitismo y mantener los valores por encima de 50 nmol/l (20 ng/ml), 2) los valores de 25(OH)-D son muy escasos en los niños con lactancia materna que no reciben suplementos y 3) la exposición al sol suficiente para mantener los valores de 25(OH)-D en los límites recomendados puede no ser posible a gran latitud durante los meses invernales, recomendamos que todos los lactantes con lactancia materna, y los lactantes con lactancia artificial y los niños que no ingieran al menos un litro de leche reforzada en vitamina D al día reciban 400 UI diarias de vitamina D en forma de suplemento172. El consumo diario de un litro de fórmula reforzada puede ser alcanzado en los lactantes mayores con lactancia artificial exclusiva, pero es poco probable en los lactantes con lactancia mixta, por lo que el suplemento con 400 UI diarias es necesario en todos los lactantes con lactancia materna. Recomendamos iniciar el suplemento a los pocos días del nacimiento, dado que la deficiencia de vitamina D puede comenzar temprano e incluso intrauterinamente cuando la madre es deficiente en vitamina D. Esta cantidad de suplemento de vitamina D no se asocia con efectos adversos, y los costes asociados no son importantes. Zipitis et al informan que el coste de la prevención primaria de la deficiencia de vitamina D en una población de alto riesgo en Reino Unido es ventajoso, tanto en el plano médico como en el financiero, respecto al tratamiento de la enfermedad establecida173. Es necesario realizar estudios similares en otras partes del mundo para evaluar la rentabilidad del suplemento con dosis de vitamina D superiores a las actualmente recomendadas.
Los niños de piel oscura con lactancia materna exclusiva deberían recibir al menos 400 UI diarias de vitamina D en forma de suplemento, pero pueden necesitar una mayor cantidad. Los niños pretérmino deben recibir suplemento desde el nacimiento con 400-800 UI diarias por la inadecuada transferencia de los depósitos maternos de vitamina D, así como los temas asociados con la prematuridad, como la mala alimentación, las dificultades gastrointestinales que alteran la absorción y, a veces, la alteración hepática y renal. Se debe prestar consideración a las recomendaciones de la Canadian Paediatric Society, que sugiere la suplementación con 800 UI diarias de los lactantes con lactancia materna durante los meses invernales. Esto sería particularmente importante para los hijos de madre de piel oscura que reciben lactancia materna exclusiva y viven a gran latitud. Se debe controlar, al menos anualmente, los valores de 25(OH)-D de los lactantes y niños que reciban dosis mayores de vitamina D en forma de suplemento. Debemos destacar que cada vez más pruebas indican que la ingestión dietética recomendada de vitamina D para los adultos en Estados Unidos debe ser cercana a las 1.000 UI. Es necesario realizar estudios para determinar si estas recomendaciones también debieran aplicarse a los niños. Datos recientes indican que la administración de grandes dosis de vitamina D (4.000-6.400 UI diarias) a madres durante la lactancia consigue aumentar los valores de 25(OH)-D en el lactante hasta una cifra similar a la observada con la suplementación del lactante, pero sin producir hipervitaminosis D en la madre, y aumenta la actividad antirraquítica de la leche materna159,160. Así pues, el suplemento con grandes dosis de vitamina D a las madres durante la lactancia constituye otra posible estrategia para mejorar el estado en vitamina D de los lactantes con lactancia materna exclusiva.
Estudio sistemáticoLos pediatras deberían ser propensos al estudio sistemático de la deficiencia de vitamina D: 1) en presencia de síntomas inespecíficos, como el escaso crecimiento, el retraso motor grosero y la irritabilidad poco habitual, 2) en los lactantes de piel oscura que viven a gran latitud y durante los meses de invierno y primavera, 3) en los niños que reciben anticonvulsivos o glucocorticoides de forma crónica y 4) en los niños con enfermedades crónicas asociadas con la malabsorción, como la fibrosis quística y la enteropatía inflamatoria. Otro posible grupo a considerar para el estudio sistemático de la deficiencia de vitamina D es el de niños con fracturas frecuentes y escasa densidad mineral ósea, en los que el mantenimiento de un valor óptimo de vitamina D sería importante para llevar al máximo la absorción de calcio. Una ayuda para la detección sistemática del raquitismo por deficiencia de vitamina D es la FA sérica174, que, si está elevada para su edad, debe seguirse de la medición del valor sérico de 25(OH)-D, calcio, fósforo y PTH, junto con una exploración radiológica de los extremos distales de: 1) el cúbito y el radio (imagen AP de la muñeca) o 2) la tibia y el fémur (imagen AP de la rodilla), según sea la edad del niño96. Los valores de FA suelen ser < 500 UI/l en los neonatos, < 1.000 UI/l hasta los 9 años de edad y disminuyen tras la pubertad175, aunque la gama varía según el método utilizado para la determinación. Sin embargo, algunos estudios indican que, mientras que todos los niños con pruebas radiológicas de raquitismo tienen un bajo valor de vitamina D, no todos tienen unos valores elevados de fosfatasas alcalinas, y argumentan que la radiografía de muñeca pudiera ser la prueba más fiable para la detección del raquitismo subclínico176,177.
TratamientoLa tabla 7 detalla los protocolos de tratamiento de la deficiencia de vitamina D.
TABLA 7. Tratamiento del raquitismo por deficiencia de vitamina D: suplemento de vitamina D y de calcio y control del tratamiento
¿Cuándo tratar?El tratamiento con vitamina D es necesario en los lactantes y niños que manifiestan rasgos clínicos de hipocalcemia por deficiencia de vitamina D o raquitismo, y cuando los valores de vitamina D están en la zona de deficiencia.
Sustitución de vitamina D y de calcioSe puede utilizar la vitamina D a dosis diarias de 25- 250 mcg (1.000-10.000 UI) (según la edad del niño) durante un período de 2-3 meses para normalizar los valores de 25(OH)-D y rellenar los depósitos. Recomendamos el empleo de dosis de 1.000 UI diarias para los lactantes < 1 mes de edad, 1.000-5.000 UI diarias para los lactantes de 1-12 meses de edad y > 5.000 UI diarias para los niños de > 12 meses de edad63. Con el tratamiento se observan pruebas radiológicas de curación al cabo de dos a cuatro semanas, tras lo cual se puede disminuir la dosis de vitamina D a 400 UI diarias. La falta de cumplimiento es una importante causa de la falta de respuesta, y una opción tras el primer mes de vida es administrar grandes dosis de vitamina D en una sola administración178,179 (100.000 a 600.000 UI durante 1-5 días), en lugar de dosis menores durante un período más prolongado, seguido de dosis de mantenimiento. Puede ser necesario repetir de forma intermitente una dosis elevada de vitamina D (por lo general cada 3 meses) si persiste el mal cumplimiento con la dosis de mantenimiento. Cuando es necesario administrar grandes dosis de vitamina D (tratamiento “stossâ€, del alemán stossen, que significa “empujarâ€) se debe extremar la precaución si se utilizan presentaciones orales de vitamina D que contienen propileno glicol, como Drisdol, porque el propileno glicol puede ser tóxico a dosis muy elevadas. Un posible abordaje en los niños pequeños es: 1) empapar una cápsula de 50.000 UI en una pequeña cantidad de agua para reblandecerla y administrar la cápsula intacta con un alimento mezclado como zumo de manzana178 o 2) triturar un comprimido de 25.000 a 50.000 UI de vitamina D antes de su administración, para evitar la excesiva administración de propileno glicol. Shah y Finberg han conseguido administrar 100.000 UI de vitamina D cada 2 h durante un período de 12 h178. En los adolescentes y los adultos se ha podido administrar 50.000 UI de vitamina D por vía oral una vez a la semana durante 8 semanas165. La hipocalcemia debería tratarse con suplementos de calcio (tabla 7). Es necesario administrar calcio parenteral en forma de gluconato (10-20 mg de calcio elemento/ kg i.v. lento durante 5-10 min; administrado habitualmente como 1-2 ml/kg de gluconato cálcico al 10%) en caso de tetania o convulsiones manifiestas. En ocasiones también pueden ser necesarios reiterados bolos, así como la administración de calcio con los líquidos intravenosos. Luego se debe mantener los valores de calcio con suplementos orales de calcio. Incluso en los niños no claramente hipocalcémicos, los suplementos de calcio son importantes para evitar la posterior hipocalcemia por una disminución de la desmineralización ósea y un aumento de la mineralización ósea cuando se normalizan los valores de PTH (síndrome del “hueso hambrientoâ€), especialmente con el tratamiento “stossâ€. Las dosis recomendadas de calcio elemento son 30- 75 mg/kg/día fraccionados en tres dosis. Además de los suplementos de calcio puede ser necesario calcitriol a dosis de 20-100 ng/kg/día fraccionados en 2-3 dosis hasta la normalización de los valores de calcio. Son necesarias grandes dosis de calcio al inicio del tratamiento, tras lo que se disminuyen a la mitad durante las siguientes una o dos semanas. Una vez disminuido el suplemento oral con vitamina D a 400 UI diarias, con valores normales de PTH y 25(OH)-D, el suplemento de calcio suele dejar de ser necesario.
Presentaciones disponibles de vitamina D y de calcioLa tabla 8 describe las presentaciones habituales de vitamina D y calcio. La vitamina D inyectable constituye una excelente opción para el tratamiento “stossâ€, pero ya no se comercializa. No obstante, se ha preparado por farmacéuticos locales cuando ha sido necesario. Se debe alentar a las compañías farmacéuticas a fabricar esta presentación parenteral de vitamina D, dada su utilidad en las situaciones de mal cumplimiento. En el tratamiento “stoss†no se utiliza calcitriol. Es caro, tiene una semivida corta y no incrementa los depósitos de vitamina D. Por lo tanto, su empleo en la deficiencia nutricional de vitamina D no es óptimo, y se limita a tratar la hipocalcemia asociada aislada. Además, la administración de calcitriol a grandes dosis puede causar hipercalcemia por su rápida aparición de acción, lo que limita la cantidad que puede ser administrada. De forma similar, el dihidrotaquisterol sólo puede tratar la hipocalcemia asociada con la deficiencia de vitamina D, pero no incrementa los depósitos de vitamina D. La tabla 8 muestra los preparados de calcio habitualmente utilizados. Destaca que el aumento de actividad de 1- alpha;-hidroxilasa por los elevados valores de PTH en la segunda fase del raquitismo puede causar una hipercalcemia transitoria tras el tratamiento con vitamina D por el aumento de 1,25(OH)2-D muy por encima del límite superior de la gama normal.
TABLA 8. Preparaciones de vitamina D, calcio y fósforo
Control del tratamientoEs importante determinar los valores de calcio, fósforo y FA un mes después de iniciado el tratamiento. En el tratamiento “stossâ€, la respuesta bioquímica ocurre al cabo de una o dos semanas, siendo el primer signo un aumento de la tasa de formación ósea. Además, suele producirse un aumento inicial de los valores de 1,25(OH)2-D. Luego, los valores de FA y de 1,25(OH)2- D disminuyen a la normalidad, y los de 25(OH)-D aumentan hasta el valor normal. La curación radiológica completa puede tardar meses, pero los cambios son evidentes al cabo de una semana. Es importante determinar los valores de calcio, fósforo, magnesio, FA, 25(OH)-D y PTH a los 3 meses, y se puede considerar la toma de una muestra de orina para determinar la razón calcio/creatinina. También se debe repetir la radiografía a los 3 meses. Luego, se debe controlar anualmente los valores de 25(OH)-D.
¿Cuándo se debe trasladar al paciente?Si con la sustitución de vitamina D y calcio no existen pruebas de cierta cicatrización al cabo de 3 meses, se debe considerar la malabsorción, la hepatopatía o la falta de cumplimiento con el tratamiento de sustitución. También se debería descartar el consumo de medicamentos que puedan afectar a los valores de la vitamina D. En los pacientes que desarrollan deficiencia de vitamina D como consecuencia de la malabsorción es necesario utilizar dosis de vitamina D superiores a las recomendadas para la deficiencia de vitamina D (hasta 4.000-10.000 UI/día). Suele administrarse en forma de solución acuosa, como Drisdol, con un suplemento oral de calcio. Una gran dosis de vitamina D administrada como inyección intramuscular en aceite es eficaz en las situaciones de malabsorción. Sin embargo, la disponibilidad de esta inyección es variable, lo que limita su empleo. También es necesaria una mayor dosis de vitamina D como tratamiento o suplemento en los niños que reciben anticonvulsivos o glucocorticoides. Wharton y Bishop175 revisaron detalladamente las indicaciones para considerar otras causas de raquitismo, que se resumen aquí. Incluyen la prueba radiológica de raquitismo a < 6 meses de edad y entre los 3 y 10 años. A edades muy jóvenes, la deficiencia de vitamina D tiene más probabilidades de presentarse en forma de hipocalcemia que como raquitismo, y las necesidades de la vitamina D no son tan marcadas en los años infantiles como en los puberales. Las radiografías que muestran una reacción perióstica y una metáfisis apolillada en lugar de los hallazgos descritos anteriormente en esta revisión deberían despertar la sospecha de alteraciones distintas al raquitismo por deficiencia de vitamina D. De forma similar, los valores normales de FA y 25(OH)-D, los valores muy altos o muy bajos de 1,25(OH)2-D y elevados de BUN y creatinina son alertas para considerar otras causas de raquitismo. Entre ellas se incluye la deficiencia de calcio y de fósforo, las formas hereditarias de raquitismo hipofosfatémico y las mutaciones del receptor de la vitamina D. Estas alteraciones no se revisarán aquí, pero es importante tenerlas en cuenta.
CONCLUSIóNEl creciente número de informes sobre el raquitismo en los países occidentales industrializados está relacionado con la práctica de la lactancia materna exclusiva sin suplemento coetáneo de vitamina D en las latitudes septentrionales, la disminución de la exposición a UVB, especialmente en las personas de piel oscura, y el empleo excesivo de filtros solares. Las recomendaciones de suplemento de vitamina D en los lactantes con lactancia materna deberían tener en cuenta la pigmentación cutánea y la geografía. Es necesario que las recomendaciones para el refuerzo de los alimentos utilizados habitualmente con la vitamina D encajen con diversas normas culturales de la ingestión de alimentos y la geografía. Las actuales recomendaciones de exposición al sol y suplemento con vitamina D están limitadas por la escasez de estudios en los niños, la falta de homogeneidad de las determinaciones de 25(OH)-D utilizadas en los estudios de investigación y la carencia de uniformidad en la descripción de los valores normales y anormales de 25(OH)-D en los niños. Es necesario realizar más estudios sobre niños, con determinaciones normalizadas, para determinar los valores de seguridad de la exposición al sol y de los consiguientes valores de vitamina D, así como los valores de 25(OH)-D por debajo de los cuales comienzan las alteraciones patológicas. Se recomienda un umbral bajo para evaluar la suficiencia en vitamina D de los lactantes, los niños y los adolescentes, dado el creciente conocimiento de los efectos de la vitamina D no sólo sobre el metabolismo mineral óseo, sino también sobre el sistema inmunitario y en la prevención de diversos tipos de cáncer. Los datos indican unos mayores costes de la asistencia sanitaria de las enfermedades relacionadas con la deficiencia de vitamina D que los originados por la exposición excesiva a la RUV, lo que indica la necesidad de volver a valorar las recomendaciones del comportamiento de evitación del sol, incluyendo el empleo de filtros solares.
RESUMEN Y PAUTASAgradecemos a los actuales y anteriores miembros del Lawson Wilkins Pediatric Endocrine Society (LWPES) Drug and Therapeutics Committee la meticulosa revisión del manuscrito y sus instructivos comentarios: Mark Palmert, MD; David Geller, MD; Erica Eugster, MD; Phyllis Speiser, MD; Dorothy Shulman, MD; Alan D. Rogol, MD. También damos las gracias a los tres expertos revisores seleccionados por el Board of Directors de la LWPES para revisar y criticar este manuscrito.