La displasia broncopulmonar es una enfermedad pulmonar crónica asociada con el nacimiento prematuro y caracterizada por una lesión pulmonar temprana. En esta revisión analizamos algunas de las dificultades, problemas y progresos en esta alteración durante la última década, centrándonos principalmente en los últimos 5 años, y limitándonos a los estudios sobre neonatos. Revisaremos los cambios de la definición, la patogénesis, la susceptibilidad genética y los marcadores biológicos recientes asociados con la displasia broncopulmonar. Evaluaremos el progreso de las actuales estrategias terapéuticas, junto con los abordajes y tratamientos novedosos. Finalmente, resumiremos los datos recientes sobre el resultado pulmonar y del desarrollo neurológico a largo plazo de los neonatos con displasia broncopulmonar.
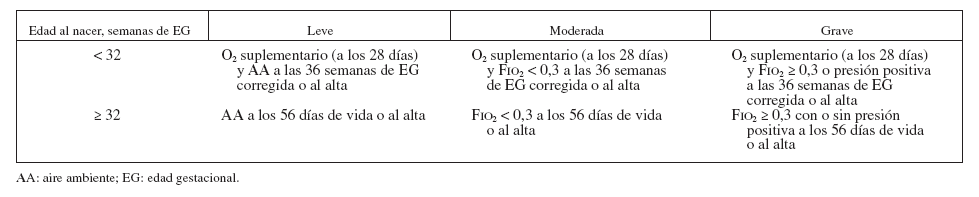
La antigua definición de la displasia broncopulmonar (DBP), la causa más habitual de enfermedad pulmonar crónica del lactante1, se basaba únicamente en la duración de la necesidad de oxígeno suplementario, que está intrínsecamente relacionada con la patogénesis y el tratamiento de esta enfermedad2. Para resolver este problema se propusieron criterios específicos para el diagnóstico y la gravedad de la DBP3 (tabla 1).
TABLA 1. Criterios diagnósticos de la DBP
INCIDENCIALos primeros estudios se centraron principalmente en neonatos de una edad gestacional (EG) < 32 semanas y un peso al nacimiento (PN) < 1.500 g4. La mayoría de los casos actuales (“nueva” DBP) corresponde a neonatos de < 30 semanas de EG y < 1.200 g de PN. En un estudio reciente, la incidencia de DBP (aplicando la definición de 36 semanas de edad posmenstrual [EPM]) fue del 42% (PN = 501-750 g), 25% (PN = 751-1.000 g), 11% (PN = 1.001-1.250 g) y 5%5 (PN = 1.251-1.500 g). Los neonatos con un PN < 1.250 g constituyeron el 97% de los pacientes con DBP6.
La definición fisiológica, basada en una prueba de disminución de oxígeno a las 36 semanas de EPM, disminuyó la incidencia de la DBP en un 10%7. Los resultados adversos, pulmonares y del desarrollo neurológico, de los neonatos aumentan conforme a la gravedad de la DBP8.
ANATOMÍA PATOLÓGICAAl cambiar la población a neonatos de menor EG y PN, los hallazgos anatomopatológicos pulmonares de la nueva DBP revelan una insuflación más uniforme y me-nor fibrosis, con ausencia de metaplasia epitelial en las vías respiratorias pequeñas y grandes e hipertrofia del músculo liso, comparado con la “antigua” DBP.
Ha resultado difícil alcanzar el consenso sobre si la microvascularización pulmonar disminuye9 o aumenta10,11. La controversia deriva de los hallazgos de los estudios sobre animales12 y de las dificultades técnicas en la obtención y la realización de un meticuloso estudio anatomopatológico sobre muestras humanas10,11. Es indudable la alteración de la vascularización pulmonar en la DBP1,13. Las alteraciones vasculares observadas fueron una marcada angiogénesis, proporcional al crecimiento del parénquima pulmonar que realiza el intercambio de gases11, una anormal distribución de los capilares alveolares14, unos vasos angulares destacados con densidad capilar variable en los alvéolos adyacentes15 y unos vasos más alejados de la superficie aé
rea11,16.
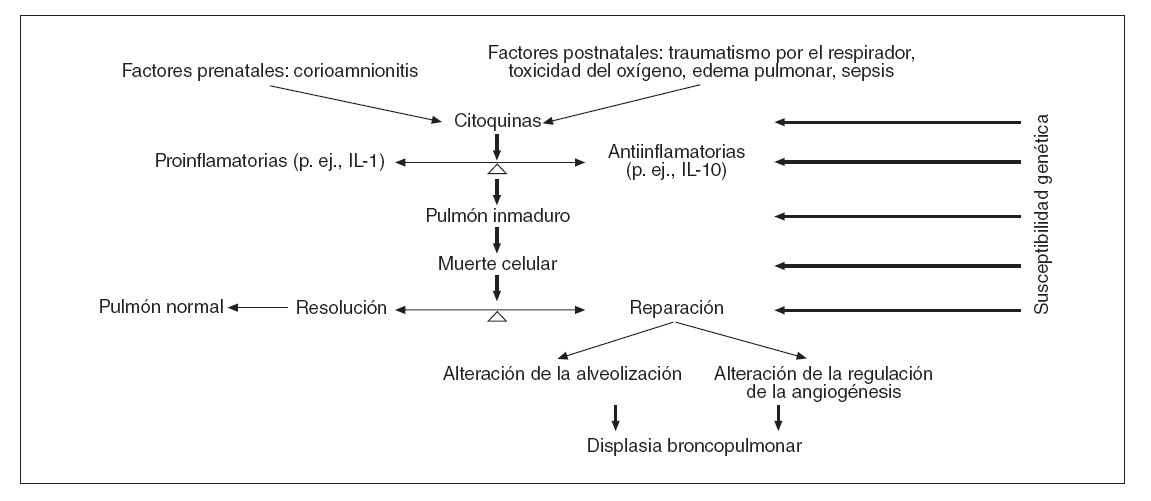
PATOGÉNESISAunque la piedra angular de la patogénesis de la DBP ha sido el pulmón inmaduro en el que una serie de facto-res “ambientales” (infección, hiperoxia, barotrauma/volutrauma) produce lesiones, durante los últimos 5 años se ha conocido mejor este proceso. Factores pre y posnatales contribuyen a la liberación de citoquinas “pro y antiinflamatorias”. El desequilibrio de estos mediadores provoca la activación de las vías de la muerte celular en el pulmón, lo que se sigue de la cicatrización (paso de la lesión a una arquitectura pulmonar normal) o a la reparación17,18. Esto se caracteriza por una alteración de la alveolización y la alteración de la regulación de la angiogénesis, que conduce a una disminución del número de alvéolos, simplificados y de mayor tamaño, y a una vascularización pulmonar dismórfica (fig. 1), que constituyen las piedras angulares de la DBP1.
Fig. 1. Patogénesis de la nueva DBP.
GENÉTICALos factores genéticos y ambientales que hacen más o menos probable el desarrollo de una enfermedad en una persona constituyen la predisposición o la susceptibilidad. La heredabilidad consiste en el componente genético de la enfermedad. El gran tamaño de la muestra de un estudio multicéntrico que ajustó respecto a las principales covariantes19 permitió que los resultados fueran generalizables a la población de pretérminos, porque no se pudo atribuir un riesgo adicional de DBP a la gemelaridad20, aparte del debido a la prematuridad. La identificación de un componente genético (que contribuyó a > 50% de la susceptibilidad) de la DBP ha transformado una enfermedad tradicionalmente considerada como exclusivamente secundaria a factores “ambientales” en otra resultante de interacciones “gen-ambiente”19,31. El establecimiento de una tendencia familiar y de la heredabilidad en los estudios sobre gemelos debería impulsar los esfuerzos por identificar una asociación alélica reproducible con la susceptibilidad genética a la DBP21-24.
Los problemas de los estudios publicados son numerosos. Cerca de la mitad de los estudios iniciales de la asociación genética, incluso los que muestran los efectos más potentes (razón de posibilidades > 2,0) o con menores valores de p (< 0,001), no han sido replicados. Entre las razones para ello se cuentan la mezcla poblacional (casos y controles no igualados), la heterogeneidad fenotípica (inclusión de casos genéticos y no genéticos) y, habitualmente, la escasa potencia de los estudios. Los estudios de seguimiento con mayor tamaño de la muestra probablemente amortiguarán los informes iniciales de la asociación en los estudios de menor tamaño todavía no replicados. Esto tendría sentido si la DBP es, al menos parcialmente, poligénica, porque ningún gen en concreto ejercerá un efecto suficientemente grande para ser evidente en los estudios de pequeño tamaño. Los abordajes de gen candidato se han limitado a uno o unos pocos genes candidatos, por lo que omiten importantes determinantes moleculares de la enfermedad que no se relacionan intuitivamente con la DBP. Además, la publicación de resultados irreproducibles por el pequeño tamaño de la muestra disminuirá la credibilidad y el entusiasmo de los robustos estudios genéticos en la DBP.
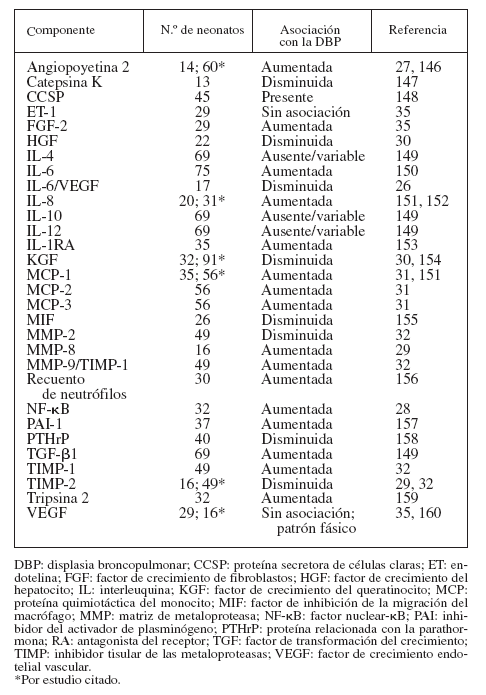
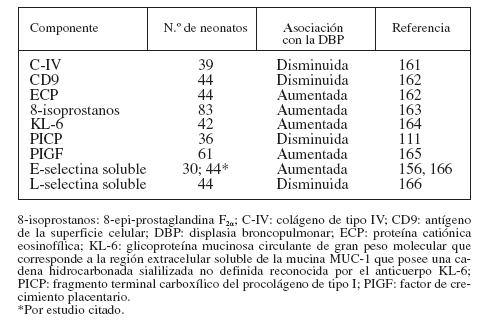
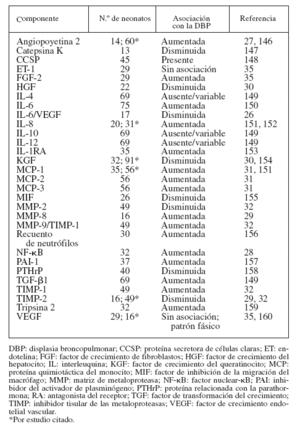
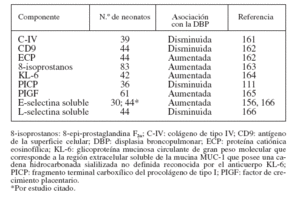
MARCADORES BIOLÓGICOSPara la identificación temprana de los neonatos que posteriormente desarrollarán DBP se ha propuesto un gran número de marcadores biológicos detectados en el aspirado traqueal (AT), la sangre y la orina. Las muestras de AT pueden ser sustitutos idóneos de las muestras de lavado broncoalveolar en los neonatos pretérmino25, aunque se duda de la validez de los marcadores del AT por la carencia de “valores normales”. Aunque algunos autores han defendido el empleo de las proteínas totales26,27, el componente secretor de la inmunoglobulina A28-32 y la urea sérica33,34, otros han alegado que no es necesaria la normalización35-38. El AT tiene la desventaja adicional de la imposibilidad de obtener datos de los neonatos no intubados (con una enfermedad menos grave) para establecer comparaciones. Las tablas 2 y 3 resumen los parámetros determinados en el AT y en la sangre, obtenidos habitual-mente durante la primera semana de vida.
Los valores urinarios de los F2 isoprostanos no muestran correlación39 (n = 24), pero los valores urinarios elevados del péptido similar a bombesina se asocian con un aumento al décuplo del riesgo de desarrollar DBP40 (n = 50).
Los lactantes con DBP (n = 15) mostraron una menor área de los vasos sanguíneos y una mayor complejidad de la red vascular en la mucosa gingival y vestibular inferior que los controles41.
El problema de estos estudios es que, en su mayoría, se realizaron sobre un pequeño número de neonatos. La mayor parte de los intentos de identificar marcadores biológicos ha debido recurrir al compartimento pulmonar. Otros puntos difíciles son la recogida del AT en distintos momentos, la habitual medición de marcadores aislados, con o sin normalización, y la variable definición de la DBP. Pocos se han replicado sobre distintas cohortes. Los que obtuvieron resultados congruentes fueron la angiopoyetina 2, la interleuquina 6 (IL-6), la proteína 1 quimiotáctica del monocito y el inhibidor tisular de la metaloproteasa 2 (tabla 2). Se pudo replicar el factor de crecimiento endotelial vascular (VEGF), pero con resultados variables (tabla 2). La mayoría de los comentarios antes expresados son igualmente ciertos para los marcadores sanguíneos y urinarios. De momento, no existe un marcador biológico “mágico” para la identificación temprana de los neonatos que posterior-mente desarrollarán DBP. En este campo, la proteómica es un nuevo abordaje prometedor.
TABLA 2. Empleo de los componentes del AT como marcadores biológicos de la DBP
TABLA 3. Empleo de los componentes de la sangre y del suero como marcadores biológicos de la DBP
Otro problema consiste en que la mayoría sólo ha demostrado una asociación con la DBP. Para demostrar una relación causal, deben ser estudiados sobre modelos ani-males adecuados desde el punto de vista del desarrollo y sobre pulmones humanos con DBP. En este sentido, se ha conseguido cierto progreso con la elastina42,43, la catepsina S44,45, el factor de crecimiento del hepatocito46, el factor de crecimiento del queratinocito47, la IL-1β48, la IL-649, la proteína 1 quimiotáctica del monocito50, el factor de transformación del crecimiento β151,52, el VEGF53-58, el péptido similar a bombesina59 y la angiopoyetina 227, aunque es necesario profundizar en el trabajo.
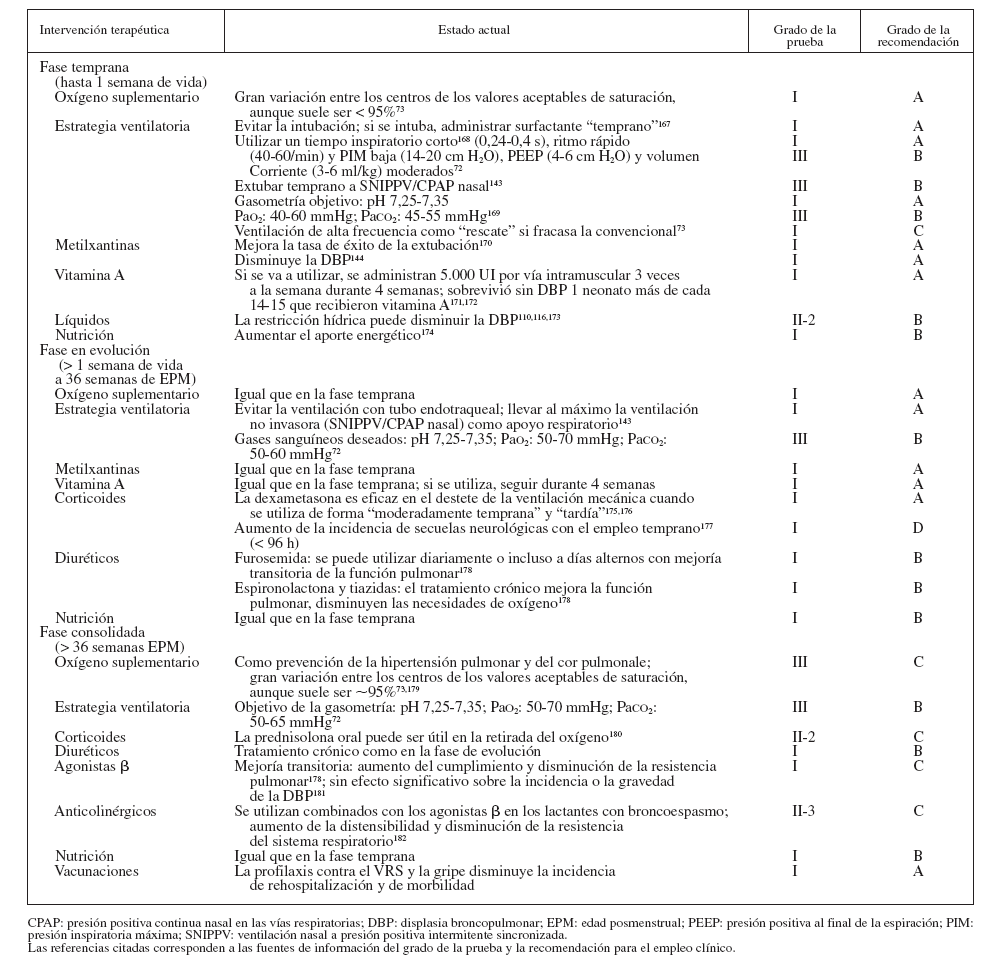
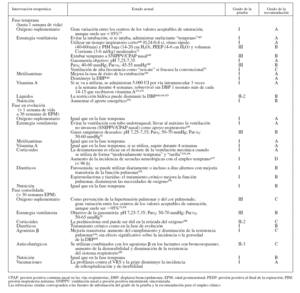
TRATAMIENTOLa tabla 4 muestra la clasificación de la solidez de las pruebas y las recomendaciones de empleo en las pautas clínicas. La tabla 5 resume el estado actual de los enfoques terapéuticos en las 3 fases (temprana, en evolución y consolidada) de la DBP. Entre los supervivientes a la DBP de mayor edad se utilizaron los corticoides inhalados y los agonistas β como tratamiento de los síntomas, con independencia de la gravedad de la DBP durante la lactancia. No existen ensayos aleatorizados controlados (EAC) que apoyen o se opongan a este abordaje.
TABLA 4. Grados de las pruebas y las recomendaciones de empleo clínico según las pautas desarrolladas por el US Preventive Services Task Force
TABLA 5. Tratamiento de la DBP según la fase (temprana, en evolución y consolidada)
Sería ideal prevenir la DBP. Entre los factores prenatales, la medida aislada más eficaz es la prevención del nacimiento prematuro. La comprensión del trabajo de parto pretérmino60 y los tratamientos dirigidos a inhibirlo con seguridad serían objetivos importantes. El empleo de progesterona para prevenir el trabajo de parto prematuro ha sido prometedor, aunque prolongar la gestación por este medio no ha mejorado todavía el resultado neonatal61. El abordaje de los aspectos sociales y educacionales relativos al nacimiento pretérmino62 podría ejercer un impacto importante.
Los corticoides prenatales siguen siendo la intervención aislada más eficaz para la maduración pulmonar. El impacto de los corticoides prenatales sobre la DBP ha sido tema de debate, ya que algunos estudios informan de un beneficio escaso o nulo. No es sorprendente, dada la compleja naturaleza de la enfermedad (fig. 1) y que otros factores pueden enmascarar su beneficio63. No se recomienda la administración semanal repetida de corticoides prenatales64. Se prefiere la betametasona a la dexametasona65,66.
Gran parte del esfuerzo de investigación se dedicó a la comprensión del papel de la inflamación, pre y posnatal, en la patogénesis de la DBP67-69. Aunque se recomienda la administración de antibióticos a la madre cuando se sospecha o diagnostica una infección intraamniótica70, las intervenciones prenatales para tratar la corioamnionitis no han disminuido la incidencia de DBP; las intervenciones posnatales pueden ser demasiado tardías para que resulten eficaces71.
Los abordajes y tratamientos novedosos utilizados en el tratamiento o la prevención de la DBP incluyen estrategias de ventilación y farmacológicas. Los estudios realizados con ventilación desencadenada por el paciente no han demostrado disminución alguna de la incidencia de DBP72,73, aunque se ha apuntado que puede ser más beneficiosa para los neonatos con PN < 1.000 g74. Un metaanálisis que comparó la ventilación regida por volumen con la limitada por presión no encontró diferencia en la incidencia de DBP entre los 2 grupos75. Se sigue investigando para definir mejor los parámetros que pudieran ser beneficiosos73. Como ninguno de los nuevos aparatos ha demostrado su superioridad en la prevención de la DBP, el mejor abordaje podría ser evitar la ventilación. En este sentido, el tratamiento tensioactivo temprano con extubación para proseguir con presión positiva continua nasal en las vías respiratorias (CPAP) se asocia con una menor necesidad de ventilación mecánica, menor incidencia de DBP y menor número de síndromes de escape aéreo, comparado con el tratamiento tensioactivo selectivo posterior y el mantenimiento de la ventilación mecánica seguido de extubación a un menor soporte ventilatorio76. El empleo de un valor límite de la fracción inspiratoria de oxígeno (Fio2) de 0,45 para decidir sobre la intubación transitoria y el tratamiento tensioactivo parece disminuir la incidencia de escapes aéreos y de DBP26. Sin embargo, la revisión Cochrane no incluyó los resultados del ensayo de CPAP o intubación al nacer (COIN), en el que el CPAP nasal temprano en los neonatos de 25 a 28 semanas de gestación no disminuyó significativamente la tasa de muerte o DBP, comparado con la intubación, y el grupo con CPAP mostró mayor incidencia de neumotórax77. Se está realizando el estudio SUPPORT, de la Neonatal Research Network, patrocinado por el Eunice Kennedy Shriver National Institute of Child Health and Human Development, que examina este mismo asunto además de los límites óptimos de saturación de oxígeno. Otro abordaje consiste en utilizar la ventilación nasal a presión positiva intermitente, en modo sincronizado78 o no sincronizado79, que ha conseguido una disminución de la DBP en los EAC. El ensayo de ventilación nasal en pretérminos (NTP), en realización, es un gran EAC multicéntrico internacional que trata de confirmar los hallazgos de los estudios iniciales. Una atractiva alternativa a la intubación y la administración intratraqueal de surfactante sería la administración en aerosol. Un nuevo surfactante sintético (lucinactant), que contiene el novedoso péptido sinapultide, un mimético de la proteína B del surfactante80, parece ser similar al surfactante obtenido de animales cuando se administra por vía intratraqueal en 2 ensayos clínicos aleatorizados multicéntricos81,82. El metaanálisis de estos estudios no mostró diferencias estadísticamente significativas en los resultados de muerte y DBP83. Sin embargo, en la actualidad no se dispone de una presentación tensioactiva eficaz en aerosol para su empleo clínico rutinario. Aguardamos a los nuevos progresos en esta área84,85. El óxido nítrico inhalado (NOi) puede ser beneficioso86,87 o no88,89, por lo que será necesario realizar más estudios para identificar mejor los posibles beneficios para la población diana con probabilidades de desarrollar una DBP90. El empleo de NOi parece seguro en esta población91, aunque no parece modificar la composición del surfactante92 ni la función pulmonar93. En la actualidad no se recomienda el empleo rutinario del NOi para disminuir la incidencia de DBP en la población de pretérminos94, a la espera de los datos del resultado a largo plazo.
El empleo de corticoides posnatales, de los que el mejor estudiado es la dexametasona, ha resultado muy controvertido, y el péndulo oscila de un extremo al otro71.
Otro corticoide, la hidrocortisona, no mejoró la supervivencia sin DBP en un EAC, y hubo que concluir el ensayo porque los neonatos tratados con hidrocortisona que recibieron indometacina mostraron mayor número de perforaciones gastrointestinales95. Se debe ponderar la bien conocida eficacia en la extubación96 frente a la posibilidad de producir un daño al desarrollo neurológico97, y es necesario seguir investigando para encontrar la preparación corticoide “correcta”, así como su dosis y su cronología.
En la mayoría de los casos es prudente mantener la saturación de oxígeno de los neonatos pretérmino entre el 90% y el 95%, a fin de evitar la toxicidad del oxígeno e intentar prevenir el desarrollo de la DBP98, aunque puede ser difícil conseguir los objetivos deseados99,100. La identificación del óptimo objetivo de la saturación de oxígeno es un área de intensa investigación.
Otros fármacos estudiados son los siguientes:
InositolEn un metaanálisis de EAC que utilizaron el suplemento con inositol en recién nacidos prematuros, 2 ensayos informaron del resultado de muerte o DBP, que disminuyó significativamente101.
Antibióticos macrólidosNo se ha demostrado que la eritromicina disminuya la incidencia de DBP en los neonatos tratados de manera profiláctica o tras conocer su colonización por Ureaplasma102. En un estudio piloto, la azitromicina no disminuyó la incidencia de DBP103.
N-acetilcisteínaEn un gran EAC, el tratamiento durante 6 días con Nacetilcisteína no previno la DBP ni la muerte de los neonatos de PN < 1.000 g104.
Proteína recombinante de 10 kilodaltones de célula claraEl empleo de una proteína antiinflamatoria, la proteína recombinante de 10 kilodaltones de la célula clara humana (CC10), ha mostrado resultados iniciales prometedores105.
Superóxido dismutasa recombinanteAunque el antioxidante recombinante Cu-Zn superóxido dismutasa (SOD) no ha mostrado diferencia alguna en el resultado106, los neonatos de < 27 semanas de EG que recibieron SOD en un estudio tuvieron menos hospitalizaciones y visitas al servicio de urgencias y utilizaron el tratamiento broncodilatador con menor frecuencia al año de edad, comparado con los neonatos que no recibieron SOD107, lo que apunta a que la SOD pudo interrumpir la cascada inflamatoria de los radicales oxígeno y conferirles un beneficio a largo plazo.
Dada la compleja naturaleza de la DBP (fig. 1), no es probable que una sola “bala mágica” (con la posible excepción de la prevención del parto pretérmino) ejerza un impacto significativo sobre la DBP. Se puede conseguir una mejoría abordando numerosos aspectos de esta alteración, como el diagnóstico y tratamiento temprano de la sepsis pre y posnatal, el óptimo mantenimiento de la oxigenación y el equilibrio hidroelectrolítico y la enérgica nutrición temprana, parenteral y enteral, junto a las adecuadas estrategias de ventilación108-116. El empleo de este abordaje combinado ha obtenido resultados prometedores117.
RESULTADOS PULMONARESEs importante tener en cuenta las limitaciones de la mayoría de estos estudios, que incluyeron a neonatos pretérmino nacidos antes del amplio empleo de los corticoides prenatales y el surfactante.
MorbilidadLos neonatos con DBP muestran mayores tasas de rehospitalización (hasta el 50%) durante el primer año de vida118,119. Los síntomas respiratorios de los pacientes con DBP perduran tras los 2 primeros años de vida, hasta los años preescolares120, la adolescencia y la juventud121,122. No está claro si la gravedad de la DBP o la prematuridad influyen, por sí mismas, sobre la persistencia y la gravedad de los síntomas.
Hallazgos radiológicosLas anomalías de la radiografía y la tomografía computadorizada (TC) de tórax persisten hasta la adolescencia y la edad adulta, siendo más sensible la TC123,124. Las imágenes de TC de los neonatos con la nueva DBP no son muy distintas a las de la antigua DBP, excepto en la ausencia de afectación bronquial125. Un curso clínico más grave se correlaciona con mayores anomalías radiológicas y de la función pulmonar125. Un sistema de puntuación de la TC puede ayudar en el pronóstico de la DBP126.
Función pulmonarLos pacientes con DBP siguen presentando una importante alteración y deterioro de la función pulmonar al final de la adolescencia127,128. Se ha publicado una relación inversa entre el volumen espiratorio forzado en 1 s en la edad escolar y la duración del oxígeno suplementario129. Por otra parte, algunos autores han observado una mala correlación entre la duración de la ventilación mecánica y la del oxígeno suplementario con el flujo espiratorio forzado en los neonatos con DBP130. Otro problema es la escasez de estudios comparativos de los distintos modos de ventilación con la función pulmonar en los supervivientes a la DBP. Los neonatos que recibieron ventilación oscilatoria a gran frecuencia (VOAF) o ventilación mecánica convencional (VMC) mostraron un bajo flujo espiratorio a los 6 y 12 meses131. Sin embargo, a los 12 meses, los neonatos sometidos a VOAF tuvieron una función pulmonar significativamente mejor131. Otro estudio comparó la función pulmonar a los 8 o 9 años de edad de los neonatos pretérmino con antecedente de síndrome de dificultad respiratoria o DBP tratados con VMC con la de grupos similares que recibieron VOAF132. No hubo diferencia significativa en el grado de enfermedad pulmonar obstructiva leve en función del modo de ventilación, lo que sugiere la influencia de otros factores en el resultado pulmonar a largo plazo132.
Otro problema es la escasez de estudios que examinasen si la anomalía de la función pulmonar en la lactancia se correlaciona con el grado de la anomalía en una etapa posterior. Filippone et al133 midieron la función pulmonar en el mismo grupo de niños en edad escolar e informaron de una significativa correlación entre la capacidad funcional residual (Vmax [CFR]) medida a los 24 meses y tanto el volumen espiratorio forzado en 1 s (VEF1) como el flujo medioespiratorio forzado (FEF25%-75%). No se han publica-do datos seriados para los adolescentes ni los adultos.
La mayoría de los estudios no mostró disminución de la capacidad de esfuerzo de los niños con DBP comparados con neonatos a término sanos o con neonatos pretérmino sin enfermedad pulmonar134. Estudios recientes sobre grandes cohortes de neonatos prematuros informan de una significativa disminución de la capacidad de esfuerzo pese a la normalidad de la media de la función pulmonar o una leve obstrucción de las vías respiratorias pequeñas y el atrapamiento gaseoso135, lo que indica que la alteración de la tolerancia al esfuerzo fue secundaria a la mala forma física, que puede mejorar con un programa de entrenamiento136.
Las anomalías pulmonares que pueden persistir hasta la edad adulta son la obstrucción de las vías respiratorias, la hiperreactividad de las vías respiratorias y el enfisema123,128,135,137,138.
RESULTADOS DEL DESARROLLO NEUROLÓGICOLa mayoría de los estudios sobre la DBP ha tenido un diseño transversal, y el efecto independiente de la DBP es difícil de evaluar dada la gran probabilidad de la presencia de complicaciones médicas adicionales en estos neonatos. Aunque los neonatos pretérmino corren mayor riesgo de alteración del desarrollo neurológico, la DBP es un factor de riesgo adicional139. Probablemente es consecuencia de numerosos factores, como los frecuentes episodios de hipoxia, el mal crecimiento y, posiblemente, los corticoides posnatales139. Los neonatos de < 1.500 g de PN con DBP muestran mayor alteración de la motilidad grosera y retraso de la función cognitiva y del lenguaje comparado con los libres de DBP140,141. Los niños con DBP grave tienen peores resultados y necesitan más intervenciones a los 8 años de edad que los niños con DBP moderada o leve142.
La DBP no parece estar asociada con una alteración específica del desarrollo neuropsicológico, sino con una alteración global139. El espectro de alteración del desarrollo neurológico parece mostrar buena correlación con la gravedad de la DBP8,119.
RESUMENDurante los últimos 5 años se ha progresado en la definición, la patogénesis y las estrategias de tratamiento de la DBP:
- Una definición de la DBP, validada por consenso, con clasificación de la gravedad8 (tabla 1).
- La identificación y la cuantificación de la contribución genética a la DBP19.
- Resurgimiento de la ventilación no invasora en la prevención y el tratamiento de la DBP143.
- La eficacia y la seguridad de la cafeína en la prevención de la DBP144,145.
La tabla 6 detalla ciertos aspectos sobresalientes específicos.
TABLA 6. Lista de preguntas específicas importantes en la DBP
CONCLUSIONESSe ha progresado, pero persisten los problemas, y es necesario seguir investigando para mejorar los resultados. La máxima posibilidad de obtener este impacto estriba en centrarse en los aspectos de la biología básica (desarrollo pulmonar, identificación de marcadores biológicos, genética, modelos animales) y en los abordajes de tratamiento farmacológico6. Las futuras mejorías significativas probablemente dependerán de nuestra capacidad de identificar los componentes genéticos de la DBP y de acotar los tratamientos específicos19.
Correspondencia: Vineet Bhandari, MD, DM, Yale University School of Medicine, Division of Perinatal Medicine, Department of Pediatrics, LCI 401B, PO Box 208064, New Haven, CT 06520-8064, Estados Unidos.
Correo electrónico: vineet.bhandari@yale.edu