Se presentan aquí los problemas que afrontan los supervivientes del cáncer infantil y los efectos tardíos de su tratamiento, malignos y no malignos, diferenciados por sistemas orgánicos. Se ofrecen recomendaciones para monitorizar dichos efectos tardíos, así como una tabla donde se enumeran los lugares irradiados y los agentes quimioterápicos empleados, con determinados efectos tardíos resultantes. Finalmente, se sugiere una recomendación para el establecimiento de una consulta orientada hacia los mencionados efectos tardíos.
Los médicos de asistencia primaria, a saber, pediatras, internistas, médicos de familia y obstetras/ginecólogos, son y seguirán siendo quienes se ocupan de los supervivientes del cáncer infantil. Por lo tanto, es obligado que se familiaricen con los efectos tardíos del tratamiento anticanceroso, para prevenir o disminuir dichos efectos. No nos ocuparemos de la quimioterapia que se emplea para tratar el cáncer del adulto pero no el infantil, ni tampoco de los efectos tardíos del tratamiento quirúrgico. En la literatura de asistencia primaria correspondiente a los últimos 5 años sólo se ha publicado una revisión global sobre los efectos tardíos del tratamiento del cáncer infantil1. Desde dicha publicación en 2002, se dispone de una enorme cantidad de información acerca de este tema.
EL PROBLEMAEn Estados Unidos hay 10 millones de individuos que viven hoy en día con un diagnóstico de cáncer, lo que triplica el número de supervivientes en 19712. En los adultos, la tasa de supervivencia del cáncer a los 5 años es del 60-65%; en los niños, del 80-85%3. En un futuro próximo, 1 de cada 450 individuos de la población será un superviviente a largo plazo del cáncer infantil4; en la actualidad, la proporción es de 1 por cada 640 personas de 20-39 años5.
La morbilidad a largo plazo de los supervivientes del cáncer infantil, que actualmente son unos 270.000 en Estados Unidos, se determinó en el trabajo de referencia Childhood Cancer Survivor Study6 (CCSS). Se entrevistó a 10.397 pacientes con una edad media de 26,6 años (límites 18-48 años) que se habían tratado desde 1970 a 1986, y se compararon con sus hermanos. El 62,3% sufría al menos 1 proceso crónico; el 27,5%, un problema grave potencialmente mortal. El riesgo relativo (RR) de un proceso crónico en un superviviente, en comparación con un hermano, fue de 3,3; en cuanto a los procesos graves potencialmente mortales, el RR fue de 8,2 en comparación con un hermano. La incidencia acumulada de procesos crónicos fue de 73,4% 30 años después del diagnóstico, con una incidencia acumulada del 42,4% para los procesos graves, discapacitantes o potencialmente mortales, o el fallecimiento por un proceso crónico. El 37,6% de los pacientes presentaba 2 o más procesos crónicos, en comparación con el 13,1% en los hermanos, y el 23,8% sufría 3 o más procesos crónicos, frente al 5,4% en los hermanos. El RR de determinados procesos graves, potencialmente mortales o discapacitantes fue el siguiente: reemplazamiento de una articulación importante sin formar parte del tratamiento (54), insuficiencia cardíaca congestiva (15,1), segundo cáncer excluidos los carcinoma de células basales o escamosas (14,8), disfunción cognitiva grave (10,5), arteriopatía coronaria (10,4), accidente cerebrovascular (9,3), insuficiencia renal o diálisis (8,9), sordera que no se corrige con una prótesis auditiva (6,3), legalmente ciego de un ojo (5,8) e insuficiencia ovárica (3,5). Los supervivientes de tumores óseos, del sistema nervioso central (SNC) o del linfoma de Hodgkin tuvieron el riesgo máximo de presentar estos procesos graves o potencialmente mortales y también más probabilidades de sufrir varios procesos.
Los supervivientes de tumores óseos presentaron con más frecuencia graves problemas osteomusculares, insuficiencia cardíaca congestiva y sordera, mientras que en los supervivientes de tumores del SNC hubo más tendencia hacia la disfunción cognitiva, las convulsiones y las endocrinopatías. Los supervivientes del linfoma de Hodgkin tuvieron más probabilidades de sufrir coronariopatías, accidentes cerebrovasculares, cardiopatías valvulares, miocardiopatías, segundos cánceres (mama) y patología pulmonar y tiroidea. La exposición a 1 de 5 combinaciones terapéuticas se asoció con un riesgo de presentar un proceso crónico o potencialmente mortal que superaba en 10 veces al riesgo esperado: radioterapia torácica y bleomicina, radioterapia torácica y antraciclina, radioterapia torácica y abdominal o pélvica, antraciclina y un agente alquilante e irradiación abdominal o pélvica y un agente alquilante. Las evoluciones psicosociales adversas, como la depresión, no se incluyen en este análisis.
Cerca del 95% de los niños de 0-14 años recibe tratamiento en centros del Children’s Oncology Group (COG), y el 65% se incluye en ensayos clínicos7. En otro trabajo del CCSS para determinar el tipo de asistencia médica recibida durante un período de 2 años, se encuestó a 9.434 pacientes con una edad media de 26,8 años (límites 18-48 años). El 87% visitaba a un médico general, el 71,4% se sometía a una exploración física general, el 41,9% se visitaba a causa del cáncer, y sólo el 19,2% acudía a un centro oncológico8.
Recientemente se han descrito las ventajas e inconvenientes que se observan en las clínicas de seguimiento a largo plazo. En una encuesta efectuada a los directores de 24 programas de seguimiento global a largo plazo para los supervivientes del cáncer infantil en Estados Unidos y Canadá, se enumeraron los siguientes beneficios primarios: asistencia por parte de clínicos familiarizados con los riesgos a largo plazo, cribado basado en el riesgo y educación dirigida a disminuir el riesgo y a mantener un estilo de vida saludable. Los obstáculos para el funcionamiento de estas clínicas fueron: recursos y financiación insuficientes, escaso compromiso de las instituciones, falta de capacidad para asistir a una creciente población, dificultades para la comunicación continuada con los médicos de la colectividad y falta de interés y conocimientos específicos entre los supervivientes9.
En un estudio efectuado en Suecia se enviaron cuestionarios, 5 o más años después de haber finalizado el tratamiento, a 335 supervivientes de leucemia aguda, linfoma o tumor de Wilms mayores de 18 años10 (tasa de respuestas del 73%). El 60% no realizaba visitas de control con regularidad, y el 42% de ellos las encontraba a faltar. Un tercio estaba descontento del programa de seguimiento, pero sólo el 3% que acudía con regularidad a las visitas de control las encontraba innecesarias. El 47% manifestó quejas subjetivas sobre su enfermedad o tratamiento. El 34% de todos los que respondieron no echaba de menos los controles regulares, y el hecho de no percibir molestias relacionadas con la enfermedad o la radioterapia predecía el tener visitas de control programadas.
En un trabajo sobre 650 supervivientes del cáncer infantil, se determinó que cerca del 40% se controlaba por problemas endocrinos, dificultades auditivas o visuales, trastornos neurocognitivos, disfunción cardiopulmonar, problemas digestivos, segundos procesos malignos y complicaciones varias, mientras que aproximadamente el 30% no presentaba problemas11. En otro estudio realizado en 290 supervivientes del cáncer infantil, el 41% presentaba problemas endocrinos, el 26% toxicidad en los órganos, el 17% problemas de movilidad, el 15% dificultades neuropsicológicas, el 14% infertilidad, el 13% dificultades visuales o auditivas, y el 10% problemas estéticos12. Además, los supervivientes del cáncer infantil tienen problemas de cobertura sanitaria13 y de desempleo, especialmente si han sufrido tumores del SNC14.
Todas las recomendaciones de monitorización que siguen son mías personales. Las recomendaciones del COG pueden hallarse en su página web15.
EFECTOS TARDÍOS NO MALIGNOS DEL TRATAMIENTO ANTICANCEROSOEl tratamiento del cáncer puede afectar adversamente a los siguientes órganos.
CorazónSe han descrito miocardiopatías, disfunción ventricular izquierda subclínica, valvulopatías, patología pericárdica y arritmias. Las lesiones cardíacas pueden producirse por las antraciclinas (doxorubicina, daunorubicina, mitoxantrona, epirubicina e idarubicina), que reciben aproximadamente el 60% de los pacientes de cáncer infantil tratados en la actualidad16. Puede haber un mayor riesgo de lesiones cardíacas a consecuencia del tratamiento con antraciclinas en mujeres embarazadas (el 40% de aumento de la volemia que se produce en el embarazo puede influir adversamente sobre la miocardiopatía subclínica por antraciclinas o propia del embarazo, si ocurre), en niñas < 4 años o en mujeres que se tratan con otros fármacos que afectan al corazón o si se emplea la radioterapia torácica17.
Después del tratamiento con antraciclinas, el riesgo de insuficiencia cardíaca congestiva es del 0-16%, y el de miocardiopatía subclínica, de 0-57%18. El riesgo de lesión cardíaca depende principalmente de la dosis acumulada de antraciclinas. Después de más de 6 años de seguimiento, el 57% de los niños con leucemia linfoide aguda tratados con 45-500 mg/m2 (media, 360 mg/m2) de doxorubicina presentaba anomalías de poscarga o de contractilidad ventricular izquierda. Sin embargo, el 17% de los pacientes que recibieron sólo una dosis de doxorubicina (45 mg/m2) desarrolló un aumento de la poscarga, y los pacientes que recibieron una dosis acumulada de sólo 228 mg/m2 de doxorubicina presentaban un aumento de la poscarga (59%), una disminución de la contractilidad (23%), o ambas19. La protección frente a la toxicidad cardíaca de las antraciclinas debida a los radicales libres puede lograrse con dexrazoxano, un eliminador de los radicales libres del oxígeno20. Otros fármacos antineoplásicos pueden producir también lesiones cardíacas, aunque en menor grado21. La irradiación torácica puede ser responsable así mismo de cardiotoxicidad22. Se ha descrito la fisiopatología de la miocardiopatía asociada con las antraciclinas y la radioterapia22,23.
Deben realizarse controles anuales mediante la historia clínica y la exploración física (HC/EF), así como ecocardiografías cada año durante 2 años, y luego cada 2 años si los resultados son normales. En las embarazadas se realizará una ecocardiografía cada trimestre y al menos un estudio cardiológico si la ecocardiografía es anormal.
Sistema vascularSe han descrito lesiones arteriales con ictus o infarto de miocardio. Los pacientes que reciben irradiación craneal o torácica tienen riesgo de sufrir estas complicaciones. En un informe del CCSS sobre los procesos malignos del SNC en el niño, se produjo el ictus en el 1,6% de los pacientes24. En un informe del CCSS25 se identificó a 37 de 4.828 supervivientes con leucemia (edad media en el momento del diagnóstico: 5,9 años) y a 63 de 1.871 supervivientes con tumores cerebrales (edad media en el momento del diagnóstico: 7,7 años), diagnosticados entre 1970 y 1986, que presentaron ictus de aparición tardía, definida ésta por un intervalo de 5 o más años después del diagnóstico primario. El intervalo medio desde el primer diagnóstico de cáncer hasta el ictus tardío fue de 9,8 años para los pacientes citados en primer lugar y de 13,9 años para los segundos. En comparación con los hermanos, el RR del ictus tardío fue de 6,4 para los casos de leucemia, y de 29 para los de tumor cerebral. Una dosis media de irradiación craneal µ 30 Gy se asoció de modo dosis-dependiente con un aumento de dicho riesgo en ambos grupos de supervivientes. En un estudio piloto26 se observó que las antraciclinas alteraban la función endotelial, lo cual sugiere que pueden desempeñar un papel en la progresión de la coronariopatía. Las lesiones venosas son raras.
Hay que monitorizar anualmente con una HC/EF.
PulmónSe han descrito fibrosis pulmonar, neumopatía restric-tiva-obstructiva y neumonía intersticial tardía. El riesgo de estas complicaciones aumenta cuanto menor sea la edad en el momento del diagnóstico. Tras la radioterapia torácica se han observado lesiones pulmonares, do-sis-y fraccionamiento-dependientes, y anomalías importantes de la función pulmonar27. Si la radioterapia torácica se combina con bleomicina, actinomicina D, ciclofosfamida, vincristina o adriamicina, se pueden producir neumonitis con unas dosis de radiación mucho más bajas28. Este efecto sinérgico se observa en los órganos abdominales cuando se administran estos fármacos con radioterapia del abdomen.
En un informe del CCSS sobre 12.390 niños29, realizado 5 años después del diagnóstico, se demostró una asociación significativa entre la radioterapia y la fibrosis pulmonar (RR 4,3), el uso de oxígeno suplementario (RR 1,8), enfisema (RR 2), neumonías recurrentes (RR 2,2), tos crónica y disnea durante > 1 mes (RR 2), disnea de esfuerzo (RR 1,8) y desarrollo anormal de la pared torácica (RR 5), así como una asociación significativa de la fibrosis pulmonar con los siguientes fármacos: carmustina (BCNU) (RR 1,4), bleomicina (RR 1,7), busulfán (RR 3,2), lomustina (CCNU) (RR 2,1) y ciclofosfamida (RR 1,6). La radioterapia torácica se asoció con una incidencia acumulada del 3,5% de fibrosis pulmonar 20 años después del diagnóstico.
Si la dosis de bleomicina es < 450 mg, se afecta el 35% de los pacientes; si es > 500 mg, el 20%28; con BCNU, hasta un 30% de los pacientes desarrolla fibrosis pulmonar con dosis de 80-240 mg/m2 cada 6-8 semanas durante más de 2 años (dosis acumulada 700-1.800 mg/m2), y existe un notable aumento de incidencia con dosis30 > 1.500 mg/m2. El metotrexato puede producir lesiones pulmonares31; en cambio, raras veces producen toxicidad pulmonar otros quimioterápicos no mencionados previamente28.
Deben realizarse controles con HC/EF y pruebas de función pulmonar cada 2 años, o cada año si los resultados son anormales. Practicar una TC torácica si existen anomalías significativas de la función pulmonar y/o hay síntomas clínicos.
Aparato digestivoA consecuencia de la radioterapia puede producirse una fibrosis, con obstrucción parcial o completa32.
Monitorizar cada año con HC/EF.
BazoLa asplenia funcional (inducida por las radiaciones) o anatómica (esplenectomía en el curso de la determinación del estadio, que raras veces o nunca se efectúa en la actualidad) puede predisponer a la sepsis, un problema que persiste toda la vida33.
Hay que realizar una prevención con vacunas anti-Haemophilus influenzae, Streptococcus pneumoniae y Neisseria menigitidis, si no se ha vacunado previamente, y aconsejar que informe de inmediato al médico si presenta fiebre o se siente enfermo. Actualmente existe un debate sobre el uso de la profilaxis antibiótica34. El Working Party of the British Committee for Standards in Clinic Hematology Task Force recomienda, al igual que yo mismo, una profilaxis antibiótica durante toda la vida35, mientras que la American Academy of Pediatrics afirma que esta profilaxis puede suspenderse después de los 5 años de edad36.
HígadoPueden ocurrir hepatitis y cirrosis. Pueden producirse lesiones hepáticas por el metotrexato y la 6-mercaptopurina37,38, así como por otros muchos agentes39 y hemoderivados contaminados40-42. Las hepatitis B y C por transfusión raras veces se observan hoy en día; sin embargo, pueden constituir un problema significativo para los pacientes tratados en épocas anteriores, especialmente por lo que respecta al riesgo de carcinoma hepático secundario a la infección por hepatitis C.
Hay que monitorizar cada año con HC/EF y AST/ ALT.
RiñónPueden ocurrir nefropatías glomerulares o tubulares43. Las lesiones renales pueden producirse por radioterapia44 e ifosfamida45, así como por otros fármacos antineoplásicos, como el cisplatino46.
Monitorizar cada año con HC/EF, análisis y examen microscópico de la orina, estudio metabólico completo, cifras de magnesio y presión arterial.
Vejiga urinariaPuede haber hematuria, cistitis, fibrosis y trastornos funcionales de la micción. Pueden producirse lesiones vesicales por radioterapia47, ciclofosfamida e ifosfamida. El metabolito de estos dos fármacos es la acroleína, que provoca lesiones vesicales irritativas. La incidencia de los efectos secundarios producidos por la ciclofosfamida y la ifosfamida puede reducirse con hidratación y mesna, que se une a la acroleína. La incidencia de lesiones vesicales es del 5-10% para la ciclofosfamida48 y del 20-40% para la ifosfamida49.
Monitorizar cada año con HC/EF, análisis y examen microscópico de la orina.
Sistema óseoPuede haber osteopenia, osteoporosis, necrosis avascular, deformidades raquídeas y otras alteraciones óseas. Pueden producirse lesiones óseas por esteroides50, metotrexato, radioterapia craneal (disminución de la hormona de crecimiento, con anomalías del metabolismo óseo), irradiación ósea directa y ciclofosfamida/ifosfamida51,52 (lesión gonadal con disfunción ovárica y/o de las células de Leydig, con pérdida de masa ósea).
En la leucemia linfoide aguda infantil puede producirse una disminución de la densidad mineral ósea, cuya intensidad disminuye con el paso del tiempo después del tratamiento53. Hasta el momento se desconoce el significado de dicho hallazgo en estos pacientes54. También se ha descrito una disminución de la densidad mineral ósea hasta en un tercio de los supervivientes de los tumores cerebrales infantiles; los motivos son multifactoriales, aunque el factor más importante es probablemente la radioterapia craneorraquídea55. Las deformidades raquídeas y otras alteraciones óseas que pueden producirse tras la radioterapia56 se observan actualmente con menos frecuencia debido al empleo de dosis más bajas y a las nuevas técnicas de irradiación.
Monitorizar cada año con HC/EF, cribaje de la escoliosis y un estudio de la densidad ósea 2-3 años después del tratamiento; si es normal, no es necesario repetirlo, a menos que haya signos o síntomas clínicos que sugieran un problema.
Sistema muscularPuede producirse atrofia muscular después de la irradiación directa al músculo56.
Monitorizar cada año con HC/EF.
TiroidesPuede ocurrir hipo-o hipertiroidismo después de la radioterapia torácica, craneal o cervical. En un informe del CCSS sobre 13.674 pacientes con linfoma de Hodgkin, se halló un mayor riesgo de hipotiroidismo al aumentar las dosis de radiaciones (> 4,5 Gray [Gy]), con la mayor edad, en el sexo femenino y en los plazos < 5 años desde el diagnóstico. El RR para el hipotiroidismo fue de 17,1 y ocurrió en el 25% de los pacientes (en el 50% a los 20 años si se administraron > 4,5 Gy). Se desarrolló a una media de 7 años después del diagnóstico y la edad mediana en el momento del tratamiento fue de 14 años. El RR para el hipertiroidismo fue de 8, y ocurrió en el 5% de los pacientes, con una edad media de 8 años57.
En un estudio de 461 pacientes tratados por linfoma de Hodgkin, el 43% desarrolló hipotiroidismo (el 47% de los pacientes de raza blanca y el 21% de raza negra), a una mediana de 2,9 años después del tratamiento; el riesgo fue mayor en el sexo femenino58. En otro estudio anterior sobre 1.787 pacientes (cerca de un 35% menores de 22 años) con linfoma de Hodgkin, se observó hipotiroidismo manifiesto o subclínico en el 44% de los pacientes 20 años después del tratamiento con > 30 Gy, o en el 27% de los pacientes a los 20 años del tratamiento con 7,5 a 30 Gy. La mayoría de los casos se identificó 2-3 años después del tratamiento. La mayoría de los casos ocurrió en pacientes tratados a los 15-25 años de edad y el riesgo fue mayor en las mujeres. Se observó hipertiroidismo en el 1,7% de los pacientes y el riesgo fue 7,2-20,4 veces mayor que en los sujetos normales59. Monitorizar cada año con HC/EF, TSH y T4 libre.
Crecimiento y desarrolloObesidad
La prevalencia de obesidad después del tratamiento de la leucemia linfoide aguda infantil es de 16-56%, por radioterapia craneal (déficit de hormona de crecimiento), tratamiento esteroide, inactividad física y aumento de la ingesta alimentaria60. En los adultos supervivientes de la leucemia linfoide aguda infantil, la radioterapia craneal con > 20 Gy se asoció con obesidad, sobre todo en las niñas que se trataron a los 0-4 años de edad61. La quimioterapia sin radioterapia craneal puede conducir así mismo a obesidad en los supervivientes de la leucemia linfoide aguda infantil62.
Monitorizar cada año con HC/EF (peso corporal) y consejos dietéticos.
Baja estatura
En la leucemia linfoide aguda infantil, la baja estatura puede producirse por radioterapia craneal, con déficit de GH63; el riesgo es mayor si el paciente tiene < 4 años. Se observa una desaceleración precoz del crecimiento, con retraso de la edad ósea; al final del tratamiento, cerca del 70% de los pacientes presenta un grado variable de crecimiento de recuperación, que puede completarse 2-3 años después del tratamiento en los pacientes que no recibieron radioterapia craneal, pero que es incompleto si la recibieron. Dado que el crecimiento se altera en los pacientes con leucemia linfoide aguda infantil que no reciben radioterapia craneal, es posible que la quimioterapia u otros factores, o ambos, sean responsables de este problema64. Mediante tratamiento con hormona de crecimiento se puede maximizar la talla final si se inicia a la edad ósea más precoz en que sea clínicamente factible65.
Monitorizar anualmente con HC/EF (talla) y obtener radiografías para determinar la edad ósea cuando esté indicado clínicamente.
GónadasPuede ocurrir insuficiencia gonadal. La lesión testicular u ovárica puede producirse por radioterapia (directamente a las gónadas o al cerebro [lesión del eje hipotála-mo-hipofisario]) o agentes alquilantes (ciclofosfamida, nitrosourea, clorambucilo, ifosfamida, dacarbazina, tiotepa, melfalán, busulfán, BCNU, CCNU, citarabina o procarbazina). La función de las células de Sertoli (producción de esperma) se altera con dosis bajas de los fármacos, en comparación con el trastorno funcional de las células de Leydig (producción de testosterona). El grado de alteración gonadal guarda relación con la edad, la dosis y la pauta de fraccionamiento de la radioterapia, y con la edad y la dosis de quimioterapia en el momento del tratamiento30,66,67.
Las niñas prepuberales y adolescentes son más resistentes a la insuficiencia inducida por alquilantes y radioterapia, debido a que existe un mayor número de folículos. La mayoría de las niñas tratadas con quimioterapia estándar conserva la función ovárica. Los ovarios son más resistentes a la radioterapia en las niñas más jóvenes, pero las dosis > 20 Gy provocan insuficiencia en la mayoría de ellas. En las niñas prepuberales, las dosis > 20-30 Gy pueden provocar insuficiencia o desarrollo puberal incompleto. En los varones no es frecuente que los agentes alquilantes provoquen una insuficiencia de las células de Leydig que requiera la administración de testosterona; en cambio, la lesión de las células germinales y la infertilidad son comunes. Con la radioterapia, la insuficiencia gonadal depende de la dosis y el fraccionamiento; > 3 Gy producen habitualmente una azoospermia irreversible. Con < 12 Gy, la función de las células de Leydig queda habitualmente indemne en los niños prepuberales30,66,67. Puede preservarse la fertilidad con bancos de esperma68, transposición ovárica y bancos de óvulos o tejido ovárico69,70.
Monitorizar con HC/EF (talla, peso y estadio de Tanner) y cifras de FSH, LH, testosterona y estradiol, cuando esté indicado clínicamente. Los valores de FSH y LH son altos cuando la insuficiencia gonadal se debe a radioterapia gonadal directa o agentes alquilantes, y bajos cuando se produce por radioterapia craneal.
Sistema nervioso centralLa radioterapia craneal puede provocar trastornos intelectuales o cognitivos que afecten al procesado mental, déficit de atención o memoria, capacidad visuo-es-pacial, concentración de la atención, memoria no verbal o función somatosensorial. Las alteraciones son más intensas en el sexo femenino, con una menor edad al recibir el tratamiento (< 4 años) y cuando las dosis de radiaciones son elevadas30. En un estudio reciente se ha demostrado que el metotrexato intratecal, combinado con una dosis alta o muy alta por vía IV, no afecta a la función neurocognitiva o cognitiva o al rendimiento escolar en los niños tratados por leucemia linfoide aguda, en comparación con la norma poblacional71.
Monitorizar anualmente con HC/EF y pruebas neuropsicológicas cuando esté indicado clínicamente.
En el 10-20% de los supervivientes a largo plazo del cáncer infantil puede haber desajuste psicológico, modificaciones del estado de ánimo, problemas conductuales, distrés somático, escaso rendimiento escolar, desempleo y/o trastorno de estrés postraumático72. En un estudio sobre 9.535 pacientes del grupo CCSS, el 44% presentó al menos 1 trastorno en su estado general de salud, salud mental, funcionalismo, dolor canceroso o ansiedad y temores provocados por el cáncer. Se halló un riesgo más elevado en el sexo femenino y en los pacientes con bajos ingresos económicos o logros educativos72. En otro estudio realizado en 226 supervivientes adultos del cáncer infantil, 29 pacientes (12,83%) presentaron ideas de suicidio, aunque sólo en 11 existía una depresión significativa, según el cuestionario Beck Depression Inventory. Las ideas de suicidio estuvieron relacionadas con el tratamiento del cáncer y con el estado de salud mental y física después del tratamiento73. El estrés intenso puede conducir a diversas conductas con riesgo para el estado de salud, como el tabaquismo, la falta de ejercicio y/o el no seguir las normas de protección solar74.
Monitorizar cada año con HC/EF y pruebas de cribaje psicológico75.
El eje hipotálamo-hipofisario puede afectarse por la radioterapia craneal, con déficit de GH, TSH, ACTH y/o gonadotropinas. El riesgo depende de la dosis, y la hormona de crecimiento es la más sensible a las radiaciones76. A excepción del déficit de GH y del desarrollo sexual prematuro, que puede presentarse con dosis tan bajas como 18 Gy, este eje raras veces se afecta, a menos que se apliquen dosis > 40 Gy77. Se ha descrito un déficit de GH en el 24% de los pacientes con leucemia linfoide aguda infantil tratados con radioterapia craneal, y en el 8% de quienes no la recibieron78. La disfunción hipotalámica puede ocurrir después del tratamiento exclusivo con quimioterapia, sin que se conozca bien el mecanismo. En un estudio realizado en 31 supervivientes del cáncer infantil que recibieron quimioterapia, pero no radioterapia, se observó hipotiroidismo central en 16 (52%) de ellos, déficit de GH en 15 (48%) y anomalías puberales en 10 (32%). En el último grupo, 5 (19%) presentaban insuficiencia gonadal, 3 (11%) déficit de gonadotropina y 2 (6%) pubertad precoz78.
Monitorizar cada año con HC/EF (talla y estadio de Tanner), y niveles de GH, TSH, ACTH y/o gonadotropinas cuando esté indicado clínicamente.
Pueden producirse neuropatías por vincristina, con hiporreflexia tendinosa profunda (lo más común), parestesias, síntomas sensitivos, paresia muscular, íleo paralítico y neuropatías de los pares craneales79. La neuropatía puede incrementarse por el uso concomitante de itraconazol80. La talidomida puede causar una neuropatía sensitiva, sin recuperación hasta en un 50% de los pacientes, mientras que la neuropatía sensitiva producida por el cisplatino puede persistir y afectar hasta un 20-60% de los pacientes79.
Monitorizar cada año con HC/EF (exploración neurológica).
La leucoencefalopatía, definida por la presencia de desmielinización, necrosis de la sustancia blanca, calcificación y lesiones gliales, puede aparecer tras la radioterapia del SNC o el metotrexato intratecal. Se presenta con convulsiones, signos motores focales, demencia, ataxia y trastornos cognitivos. El riesgo guarda relación con la dosis y la vía del metotrexato, la edad durante el tratamiento y la cantidad de radiaciones79. Puede realizarse una TC cerebral para diagnosticar este proceso.
OjosPueden aparecer cataratas por radioterapia, esteroides y busulfán. La radioterapia craneal puede producir queratoconjuntivitis81.
Monitorizar cada año con HC/EF (examen del cristalino).
OídosPuede desarrollarse una sordera neurosensorial a los sonidos de alta frecuencia después del tratamiento con cisplatino, sobre todo cuando las dosis acumuladas se acercan82 a los 400 mg/m2. La ifosfamida y la radioterapia craneal pueden exacerbar la sordera producida por el cisplatino83. Se están comenzando a investigar nuevos tratamientos para prevenir la ototoxicidad del cisplatino. Se cree que el cisplatino suprime la formación de antioxidantes endógenos que protegen el oído interno frente a las especies reactivas del oxígeno; estos nuevos tratamientos provocan una supresión de los radicales libres84.
Monitorizar cada año con HC/EF y pruebas auditivas. Hay que valorar cuidadosamente el retraso o las anomalías del lenguaje, así como el rendimiento escolar, dado que pueden ser las primeras manifestaciones de la pérdida auditiva.
Dientes y encíasPuede haber defectos de la dentición, aumento de las caries, anomalías de las raíces y enfermedad periodontal. Las anomalías orales pueden producirse por radioterapia en la zona, con un mayor riesgo si se utilizan dosis > 2,5 Gy o el paciente tiene < 5 años de edad. Incluso con 0,4 Gy puede haber algunos problemas. La quimioterapia también puede causar defectos dentarios85,86.
Monitorizar cada año con HC/EF y examen por el odontólogo.
SEGUNDAS NEOPLASIAS MALIGNAS (SNM)RESULTANTES DEL TRATAMIENTO DEL CÁNCERLos supervivientes del cáncer infantil tienen un riesgo 19 veces mayor de desarrollar otro proceso maligno87. El CCSS informó sobre 314 SNM en 13.518 pacientes, con un cociente de incidencia estandarizado (CIE) de 6,38; las cifras más elevadas se observaron en los tumores óseos (CIE de 19,14) y el cáncer de mama (CIE de 16,18). Se observó un mayor riesgo de SNM en las mujeres y en los pacientes más jóvenes en el momento del diagnóstico. Veinte años después del diagnóstico de cáncer, el valor estimado de la incidencia acumulada de SNM fue de 3,2%88.
Cáncer de pielEl cáncer de piel es probablemente el resultado de una disminución de la inmunovigilancia, secundaria a la radioterapia y la quimioterapia, junto a la exposición a la luz solar. El melanoma maligno y los cánceres de piel no melanóticos representan el 10-20% de las SNM después del tratamiento anticanceroso; el riesgo de desarrollar un cáncer de piel aumenta al paso del tiempo. Existe también una mayor incidencia de nevos melanocíticos, un factor de riesgo para el melanoma maligno, en localizaciones poco frecuentes como palmas y plantas, en niños que reciben quimioterapia89.
En un segundo estudio del CCSS sobre 13.132 pacientes, se hallaron 213 (1,6%) con cánceres de piel no melanóticos, responsables del mayor porcentaje (41%) de cánceres posteriores. En el 46% de los pacientes hubo múltiples procesos cancerosos; el 90% había recibido radioterapia, y el 90% de los cánceres se localizó en el campo irradiado. La edad mediana de aparición fue de 31 años (límites 7-46 años). La radioterapia se asoció con un riesgo 6,3 veces mayor de aparición de un cáncer de piel90.
Monitorizar con HC/EF y aconsejar al paciente que evite el sol, lleve un sombrero, se cubra la piel y acuda al dermatólogo anualmente para revisión.
Cáncer de mamaEl cáncer de mama (CM) puede aparecer después de la radioterapia torácica, habitualmente para el tratamiento del linfoma de Hodgkin. En Estados Unidos hay unos 120.000 supervivientes del linfoma de Hodgkin, y las SNM son la causa principal de muerte en los supervivientes a largo plazo de este proceso; el CM es el tumor sólido más frecuente en las mujeres tratadas por un linfoma de Hodgkin91. El exceso de incidencia anual de CM se incrementa al aumentar la edad de las pacientes después del tratamiento del linfoma de Hodgkin. El riesgo de CM aumenta 4-56 veces después de la radioterapia torácica por un linfoma de Hodgkin en mujeres < 30 años92,93, según la dosis de radiaciones y la edad en el momento del tratamiento; el riesgo es máximo en las mujeres que se trataron a los 10-20 años de edad92-98. El riesgo de CM se incrementa paralelamente a la dosis de radiaciones: cada unidad de Gy recibida en la mama aumenta el RR98 en 0,13.
En un estudio realizado por el Late Effects Study Group (LESG) en pacientes adultas supervivientes del linfoma de Hodgkin pediátrico, no se halló un mayor riesgo de CM si se administraban < 26 Gy93, y en los protocolos actuales no suelen emplearse dosis superiores a la citada. El riesgo de CM disminuye significativamente en una paciente que tenga > 30 años en el momento de diagnosticar el linfoma de Hodgkin, y no existe apenas un mayor riesgo de CM en las mujeres que se trataron cuando tenían 30-40 años98,99. La mediana del tiempo que transcurre hasta el desarrollo del CM es de 15 años después del tratamiento94, y la estimulación hormonal puede ser necesaria para el desarrollo del CM inducido por la radioterapia, ya que en un estudio se observó un menor riesgo de CM en relación con el daño ovárico resultante del empleo de agentes alquilantes o radioterapia91.
La mayoría de CM secundarios ocurren en el campo irradiado y son carcinomas ductales invasivos, aunque cerca del 13% son carcinomas ductales in situ. Existe una mayor incidencia de CM en la mama contralateral100. No se ha determinado todavía si hay una mayor incidencia de CM en los varones que reciben radioterapia torácica.
Monitorizar con autoexámenes mamarios mensuales, HC/EF cada año y realizar además una mamografía 5 años después del diagnóstico, recomendación que apoyan otros autores100, dado que algunos CM aparecen tempranamente después del tratamiento del linfoma de Hodgkin, incluso a los 5 años. El COG recomienda efectuar una mamografía 8 años después del tratamiento o a los 25 años de edad, lo que ocurra más tardíamente15. La exploración con RMN mamaria es más sensible para detectar el CM, en comparación con la ecografía o la mamografía, en mujeres con un mayor riesgo de CM por mutaciones de genes BRCA101. Aunque no está claro si este método de vigilancia logrará reducir la mortalidad, en mi opinión es preferible la RMN a la mamografía en las pacientes que reciben radioterapia torácica, sobre todo en las que se aplicaron dosis más elevadas con métodos no muy perfeccionados.
Cáncer de tiroidesEl cáncer de tiroides (CT) puede desarrollarse después de la radioterapia craneal, cervical o torácica. En un estudio del CCSS sobre 14.054 pacientes, en 69 de los cuales apareció un CT102, la incidencia de éste en los pacientes con un primer proceso maligno de cualquier localización, y que recibieron radioterapia en la cabeza, el cuello o el tórax, se incrementó al aumentar la dosis de radiaciones. Hubo una mayor incidencia con 2029 Gy, pero descendió con > 30 Gy, es decir, el efecto destructor. El RR estimado de CT fue de 1,32/Gy para las dosis < 15 Gy. El mayor o menor riesgo de CT fue más pronunciado en los pacientes diagnosticados de un primer proceso maligno antes de los 10 años de edad, en comparación con el riesgo observado en quienes fueron diagnosticados después de dicha edad. La quimioterapia no ejerció ninguna influencia sobre el desarrollo del CT secundario. En este estudio, los pacientes menores de 10 años presentaron un riesgo de CT sustancialmente mayor en toda la gama de dosis de radiaciones, en comparación con los pacientes mayores de 10 años, lo cual demuestra la mayor susceptibilidad de la glándula tiroides en los pacientes más jóvenes. De los 69 pacientes con CT, el 42% tenía un primer diagnóstico de linfoma de Hodgkin, y el 20%, de leucemia101. En otros estudios se ha observado también un aumento del riesgo de CT después de la radioterapia: RR57 de 18,3, RR59 de 15,6, un exceso de riesgo absoluto92 (ERA) de 1,4, CIE93 de 36,4 y CIE de 35 con 0,5 Gy y de 73 con 3,6 Gy103.
Puede palparse un nódulo tiroideo en el 4-7% de los adultos104, y la incidencia de estos nódulos aumenta si se utiliza la ecografía para la detección, o si se determina su incidencia en la necropsia105. Al cabo de un período medio de 11 años después del tratamiento del linfoma de Hodgkin, se detectaron nódulos por ecografía hasta en un 44% de los supervivientes del cáncer infantil que habían recibido radioterapia craneal o cervical106. En un informe sobre 647 pacientes pediátricos tratados por un linfoma de Hodgkin se determinó que 67 (10,4%) de ellos desarrollaron 1 o más nódulos. Cuatro pacientes habían presentado patología tiroidea antes del diagnóstico, y 19 (28%) habían recibido reemplazamiento con hormona tiroidea antes de descubrir un nódulo. En 7 (10%) pacientes se diagnosticó el CT a una mediana de 16,2 años después del tratamiento del linfoma de Hodgkin (límites 8,4-23, 7 años). Sólo se halló 1 CT por ecografía; el resto se descubrió por palpación o a causa de los síntomas clínicos (en 53/67 se practicaron ecografías). En 41 de los 67 pacientes había nódulos asintomáticos que sólo se detectaron por ecografía. En 34 pacientes, el curso clínico y las características de las imágenes fueron compatibles con nódulos benignos, y no se biopsiaron. La mediana del tamaño de los nódulos fue de 0,7 cm (límites 0,2-2 cm) y el 30% se resolvió107. La mayoría de los CT consecutivos a la radioterapia son papilares108, con una baja tasa de mortalidad incluso después de metastatizar109.
Monitorizar cada año con HC/EF y niveles de TSH y T4 libre, y practicar una ecografía tiroidea cada 3-4 años si no hay cambios en la ecografía anterior, o bien cada año si los hay. Se debate el papel del cribaje ecográfico108. Practicar una ecografía en todos los nódulos palpables. Aspirar con aguja fina si el nódulo crece, o bien si es > 10 mm o se observan áreas hipoecoicas en la ecografía.
LeucemiaLa aparición de LMA (leucemia mieloide aguda)/ SMD (síndrome mielodisplásico) en relación con el tratamiento110 (LMA/SMD-t) puede deberse a los agentes alquilantes, asociados también con tumores óseos y vesicales, y a inhibidores de la topoisomerasa111 2 (etopósido o VP-16, y tenipósido o VM-26). La supervivencia a largo plazo de los pacientes pediátricos con LMA/ SMD-t que reciben un trasplante alogénico de células madre es de 15-24%112. LMA/SMD-t es uno de los pocos efectos tardíos en los que la incidencia se estabiliza o normaliza después de un período de tiempo.
Con los agentes alquilantes, el riesgo de LMA/SMD-t se incrementa al aumentar la dosis y la edad del paciente. La incidencia de LMA/SMD-t es de 0,8-2,8% y la mediana del período latente es de 4-6 años111 (límites 120 años). Habitualmente hay una pérdida o deleción de los cromosomas113 5 o 7. Con los inhibidores de la topoisomerasa 2 hay un mayor riesgo de LMA (morfología M4 o M5)/SMD-t al aumentar la dosis, y habitualmente ocurre en los pacientes más jóvenes. El riesgo acumulado es de 0,5-18,4%, según la intensidad de la dosis, y la mediana del período latente es de 1-3 años111 (límites 0,5-4,5 años). Habitualmente se produce un reagrupamiento, con el gen MLL sobre la banda cromosómica114 11q23.
Después del tratamiento con etopósido, el empleo a corto plazo del factor estimulante de las colonias de granulocitos puede aumentar el riesgo de desarrollar LMA/ SMD-t115. Aunque se cree que el riesgo de LMA/SMD-t después del uso de antraciclinas es relativamente bajo, un estudio sugiere lo contrario116. Los supervivientes del linfoma de Hodgkin pediátrico tienen un riesgo 4 a 175 veces mayor de desarrollar LMA/SMD-t97. El ERA de LMA/SMD-t fue de 6,3 en un estudio sobre 32.591 pacientes adultos con linfoma de Hodgkin92, mientras que el CIE fue de 174,8 en un estudio de Late Effects Study Group (LESG) sobre 1.380 pacientes pediátricos con linfoma de Hodgkin93.
Se debe monitorizar cada año con HC/EF y hemograma completo.
Es común hallar unas cifras ligeramente anormales en el hemograma (valores bajos de leucocitos, plaquetas y hemoglobina y aumento del volumen corpuscular medio) en los supervivientes del cáncer infantil; estos valores tienden a persistir, su significado es discutible y al parecer no reflejan cambios preleucémicos117. Se cree que el acortamiento telomérico debido a la quimioterapia, que conduce a unos ciclos repetidos de regeneración hematopoyética, sería responsable de las alteraciones de los hemocitoblastos118.
Sarcoma óseo y del tejido conjuntivoDespués de la radioterapia pueden presentarse sarcomas óseos y de los tejidos blandos; el riesgo es proporcional a la dosis y al uso concomitante de agentes alquilantes. En un informe del British Childhood Survivors of Cancer Study sobre 13.175 pacientes diagnosticados entre 1940 y 1983, la probabilidad acumulada de desarrollar un cáncer óseo después de la radioterapia fue del 0,9% en toda la cohorte durante los 20 años siguientes al tratamiento. El riesgo aumentó a 7,2% después del retinoblastoma hereditario (que predispone al desarrollo de un osteosarcoma), a 5,4% tras el sarcoma de Ewing y a 2,4% después de otros tumores óseos malignos119. Después del tratamiento del linfoma de Hodgkin pediátrico, el RR de sarcomas, los más frecuentes de los cuales son los que afectan al hueso y al tejido conjuntivo, era de 1,3 a 37,197. En otro estudio, el ERA para los cánceres óseos y del tejido conjuntivo después del tratamiento del linfoma de Hodgkin fue de 2,3 en los pacientes < 21 años, con valores más bajos en los pacientes con más edad al recibir el tratamiento92. En un informe sobre 11.183 pacientes < 21 años, los tumores pertenecientes a la familia del sarcoma de Ewing ocurrieron raras veces después del tratamiento de un cáncer primario infantil (1,3% de 479 segundos cánceres). La mayoría no guardó relación con la radioterapia y fue posible la supervivencia prolongada120.
Monitorizar cada año con HC/EF.
Segundos carcinomas diferentes a los de mama, tiroides y piel
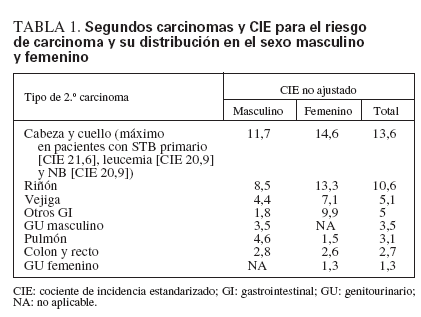
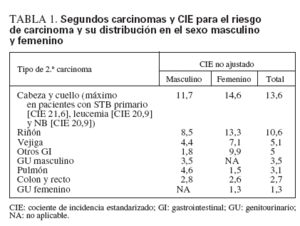
El grupo CCSS, en el estudio a mayor escala realizado hasta la fecha sobre los carcinomas secundarios, identificó 71 carcinomas (excluidos los de mama, tiroides y piel) en 13.136 pacientes diagnosticados desde 1970 a 1986 a edades < 21 años121. El CIE para un carcinoma posterior de tipo adulto fue de 4 (un riesgo 4 veces mayor), y estaba significativamente elevado para todos los diagnósticos de cáncer primario, excepto las neoplasias del SNC. En los pacientes con una SNM eran mayores las probabilidades de tener más edad, presentar un diagnóstico primario de linfoma de Hodgkin, sarcoma de los tejidos blandos o neuroblastoma, antecedentes de un familiar de primer grado con cáncer e historia de alcoholismo. La incidencia global acumulada del desarrollo de un segundo carcinoma fue de 0,45% a los 20 años de seguimiento. En la tabla 1 se enumeran los tipos de segundos carcinomas, con el CIE para el riesgo de carcinoma y la distribución en el sexo masculino (M) y femenino (F).
Los supervivientes de neuroblastoma, sarcoma de los tejidos blandos y tumor de Wilms presentaban el riesgo más elevado de desarrollar un carcinoma posterior, con valores de CIE de 24, 6,2 y 4,8, respectivamente. El segundo carcinoma ocurrió a una edad mediana de 27 años (límites 10-44 años), y la mediana del tiempo transcurrido entre el desarrollo del segundo carcinoma y el tratamiento primario fue de 15 años (límites 6-28 años). En cambio, la incidencia de la mayoría de carcinomas en la población general aumenta desde los 41 a 50 años de edad y alcanza su máximo a los 50-70 años.
Los supervivientes del tumor de Wilms presentaron un mayor riesgo de desarrollar carcinomas colorrectales (CIE 25,4) y otros GI (CIE 18), al igual que los supervivientes del linfoma de Hodgkin (CIE 2,5 y 7,4, respectivamente). En la mayoría de las localizaciones tumorales, los pacientes menores de 10 años en el momento del diagnóstico tenían más riesgo de desarrollar carcinomas secundarios. Los pacientes tratados con inhibidores de la topoisomerasa 2 (VP-16, VM-26) tenían un mayor riesgo de desarrollar cáncer de pulmón (CIE 73,4, frente a CIE 1,8 en los pacientes no expuestos), al igual que los pacientes tratados con agentes alquilantes (CIE 7 frente a CIE 0 en los no expuestos). El tratamiento con platino se asoció a un CIE elevado para los carcinomas colorrectales (CIE 14,7) y renales (CIE 48,7). La radioterapia se asoció con un riesgo más elevado para todos los carcinomas secundarios, excepto los del tracto genitourinario, y el CIE fue mayor para los carcinomas craneales y cervicales (CIE 18,5 frente a CIE 2,3 en los pacientes no irradiados). La localización del segundo carcinoma se produjo en el campo previamente irradiado en todos los carcinomas pulmonares (4 de 4), en el 85% en los carcinomas de cráneo y cuello (17 de 20) y en el 71% en los carcinomas GI (10 de 14).
TABLA 1. Segundos carcinomas y CIE para el riesgo de carcinoma y su distribución en el sexo masculino y femenino
En 22 de 71 pacientes (33%) aparecieron segundos carcinomas en un área no expuesta a la radioterapia, y en 11 de los 22 (50%) no hubo irradiación previa. Dieciséis de estos pacientes (73%) recibieron agentes alquilantes. Cuatro de los 71 pacientes (5,6%) no habían recibido quimioterapia ni radioterapia. Los autores del estudio advierten que el tamaño de la muestra fue demasiado reducido para realizar análisis ajustados con el fin de determinar la contribución independiente de los factores relacionados con el tratamiento y el paciente120.
Además de realizar anualmente la HC/EF, en los pacientes que recibieron radioterapia abdominal hay que monitorizar para el cáncer de colon con una colonoscopia cada 10 años, 15 años después del tratamiento o a los 35 años de edad, la que sea más tardía, según recomienda el COG15.
SNM después del tratamiento de un tumor cerebral, o tumores cerebrales después del tratamiento de un cáncer infantilLos tumores cerebrales resultantes de la radioterapia craneal presentan un período de latencia de 9-10 años. Cuanto menor es la edad en el momento del tratamiento, tanto mayor es el riesgo122. El CCSS informó sobre 116 neoplasias subsiguientes del SNC en 14.361 supervivientes a los 5 años de cánceres infantiles123. Los gliomas (n = 30) ocurrieron a una mediana de 9 años tras el diagnóstico original, con un CIE de 8,7. Los meningionas (n = 66) se produjeron a una mediana de 17 años después del diagnóstico original. Otros tumores fueron los neuroectodérmicos primitivos (n = 6) y los linfomas del SNC (n = 1). Después del ajuste para el factor de la dosis de irradiación, ni el diagnóstico del cáncer original ni la quimioterapia se asociaron con un mayor riesgo. Un análisis del National Cancer Institutes Surveillance and End Results (SEER) sobre 2.056 pacientes supervivientes de tumores cerebrales infantiles reveló que había 39 SNM124. Hubo un riesgo 4,7 veces mayor en los pacientes tratados desde 1979 a 1984, y 6,7 veces mayor en los tratados después de 1985; la diferencia guardó relación posiblemente con la intensidad del tratamiento, dado el uso creciente de la quimioterapia además del tratamiento estándar con radioterapia. En los astrocitomas, los 3 SNM más comunes fueron “otros tumores” (5), seguidos de los fibrosarcomas (3) y los melanomas (3). En los tumores neuroectodérmicos primitivos, los 2 SNM más frecuentes fueron “otros tumores” (3) y la leucemia linfoide aguda (2). En los otros gliomas, los astrocitomas (3) fueron los SNM más comunes. La edad media en el momento del diagnóstico primario fue de 9,5 años y la mediana de tiempo hasta el diagnóstico de la SNM fue de 14,1 años.
Monitorizar cada año con HC/EF (examen neurológico).
Trasplante de médula ósea y células madreAdemás de los efectos tardíos habituales de la quimioterapia y la radioterapia, los pacientes trasplantados presentan un riesgo de desarrollar la enfermedad de injerto contra huésped, con todas sus complicaciones in-herentes125-127. También tienen riesgo de desarrollar SNM128. En un estudio, el CIE de las SNM fue de 5,4 (excluido el trastorno proliferativo postrasplante, que suele desarrollarse en el primer año), y el CIE para LMA/SMD fue de 300129.
Para facilitar el uso de la información ofrecida más arriba, he elaborado una tabla (tabla 2) donde se indica la localización de la radioterapia y se enumeran los agentes quimioterápicos y determinados efectos tardíos resultantes de su empleo. El lector puede acudir al apartado de cada órgano, en las secciones de efectos tardíos malignos y no malignos, para recoger una información más detallada sobre los efectos tardíos del tratamiento anticanceroso sobre cada sistema orgánico, así como las recomendaciones pertinentes para la monitorización.
TABLA 2. Determinados efectos tardíos tras la radioterapia y la quimioterapia
TABLA 2. Determinados efectos tardíos tras la radioterapia y la quimioterapia (continuación)
RESUMEN Y CONCLUSIONESEl número de adultos supervivientes a largo plazo del tratamiento del cáncer infantil seguirá en aumento, y casi el 75% presentará alguna afección crónica a causa de dicho tratamiento, mientras que más del 40% sufrirá algún problema grave, discapacitante o potencialmente mortal, o fallecerá por un trastorno crónico consecutivo al tratamiento.
En mi opinión, además del seguimiento que debe efectuar el médico de asistencia primaria, todos los supervivientes a largo plazo del tratamiento del cáncer infantil deben acudir cada año a una clínica especializada en los efectos tardíos de dicho tratamiento, para su estudio por parte de un miembro del equipo oncológico que lo trató inicialmente, ya sea el médico o la enfermera especializada en oncología pediátrica. Siempre debe estar presente un psicólogo y un asistente social, y han de estar disponibles los especialistas que sean necesarios. Lo ideal es que tales clínicas se hallen en el mismo centro en donde se efectuó inicialmente el tratamiento, sin relación con la clínica habitual de hematología/oncología. Se han descrito 4 modelos posibles de clínicas especializadas en los efectos tardíos130, y se ha propuesto un modelo de asistencia global, basado en la clínica, para los supervivientes del cáncer infantil131. Recientemente se han publicado 11 artí-culos de revisión sobre una serie de temas relacionados con la supervivencia al cáncer infantil, como los de seguimiento, efectos tardíos, modelos para prestar asistencia, educación del paciente, protección del paciente, situación laboral y problemas psicosociales, promoción de la salud y normas para la investigación, en adultos supervivientes del cáncer infantil o del cáncer en el adulto132.
Al suprimir o reducir la radioterapia con equipos más modernos y unos esquemas de fraccionamiento más adecuados, y con el reemplazamiento o el uso de dosis más reducidas de quimioterápicos inductores de SNM, los efectos tardíos disminuirán en comparación con los descritos aquí. De hecho, en los protocolos más recientes para algunos pacientes con linfoma de Hodgkin se ha omitido la radioterapia o se ha aplicado a dosis más bajas, al igual que en el tratamiento de algunas neoplasias abdominales, mientras en la leucemia linfoide aguda infantil se utiliza sólo en los pacientes de alto riesgo. Sin embargo, hay todavía muchos supervivientes a largo plazo del cáncer infantil que se trataron hace 10-50 años y que requieren una monitorización particularmente estrecha.
Las estimaciones de riesgo presentadas aquí, que se han determinado a partir de pacientes tratados hace algunos años, son probablemente demasiado elevadas en relación con las actuales, pues el tratamiento del cáncer ha cambiado espectacularmente en los últimos años; sin embargo, los nuevos tratamientos anticancerosos, empleados actualmente o en el futuro, con toda probabilidad se acompañarán de sus propios efectos tardíos. Por lo tanto, los pacientes que reciban estos nuevos tratamientos deben monitorizarse estrechamente para valorar la magnitud de cualquier efecto tardío. En la página web de COG15 hay notas para los pacientes donde se describen los efectos tardíos del tratamiento anticanceroso, que se entregarán en la primera visita de los pacientes a la clínica especializada en los efectos tardíos. Para los lectores interesados en el campo en embrión que se ocupa de los efectos tardíos del tratamiento anticanceroso en los supervivientes adultos del cáncer en el adulto, el Institute of Medicine Report ofrece también información sobre el tema en su página web133.
AGRADECIMIENTODeseo expresar mi agradecimiento a Nancy Moreland por su inestimable ayuda en la preparación del manuscrito.
Correspondencia: Joseph D. Dickerman, MD, University of Vermont College of Medicine, Department of Pediatrics, 89, Beaumont Ave., Given D201, Burlington, VT 05405-0068, Estados Unidos.
Correo electrónico: joseph.dickerman@uvm.edu