La introducción en la práctica clínica del estudio serológico para detectar la presencia de anticuerpos circulantes contra el endomisio y la transglutaminasa tisular es en gran medida responsable de nuestro conocimiento de la enfermedad celíaca como trastorno multisistémico con una miríada de presentaciones1. La prevalencia de la enfermedad celíaca se estima entre el 0,3% y el 1,0% en Norteamérica, y la mayoría de los casos siguen sin ser diagnosticados2,3. Los niños pueden presentar síntomas atípicos o extraintestinales o alteraciones asociadas a la enfermedad celíaca4-8.
Las actuales pautas norteamericanas recomiendan el estudio de la enfermedad celíaca en una serie de dolencias, como los síntomas gastrointestinales, la fatiga crónica, la talla baja, el retraso puberal, los defectos del esmalte dentario, el aumento de las transaminasas hepáticas, la dermatitis herpetiforme y las anemias nutricionales9. También se recomienda el estudio en los pacientes con alteraciones asociadas con la enfermedad celíaca, como la diabetes sacarina de tipo 1, la tiroiditis autoinmune, la deficiencia de inmunoglobulina A (IgA), el síndrome de Down, el síndrome de Turner y el antecedente familiar de enfermedad celíaca9. La evidencia para estas recomendaciones proviene principalmente de estudios europeos. Nuestro conocimiento del cuadro clínico de la enfermedad celíaca infantil en Norteamérica es limitado8,10,11. Telega et al8 ofrecieron evidencias preliminares del cambiante aspecto de la enfermedad celíaca al describir la presentación clínica en Wisconsin. El único informe de los aspectos clínicos de casos consecutivos de enfermedad celíaca en niños canadienses data de hace 40 años10. Más recientemente, Rashid et al11 estudiaron retrospectivamente las presentaciones clínicas en los niños canadienses en un grupo de apoyo a los enfermos celíacos.
Los niños con enfermedad celíaca no diagnosticada siguen en riesgo de complicaciones, como el fracaso de crecimiento, el retraso puberal, la anemia, la disminución de la mineralización ósea y la enfermedad autoinmune, así como de infertilidad y de neoplasia en los años posteriores1,9. En la actualidad se recomienda un enfoque diagnóstico que utiliza el estudio serológico en los pacientes con síntomas y en los grupos en riesgo1. Por lo tanto, los médicos de cualquier especialidad deben reconocer las variables presentaciones de la enfermedad celíaca. El objetivo de este estudio fue evaluar el impacto del estudio serológico con una estrategia de búsqueda de casos sobre la incidencia y la presentación clínica en una población norteamericana y explicar a los médicos la diversidad multisistémica de la enfermedad celíaca.
MÉTODOS
Identificación de casos y recogida de datos
Los datos de los pacientes consecutivos (< 18 años de edad) remitidos con síntomas, hallazgos serológicos de enfermedad celíaca, o ambas situaciones, y diagnosticados de enfermedad celíaca tras una biopsia intestinal en el Alberta Children's Hospital entre el 1 de enero de 1990 y el 31 de diciembre de 2006 se introdujeron en una base de datos. Este hospital es el único centro de referencia de Gastroenterología pediátrica del sur de Alberta. Los pacientes diagnosticados de padecer una enfermedad celíaca fueron identificados mediante una búsqueda en la base de datos de patología quirúrgica del Calgary Laboratory Services de expresiones diagnósticas congruentes con la enfermedad celíaca ("atrofia de vellosidades", "vellosidades romas", "enfermedad celíaca", "esprue" o "enteropatía sensible al gluten") en las biopsias realizadas durante este período de tiempo. Se realizó una segunda búsqueda de historias clínicas para asegurar la integridad de la base de datos. Se revisaron las historias clínicas y los informes anatomopatológicos, extrayendo los datos de las siguientes variables: 1) información clínica, como aspectos demográficos de los pacientes, síntomas, alteraciones asociadas, indicación de la biopsia intestinal y fecha de la biopsia; 2) anomalías de laboratorio al diagnóstico, como la ferropenia, la anemia, la hipoalbuminemia, el aumento de las transaminasas hepáticas, la deficiencia de IgA12 (valor de IgA < 0,06 g/l), y los resultados del estudio de anticuerpos IgA antiendomisio13 (AEM), y 3) los resultados de la biopsia del intestino delgado al diagnóstico, incluyendo el índice modificado de Marsh14. Uno de 2 anatomopatólogos pediátricos interpretó las biopsias, que se volvieron a evaluar para la asignación de los índices modificados de Marsh14. El diagnóstico de enfermedad celíaca se basó en las actuales pautas de la North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition9. Los niños seropositivos con síntomas y lesiones Marsh I a III en la biopsia y con respuesta clínica y serológica a una dieta sin gluten (DSG) fueron diagnosticados de padecer una enfermedad celíaca. Los niños seropositivos sin síntomas, pero con alteraciones asociadas, que tenían lesiones Marsh I a III en la biopsia y mostraron respuesta serológica a la DSG fueron diagnosticados de padecer una enfermedad celíaca. Los niños seronegativos con síntomas y lesiones Marsh III en la biopsia, y con respuesta clínica e histológica a la DSG fueron diagnosticados de padecer una enfermedad celíaca. Para determinar la respuesta a la DSG los niños fueron controlados durante ≥ 1 año.
Análisis de los datos
Según la documentación clínica, los pacientes fueron asignados a un síntoma, signo o indicación principal (alteración asociada) que desembocó en la biopsia intestinal (es decir, la razón del traslado). Las presentaciones clínicas se agruparon en 4 categorías: 1) enfermedad celíaca clásica, definida por diarrea con fracaso de crecimiento15 o pérdida de peso > 10%; 2) presentación gastrointestinal atípica, definida por cualquier síntoma gastrointestinal, incluyendo el dolor abdominal, el reflujo gastroesofágico, los vómitos, el estreñimiento y la diarrea, sin fracaso de crecimiento o pérdida de peso; 3) presentación extra-intestinal, definida por signos o síntomas ajenos al tracto gastrointestinal, como la anemia ferropénica o la talla baja, y 4) presentación silente. Los niños con presentación silente fueron identificados por el estudio solicitado por el antecedente familiar de enfermedad celíaca o una alteración asociada con la enfermedad celíaca. No informaron de síntomas, ni siquiera en el interrogatorio directo, antes del establecimiento de la DSG. Las alteraciones asociadas fueron la diabetes sacarina de tipo 1, la trisomía 21 y el hipotiroidismo. El interrogatorio directo en las visitas de seguimiento durante 1 año identificó síntomas reconocidos retrospectivamente tras el inicio de la DSG.
El estudio de AEM IgA comenzó en 1997. Los niños fueron divididos en el grupo anterior al estudio (1990-1996) y el grupo sometido al estudio (2000-2006) según el año del diagnóstico. Como el cambio de los patrones de la práctica médica consume tiempo, los años 1997-1999 fueron considerados años de transición y los 21 diagnósticos establecidos en esos años no fueron tenidos en cuenta en la comparación. Se comparó la incidencia y la presentación clínica de la enfermedad celíaca (incluyendo los signos/síntomas, los índices de Marsh y las anomalías de laboratorio) entre los grupos anterior y el sometido al estudio, examinando las diferencias, relacionadas con la edad y el sexo, del modo de presentación de la enfermedad celíaca infantil en el grupo sometido al estudio. La incidencia se determinó promediando los datos de la incidencia anual en cada período del estudio, utilizando los datos poblacionales (edad: 0-17 años) ofrecidos por la Alberta Health Services, Health Outcomes Office.
Análisis estadísticos
Los análisis estadísticos fueron realizados con SPSS 16.0 (SPSS, Chicago, IL). Las variables continuas se expresaron en medianas con intervalos de confianza (IC) del 95%, porque su distribución no fue normal. Se utilizó el test U de Mann y Whitney para detectar las diferencias en las variables continuas, y el test χ2 de Pearson o el test exacto de Fisher cuando fue oportuno, para detectar las diferencias entre las variables cualitativas. Se utilizó la correlación de rango de Spearman para comprobar las asociaciones cuando las variables se midieron en una escala ordinal. Se aceptó como estadísticamente significativo un valor de p < 0,05. El Comité de Ética conjunto de la University of Calgary aprobó este estudio.
RESULTADOS
Aspectos demográficos
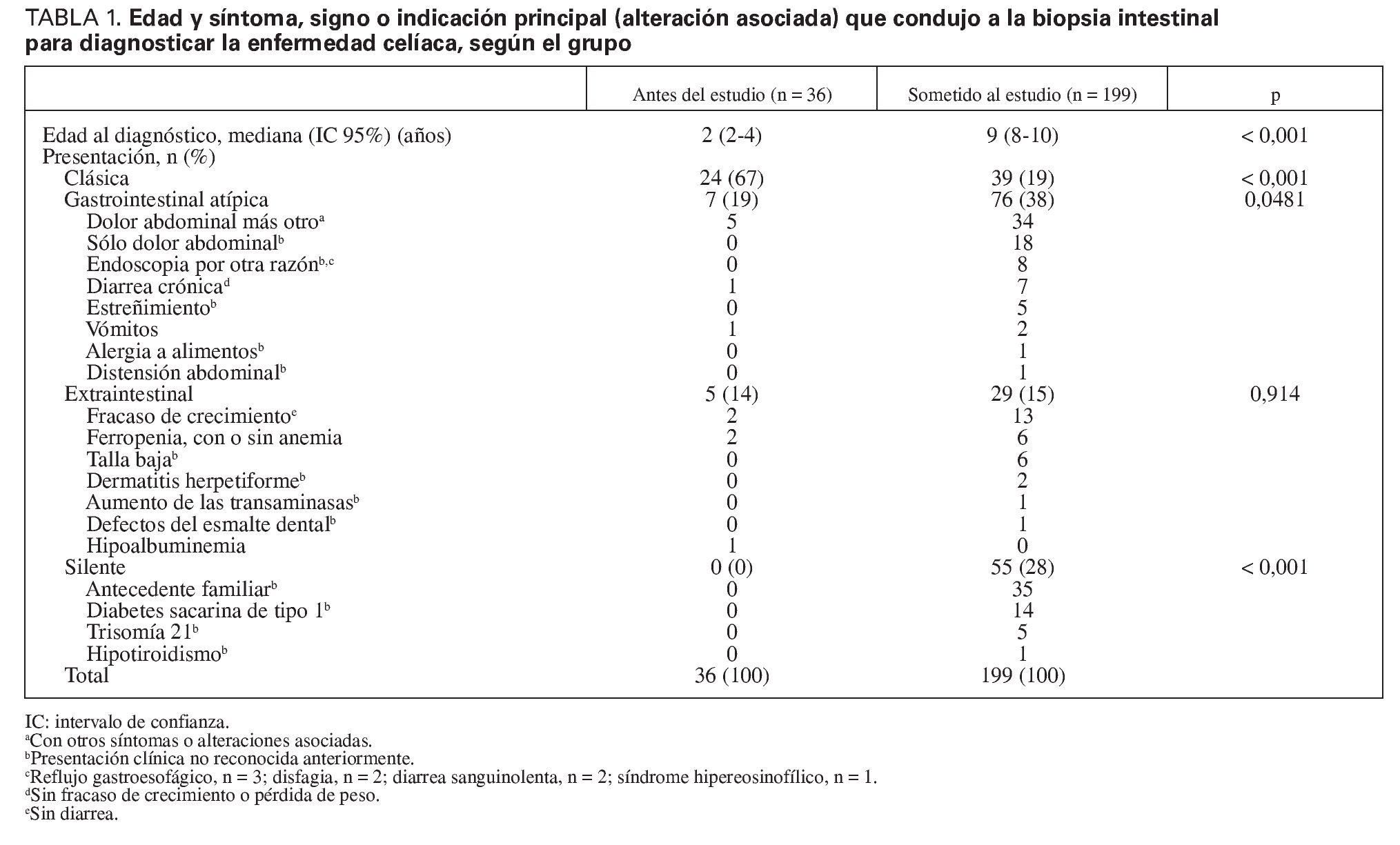
Entre 1990 y 2006 se diagnosticó una enfermedad celíaca mediante biopsia intestinal a 266 niños (161 niñas; 61% [IC 95%: 55%-66%]) en el Alberta Children's Hospital. La cifra anual de diagnósticos de enfermedad celíaca se cuadriplicó en estos 16 años, de 6 a 28 casos anuales. Entre 1990 y 1996 (grupo anterior al estudio), 36 niños (22 niñas; 61% [IC 95%: 45%-75%]) fueron diagnosticados de enfermedad celíaca; esta cifra aumentó a 199 pacientes (122 niñas; 61% [IC 95%: 54%-68%]) entre 2000 y 2006 (grupo sometido al estudio). La proporción niños/ niñas (1,6:1) no varió (p = 0,982), La mediana de la edad al diagnóstico aumentó desde 2 años (IC 95%: 2-4 años) en el grupo anterior al estudio a 9 años (IC 95%: 8- 10 años) en el grupo sometido al estudio (p < 0,001) (tabla 1). La estimación poblacional de la incidencia de la enfermedad celíaca aumentó de 2,0 casos por 100.000 niños y año en el grupo anterior al estudio a 7,3 casos por 100.000 niños y año en el grupo sometido al estudio (p = 0,0256).
Comparación de las presentaciones clínicas
La tabla 1 presenta los síntomas, signos o alteraciones principales asociadas que condujeron a la biopsia intestinal de cada niño. La frecuencia de enfermedad celíaca clásica disminuyó desde el 67% (24 de 36 niños) en el grupo anterior al estudio al 19% (39 de 199 niños) en el grupo sometido al estudio (p < 0,001) (tabla 1). Sin embargo, la incidencia de enfermedad celíaca clásica no difirió entre el grupo anterior al estudio (0,8 casos por 100.000 niños y año) y el grupo sometido al estudio (1,6 casos por 100.000 niños y año; p = 0,154).
La frecuencia de la presentación con síntomas gastrointestinales atípicos aumentó en el grupo sometido al estudio, comparado con el grupo anterior al estudio, y el modo de presentación silente sólo se produjo en este grupo (tabla 1). Además, hubo 13 presentaciones clínicas no reconocidas previamente en 98 (49%) de los 199 niños del grupo sometido al estudio, incluyendo el antecedente familiar de enfermedad celíaca (n = 35 niños), el dolor abdominal aislado (n = 18), la diabetes de tipo 1 (n = 14), la endoscopia por razones distintas al estudio serológico de la enfermedad celíaca (n = 8) y la talla baja (n = 6) (tabla 1). Las presentaciones extraintestinales no observadas anteriormente fueron la talla baja (n = 6), la dermatitis herpetiforme (n = 2), el aumento de los valores de transaminasas (n = 1) y los defectos del esmalte dental (n = 1), mientras que el fracaso del crecimiento sin diarrea y la ferropenia, con o sin anemia, tuvieron una frecuencia similar en los 2 grupos (tabla 1). El estudio serológico de los niños sin síntomas llevó al diagnóstico de 21 niños (75%) con antecedente familiar de enfermedad celíaca, 6 (21%) con diabetes de tipo 1 y 1 (4%) con hipotiroidismo. Se observaron una lesión Marsh I y una lesión Marsh II en 2 niños seropositivos sin síntomas y con antecedente familiar de enfermedad celíaca. Los resultados serológicos de ambos niños se normalizaron con la DSG. Entre los 55 pacientes con presentación silente del grupo sometido al estudio, 27 (49%; 14 niñas) tenían síntomas que sólo fueron reconocidos retrospectivamente y 28 (51%; 16 niñas) no presentaron síntomas.
La evaluación del espectro de síntomas documentados en el momento del diagnóstico reveló que la diarrea estaba presente en 28 (78%) de los 36 pacientes del grupo anterior al estudio y en 59 (30%) de los 199 del grupo sometido al estudio (p < 0,001), el fracaso de crecimiento/pérdida de peso en 26 pacientes (72%) del grupo anterior al estudio y en 71 (36%) en el grupo sometido al estudio (p < 0,001) y la distensión abdominal en 11 pacientes (31%) en el grupo anterior al estudio y en 28 (14%) en el grupo sometido al estudio. Por el contrario, el dolor abdominal estuvo presente en 5 pacientes (14%) del grupo anterior al estudio y en 77 (39%) en el grupo sometido al estudio (p = 0,007). Entre los niños sometidos al estudio de laboratorio, hubo ferropenia, con o sin anemia, en 6 pacientes (17%) del grupo anterior al estudio y en 35 (18%) en el grupo sometido al estudio (p = 0,893), mientras que hubo hipoalbuminemia en 3 pacientes (8%) en el grupo anterior al estudio y en 5 (3%) en el grupo sometido al estudio (p = 0,107).
Diferencias de la presentación de la enfermedad celíaca relacionadas con la edad y el sexo
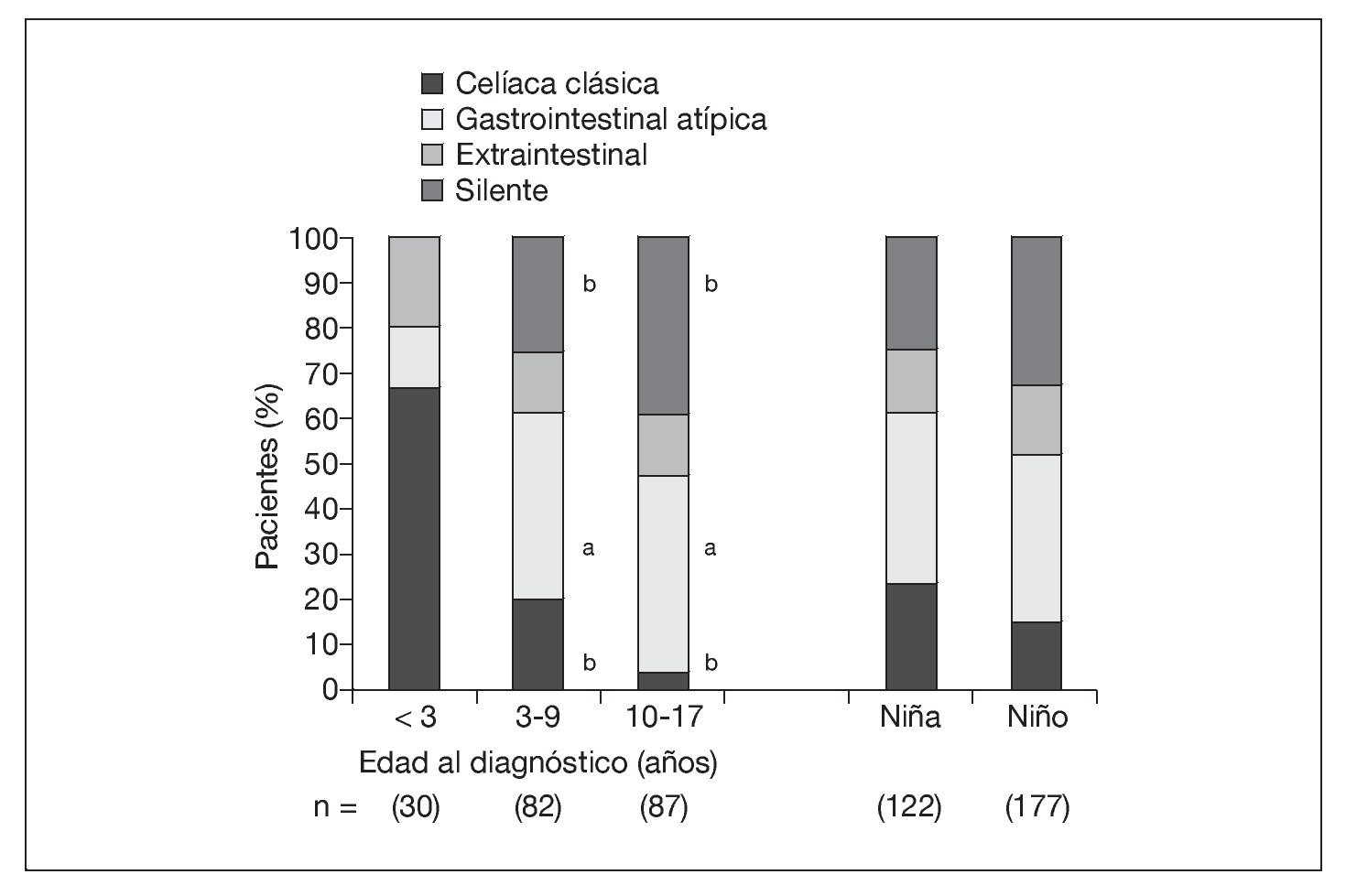
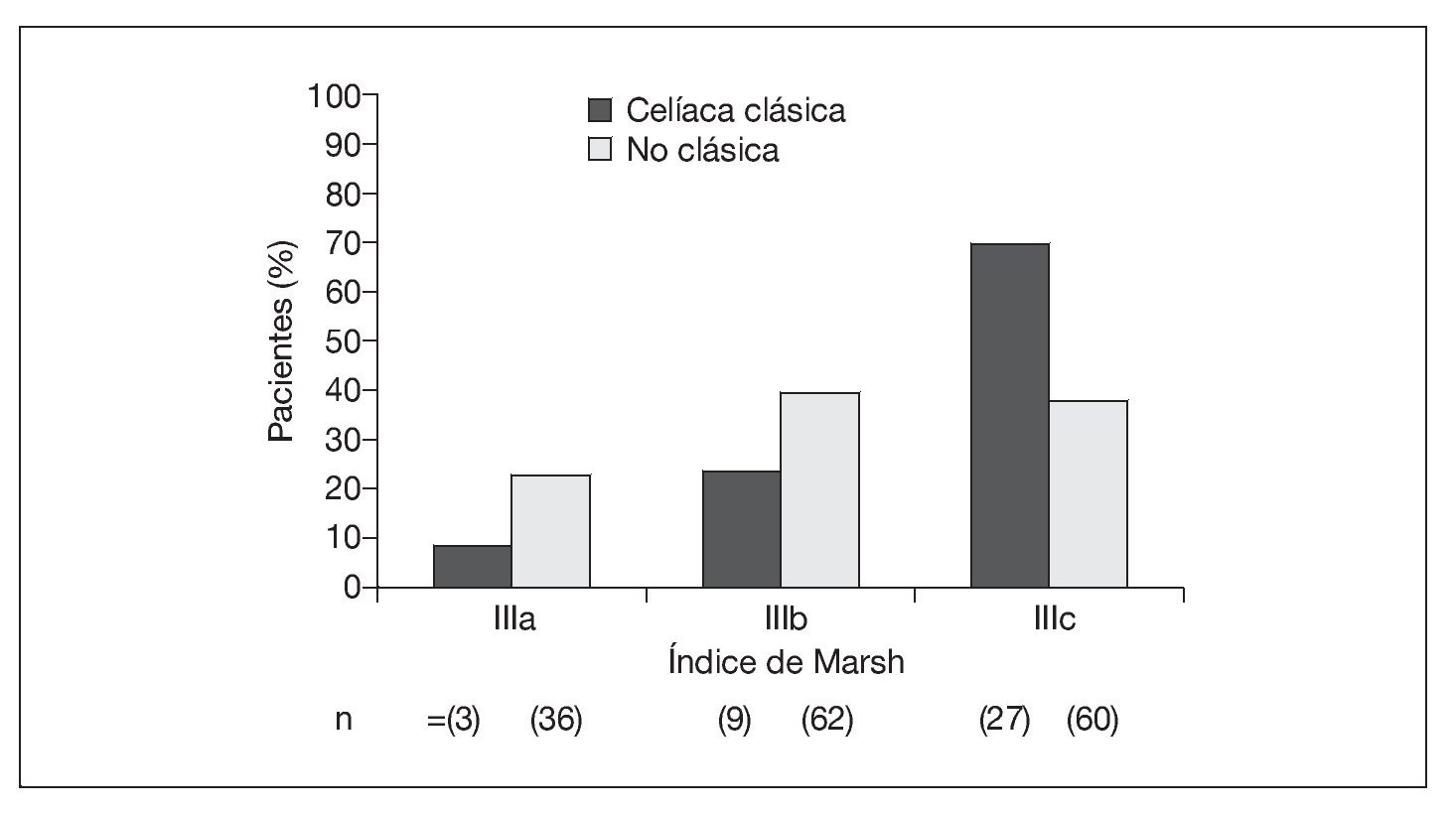
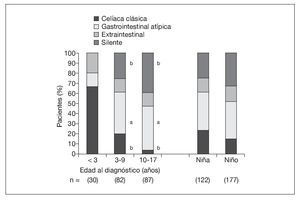
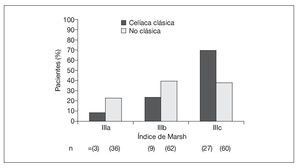
En el grupo sometido al estudio, la mediana de edad al diagnóstico fue de 8 años (IC 95%: 7-9 años) en las niñas y de 10 años (IC 95%: 8-11 años) en los niños (p = 0,054). La presentación clásica mostró una asociación inversa con la edad al diagnóstico (p < 0,001) (fig. 1). La presentación gastrointestinal atípica (p < 0,01) y la silente (p < 0,001) mostraron una asociación directa con la edad al diagnóstico (fig. 1). La presentación extraintestinal tuvo una frecuencia similar en los grupos de edad (p = 0,650). No hubo asociación significativa entre el modo de presentación y el sexo, tanto en conjunto (p = 0,379) (fig. 1) como en los grupos de edad (datos no ofrecidos). Además, la presentación clásica se asoció con mayores índices Marsh (p = 0,003) (fig. 2). La frecuencia de lesiones Marsh IIIc en la biopsia en el grupo anterior al estudio (64%) fue mayor que en el grupo sometido al estudio (44%, p = 0,0403).
Fig. 1. Presentaciones de la enfermedad celíaca según la edad y el sexo en el grupo sometido a estudio. ap < 0,01, bp < 0,001, comparado con la edad < 3 años.
Fig. 2. Índices de Marsh según la presentación de la enfermedad celíaca en el grupo sometido a estudio.
Estudio serológico
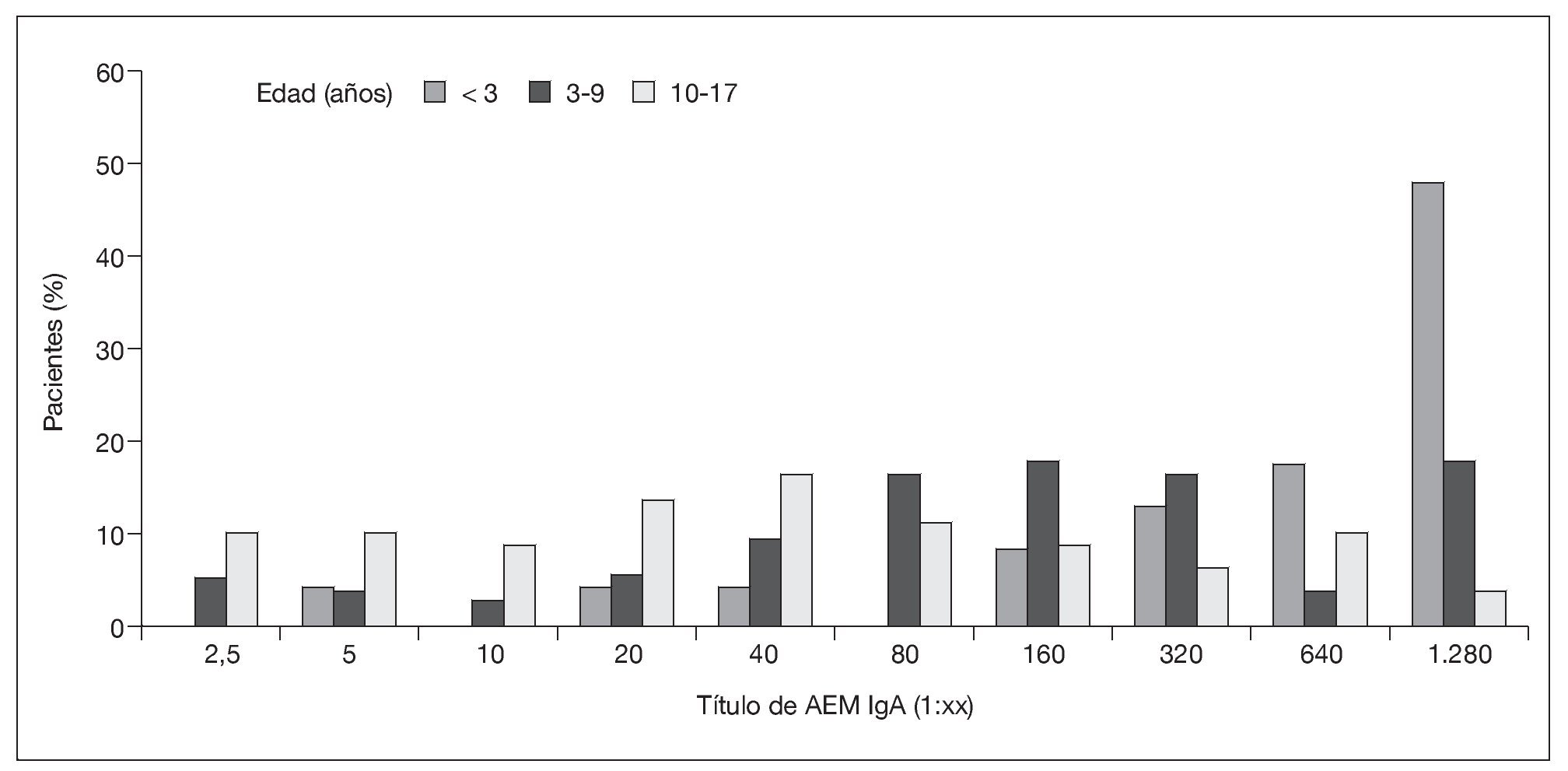
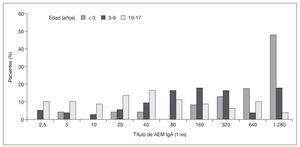
En el grupo sometido al estudio, 191 (96%) de los 199 niños se sometieron a estudio serológico antes de la biopsia intestinal; hubo resultados positivos de AEM IgA en 185 niños (97%), incluyendo a 2 con deficiencia de IgA (títulos de 1:1.280 en un niño de 6 años de edad y de 1:320 en un niño de 9 años de edad). Entre los 191 niños estudiados, 5 niños con suficiencia de IgA (3%; 1, 2, 9, 13 y 16 años de edad) y 1 niño con deficiencia de IgA (0,5%), todos con síntomas gastrointestinales, tuvieron resultados negativos de AEM IgA. Los 8 pacientes con hallazgos positivos en la biopsia antes del estudio de AEM IgA se sometieron al estudio serológico inmediatamente después de que los médicos recibiesen los informes de anatomía patológica. Todos los resultados del estudio serológico de AEM IgA fueron positivos. La potencia del título de AEM IgA mostró correlación directa con la gravedad de la lesión del intestino delgado, medida por el índice de Marsh (ρ de Spearman = 0,387; p < 0,001), e inversa con la edad al diagnóstico (ρ de Spearman = -0,373; p < 0,001) (fig. 3).
Fig. 3. Títulos de AEM IgA según la edad. AEM IgA: inmunoglobulina A antiendomisio.
ANÁLISIS
Nuestros hallazgos demuestran que la incidencia y la mediana de la edad al diagnóstico de enfermedad celíaca infantil se triplicó y cuadriplicó, respectivamente, tras la introducción del estudio de AEM IgA. Además, la introducción del estudio serológico amplió el espectro clínico de la enfermedad celíaca reconocida por los médicos, como prueba la identificación de 13 presentaciones no reconocidas anteriormente en la mitad de los casos diagnosticados entre 2000 y 2006. Aunque la frecuencia de presentación de niños con enfermedad celíaca clásica disminuyó en más de la tercera parte entre el grupo anterior al estudio y el grupo sometido a estudio, la incidencia de enfermedad celíaca clásica no varió. Que sepamos, la estabilidad de la incidencia de la enfermedad celíaca clásica no se había publicado anteriormente. El marcado aumento de la incidencia de enfermedad celíaca entre los períodos de tiempo puede atribuirse a la mejor detección de las presentaciones no clásicas, especialmente en los niños mayores. Es probable que a ello contribuyeran el mayor conocimiento del médico mediante programas de formación y el mayor énfasis sobre la enfermedad celíaca en la bibliografía médica. Además, los resultados serológicos positivos de la enfermedad celíaca pueden persuadir a los cuidadores a otorgar el consentimiento para la biopsia en los niños con síntomas leves.
Aunque observamos muchas manifestaciones clínicas atípicas de la enfermedad celíaca, los síntomas gastrointestinales siguieron siendo la presentación clínica más frecuente tras la introducción del estudio serológico. Sin embargo, estos síntomas gastrointestinales fueron cada vez más diversos y se asociaron con una lesión intestinal más leve, como prueba la disminución de los índices de Marsh en la biopsia. De forma congruente con los resultados de los estudios europeos, la presentación clásica sigue siendo más habitual en los niños pequeños y a menudo se asocia con lesiones Marsh IIIc, mientras que los niños mayores presentan con frecuencia síntomas gastrointestinales atípicos4,7,16,17. Es interesante que la frecuencia de anomalías de laboratorio, incluyendo la ferropenia, con o sin anemia, y la hipoalbuminemia, no disminuyera entre ambos períodos de tiempo, pese a la menor gravedad de las lesiones intestinales. La anemia observada en la enfermedad celíaca no clásica con lesiones intestinales más leves puede ser atribuible a una inflamación crónica18.
La correlación directa entre los títulos de AEM IgA y los índices de Marsh concuerda con los resultados de un estudio anterior16. Aunque se ha dudado de la fiabilidad de la determinación de AEM IgA en los niños de < 3 años de edad9, observamos una correlación inversa entre el título de AEM IgA y la edad al diagnóstico de la enfermedad celíaca. Esta situación probablemente sea consecuencia de que la mayoría de los niños pequeños presentan los síntomas celíacos clásicos. Como otros autores19, hemos demostrado que la presentación clásica se asocia con mayores títulos de AEM IgA y una lesión intestinal más grave que las presentaciones no clásicas. Además, sólo 2 de 5 niños suficientes en IgA con resultados serológicos falsamente negativos tenían < 3 años de edad. Los niños de cualquier edad con síntomas sugestivos de enfermedad celíaca deben someterse a una biopsia intestinal, pese a los negativos hallazgos de la serología celíaca.
La frecuencia de la presentación clásica observada en nuestro grupo de estudio (20%) fue menor que la de los niños europeos diagnosticados durante la época del estudio serológico5-7,16,20. Esto podría deberse a diferencias en la práctica de la alimentación infantil, que influye sobre la incidencia, la edad al diagnóstico y la presentación clínica de la enfermedad celíaca16. El conocimiento del médico, los umbrales para el estudio serológico, la disponibilidad de la endoscopia y las diferencias en los métodos de identificación de caso también pueden explicar las diferencias entre los estudios. Como otros, nuestro estudio indica que la presentación clínica de la enfermedad celíaca está cambiando, de forma independiente al estudio21-23. En el grupo anterior al estudio, el 44% de los pacientes tenía > 3 años de edad en el momento del diagnóstico, comparado con el 17% en el estudio de Toronto, realizado hace 4 décadas10. Una posible explicación de estas observaciones está relacionada con el aumento de la prevalencia de la lactancia materna en Canadá, desde el 25% en 1965 al 85% en 2003, y el 35% de las madres dieron de mamar durante ≥ 3 meses24. La lactancia materna y la mayor edad a la introducción del gluten se asocian con el retraso del inicio de la enfermedad celíaca y los síntomas atípicos16,25.
Las actuales pautas para los niños que presentan dolor abdominal crónico en ausencia de otros síntomas no recomiendan el estudio de la enfermedad celíaca26 o recomiendan realizarlo sólo cuando existan síntomas de alarma27. Destaca que casi uno de cada 10 niños diagnosticados de enfermedad celíaca en nuestro grupo sometido a estudio presentó dolor abdominal crónico sin otros signos o síntomas. Que sepamos, éste es el único estudio que demuestra la enfermedad celíaca en niños con dolor abdominal sin otros síntomas, signos o alteraciones asociadas que hubieran merecido el estudio de la enfermedad celíaca. Dos estudios examinaron la prevalencia de la enfermedad celíaca en los niños con dolor abdominal crónico, y ambos concluyeron que no se debía recomendar el estudio28,29. Estos estudios tuvieron un pequeño tamaño de la muestra, y sólo uno incluyó a sujetos de control. Ambos estudios se realizaron antes del reconocimiento de que la enfermedad celíaca afecta a entre el 0,3% y el 1,0% de los niños2,3. Es necesario seguir investigando para determinar la prevalencia de la enfermedad celíaca en los niños con dolor abdominal crónico sin síntomas de alarma y para determinar el valor del estudio en este subgrupo.
En los últimos 7 años, > 1 de cada 4 niños fue diagnosticado de enfermedad celíaca en el sur de Alberta como consecuencia de la búsqueda debida a alteraciones asociadas, lo que concuerda con los datos de Reino Unido6. Aunque las actuales pautas recomiendan el estudio de la enfermedad celíaca en los niños con alteraciones asociadas, no se conoce por completo los beneficios a corto y largo plazo. Los niños con enfermedad celíaca detectada en el estudio tienen un peso y una talla significativamente menores en comparación con los sujetos de control30,31. Como otros autores, hemos observado que los niños con enfermedad "asintomática", detectada por el estudio, que inician una DSG suelen informar de mejoría de unos síntomas que no se habían reconocido antes del diagnóstico30-34. No se sabe si la enfermedad celíaca asintomática, o la reconocida retrospectivamente, comportan los riesgos a largo plazo asociados con la enfermedad celíaca sintomática no tratada35. Además, los niños con enfermedad celíaca detectada por el estudio pueden no percibir un beneficio de la DSG, lo que puede aumentar la carga de enfermedad y disminuir el cumplimiento con la dieta11,36-40.
Las posibles limitaciones de este estudio retrospectivo incluyen la notificación incompleta de los síntomas y los datos de laboratorio en las historias clínicas, así como la identificación incompleta de todos los casos por un error administrativo, los cambios de los patrones de traslado y la evaluación de los niños mayores por un gastroenterólogo de adultos. Durante todo el estudio, nuestra consulta fue el único centro de referencia pediátrico en el sur de Alberta.
CONCLUSIONESLa introducción del estudio serológico llevó a un marcado aumento del reconocimiento de la diversidad de las presentaciones clínicas de la enfermedad celíaca, especialmente en los niños mayores. Este estudio es el primero en informar de las frecuencias de las presentaciones clínicas de la enfermedad celíaca observadas en la práctica clínica antes y después de la introducción del estudio serológico en los niños norteamericanos. Aunque la incidencia de enfermedad celíaca clásica no disminuyó, muchos niños con presentaciones gastrointestinales atípicas y los de los grupos de alto riesgo fueron reconocidos a causa del estudio serológico. Son necesarios más esfuerzos de formación para mejorar la detección de la enfermedad celíaca no clásica, así como estudios de seguimiento a largo plazo para comprender el impacto de la enfermedad celíaca y la DSG sobre la salud y el bienestar de los niños, especialmente los identificados mediante el estudio serológico. AGRADECIMIENTOS
Esta investigación fue financiada con becas del Calgary Chapter de la Canadian Celiac Association y la Canadian Association of Gastroenterology. Calgary Laboratory Services ofreció el acceso a los resultados de la anatomía patológica, la IgA y los AEM IgA.
Correspondencia: J. Decker Butzner, MD, Division of Gastroenterology and Nutrition, Alberta Children's Hospital, 2888 Shaganappi Trail NW, Calgary, Alberta, T3B 6A8, Canadá.
Correo electrónico: butzner@ucalgary.ca