Los pacientes acuden al departamento de urgencias (DU) con una gran variedad de procesos dolorosos, incluidas fracturas, contusiones y esguinces. En el departamento de urgencias pediátricas del centro de los autores, alrededor del 10% de todas las visitas al DU corresponden a dichas lesiones. Una importante parte del plan de tratamiento en el DU debe ser la provisión de una analgesia suficiente, puesto que numerosos estudios han demostrado que los pacientes tanto pediátricos como adultos que acuden a DU no reciben la analgesia suficiente1-6.
Cuando los niños son tratados para el dolor en el DU, son de elección los fármacos por vía oral. Evitan el sufrimiento que causa una inyección intravenosa o intramuscular y corren un menor riesgo de acontecimientos adversos graves (como apnea y aspiración) que se asocian con los analgésicos administrados por vía parenteral. Aunque se han publicado estudios que comparan el alivio del dolor proporcionado por los diferentes analgésicos orales en niños en el período postoperatorio7-10, no se han publicado ensayos aleatorizados, controlados (EAC), que examinen la utilización de los analgésicos habituales por vía oral para niños con una lesión musculoesquelética aguda que se presentan en el DU. La mayor parte de estudios publicados sobre analgesia oral para el dolor musculoesquelético agudo en pacientes adultos que se presentan en el DU no han examinado los analgésicos orales que suelen prescribirse a niños11-14.
En un estudio a gran escala, publicado recientemente, basado en un DU, sus autores no identificaron diferencias en el alivio del dolor entre pacientes adultos tratados con paracetamol, indometacina, diclofenaco o paracetamol combinado con cualquier analgésico no esteroideo15.
El objetivo del presente estudio fue determinar cuál de tres fármacos administrados por vía oral –paracetamol, ibuprofeno o codeína– prescritos en forma de dosis única confiere la mayor eficacia analgésica para niños que se presentan en el departamento de urgencia con lesiones traumáticas musculoesqueléticas agudas.
MÉTODOSDiseño del estudioEl presente ensayo aleatorizado, controlado, comparó el cambio del dolor entre niños con dolor musculoesquelético agudo tratados con paracetamol, ibuprofeno y codeína.
Ámbito y población del estudioEl presente ensayo se efectuó entre mayo de 2002 y enero de 2003 en un hospital académico, pediátrico, de asistencia terciaria en Ottawa, Canadá, con un censo anual en el departamento de urgencias de 55.000 (Children’s Hospital of Eastern Ontario). Eran elegibles niños de 6-17 años de edad si se presentaron en el DU con dolor debido a una lesión musculoesquelética (extremidades, cuello y vértebras) que aconteció en las 48 horas previas. Se excluyó a los niños si tenían una contraindicación de fármaco del estudio, precisaron reanimación, presentaron una fractura abierta, se les insertó una línea intravenosa, habían recibido uno de los fármacos del estudio en las 4 horas previas para paracetamol y codeína o 6 horas para ibuprofeno, o presentaron un deterioro cognitivo significativo. Se obtuvo el consentimiento informado por escrito. Nuestro comité de investigación institucional aprobó la presente investigación.
Protocolo del estudioUn asistente de la investigación reclutó a los participantes en el DU durante 8 horas diarias a lo largo del período de estudio. Una vez se obtuvo el consentimiento, se registraron los datos basales y las determinaciones del estudio. A continuación, se asignó aleatoriamente a los participantes a uno de tres grupos. Recibieron 15 mg/kg de paracetamol (dosis máxima 650 mg), 10 mg/kg de ibuprofeno (dosis máxima de 600 mg) o 1 mg/kg de codeína (dosis máxima de 60 mg) por vía oral. Se seleccionaron estas dosis porque ya se habían utilizado en otros ensayos sobre analgesia y antitérmicos11,16, porque el Compendium of Pharmaceuticals and SpecialtiesTM, nuestra consulta de referencia nacional de los medicamentos, cita estas dosis como las de referencia, y porque el farmacéutico de investigación de nuestro centro las confirmó, incluidas las máximas, como las de referencia y las recomendadas. La secuencia de aleatorización se generó con ordenador con un tamaño de los bloques de 9. Para ocultar la secuencia de asignación se utilizaron sobres opacos, cerrados. Los fármacos eran de color morado, con sabor a uva, y se administraron en jeringas ámbar recubiertas de una bolsa de plástico opaca. Debido a su farmacocinética, los volúmenes del fármaco del estudio por kilogramo de peso fueron similares pero no idénticos. Con el objetivo de mantener el enmascaramiento, la enfermera responsable de la selección abrió el sobre de la aleatorización y administró el fármaco apropiado del estudio. La enfermera no participaba de otro modo en el estudio o en una asistencia adicional del paciente. Los niños-padres y asistente de investigación permanecieron enmascarados para la asignación del grupo.
El asistente de investigación explicó al niño la utilización de la escala de análogos visuales (EAV) para medir el dolor.
El niño registró la puntuación de dolor basal utilizando una EAV antes de la aleatorización y de que se administrara el fármaco asignado del estudio (“tiempo 0”). Se efectuaron mediciones adicionales del dolor cada 30 minutos durante 120 minutos utilizando la EAV y, para impedir un sesgo remanente, el niño no pudo ver las puntuaciones previas. A los 60 minutos y, a continuación, cada 30 minutos, se preguntó a los niños si requerían analgesia adicional. No se permitió un analgésico adicional durante los 60 minutos después de la administración del fármaco del estudio. Los participantes dados de alta antes de los 120 minutos recibieron materiales para completar las puntuaciones restantes en los momentos apropiados al igual que sobres franqueados. Se contactó por teléfono con los padres dos días después de la visita para determinar la presencia de cualquier efecto adverso y alentar el envío por correo de las hojas de datos.
Todas las intervenciones, incluidas las exploraciones físicas, fármacos adicionales, radiografías, colocaciones de férulas, escayolas y reducciones que tuvieron lugar durante la visita del paciente al DU se documentaron prospectivamente, al igual que el diagnóstico del alta. Los efectos adversos producidos en el DU se detectaron utilizando una pregunta abierta, “aparte del dolor, ¿tienes alguna otra molestia?”. A los dos días de seguimiento, los efectos adversos se examinaron mediante preguntas específicas y abiertas. Justo antes del alta del DU, se preguntó a niños, padres y asistentes de la investigación qué fármacos creían que se habían administrado. El médico que atendió la urgencia determinó el diagnóstico final y destino de los pacientes. A continuación, se agruparon los diagnósticos en líneas generales en fracturas y lesiones de los tejidos blandos.
Variables analizadasLas determinaciones basales incluyeron la edad, sexo, puntuación del dolor y uso previo de analgésicos. La principal variable analizada fue el cambio del dolor autoevaluado por el paciente desde el período basal a los 60 minutos de recibir el fármaco del estudio. El dolor se determinó utilizando una escala de análogos visuales (una línea de puntos de 100 mm fijada en un extremo con una etiqueta que indicaba “sin dolor”), y en el otro, con una que indicaba “empeoramiento del dolor”. Las escalas de análogos visuales (EAV) se han utilizado ampliamente en los ensayos sobre analgésicos y son válidas para niños µ 6 años de edad17. Se considera que un cambio clínicamente importante de la EAV fluctúa de 9 a 18 mm18-22. Seleccionamos el período de 60 minutos después de la administración como el tiempo de análisis de la variable primaria ya que los fármacos se habrían absorbido y serían eficaces en dicho punto. Se seleccionó la evaluación del niño sobre el dolor más que la de los padres o el asistente de investigación porque se ha puesto de relieve que los padres y el personal sanitario no son precisos cuando evalúan el dolor de un niño23,24. Las variables secundarias analizadas incluyeron el cambio de la EAV desde el período basal a los 30, 90 y 120 minutos, necesidad de analgésicos adicionales, y número de pacientes que alcanzaron una EAV < 30 mm (definida como “analgesia suficiente”) a los 60 y 120 minutos. Esta última variable se seleccionó porque en un estudio previo se ha sugerido que una puntuación de dolor de menos de 30 mm indica un alivio suficiente del dolor25.
Tamaño de la muestraLos estudios previos han indicado que, según lo determinado mediante la EAV, una diferencia mínima clínicamente significativa del dolor fluctúa entre 9 y 18 mm con una desviación estándar (DE) que varía de 14 a 40 mm18-22. Debido a esta variación, elegimos una diferencia de 15 mm (DE = 20 mm) en el cambio de la puntuación EAV entre grupos como la diferencia clínicamente significativa mínima detectable en la presente investigación. Por lo tanto, los cálculos del tamaño de la muestra se basaron en las asunciones siguientes: 1) detección de una diferencia de 15 mm entre grupos; 2) desviación estándar de 20 mm; 3) prueba de dos colas (bilateral); y 4) potencia estadística del 80% y tasa de falsos positivos (error de tipo I) de 0,05.
A pesar de que estas asunciones eran apropiadas, a posteriori se puso de relieve que las fórmulas usadas para calcular el tamaño de la muestra eran insuficientes. En primer lugar, se utilizó una fórmula para un ensayo de dos grupos que se expandió para adaptarse a un ensayo de 3 grupos. En segundo lugar, el tamaño de la muestra obtenido utilizando las asunciones descritas previamente requería un número total de 56 participantes, lo que se interpretó por error como 56 participantes por grupo. Por esta razón, planificamos reclutar a 168 pacientes en total, y duplicamos el número con el objetivo de tener la potencia suficiente para los análisis de subgrupo.
Análisis de los datosEl sexo y el tipo de lesión de los participantes aleatorizados frente a los no aleatorizados se compararon utilizando pruebas de la µ2. La diferencia de edad se evaluó utilizando la prueba de la t de Student. La comparación de las variables continuas (como el cambio de la EAV desde el período basal) entre los 3 grupos de estudio se efectuó utilizando modelos ANOVA, seguido de pruebas post hoc de Tukey de la significación cuando se observó una diferencia significativa. Las variables categóricas (como la obtención de una analgesia suficiente) se compararon utilizando pruebas de la µ2 o pruebas exactas de Fisher cuando fue necesario. La eficacia del enmascaramiento se evaluó utilizando una prueba de la µ2. Todos los valores de p documentados son de dos colas y se consideraron significativos cuando alcanzaron un nivel del 5%. Los subgrupos planificados a priori incluyeron aquellos con determinaciones basales en la EAV > 30 mm (ya que se supuso que experimentaban más dolor significativo), pacientes con fracturas y pacientes con lesiones de los tejidos blandos.
Los datos se analizaron primero por protocolo. Se incluyó a los pacientes en el análisis por protocolo si recibieron una dosis del fármaco del estudio, tuvieron disponibles datos basales y datos de la variable primaria. Para la variable primaria y el cambio en la puntuación del dolor desde el período basal a los 120 minutos se efectuó un análisis en intención de tratar (ITT), que incluyó a todos los pacientes aleatorizados inicialmente. Los datos para los participantes en los que no estuvo disponible una serie completa de información se imputaron utilizando el último valor de suma y sigue.
RESULTADOSReclutamiento y características basales de los pacientes
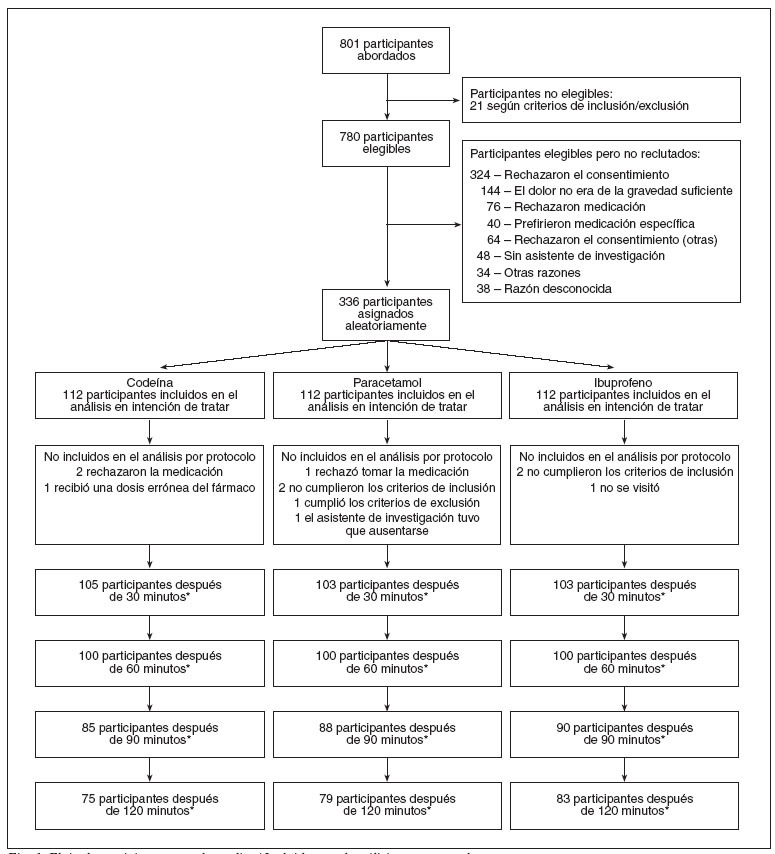
Durante el período en el que estuvieron disponibles asistentes de la investigación se presentaron en el departamento de urgencias 801 niños con dolor secundario a una lesión musculoesquelética aguda. Fueron elegibles 780 niños y se asignaron aleatoriamente 336 (fig. 1). Rechazaron el consentimiento 324 familias, 48 niños no se abordaron porque el asistente de investigación estaba reclutando a otro niño, 38 se pasaron por alto, y 34 no se reclutaron por otras razones. Los niños reclutados fueron dados de alta del departamento de urgencias durante el período del estudio y en la figura 1 se indica el número para los que estuvieron disponibles datos de resultados. En 300 pacientes se había obtenido una determinación de la variable primaria para el análisis final (fig. 1). Los pacientes elegibles aleatorizados frente a los no aleatorizados fueron comparables con respecto a la edad, sexo, aunque los no aleatorizados tuvieron ligeramente más probabilidades de presentar lesiones de tejidos blandos que los pacientes aleatorizados (54% comparado con 47%). Las características basales fueron similares en todos los grupos de estudio (tabla 1). Recibieron las dosis máximas de los fármacos del estudio basadas en el peso 23 (22%) niños del grupo ibuprofeno, 51 (48%) del grupo paracetamol y 23 (21%) del grupo codeína.
Fig. 1. Flujo de participantes en el estudio. *Incluidos en el análisis por protocolo.
TABLA 1. Características basales
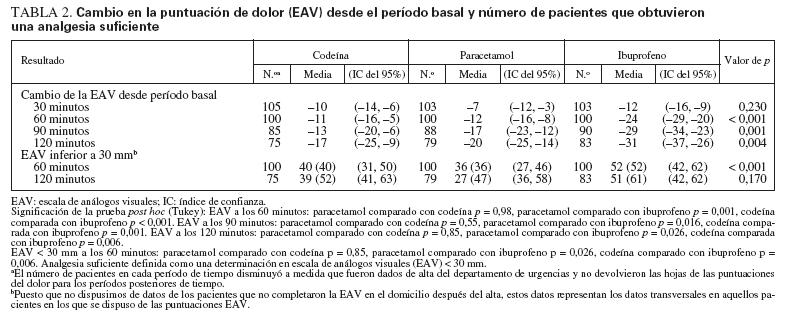
Cambio del dolor y suficiencia de la analgesiaEn conjunto, los pacientes manifestaron una mejora del dolor desde el período basal durante el curso del estudio. Sin embargo, a los 30 minutos, no se halló una diferencia significativa en el cambio de la puntuación del dolor entre los 3 grupos. Desde los 60 minutos en adelante, los pacientes del grupo ibuprofeno presentaron una mejora significativamente mayor de la puntuación del dolor que los del grupo codeína y paracetamol. En ningún período de tiempo hubo una diferencia significativa del cambio de la puntuación del dolor entre el grupo codeína y paracetamol (tabla 2). Así mismo, a los 60 minutos, obtuvo una analgesia suficiente (según lo definido por una EAV > 30 mm) un mayor número de pacientes del grupo ibuprofeno que de los otros dos grupos. Entre los grupos codeína y paracetamol no se identificó una diferencia significativa (tabla 2). Durante el curso del ensayo, no se observó una diferencia significativa en el número de pacientes que requirieron un analgésico adicional (22,2% de los pacientes del grupo codeína, 15,6% de los del grupo paracetamol, y 14,3% de los del grupo ibuprofeno) (p = 0,32). Todos los fármacos adicionales se administraron después de la determinación de la variable primaria y, en consecuencia, el análisis no se ajustó para dichos tratamientos adicionales. El análisis ITT para el cambio de la puntuación del dolor desde el período ba-sal a los 60 y 120 minutos y el número de pacientes que obtuvieron una analgesia suficiente produjo resultados similares a los del análisis por protocolo (datos no mostrados).
TABLA 2. Cambio en la puntuación de dolor (EAV) desde el período basal y número de pacientes que obtuvieron una analgesia suficiente
Efectos secundarios y acontecimientos adversosMientras los participantes permanecieron ingresados en el DU no se documentaron efectos secundarios significativos. En el grupo codeína un niño recibió accidentalmente 5 mg/kg como dosis única. Este paciente fue retirado del estudio, tratado con carbón activado, monitorizado en el DU, y no presentó efectos adversos. En el seguimiento por teléfono a las 48 horas, no se encontró una diferencia significativa en el número de pacientes que mencionaron efectos adversos menores (como náuseas, somnolencia y estreñimiento), documentando un 16,2% (16/99) en el grupo codeína, 7,7% (8/104) en el grupo paracetamol y 10,9% (11/101) en el grupo ibuprofeno, como mínimo, un efecto adverso (p = 0,16).
Comparaciones de subgrupoEn la tabla 3 se describen los detalles de las comparaciones de subgrupo. Entre pacientes con fracturas, ibuprofeno dio lugar a una mejora significativamente mayor del dolor que los otros fármacos tanto a los 60 como a los 120 minutos. No se identificó una diferencia estadísticamente significativa entre codeína y paracetamol. Entre pacientes con una lesión de los tejidos blandos no se detectó una diferencia estadísticamente significativa en el cambio de la puntuación del dolor entre cualquiera de los 3 fármacos a los 60 o 120 minutos. Cuando en el análisis sólo se consideró a pacientes con dolor > 30 mm, ibuprofeno fue significativamente mejor que los otros fármacos a los 60 minutos. Los otros dos analgésicos fueron equivalentes. A los 120 minutos, tanto ibuprofeno como codeína produjeron efectos similares y fueron significativamente mejores que paracetamol.
TABLA 3. Cambio medio de la EAV desde el período basal entre pacientes con fracturas, lesiones de tejidos blandos y EAV basal > 30 mm
EnmascaramientoTanto en pacientes como en los padres pareció suficiente el enmascaramiento a la identidad del fármaco del estudio, eligiendo la respuesta correcta con las mismas probabilidades que por azar. Sin embargo, los asistentes de la investigación identificaron correctamente el fármaco del estudio como paracetamol en el 52% de casos e ibuprofeno en el 42% de casos, lo que representa un porcentaje de respuestas correctas mayor de lo que sería predecible por azar.
DISCUSIÓNLas visitas al DU para procesos dolorosos como fracturas, contusiones y esguinces son sumamente frecuentes. A pesar de esto, no suele proveerse una analgesia suficiente a los pacientes y, en particular, a los pacientes pediátricos1-6. El presente estudio, el primero que compara tres analgésicos por vía oral de utilización muy difundida en el tratamiento del dolor debido a lesiones musculoesqueléticas en niños, ha demostrado que ibuprofeno alivia mejor el dolor agudo de estos niños que el paracetamol o la codeína. Los niños tratados con ibuprofeno también tuvieron más probabilidades de obtener una analgesia suficiente. No identificamos diferencias en el número de efectos adversos de los tres fármacos. Es interesante destacar que en el análisis de subgrupo el ibuprofeno se tradujo en mayores mejoras de las puntuaciones del dolor entre pacientes con fracturas, comparado con codeína o paracetamol, pero, entre pacientes con lesiones de tejido blandos, no se observaron diferencias estadísticamente significativas. Dado que entre pacientes con este tipo de lesiones la puntuación del dolor basal fue la misma que la de aquellos con fracturas, esto no puede guardar relación con un menor “margen de mejora” entre pacientes con lesiones de tejidos blandos. No está clara la etiología de esta diferencia pero podría reflejar una diferencia en la fisiología del dolor entre ambos grupos. Quizá los efectos antiinflamatorios del ibuprofeno son responsables de un mejor alivio del dolor.
También es importante observar que, aunque el ibuprofeno fue más eficaz en la provisión de una analgesia suficiente, sólo el 52% de niños de este grupo pudo definirse como receptores de una “analgesia suficiente” a los 60 minutos. Así mismo, aunque la codeína y el paracetamol dieron lugar a un cierto grado de mejora del dolor, el nivel real de mejora (un cambio de 10 a 11 mm en la EAV) sólo se encuentra dentro de los límites que los estudios previos han sugerido que representan una mejora significativa del dolor18-22. Por lo tanto, aunque, en el presente estudio, ibuprofeno confirió un mejor alivio del dolor que la codeína y paracetamol, parece ser que ibuprofeno solo no es suficiente para aliviar el dolor en todos los niños con lesiones musculoesqueléticas.
Aunque en ningún estudio se ha efectuado una comparación directa de estos fármacos entre niños con lesiones musculoesqueléticas, otros estudios han revelado que ibuprofeno es mejor que el paracetamol para otros procesos que cursan con dolor16,26. Por ejemplo, se ha demostrado que el ibuprofeno es superior al paracetamol para controlar el dolor de la amigdalitis26 y para el dolor de la migraña16. En dos estudios se ha comparado el alivio del dolor con ibuprofeno con un preparado de paracetamol y codeína combinados7,8 después de una amigdalectomía. Los resultados son controvertidos demostrando un estudio un alivio similar del dolor8 mientras que el otro sugiere que la combinación de paracetamol y codeína es ligeramente mejor7. Ninguno de ambos estudios utilizó ibuprofeno en dosis de 10 mg/kg. En un estudio de pacientes con lumbalgia aguda sus autores documentaron que ketorolaco, otro fármaco antiinflamatorio no esteroideo (AINE), no confirió un mejor alivio del dolor que un preparado de paracetamol y codeína combinados11. En comparación con los resultados del presente estudio, muchos de estos estudios sugirieron que los analgésicos opiáceos se asociaron con mayores efectos adversos que los AINE8,10,11. No obstante, muchos de estos estudios trataron a pacientes con múltiples dosis de medicación. En un gran estudio en un departamento de urgencias (n = 300) entre pacientes adultos con dolor debido a lesiones musculoesqueléticas sus autores no documentaron diferencias en el alivio del dolor entre pacientes tratados con paracetamol, indometacina, diclofenaco o una combinación de paracetamol y un AINE. La dosis de indometacina y diclofenaco no fueron las máximas permitidas, aunque son dosis utilizadas habitualmente. Así mismo, a diferencia del presente estudio, sólo un reducido número de pacientes era portador de fracturas15. En un ensayo no aleatorizado, de pequeño tamaño, que incluyó tres grupos (76 pacientes) sus autores compararon el efecto del patrón de asistencia (aplicación de hielo y elevación de la extremidad), el patrón de asistencia más 10 mg/kg de ibuprofeno, y el patrón de asistencia más distracción en el alivio del dolor en niños con fracturas. Es interesante destacar que en este ensayo se puso de relieve que el ibuprofeno no aumentó los beneficios analgésicos del patrón de asistencia mientras que la distracción fue beneficiosa.
Se han expresado preocupaciones relativas al efecto de los AINE sobre el metabolismo óseo y la curación de las fracturas. Los estudios en animales han sugerido que múltiples dosis de indometacina, aspirina e ibuprofeno27-30 pueden afectar a la curación de diversas fracturas en ratas. En seres humanos los estudios retrospectivos efectuados han deparado resultados heterogéneos. En ningún ensayo prospectivo, aleatorizado, controlado, se ha examinado el efecto del ibuprofeno sobre la curación de las fracturas. En un EAC que examinó la utilización de piroxicam no se documentó un retraso significativo de la curación de fracturas de Colles31, mientras que en otro EAC sus autores documentaron que una tanda de 6 semanas de indometacina aumentó significativamente el riesgo de falta de unión de las fracturas acetabulares32. No se dispone de pruebas de que una dosis única de ibuprofeno se asocie con un retraso de la curación de las fracturas en seres humanos. Así mismo, puesto que los AINE inhiben la agregación plaquetaria y prolongan el tiempo de sangría, su uso podría aumentar el riesgo de hemorragia. Sin embargo, en una revisión sistemática reciente sus autores no identificaron un aumento de las hemorragias cuando se administraron AINE para controlar el dolor después de una amigdalectomía33. Sin embargo, los AINE de dispensación libre, como ibuprofeno y naproxeno, se han asociado con un mayor riesgo de toxicidad gastrointestinal grave34 (incluidas hemorragias gastrointestinales), aunque este riesgo parece relacionarse con la duración del tratamiento35.
Las limitaciones de la presente investigación incluyen el elevado número de pacientes elegibles que no se reclutaron para el estudio. No obstante, los pacientes del estudio fueron similares a los no reclutados con respecto a sus características basales incluida la edad y sexo aunque tuvieron más probabilidades de presentar fracturas como diagnóstico final. Es interesante destacar que la razón más frecuente para rechazar el consentimiento fue que los padres consideraron que el dolor de su hijo no era del grado suficiente para justificar un analgésico. Esto sugiere que es necesaria la educación de los padres relativa a los beneficios y a la eficacia de los analgésicos para los niños. Aunque 33 pacientes aleatorizados carecieron de datos de la variable primaria, el tamaño de la muestra fue suficiente para mostrar una diferencia entre los fármacos del estudio. Además, aunque no se observaron diferencias en los efectos adversos entre grupos de estudio, la presente investigación no contó con la potencia para detectar acontecimientos adversos graves, excepcionales. Por otra parte, el número de efectos adversos descritos podría aumentar si se utilizara una lista de control para su detección36. En el DU, utilizamos una pregunta abierta, aunque en el seguimiento a los dos días se incluyó una lista de control y una pregunta abierta. Así mismo, un mayor número de niños del grupo paracetamol recibió la dosis máxima del fármaco del estudio comparado con los del grupo ibuprofeno y codeína. Aunque seleccionamos las dosis máximas de los fármacos partiendo de los estudios previos y de las dosis de referencia, es posible que la administración de las dosis máximas más altas de codeína o paracetamol diera lugar a un mayor alivio del dolor con estos fármacos.
La presente investigación está limitada por las dificultades del enmascaramiento. Aunque el informe CONSORT37 recomienda una descripción de “cómo se evalúa la eficacia del enmascaramiento”, recientemente se ha debatido el medio correcto para evaluar su suficiencia en los EAC38-41. En el presente estudio preguntamos a pacientes, padres y asistentes de la investigación que trataran de adivinar qué fármaco del estudio se había administrado. Observamos que los asistentes de investigación identificaron correctamente el fármaco del estudio como el paracetamol en el 52% de casos y el ibuprofeno en el 42%, lo que sugeriría que el enmascaramiento no habría sido suficiente. No obstante, consideramos que esto no invalida los resultados porque los participantes y sus padres no parecieron determinar qué fármaco del estudio había recibido el niño y la variable primaria era el cambio del dolor autoevaluado por el paciente.
En conclusión, la presente investigación demuestra que, entre niños con dolor por lesiones musculoesqueléticas agudas que se presentan en un departamento de urgencia pediátricas, una dosis única de ibuprofeno confiere un mayor alivio de dolor que la codeína y el paracetamol.
AGRADECIMIENTOSLa presente investigación se financió con una beca de investigación del Children’s Hospital of Eastern Ontario Research Institute. El Dr. Plint recibió financiación, en parte, a través de los honorarios del Children’s Hospital of Eastern Ontario Research Institute.
El Dr. Clark en la actualidad trabaja en la Division of Emergency and Department of Surgery, University of British Columbia, Vancouver, Canadá.
Correspondencia: Amy Plint, MD, Division of Emergency Medicine, Children’s Hospital of Eastern Ontario, 401 Smyth Rd, Ottawa, Ontario, Canadá K1H 8L1.
Correo electrónico: plint@cheo.on.ca