El reflujo vesicoureteral (RVU), la más frecuente de las anomalías urológicas, tiene una tasa de prevalencia del 1% al 2% en los niños y suele tratarse inicialmente con una profilaxis antibiótica, a la espera de su resolución espontánea. El RVU puede aumentar el riesgo de repetidas pielonefritis1,2. La American Academy of Pediatrics recomienda realizar la cistouretrografía miccional o la cistografía isotópica en cuanto sea posible en los niños pequeños con infecciones febriles de las vías urinarias (IVU) y que los niños con RVU demostrable deben recibir profilaxis antimicrobiana1.
La combinación de trimetoprima con sulfametoxazol (cotrimoxazol) es uno de los 2 agentes antimicrobianos recomendados para la profilaxis de la IVU1,3,4. Sin embargo, cada vez es mayor la preocupación por la resistencia antibiótica de los patógenos urinarios tras el empleo de cotrimoxazol como agente profiláctico5,6. Ensayos realizados en Japón y Turquía demostraron que el tratamiento con dosis bajas de cefalosporinas podría disminuir el riesgo de IVU recurrente en los niños7,8. Estos resultados indican que las cefalosporinas pueden constituir una alternativa al tratamiento profiláctico. Muchos nefrólogos y urólogos pediátricos de Japón7 y otros lugares, incluyendo Taiwán, han favorecido la profilaxis antibiótica con cefalosporinas por el RVU.
Teóricamente, es de esperar que los agentes antimicrobianos satisfactorios para el tratamiento (amoxicilina, cefalexina y cefuroxima) induzcan resistencia en los bacilos gramnegativos, por sus características farmacocinéticas de absorción en el tracto gastrointestinal tras la administración oral3. Los organismos coliformes resistentes seleccionados en el tracto gastrointestinal tras la profilaxis antibiótica oral pueden causar infecciones resistentes, aunque las pruebas clínicas publicadas que confirmen esta hipótesis son escasas. Además, no sabemos que otros estudios pediátricos hayan demostrado las ventajas, o los riesgos relativos (RR), de desarrollar resistencia antibiótica con determinados antibióticos profilácticos. Por ello, investigamos los patógenos urinarios y la sensibilidad antimicrobiana asociada en los niños tratados en 2 hospitales por IVU contraída en la comunidad mientras recibían profilaxis por un VUR con distintos antibióticos.
MÉTODOSEste estudio retrospectivo fue realizado en 2 hospitales terciarios, el Chang Gung Children’s Hospital (CGCH) y el National Taiwan University Hospital (NTUH), situados en el norte de Taiwán. Revisamos las historias clínicas entre 2001 y 2006 de todos los pacientes de hasta 15 años de edad sometidos en 2001-2002 a cistouretrografía miccional con un diagnóstico confirmado de RVU primario (según la clasificación del International Reflux Study Committee)9 en cualquiera de los hospitales. Nos centramos en los niños que desarrollaron IVU intercurrente durante el período de profilaxis. Todos los pacientes diagnosticados de IVU intercurrente ingresaron con fiebre y urinocultivo positivo (> 105 colonias por ml en muestras del chorro medio urinario o cualquier cantidad de bacterias en las muestras obtenidas mediante punción suprapúbica). También se incluyó a algunos pacientes con IVU afebril y bacteriuria confirmada mediante punción suprapúbica. Excluimos a los aislados si los pacientes habían recibido tratamiento antibiótico ambulatorio (aparte del tratamiento profiláctico) o si los aislados se obtuvieron inmediatamente después de un ciclo de tratamiento de cualquier infección bacteriana.
La sensibilidad antibiótica se determinó aplicando técnicas estándar10. Los resultados intermedios se consideraron resistentes porque no se hubiera optado por estos antibióticos. Algunos organismos no se estudian de forma rutinaria frente a determinados antibióticos. En los enterococos, los resultados se registraron como resistentes a las cefalosporinas; en las Pseudomonas se consideró la resistencia a la cefazolina, la cefuroxima y la ceftriaxona. Se estudiaron sistemáticamente los organismos productores de µ-lactamasa de espectro ampliado (BLAE), confirmándose los resultados según el método propuesto por el Clinical and Laboratory Standards Institute11.
Se registró la información médica de los pacientes, consistente en datos demográficos, RVU, resultados del urinocultivo, sensibilidad antibiótica de las IVU en el primer episodio y en infección intercurrente y los antibióticos profilácticos prescritos y la duración de su empleo. La política de la profilaxis antibiótica del RVU sólo difirió entre los 2 hospitales en el empleo de antibióticos. En el At CGCH, la elección de los antibióticos, la duración del tratamiento antibiótico profiláctico y los cambios de antibiótico dependieron de las decisiones de distintos médicos, por lo que se agruparon los aislados según los regímenes antibióticos prescritos. En el NTUH, el cotrimoxazol fue el único agente antimicrobiano utilizado como profilaxis en el RVU, y el análisis de los datos se centró sólo en este antibiótico. Loscomités de Ética aprobaron este estudio, para el que no fue necesario obtener el consentimiento informado.
Se utilizó un análisis de µ2 o un test exacto de Fisher para evaluar las diferencias de las tasas de recurrencia entre los grupos y los cambios de la frecuencia de la resistencia bacteriana entre los grupos y los cambios de la frecuencia de la resistencia bacteriana en cada régimen. Se analizaron los cambios de las infecciones por Escherichia coli o por organismos productores de BLAE tanto en como entre los grupos, calculándose el RR y los intervalos de confianza (IC) del 95%. Se consideraron estadísticamente significativos los valores de P < 0,05.
RESULTADOSRevisamos retrospectivamente las historias clínicas del hospital CGCH de 418 niños con RVU documentado que fueron tratados entre enero de 2001 y diciembre de 2002; 94 fueron excluidos por la pérdida de monitorización del seguimiento o por someterse a una intervención quirúrgica inmediatamente después de establecido el diagnóstico. En conjunto, 324 pacientes recibieron tratamiento antibiótico profiláctico durante µ3 meses antes de la intervención quirúrgica o µ6 meses sin intervención quirúrgica, y fueron incluidos. Los cambios en el tratamiento antibiótico profiláctico fueron atribuibles principalmente a los episodios de IVU intercurrentes, la disminución de los grados del reflujo en las cistouretrografías miccionales de seguimiento o los efectos secundarios adversos del antibiótico profiláctico inicial. Ciento nueve pacientes recibieron cotrimoxazol, 100 cefalexina, 44 cefaclor y 71 recibieron 2 o 3 tipos de antibióticos profilácticos de forma secuencial (monoterapia alternante). Durante el mismo período se seleccionó a 96 niños con los mismos criterios de entre 129 pacientes que recibieron profilaxis con cotrimoxazol en el NTUH, analizándose los datos de los 2 grupos.
En los niños del CGCH, la edad de inicio de la profilaxis antibiótica osciló entre 1 mes y 11 años (mediana: 8 meses; media: 18,8 meses). La media del período de seguimiento con la profilaxis antibiótica fue de 19,5 ± 13,2 meses para cotrimoxazol, 24,1 ± 16,1 meses para cefalexina, 19,7 ± 11,9 meses para cefaclor, 40,1 ± 17,7 meses para la monoterapia alternante y 25,5 ± 16,4 meses para todos los pacientes. En los pacientes del NTUH, la edad de inicio de la profilaxis antibiótica osciló entre 0 y 56 meses (mediana: 5 meses; media: 10,9 meses). La media del período de seguimiento con profilaxis con cotrimoxazol fue de 24,1 ± 16,8 meses.
La tabla 1 muestra los datos demográficos y la información clínica de cada una de las poblaciones del estudio. No se observó diferencia estadística en las tasas de recurrencia entre los 2 hospitales. Sin embargo, la tasa de recurrencia pareció ser mayor en los niños con profilaxis con cotrimoxazol en el CGCH (P = 0,007), comparado con otros grupos de pacientes del CGCH. En el CGCH, 66 niños (20,4%) sufrieron 93 episodios de IVU recurrente. En el NTUH, 24 niños (25%) sufrieron 29 episodios de IVU recurrente.
TABLA 1. Aspectos demográficos y clínicos de los niños con RVU que reciben profilaxis antibiótica
La tabla 2 enumera los patógenos urinarios antes del inicio de la profilaxis antibiótica en los 2 hospitales. El organismo más frecuente fue E. coli. La tabla 3 muestra los patógenos urinarios de las IVU recurrentes en los pacientes que recibían profilaxis antibiótica. E. coli también fue el patógeno más habitual y fue responsable de más de la mitad de las ITU recurrentes. Los pacientes que recibían antibióticos profilácticos tuvieron más probabilidades de portar un patógeno distinto a E. coli en las IVU recurrentes, comparados con sus episodios iniciales de IVU, en ambos hospitales (CGCH: RR: 3,0; IC 95%: 2,1-4,3; P < 0,0001; NTUH: RR: 2,3; IC 95%: 1,4-3,8; P = 0,003). El aumento del riesgo de IVU recurrente con patógenos urinarios distintos a E. coli no fue distinto en los 2 hospitales. Sin embargo, los organismos productos de BLAE fueron ligeramente más habituales en los niños en el CGCH que en los del NTUH (15 frente a 3%; P = 0,1).
TABLA 2. Patógenos urinarios de las IVU iniciales antes de la profilaxis antibiótica
TABLA 3. Patógenos urinarios de las IVU recurrentes durante la profilaxis antibiótica
En el CGCH, los niños que recibían cefalexina o cefaclor tuvieron más probabilidades de portar organismos productores de BLAE y patógenos distintos a E. coli, comparado con los niños que recibieron cotrimoxazol (cefalexina: RR: 9,8; IC 95%: 1,3-73,3; P = 0,005; cefaclor: RR: 2,9; IC 95%: 1,6-5,3; P < 0,0001). Este efecto de la cefalosporina sobre los organismos productores de BLAE y los patógenos distintos a E. coli siguió presente y dominante en los niños con monoterapia alternante que recibieron una secuencia de distintos antibióticos, como cotrimoxazol, cefalexina y cefaclor (P = 0,06 para cefalexina y P = 0,01 para cefaclor, comparado con cotrimoxazol). Al comparar los regímenes profilácticos con cefalosporina con la profilaxis con cotrimoxazol en el NTUH sólo se observó una mayor tasa de infecciones bacterianas productoras de BLAE (P = 0,016). Al comparar la profilaxis con cotrimoxazol en los 2 hospitales, los niños del NTUH tuvieron más probabilidades de mostrar patógenos urinarios distintos a E. coli (P = 0,022) pero no organismos productores de BLAE en las IVU recurrentes.
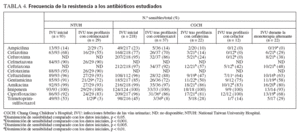
La tabla 4 resume la sensibilidad antibiótica de los organismos recuperados de la IVU inicial y las recurrentes en pacientes que recibieron distintos antibióticos profilácticos. Durante el período de estudio, los patrones de la resistencia antibiótica en las IVU contraídas en la comunidad permanecieron sin cambios (datos no ofrecidos). En los niños que recibieron profilaxis con cefalosporina disminuyó la sensibilidad antimicrobiana a las cefalosporinas de cualquier generación, el ciprofloxacino, la gentamicina y la amikacina al desarrollarse una IVU recurrente. El grado de disminución de la sensibilidad fue el mismo incluso con un régimen de monoterapia alternante. Sin embargo, en los niños que recibieron profilaxis con cotrimoxazol en cualquiera de los hospitales, no disminuyó la sensibilidad antibiótica de los patógenos recurrentes a la mayoría de los antibióticos, excepto a cotrimoxazol, gentamicina y ciprofloxacino.
TABLA 4. Frecuencia de la resistencia a los antibióticos estudiados
ANÁLISISNuestro estudio demostró la aparición de patógenos urinarios distintos a E. coli y grandes tasas de resistencia a diversos agentes antimicrobianos en las IVU recurrentes tras la recepción de antibióticos profilácticos por los niños. La primera IVU febril complicada en los niños estuvo causada por E. coli en µ70% al 90% de los casos12-15. Sin embargo, E. coli fue significativamente menos frecuente en las IVU recurrentes en los niños que recibieron antibióticos profilácticos en estudios anteriores5,15. Nuestro estudio confirmó este hallazgo en los niños que recibieron profilaxis con cotrimoxazol o con cefalosporina. La aparición de patógenos distintos a E. coli fue menos evidente en los niños que recibieron profilaxis con cotrimoxazol en el CGCH. Esta discrepancia en la profilaxis con cotrimoxazol podría explicarse por una mayor tasa de resistencia del E. coli al cotrimoxazol en la población inicial del CGCH (P = 0,019; datos no ofrecidos). Por lo tanto, en el NTUH, las cefalosporinas, el cotrimoxazol, o ambos, pueden ejercer una mayor presión de selección sobre los organismos coliformes, comparado con el cotrimoxazol en el CGCH. Esto también podría explicar una tasa de recurrencia algo mayor para los niños que recibieron profilaxis con cotrimoxazol en el CGCH. Los patógenos urinarios distintos a E. coli se seleccionaron en el tracto gastrointestinal mientras los niños recibían la profilaxis antibiótica. Algunos patógenos urinarios podrían haber provenido de los genitales externos, porque la profilaxis antibiótica no fue eficaz para disminuir la colonización bacteriana del prepucio16. La prevalencia de lactantes varones no circuncidados en las cohortes de Taiwán es elevada (W.M. Hsu y P.Y. Chang, comunicación personal) y, cuando fracasan los mecanismos que mantienen libres de infección a la vejiga y las vías urinarias altas, se puede desarrollar una IVU recurrente.
Estudios previos4,5,15 sobre pacientes que utilizaron los antibióticos actualmente recomendados, como cotrimoxazol, nitrofurantoína y ácido nalidíxico, observaron mayor resistencia antibiótica en los pacientes que recibieron profilaxis antibiótica. Un estudio reciente17 indicó también que la profilaxis antibiótica se asoció con un mayor riesgo de infecciones resistentes. En teoría, sean cuales sean los antibióticos profilácticos utilizados, la disminución de la sensibilidad antibiótica sólo se produciría al antibiótico profiláctico concreto al desarrollarse una IVU recurrente. En este estudio, la profilaxis con cotrimoxazol no disminuyó la sensibilidad antibiótica en los niños con profilaxis. No obstante, se observó la aparición de una amplia resistencia antibiótica durante la profilaxis con cefalosporinas. Al utilizar el cotrimoxazol de forma secuencial con las cefalosporinas, la disminución de la sensibilidad antibiótica fue tan evidente como la de los niños que recibieron profilaxis con cefalexina o cefaclor. Los informes anteriores revelaron varios factores de riesgo de aparición de organismos resistentes, incluyendo la exposición anterior a antibióticos5,18, el antecedente de IVU5,19, el tratamiento intrahospitalario de la IVU13,15, y las anomalías subyacentes del tracto genitourinario14,18. En este estudio, el antecedente de IVU y exposición antibiótica parece ser el factor predisponente.
La profilaxis con cotrimoxazol sigue siendo ideal, con un aumento mínimo de la resistencia antibiótica en las IVU recurrentes. Por el contrario, la profilaxis con cefalosporinas es relativamente menos adecuada, porque los antibióticos podrían influir sobre la sensibilidad de las cefalosporinas de cualquier generación y el daño colateral podría incluso ampliarse a otros agentes, como los aminoglucósidos y las fluoroquinolonas. Además, el estudio actual demostró que una gran cantidad de IVU recurrentes estuvo causada por los organismos productores de BLAE al prescribir una cefalosporina. La aparición de organismos productores de BLAE aumenta la dificultad de escoger el tratamiento antibiótico adecuado, porque muchos estudios han demostrado una gran tasa de resistencias cruzadas a las fluoroquinolonas, el cotrimoxazol y la amoxicilina-clavulánico en estos organismos resistentes20. Por lo tanto, no se recomienda la profilaxis con cefalosporinas, bien como elección única de profilaxis para el RVU, bien como secuencia de antibióticos.
La observación del desarrollo de resistencia tras el empleo de antibióticos profilácticos en los niños debe estudiarse con mayor detenimiento. Este fenómeno se había observado anteriormente5,15. Pueden intervenir varios mecanismos. La presión de selección antibiótica modifica la flora bacteriana del paciente; sólo las bacterias con resistencia intrínseca o que se han hecho resistentes al fármaco prescrito pueden sobrevivir en el tracto gastrointestinal. Como la exposición a los antibióticos es el principal mecanismo de desarrollo de resistencia21, los niños que reciben una secuencia de distintos antibióticos para la profilaxis probablemente desarrollarán una amplia resistencia antibiótica. Los estudios anteriores indicaron que la resistencia a cotrimoxazol podría estar asociada con la resistencia a otros agentes no relacionados farmacológicamente, como la ampicilina, la gentamicina y las cefalosporinas de primera generación18,22. Esto también podría explicar el hallazgo de la resistencia a gentamicina, ciprofloxacino, o a ambos fármacos, en los pacientes que estaban recibiendo profilaxis con cotrimoxazol.
Este estudio retrospectivo tiene varias limitaciones, como las historias clínicas/informes de 2 hospitales distintos, las diferencias de las prácticas de los médicos, el riesgo de sesgo de selección (incluyendo la disfunción miccional) y las distintas duraciones de la monitorización de seguimiento. Sin embargo, no es probable que estas debilidades sean factores mayores que influyan sobre los datos o produzcan los distintos patrones de resistencia antibiótica. No obstante, la confirmación de los hallazgos de este estudio retrospectivo requiere de investigaciones prospectivas.
CONCLUSIONESEste estudio ofrece pruebas en apoyo de la actual recomendación de que el cotrimoxazol es adecuado para la profilaxis y que las cefalosporinas no lo son. Los niños que reciben cefalosporinas de primera o segunda generación como antibióticos profilácticos tienen más probabilidades de infectarse con un organismo productor de BLAE o con un patógeno urinario distinto a E. coli. Aunque la prevalencia de resistencia endémica en la flora gramnegativa está aumentando, el cotrimoxazol sigue siendo el agente profiláctico preferido en el RVU.
Los Dres. Cheng y Tsai contribuyeron por igual en este estudio.
Correspondencia: Yong-Kwei Tsau, MD, Department of Pediatrics, National Taiwan University Hospital, No. 7, Chung-Shan South Road, Taipéi 100, Taiwán.
Correo electrónico: tsauyk@ntu.edu.tw