Objetivo: El propósito de este estudio fue definir la asociación entre la edad y la aparición de pielonefritis aguda y de cicatrices renales.
Métodos: Entre 1999 y 2002, incluimos a todos los niños de 0 a 14 años de edad visitados consecutivamente con una primera infección febril de las vías urinarias. Se realizó una gammagrafía renal con 99mTc ácido dimercaptosuccínico en los 5 primeros días de ingreso para la detección de la afectación del parénquima renal. La presencia de reflujo renal se evaluó mediante la cistografía, realizada un mes después de la infección. Si los resultados eran anormales, se realizó otra gammagrafía con 99mTc ácido dimercaptosuccínico al cabo de 6 meses para evaluar la frecuencia de cicatrices.
Resultados: El estudio incluyó a 316 niños (190 de < 1 año, 99 de 1-4 años y 27 de 5-14 años de edad). La gammagrafía con 99mTc ácido dimercaptosuccínico reveló que el 59% de los niños tenían afectación renal en la fase aguda de la infección. La frecuencia de afectación renal en los lactantes de < 1 año de edad (49%) fue significativamente menor que la de los niños de 1 a 4 años de edad (73%) y la de los niños de > 5 años de edad (81%). De los 187 niños con resultados positivos en la gammagrafía con 99mTc ácido dimercaptosuccínico, 123 se sometieron a una nueva gammagrafía al cabo de 6 meses. Se encontraron cicatrices renales en el 28% de los niños de < 1 año de edad, el 37% de los niños de 1 a 4 años de edad y el 53% de los niños de 5 a 14 años de edad. No hubo diferencias significativas en la frecuencia de cicatrices ni en la presencia o ausencia de reflujo vesicoureteral.
Conclusiones: Nuestros hallazgos confirman que la pielonefritis aguda y la consiguiente cicatrización renal sólo se producen en algunos niños con una primera infección febril de las vías urinarias. Los niños de < 1 año de edad tienen menor riesgo de localización parenquimatosa de la infección y cicatrización renal.
La infección febril de las vías urinarias (IVU) es uno de los trastornos pediátricos más frecuentes1. Pese a su frecuencia, la evaluación diagnóstica y el tratamiento siguen siendo un desafío para los pediatras, porque la localización de la IVU en los niños es, a veces, difícil. Los parámetros clínicos, como la fiebre y el dolor en el flanco, y los marcadores de laboratorio, como la velocidad de sedimentación globular (VSG), la proteína C reactiva (PCR) y el recuento leucocitario, son inespecíficos y no pueden distinguir entre la pielonefritis aguda (PNA) y la IVU sin afectación renal, especialmente en los niños pequeños2. Esta distinción es importante, porque la PNA se asocia con una lesión parenquimatosa irreversible (cicatriz) y finalmente con el desarrollo de hipertensión e insuficiencia renal crónica3, por lo que el tratamiento óptimo de la IVU necesita de la detección temprana de la infección del parénquima renal. En la actualidad se considera que la gammagrafía renal con 99mTc ácido dimercaptosuccínico (DMSA) es el método de referencia para el diagnóstico de la PNA y para la evaluación del grado y la progresión de la lesión del parénquima renal4-6.
Muchos estudios han demostrado que la susceptibilidad a los efectos lesivos renales de la IVU disminuye con la edad. En concreto, se ha informado que los niños de < 1 año de edad corren mayor riesgo de secuelas renales7-10. Estos hallazgos han conducido a distintos abordajes para la evaluación y el tratamiento de los niños con IVU febril según la edad, con una evaluación más enérgica en los de < 1 año de edad, comparado con los niños mayores (especialmente los de > 5 años de edad). El objetivo de este estudio prospectivo fue evaluar la asociación entre la edad y las características clínicas y biológicas de los niños con primera IVU febril que desarrollan pielonefritis y cicatrices renales.
MÉTODOSDiseño del estudioTodos los niños con una primera IVU febril ingresados en el Department of Pediatrics de la University of Udine (Udine, Italia) entre enero de 1999 y diciembre de 2002 fueron incluidos en este estudio prospectivo. Los niños fueron visitados directamente en nuestra consulta o derivados a nuestros investigadores por pediatras de familia, que suelen colaborar en el tratamiento de los pacientes con IVU febril. Este diseño del estudio refleja el abordaje habitual de las IVU que visitamos en nuestro departamento, donde siempre se informa a los padres de la naturaleza, los objetivos y los posibles riesgos y beneficios de la gammagrafía con DMSA y la cistouretrografía. Se excluyó a los pacientes con antecedente de IVU febril o con anomalías conocidas de las vías urinarias.
La IVU febril estuvo definida por un urinocultivo positivo (un solo microorganismo con un recuento de colonias ≥ 105 colonias por ml) en un niño febril (temperatura ≥ 38 °C) sin otros signos que dolor abdominal o en el flanco y, en los niños de< 1 año de edad, irritabilidad, vómitos, problemas de alimentación o falta de aumento ponderal. Las muestras de orina se tomaron mediante micción limpia o por sondaje vesical.
Todos los pacientes recibieron tratamiento inicial con antibiótico intravenoso (ceftriaxona) durante 1 a 5 días, seguido del tratamiento oral escogido según el estudio de la sensibilidad antibiótica. La duración global del tratamiento antibiótico fue de 10 días.
La tomografía computadorizada por emisión de fotón único (SPECT) renal con DMSA se realizó durante los 5 días siguientes al diagnóstico de la IVU, para detectar la afectación aguda del parénquima renal. La cistouretrografía se realizó al cabo de 1 mes, para la detección y la clasificación del reflujo vesicoureteral (RVU), en los niños cuyos padres otorgaron el consentimiento (90%). Dos terceras partes de los niños con resultados positivos en la primera gammagrafía con DMSA se sometieron a una gammagrafía de seguimiento 6 meses después de la inicial, para identificar la lesión renal permanente (cicatriz). No se realizó la gammagrafía con DMSA de seguimiento a los niños cuyos padres negaron el consentimiento o los que tenían anomalías menores, o ninguna, en la primera. Además, los niños con gammagrafía inicial positiva no se volvieron a estudiar si se produjo una IVU en el intervalo de 6 meses. La distribución de edad de los niños que no se sometieron a la gammagrafía de seguimiento fue similar a la de quienes se sometieron a ella. Todos los niños explorados tenían lesiones renales total o parcialmente reversibles en las gammagrafías con DMSA tardías, lo que confirmó retrospectivamente el diagnóstico de PNA y excluyó la existencia previa de cicatrices.
Evaluación clínica y de laboratorioLos datos clínicos registrados fueron la temperatura corporal y los días de fiebre anteriores al diagnóstico de IVU. Las evaluaciones de laboratorio se realizaron al ingreso y consistieron en recuento leucocitario, VSG y PCR, análisis de orina y urinocultivo.
Estudios por la imagenLos niños se sometieron a una SPECT renal con DMSA durante los 5 días posteriores al ingreso y a una gammagrafía de seguimiento al cabo de 6 meses si los resultados de la primera indicaron una lesión renal aguda. Los pacientes recibieron una inyección de 0,750 a 1,5 mCi de DMSA (dosis calculada según el peso corporal) y se realizó el SPECT al cabo de 2 o 3 h. Las imágenes se tomaron con una cámara de tres cabezales (Siemens, Siemans, Alemania), con colimadores de baja energía y gran resolución. Las imágenes se tomaron en una órbita no circular de 360° (contorno corporal). Se tomaron 120 proyecciones (40 por detector) en una matriz de 128 x 128, con zoom 1,45x (tamaño de píxel 5,2 mm). El movimiento del paciente se evaluó viendo las imágenes cinéticas. Los datos se reconstruyeron mediante proyección retrógrada filtrada con un filtro Butterworth con un valor límite de 0,45 ciclos/cm y un orden de 7 kHz. No se realizaron correcciones por la atenuación.
La gammagrafía mostró la lesión renal aguda en forma de áreas focales, multifocales o difusas de disminución de la captación de DMSA en el riñón sin pérdida de volumen. Se diagnosticó cicatriz renal al observar ≥ 1 área de disminución focal de la captación asociada con contracción y pérdida de volumen en la corteza renal afectada. Cada lesión de la gammagrafía tardía se comparó con los hallazgos de la primera mediante un análisis topográfico.
La cistouretrografía para la detección y la clasificación del RVU se realizó un mes después de la infección aguda. Se realizaron con técnicas radiológicas estándar (cistouretrografía miccional con contraste yodado) en los niños y con cistografía isotópica (cistografía isotópica directa con 99mTc) en las niñas. Se prefirió la cistouretrografía miccional para los niños porque esta técnica permite la evaluación de la uretra para excluir las válvulas de uretra posterior. Las cistografías radiológicas se evaluaron respecto a la presencia y el grado del RVU aplicando el sistema de clasificación internacional. Un solo radiólogo interpretó las gammagrafías con DMSA y las cistografías para disminuir la variabilidad interobservador.
Análisis estadísticoLas distribuciones de frecuencia de los participantes en el estudio se calcularon según las características clínicas (edad, sexo, días de fiebre antes del diagnóstico y media diaria de la temperatura corporal) y de laboratorio (VSG, PCR, RVU y recuento leucocitario) del paciente. Las asociaciones entre la edad y las demás variables se evaluaron mediante tests χ2.
Las asociaciones entre los resultados positivos de la DMSA durante la fase aguda de la IVU y cada una de las demás variables fueron evaluadas en primer lugar aplicando el análisis de regresión logística univariada y medidas con las razones de probabilidad (odds ratio) brutas (OR). La significación estadística de estas asociaciones viene indicada por los intervalos de confianza (IC) del 95% y los valores de p.
Luego se realizó el análisis de regresión logística multivariada para controlar respecto a los posibles efectos de confusión de cada variable sobre las asociaciones entre los resultados positivos de la DMSA aguda y los demás factores. El modelo multivariado incluyó a la edad, el sexo, la VSG, la PCR, el RVU, el recuento leucocitario, la duración de la fiebre antes del diagnóstico y la temperatura media diaria. Sólo se presentan las OR ajustadas, los IC del 95% y los valores de p de las variables asociadas significativamente con los resultados positivos de la DMSA aguda. La existencia de una tendencia lineal en la asociación entre la edad y los resultados positivos de la DMSA se evaluó utilizando la edad como variable continua en el modelo de regresión logística multivariada; se presenta el valor de p del test de la tendencia.
Finalmente, en los niños con resultados positivos de la gammagrafía con DMSA en la fase aguda de la IVU, el riesgo de DMSA positiva en el seguimiento a los 6 meses se evaluó según el grupo de edad y la presencia de RVU. Se utilizó un modelo de regresión logística, siendo las variables independientes la edad y el RVU por ser los 2 factores de interés principales. Los resultados de este modelo se expresan como OR, IC 95% y valores de p. Se realizó un test de la tendencia lineal respecto a la edad incluyendo la edad en el modelo como variable continua.
RESULTADOSEl estudio incluyó a 316 menores (223 niñas y 93 niños) de 1 mes a 14 años de edad (mediana de edad 1,6 años). De ellos, 190 (60%) tenían < 1 año de edad, 99 (31%) de 1 a 4 años de edad y 27 (9%) de 5 a 14 años de edad.
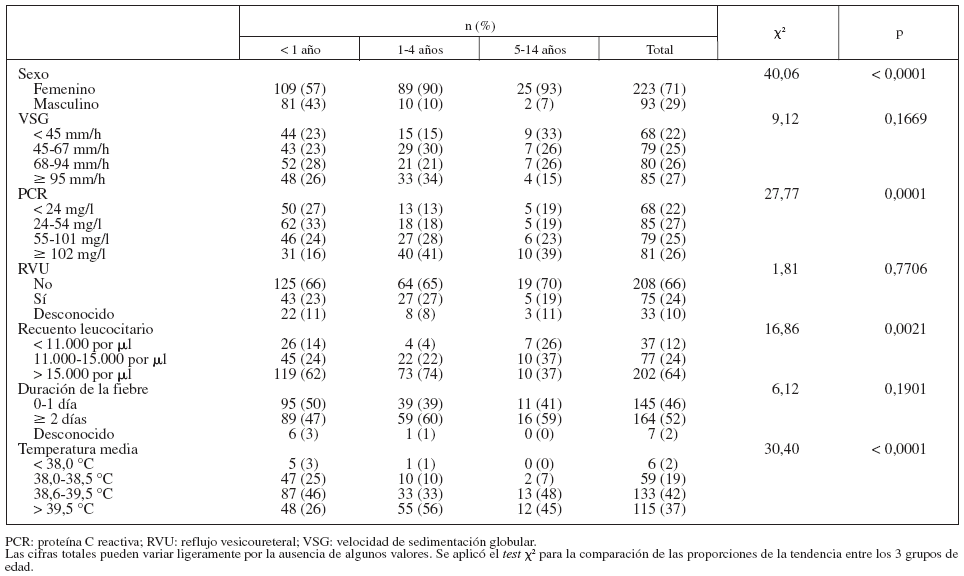
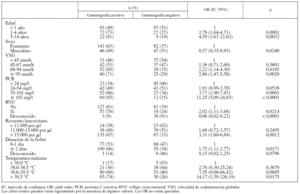
La tabla 1 muestra algunas características de los niños según la edad. No hubo diferencias significativas entre los 3 grupos con respecto a la VSG, la duración de la fiebre antes del diagnóstico de IVU o la frecuencia de RVU. La razón niña/niño favoreció ligeramente a las niñas en los pacientes de < 1 año de edad y aumentó claramente en los de mayor edad. Las proporciones de niños con PCR ≥ 102 mg/l y con temperatura máxima > 39,5 °C fueron mayores en los niños de ≥ 1 año de edad, comparados con los de menor edad.
TABLA 1. Asociaciones entre la edad y otras características de los niños
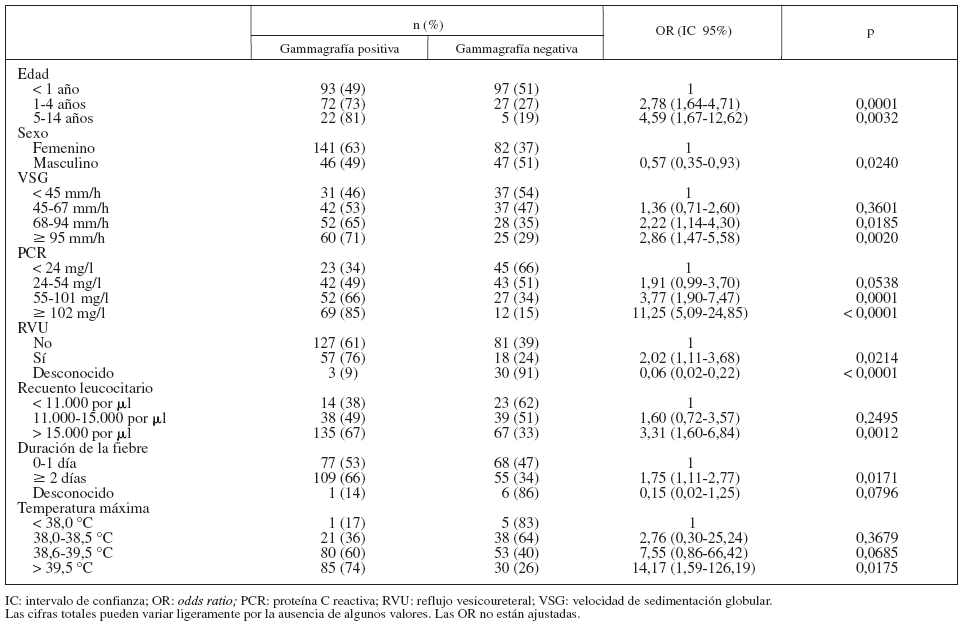
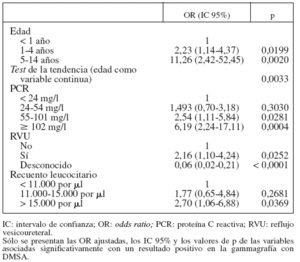
De los 316 niños incluidos 187 (59%) mostraron una gammagrafía renal con DMSA positiva en la fase aguda de la infección. La tabla 2 muestra las relaciones univariadas entre los resultados positivos de la DMSA y algunas características de los niños. Las probabilidades de gammagrafía positiva aumentaron significativamente con la edad; fueron casi 3 veces mayores en los niños de 1 a 4 años de edad respecto a los de < 1 año de edad, y ∼4,5 veces mayores en los niños de ≥ 5 años de edad con respecto a los de < 1 año de edad. Se observó un aumento del riesgo de gammagrafía positiva en los niños con VSG ≥ 69 mm/h, comparados con los niños con VSG < 45 mm/h. El riesgo de gammagrafía positiva aumentó significativamente con el aumento de los valores de PCR. Los niños con recuento leucocitario > 15.000 por μl tuvieron una probabilidad de gammagrafía positiva 1,8 veces mayor que los niños con recuento leuco- citario < 11.000 por μl. Los niños con fiebre durante ≥ 2 días antes del diagnóstico tuvieron un aumento del riesgo de gammagrafía positiva del 25%. Los niños con temperatura máxima > 38,5 °C mostraron mayor riesgo de gammagrafía positiva que los niños con temperatura máxima < 38 °C. Se observó una asociación entre DMSA positiva en la fase aguda y la presencia de RVU (OR 2,02).
TABLA 2. Resultados de la gammagrafía con DMSA durante la fase aguda de la IVU y determinadas características de los niños en los análisis univariados
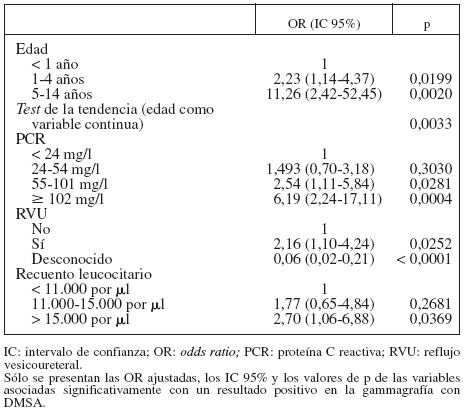
Las asociaciones independientes entre la edad, la PCR, el recuento leucocitario y el RVU y la DMSA positiva se confirmaron en un análisis de regresión multivariada (tabla 3). Los niños de 5 a 14 años de edad parecieron tener una probabilidad de gammagrafía positiva sustancialmente mayor que los de < 1 año de edad, tras controlar respecto a otros factores. Además, el riesgo de gammagrafía positiva pareció aumentar linealmente con la edad (p = 0,0033).
TABLA 3. Análisis multivariado de la asociación entre los resultados positivos de la gammagrafía con DMSA y algunas características de los niños
De los 187 niños con DMSA positiva en la fase aguda, 123 se sometieron a gammagrafía al cabo de 6 meses. Ochenta (65%) mostraron la resolución completa de las lesiones renales y 43 (35%) presentaron cicatrices (tabla 4). Tras el ajuste respecto a la presencia de RVU, los niños de ≥ 5 años de edad mostraron un significativo aumento, al triple, de la probabilidad de gammagrafía positiva de seguimiento, comparado con los niños de < 1 año de edad. El aumento del riesgo en los niños de 1 a 4 años de edad no fue estadísticamente significativo. Se observó una tendencia lineal respecto a la edad (p = 0,0598). Por el contrario, tras controlar respecto a la edad, la presencia de RVU no se asoció significativamente con las cicatrices renales.
TABLA 4. Asociaciones entre la edad, el RVU y los resultados de la gammagrafía con DMSA 6 meses después del primer episodio de IVU
Una gran preocupación en las IVU febriles es la identificación de los pacientes en riesgo de daño renal permanente. Tras disponer de la gammagrafía renal, muchos estudios han demostrado que no todos los niños con IVU febril muestran la localización parenquimatosa de la infección5,8.
Nuestro estudio fue realizado sobre 316 niños de < 14 años de edad con una primera IVU febril. En nuestra área, todos los pediatras de familia colaboran con nuestro equipo y suelen derivar a todos los pacientes con IVU febril a nuestra consulta para la evaluación, el diagnóstico por la imagen y el tratamiento. Por lo tanto, consideramos que nuestra población de estudio es una muestra no sesgada de los niños con IVU febril. Como nos centramos en la localización renal, excluimos a los niños con IVU previa y a los portadores conocidos de malformaciones de las vías urinarias, que suelen asociarse con displasia renal. Todos los pacientes con episodios previos de IVU probable o confirmada fueron excluidos. Además, todas las lesiones renales agudas mostraron una regresión total o parcial en la gammagrafía con DMSA de seguimiento, lo que confirma el diagnóstico de PNA.
Hasta ahora, la gammagrafía con DMSA se considera la técnica de imagen de referencia para la detección y la evaluación de la PNA y las cicatrices renales en los niños4. En el momento de la infección aguda, el área de hipocaptación del trazador refleja la extensión de la inflamación y de la isquemia. Se estima que el 60% de los pacientes con una IVU febril tiene una PNA11-13, en nuestra población, el 59% de los niños presentó una PNA demostrada por la gammagrafía con DMSA, lo que confirma que no todos los niños con IVU febril presentan la localización parenquimatosa de la infección.
En la práctica clínica se suele utilizar los reactantes de fase aguda (VSG, PCR y recuento leucocitario) para tratar de distinguir entre las IVU de las vías altas y las vías bajas. La PCR tiene una buena sensibilidad, pero es poco específica para el diagnóstico de la infección parenquimatosa2,5. Hace poco se ha demostrado que la procalcitonina, un nuevo marcador de la infección, puede distinguir mejor las IVU febriles con afectación renal de las carentes de esta afectación y predecir mejor las cicatrices posteriores14.
En nuestro estudio, el parámetro biológico que mostró la mejor correlación con la afectación renal en la fase aguda de la IVU fue la PCR. Aunque los valores medios de la PCR fueron mayores en los pacientes con localización renal de la infección, hubo un amplio solapamiento de valores entre los niños con DMSA normal y patológica, lo que confirma la escasa especificidad de este parámetro. Las gammagrafías con DMSA patológicas pertenecieron únicamente al grupo de pacientes con PCR > 200 mg/l (datos no ofrecidos).
Muchos estudios han demostrado claramente que el RVU no es un requisito previo para la afectación renal en los niños con IVU febril y que se puede observar cicatrices renales incluso sin RVU5,8,12,13,15,16. En nuestro estudio, aunque la presencia de RVU se asoció con un aumento del riesgo de lesiones renales en la fase aguda de la IVU (OR 2,02, p = 0,02), el 61% de los niños con primera gammagrafía con DMSA positiva no tenía un RVU. Los resultados confirman que una gran proporción de IVU febril, como demuestran las gammagrafías con DMSA aguda, se produce en ausencia de RVU. En la identificación de la afectación renal durante la IVU febril, la fiebre mostró correlación con la PNA; en particular, la fiebre elevada (≥ 39,5 °C) fue el mejor marcador de PNA (OR 14,17, p = 0,01).
La lesión inicial por la agresión inicial de la PNA conduce al desarrollo de una cicatriz renal irreversible entre el 40% y el 60% de los niños afectados17-19. En nuestra población de estudio, la incidencia de cicatrices renales fue del 35%. Esta cifra puede constituir una infravaloración, porque no todos los niños se sometieron a una nueva DMSA. Según nuestra experiencia, los padres de niños con lesiones importantes en la DMSA durante la IVU febril raras veces rehúsan el consentimiento para repetir la gammagrafía renal en busca de cicatrices. Es probable que hayamos pasado por alto a pacientes con lesiones menores en las gammagrafías de la fase aguda, que probablemente no muestran una cicatriz en las gammagrafías con DMSA de seguimiento.
Los lactantes < 12 meses de edad han sido considerados en mayor riesgo de lesión renal aguda y posterior cicatriz renal en relación con los niños mayores7-10. Esta opinión ha desembocado en un tratamiento más enérgico y en un abordaje por la imagen distinto en los lactantes con IVU; este punto de vista probablemente se basó en que los estudios previos incluyeron a niños muy pequeños, principalmente varones, con RVU intenso y displasia renal congénita.
Algunos estudios han dudado de que la edad < 1 año sea un factor de riesgo de lesión renal. Benador et al20 investigaron la incidencia de las lesiones renales en los niños de 0 a 16 años de edad y demostraron que el riesgo de lesión renal aguda y permanente debido a una IVU no disminuye con la edad. Lin et al21 informaron de una mayor incidencia de PNA en los niños mayores (1- 17 años de edad), mientras que la cicatriz renal tenía la misma prevalencia en los distintos grupos de edad. De forma similar, Ataei et al22 observaron alteraciones inflamatorias agudas en las gammagrafías con DMSA en el 78,8% de los niños > 5 años de edad ingresados con una primera IVU sintomática. Los autores suponen que este hallazgo podría ser atribuible a los distintos criterios aplicados para el ingreso de los lactantes y los niños mayores.
En nuestro estudio, los niños > 5 años de edad tuvieron mayor riesgo de PNA que los niños < 12 meses de edad (OR ajustada 11,26, p = 0,002). Además, observamos que el riesgo de cicatriz renal aumentó en los niños mayores (OR 3,35, p = 0,04), con una correlación entre la edad y el riesgo de lesiones renales. En un análisis multivariado que controló respecto a la edad, la presencia de RVU no se asoció con cicatriz renal. Vale la pena destacar que nuestra población tuvo características similares respecto a la incidencia de RVU y a la duración de la fiebre antes del diagnóstico, lo que excluye 2 posibles sesgos de selección importantes (tabla 1). No es probable que el riesgo de afectación renal en los niños mayores sea atribuible al retraso en el diagnóstico y el tratamiento.
Se ha destacado la importancia pronóstica de la afectación del parénquima renal en la IVU febril. Sólo los niños con lesiones parenquimatosas en la fase aguda tienen probabilidades de desarrollar cicatrices y las complicaciones asociadas3. Por lo tanto, la observación de la menor incidencia de afectación parenquimatosa en la fase aguda de la IVU en los niños pequeños parece ser muy relevante. Los datos experimentales en los animales de laboratorio demostraron que la reacción inflamatoria a la infección bacteriana desempeña un papel importante en la patogénesis de las lesiones renales23. En nuestro estudio, los valores de los parámetros de fase aguda fueron mayores en los niños de mayor edad y se correlacionaron con la afectación renal. Durante la IVU, la menor reacción inflamatoria que se observa en los lactantes puede protegerlos de la lesión renal aguda y permanente. En el primer paso de una IVU, el receptor Toll-like 4 (TLR4) reconoce a los patógenos urinarios mediante mecanismos en los que intervienen los factores específicos de virulencia. Las células epiteliales activadas responden a la infección local con la liberación de numerosas citoquinas, quimioquinas y otros factores que modulan a los constituyentes celulares de la respuesta inmunitaria innata24. Hace poco, Ragnarsdóttir et al25 demostraron la menor expresión de TLR4 en los niños que desarrollan una bacteriuria asintomática en lugar de la enfermedad sintomática. Además, en los pacientes con IVU febril, la expresión de TLR4 aumentó en relación con la presencia de cicatrices renales en las gammagrafías con DMSA de seguimiento. Según estos resultados se podría suponer que los lactantes tienen cierto grado de inmadurez de la respuesta inmunitaria innata y la señalización TLR4, que es esencial para la defensa de la mucosa. En consecuencia, los lactantes pueden mostrar una activación incompleta de la cascada inflamatoria, que les protegería de la lesión renal aguda y permanente. Esta observación debe ser confirmada en otros estudios.
CONCLUSIONESAunque no todas las IVU febriles muestran localización parenquimatosa en las gammagrafías con DMSA en fase aguda (PNA), una importante proporción de niños con DMSA positiva en un primer episodio de PNA podría desarrollar cicatrices renales. Las determinaciones de reactantes de fase aguda habitualmente utilizadas no son específicas para la detección de la afectación renal, la temperatura elevada es el mejor marcador clínico de la PNA y la presencia de RVU no identifica a la población en riesgo de PNA y cicatriz renal. Además, confirmamos que los lactantes con IVU febril corren menor riesgo de localización parenquimatosa renal de la infección y de cicatriz renal, comparado con los niños de 1 a 14 años de edad.
Correspondencia: Enrico Vidal, MD, Department of Pediatrics, Azienda Ospedaliero-Universitaria di Udine, P.le S. Maria della Misericordia, 15, 33100 Udine, Italia.
Correo electrónico: enrico.vidal@inwind.it