Los partos prematuros abarcan el 12,3% de los más de 4 millones de nacimientos anuales en Estados Unidos, y los neonatos de muy bajo peso al nacimiento el 1,4%1. Aunque ha mejorado la tasa de supervivencia de estos neonatos prematuros, persisten la morbilidad y las complicaciones a largo plazo. Cada año, de 10.000 a 15.000 de estos neonatos desarrollan displasia broncopulmonar (DBP) en Estados Unidos2, con una tasa de mortalidad que oscila entre el 5% y el 30%3. El tratamiento para prevenir o mejorar la DBP debería reducir la duración de la ventilación a presión positiva y el FIO2 elevada y disminuir la morbilidad pulmonar global.
Un ensayo aleatorizado, ciego, multicéntrico, controlado con placebo, recientemente finalizado, de óxido nítrico inhalado (iNO), el ensayo NO-CLD, estudió si la administración de iNO entre los 7 y 21 días de edad a neonatos de 500 a 1.250 g al nacer sería eficaz y segura para prevenir o mejorar la DBP4. Los resultados demostraron una significativa disminución de la DBP total, y de las variantes más graves de DBP, evaluadas a las 36, 40 y 44 semanas de edad posmenstrual4. La incidencia de morbilidades comunes de la prematuridad en los neonatos tratados con iNO no aumentó respecto a la de los tratados con placebo4.
Un segundo objetivo del ensayo clínico NO-CLD fue determinar la seguridad de iNO tal como se utilizó en el ensayo. El impacto del iNO administrado durante un período clínicamente significativo a un pulmón inmaduro ya inflamado es dudoso. La persistencia de elevadas concentraciones en el líquido traqueal de las sustancias proinflamatorias innatas IL-1β e IL-8 a la semana de edad se asoció con un aumento del riesgo de DBP5-7. Se ha demostrado que el síndrome de distrés respiratorio de la prematuridad8 y la lesión pulmonar asociada con la inflamación9 modifica la concentración del componente de la matriz extracelular y de la sustancia promotora de la migración celular, el hialuronano. No se ha evaluado cómo podría afectar la administración de iNO a la presencia de estas sustancias.
El óxido nítrico puede tener efecto tanto pro como antiinflamatorios. En presencia de una FIO2 elevada, el NO se convierte en NO2, peroxinitrito y otros óxidos de nitrógeno que pueden iniciar o exacerbar la inflamación pulmonar. El iNO también puede modular la respuesta inflamatoria pulmonar mediante la regulación a la baja de la producción de las citoquinas inflamatorias10,11, y la disminución de la acumulación pulmonar de neutrófilos12. En los cultivos de fibroblastos pulmonares se ha demostrado in vitro que la hiperoxia y los elevados valores de NO inducen la muerte celular13. Como la iNO se coadministra con una FIO2 elevada en un ambiente con inflamación preexistente cuando se administra a neonatos en riesgo de DBP, es importante evaluar los efectos específicos de la dosis y la duración del tratamiento utilizado en el estudio NO-CLD sobre la inflamación pulmonar14.
Otro tipo de lesión pulmonar resulta de la oxidación de la membrana celular por radicales oxígeno. Un marcador de la lesión oxidativa de la membrana, 8-epi-PGF2α, medía la hipertensión pulmonar neonatal en modelos animales15, y se asocia con hipertensión pulmonar en neonatos humanos16. Los efectos del iNO sobre la producción o la presencia de 8-epi-PGF2α en las vías respiratorias son desconocidos. La evaluación de los cambios de 8-epi-PGF2α, si los hay, con la administración de iNO podría ofrecer una perspectiva del mecanismo de acción del iNO en este marco clínico.
La potente citoquina TGF-β, derivada en parte de los macrófagos alveolares, regula la actividad del fibroblasto, disminuye la producción de surfactante y aumenta en el LAT de los neonatos que desarrollan DBP17. También se ha implicado la TGF-β activa en el desarrollo de fibrosis pulmonar en los adultos18. La fibrosis y la simplificación de las vías respiratorias son los hitos anatomopatológicos de la DBP totalmente establecida. Por lo tanto, los efectos de la administración de iNO sobre la TGF-β activa podrían ofrecer perspectivas de sus mecanismos de acción.
En este estudio, nuestros objetivos fueron: 1) determinar la relación entre los marcadores/mediadores inflamatorios y la gravedad de la enfermedad en neonatos prematuros entre los 7 y 21 días; 2) investigar el efecto del iNO sobre el perfil inflamatorio para evaluar tanto la seguridad como los posibles mecanismos del NO en la enfermedad pulmonar, y, en el subgrupo de neonatos que recibió iNO y de los que se tomaron muestras seriadas de LAT, 3) identificar si la respuesta al iNO era previsible a partir de los datos del LAT.
MÉTODOSResumen del ensayo clínico progenitorLos resultados que presenta este estudio fueron obtenidos en un subgrupo de neonatos incluidos en un ensayo de iNO, controlado por placebo (NO-CLD) para la prevención de la DBP4. El estudio incluyó a neonatos de 500 a 1.250 g de peso al nacimiento, de 7 a 21 días de edad y que necesitaron apoyo respiratorio. Los neonatos tratados recibieron concentraciones decrecientes de iNO, iniciadas entre los 7 y 21 días de edad a 20 ppm, durante una duración mínima de 24 días. La puntuación de gravedad respiratoria (PGD) fue utilizada como índice de apoyo respiratorio. La PGD se calcula como presión media en las vías respiratorias x (FIO2).
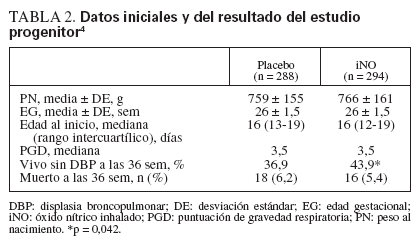
Los neonatos que recibieron iNO (n = 294) tuvieron una tasa de supervivencia sin DBP a las 36 semanas de edad posmenstrual del 43,9%, comparada con el 36,8% de los 288 neonatos tratados en el grupo placebo4 (p = 0,042). No hubo diferencia de mortalidad. El beneficio se mantuvo a las 40 y 44 semanas. En los neonatos tratados con iNO no hubo aumento de la incidencia de cualquiera de las complicaciones habituales de la prematuridad, como la lesión intracraneal.
Las muestras de aspirado traqueal de las que se derivan los actuales resultados se tomaron en 99 de los 582 neonatos incluidos. Las muestras seriadas se tomaron rutinariamente en los neo-natos incluidos en el estudio en el Children’s Hospital de Filadelfia, el Hospital de la University of Pennsylvania, el Westchester Medical Center, Valhalla, Nueva York, y el Children’s Mercy Hospitals and Clinics, Kansas City, Missouri. De los 99 neonatos en quienes se obtuvieron muestras seriadas de LAT, 52 neonatos habían sido asignados aleatoriamente a tratamiento con gas placebo y 47 a tratamiento con iNO. Se obtuvo el consentimiento informado de los padres específico para la toma de muestras, además del permiso para la inclusión en el estudio. Ninguno de los padres que dio permiso para el estudio principal lo negó para la toma de muestras de LAT.
Recogida y procesamiento del LATEl LAT se recogió como había descrito anteriormente nuestro 19,20 mediante un lavado con suero fisiológico inicial, a las 24 o 48 horas, a los 4 días y luego semanalmente durante el tratamiento con el gas de estudio (mínimo de 24 días). Las muestras aspiradas se colocaron en tubos estériles, fueron centrifugadas a 500 × g durante 10 minutos, y el sobrenadante fue congelado inmediatamente a –70 °C. Partes del sobrenadante y del extrudado celular se remitieron congeladas para su entrega a la mañana siguiente a Filadelfia. Estas porciones fueron descongeladas y centrifugadas a 27.000 × g para el aislamiento de la fracción tensioactiva. Los resultados de los estudios de la función tensioactiva se presentan por separado21. Las determinaciones de TGF-β, hialuronano, N-acetil-glucosaminidasa (NAG) y proteínas totales fueron realizadas en Filadelfia; las de IL-1β, IL-8, 8-epi PGF2α y el componente secretor de IgA fueron realizadas en Kansas City. Para tener en cuenta la dilución del líquido de recubrimiento epitelial durante la recogida, los resultados se normalizaron respecto a la proteína total y al componente secretor de IgA, ambos medidos en la misma muestra (fig. 1).
Fig. 1. Esquema del procesamiento del líquido de aspirado traqueal. LAT: líquido de aspirado traqueal; sSC: componente secretor soluble.
Determinaciones de IL-1βe IL-8La IL-1β y la IL-8 (citoquinas proinflamatorias agudas) se midieron con una deter minación inmunoenzimática comercial (R&D Systems, Minneapolis, MN). Estas determinaciones utilizan una técnica ELISA cuantitativa en bocadillo, con sensibilidad de determinación < 1 pg/ml y < 3,5 pg/ml, respectivamente, y CV intradeterminación del 2,4% y 4,6%, respectivamente.
Determinación de TGF-βEl contenido activo de TGF-β fue determinado mediante la línea celular epitelial pulmonar de visón (CEPV) según el protocolo de Abe22. La CEPV es una línea celular que responde a TGF-β, que está transfectada de forma estable con el promotor inhibidor del activador del plasminógeno humano (PAI-1), un gen que responde a TGF-β, que se funde a un gen informador luciferasa. La CEPV se sembró en una placa de 96 pocillos a una tasa de 1,8 x 104 células/pocillo, permitiendo la unión durante 3 horas y cultivando durante la noche con 30 µl de sobrenadante del LAT o de 40 a 1.200 pg/ml de patrón TGF-β. Los extractos CEPV fueron lisados al día siguiente, determinando la actividad luciferasa mediante el Luciferase Assay System (Promega, Madison, WI). La TGF-β recombinante humana se compró a Sigma (St. Louis, MO).
Determinación de N-acetil glucosaminidasaSe determinó la actividad de N-acetil glucosaminidasa (NAG) en el sobrenadante del LAT y los extrudidos celulares como índice del contenido en macrófagos. La determinación de NAG mide la liberación espectrofotométrica de p-nitrofenol de un sustrato NAG conjugado según el método de Nitta et al23. En una placa de 96 pocillos se incubaron 20 µl de sobrenadante de LAT o de extrudado celular (diluidos 1:10) o de 25 a 400 µU de patrón β-nitro-acetil glucosaminidasa (Sigma, St. Louis, MO) con 10 µl de Triton X100 y 20 µl de sustrato, 15 mM p-nitrofenil N-acetil-β-glucodami-nidasa (Sigma, St. Louis, MO), durante 30 minutos a 37 °C para permitir la formación del producto. La reacción se detuvo mediante la adición de 200 µl de Na2CO3 0,2 M a cada pocillo. Se midió el cambio de absorbancia a 450 nm de cada pocillo, y la actividad NAG de las muestras se calculó a partir de la curva estándar.
Determinación de 8-epi-PGF2La prostaglandina no derivada de la cicloxigenasa, 8-epi-PGF2α, un biomarcador del daño oxidativo lipídico, se midió con una determinación inmune comercial (correlate-EIA Kit, Assay Designs, Ann Arbor, MI). Esta técnica ELISA competitiva directa mide tanto el isoprostano libre como el esterificado tras la hidrólisis alcalina de 8-epi-PGF2α acoplado a fosfolípidos. La sensibilidad de la determinación es < 40 pg/ml y el CV intradeterminación es del 11,3%.
Determinación del hialuronanoEl hialuronano se midió mediante un método competitivo inmunoabsorbente ligado a enzimas, como el previamente publicado por Lokeshwar24 y por Maeda25. Se aplicó AH (ICN Biochemicals Aurora, OH), a 0,2 mg/ml, a placas de microtitulación para fijarse a un péptido biotinilado de fijación al AH (bHABP) (Seikagaku Corporation, Tokio, Japón). Las muestras y los patrones fueron digeridos por proteasa durante una noche a 37 ºC para eliminar cualquier proteína de interferencia. Al día siguiente, las muestras se diluyeron 1:2 o 1:4 en suero con tampón fosfato (STF), incubándose 60 µl de muestra o patrón con 60 µl de bHABP durante 1 hora a 37 ºC. Se incluyeron diluciones seriadas de patrones de AH (Healon, Pharmacia and Upjohn, Kalamazoo, MI) entre 0 y 3.000 ng/ml. Se trasladaron 100 µl de muestras o de patrones a placas cubiertas de AH, dejando reaccionar durante una hora a 37 ºC. La fijación a bHABP se detectó por la adición del complejo estreptavidina ABC (Vectatstain, Vector Laboratorios, Burlingame, CA) seguida de la adición de o-fenildiamina (OPD, Sigma, St. Louis, MO) para el análisis colorimétrico. Se estudió la absorbancia de cada pocillo a 405 nm y se normalizó el contenido de AH respecto al contenido proteico del aspirado traqueal, expresándolo como ng AH/mg de proteína.
Determinación del número total de célulasPara la determinación del número total de células en los extrudidos celulares TA se utilizó el CyQuant Cell Proliferation Assay Kit (Invitrogen, Carlsbad, CA) para determinar el contenido de ADN según las instrucciones del fabricante. En una placa de 96 pocillos se lisaron las células con un tampón de lisis celular 1X CyQUANT-GR, incubando durante 5 minutos con un contraste fluorescente comercial que fija los ácidos nucleicos. Los patrones de ADN oscilaron entre 0 y 1.000 ng/ml. La fluorescencia de cada pocillo se midió con una microplaca lectora con una excitación de 485 nm y una emisión de 535 nm. La conversión de ADN al número de células utilizó un valor de 6,5 pg ADN/célula diploide humana. Se obtuvo el recuento total de células de cada muestra para investigar la posibilidad de un aumento, o una disminución, asociado con iNO del contenido de células inflamatorias de las vías respiratorias.
Normalización de las sustancias analizadasLas determinaciones fueron normalizadas por dos métodos para explicar la inevitable variación de la dilución durante el proceso de recogida. Las concentraciones del componente secretor soluble de IgA y de proteínas totales medidas en la misma muestra sirvieron para normalizar cada muestra de LAT. El componente secretor soluble de IgA se midió con una técnica ELISA establecida de 96 pocillos26. Un AT policlonal de conejo antihumano sirvió como anticuerpo primario con HRP conjugado de conejo antihumano como anticuerpo secundario (Dako, Dinamarca). La cuantificación se realizó frente a una curva patrón entre 2,34 y 300 ng/ml utilizando calostro humano purificado. La proteína total en el sobrenadante del LAT se determinó mediante el reactivo BCA (BioRad, Hercules, CA).
Análisis estadísticoSegún las mediciones en LAT de un estudio20 de fase 2, anticipamos una amplia gama de valores iniciales. El análisis prospectivo de potencia indicó que un cambio de la media igual a la DE (razón normalizada de episodio de 1,0), estudiado a un valor de alfa (bilateral) de 0,05 y un valor de beta del 90% necesitaría 21 pacientes por grupo. Un tamaño normalizado del efecto de 0,5 con las mismas presunciones necesitaría un tamaño de muestra de 63 pacientes por grupo. Dada la tasa prevista de inclusión de pacientes en los tres centros de estudio dedicados a la recogida de muestras de LAT, tratamos de enrolar un mínimo de 50 a 60 pacientes de cada brazo del ensayo principal para el análisis del LAT.
Para la comparación de datos no paramétricos (las concentraciones normalizadas de aspirado traqueal en cada momento y de cada una de las sustancias de interés) se utilizó el test de Mann-Whitney. Los datos se expresan como cajas que muestran la mediana y los percentiles 25º y 75º como límites de la caja, y los percentiles 5º y 95º como barras de error. En los datos continuos y de distribución normal (puntuación de gravedad, peso al nacimiento, edad gestacional) se utilizó el test t no apareado con corrección por comparaciones múltiples. Los datos categóricos (sexo, resultado) fueron evaluados mediante los tests de χ2o exacto de Fisher. En el análisis post hoc generador de hipótesis no ajustamos respecto a comparaciones múltiples.
RESULTADOSSe tomaron y analizaron 519 muestras de aspirado traqueal de 99 neonatos. Cada sustancia a analizar fue determinada por duplicado en cada muestra, promediándose los resultados.
Los 47 neonatos tratados con iNO y los 52 tratados con placebo estuvieron bien igualados respecto al peso al nacimiento, la edad gestacional y la edad posnatal en el momento de la entrada en el estudio (tabla 1). De forma paralela al estudio global, hubo una tendencia a la mayor supervivencia sin DBP entre los neonatos tratados con iNO (tabla 1). Los 99 pacientes también fueron representativos de los lactantes de los dos brazos de tratamiento del estudio progenitor (tabla 2). De los 99 neonatos del subgrupo, 31 fueron tratados en Filadelfia; 13 en el Westchester Medical Center de Nueva York y 55 en el Children’s Mercy Hospital, Kansas City. Hubo 4 muertes entre los 99 neonatos, 2 en cada grupo de aleatorización. Como los neonatos fueron extubados típicamente a CPAP a medida que avanzó el ensayo, el número de muestras obtenidas disminuyó en los últimos momentos de recogida. Hubo 64 neonatos (33 tratados con placebo y 31 con iNO) todavía intubados con recogida de muestras en los días 9 a 12; en los días 23 a 26, el número total fue de 28 (17 tratados con placebo y 11 con iNO).
TABLA 1. Datos iniciales en el subgrupo de neonatos con recogida seriada de LAT
En el momento de la entrada en el estudio hubo una sustancial variabilidad en cada una de las sustancias evaluadas (figs. 2 a 8). En ningún caso hubo diferencia significativa entre los neonatos posteriormente tratados con iNO y los tratados con placebo.
TABLA 2. Datos iniciales y del resultado del estudio progenitor4
No hubo correlación entre cualquiera de las sustancias medidas y la puntuación inicial de la gravedad respiratoria (datos no ofrecidos).
La administración de iNO no produjo cambios significativos comparado con el grupo tratado con placebo durante el período de tiempo evaluado respecto a cualquiera de los marcadores (figs. 2 a 8). Los datos se presentan normalizados respecto a las proteínas totales. Al normalizar los resultados por sSC-IgA se obtuvieron los mismos resultados estadísticos (datos no ofrecidos). Además, no hubo diferencias en las concentraciones de los marcadores ni en el recuento celular total, al evaluar por separado a los neonatos incluidos de forma temprana (7 a 14 días) o tardía (15 a 21 días) (datos no ofrecidos). El análisis post hoc ha demostrado que el beneficio clínico se limitó a los neonatos incluidos tempranamente4.
Fig. 2. IL-1b frente a tiempo sometido al gas de estudio en los dos grupos. No se observaron diferencias significativas. Los datos se presentan mediante análisis de cajas con barras de error, la línea horizontal de la caja representa la mediana, los límites superior e inferior de la caja son los percentiles 75º y 25º, y las barras de error representan los percentiles 5º y 95º. El signo más (+) representa la media. Número de neonatos de los que se tomaron las muestras: inicial: 45 placebo y 47 iNO; recogida del día 9 a 12: 33 placebo y 31 iNO, y día 23 a 26: 17 neonatos con placebo y 11 con iNO. iNO: óxido nítrico inhalado.
Fig. 3. Datos de IL-8 frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. iNO: óxido nítrico inhalado.
Fig. 4. Datos de TGF- βactivo frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. iNO: óxido nítrico inhalado.
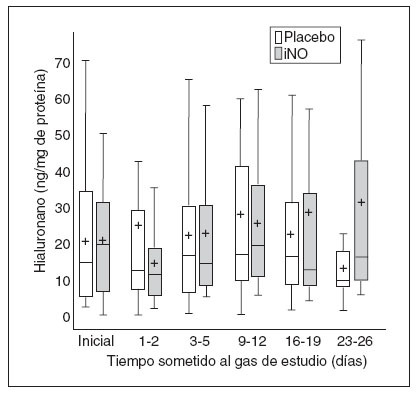
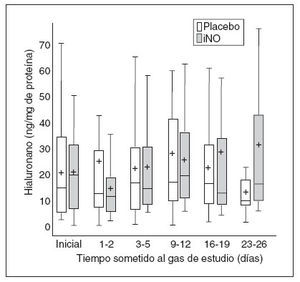
Fig. 5. Datos de hialuronano frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. iNO: óxido nítrico inhalado.
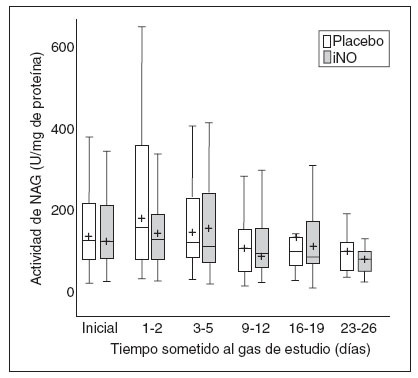
Fig. 6. Datos de N-acetil-b-glucosaminidasa frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. NAG: N-acetil- β-glucosaminidasa; iNO: óxido nítrico inhalado.
Fig. 7. Datos de 8-epi-PGF2 α frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. iNO: óxido nítrico inhalado.
Fig. 8. Recuento celular total frente al tiempo sometido al gas de estudio en los dos grupos. Los datos se expresan como en la figura 2. INO: óxido nítrico inhalado.
No hubo correlaciones entre cualquiera de las sustancias medidas y la puntuación de la gravedad respiratoria medida durante las tres primeras semanas tras el inicio del gas de estudio.
Se realizó un análisis post hoc limitado a los 47 neonatos tratados con iNO. De estos 47 neonatos, 21 (44,7%) tuvieron un resultado favorable (supervivencia sin DBP a las 36 semanas) y 26 mostraron DBP o fallecimiento (n = 2) a las 36 semanas o después. Los neonatos tratados con iNO, estratificados por este resultado primario a las 36 semanas de edad posmenstrual, no difirieron en ninguna característica demográfica importante (tabla 3). En la situación inicial, los neonatos tratados con iNO con mejor resultado tuvieron unos mayores valores normalizados de8-epi-PGF2α en el LAT que los neonatos con resultado desfavorable (p = 0,017) (tabla 4). El día 4 de tratamiento dejó de existir esta diferencia (datos no ofrecidos).
DISCUSIÓNLos actuales resultados se tomaron de un subgrupo representativo de pacientes incluidos en un ensayo aleatorizado multicéntrico, doble ciego, de iNO, el estudio NO-CLD, diseñado para disminuir la incidencia o la gravedad de la DBP4. La administración de iNO se asoció con un menor número de neonatos que desarrollaron DBP, y con una DBP menos grave en los que la desarrollaron en el brazo tratado con iNO. Los resultados de este informe aumentan el perfil de seguridad de la administración de iNO y sugieren que el mecanismo de acción por el que actúa el iNO no corresponde a un cambio agudo en el estado inflamatorio del pulmón.
Nuestro objetivo fue investigar el posible efecto del iNO en una serie de sustancias mensurables en el LAT. Con este fin determinamos el recuento celular total, las citoquinas proinflamatorias IL-1β e IL-8, la citoquina multifuncional y profibrogénica TGF-β y un marcador de la actividad del macrófago alveolar, la N-acetil glucosaminidasa. También medimos el hialuronano, un componente de la matriz extracelular que se altera durante la lesión pulmonar, y un marcador de la lesión pulmonar oxidativa, 8-epi-PGF2α.
Que sepamos, estos resultados provienen del mayor número de pacientes pretérmino en alto riesgo de desarrollar DBP presentados hasta ahora. La mayoría de los estudios publicados anteriormente han informado de resultados seriados sin un grupo de intervención y otro de control por separado. Una importante característica de nuestro conjunto de datos es que la recogida comenzó a un mínimo de 7 días, una mediana de 15 a 16 días, y continuó en muchos casos durante las 3 semanas siguientes. Los resultados no incluyen las muestras tomadas al nacimiento, sino las tomadas tras un mínimo de 7 días, presumiblemente después de la activación de los mecanismos de desarrollo de la DBP. Además, dadas las inherentes limitaciones de la determinación de sustancias en un líquido de recubrimiento epitelial, normalizamos los resultados tanto respecto a la proteína total como al componente secretor soluble de la IgA. No está claro qué denominador es preferible en esta población, ya que los neonatos que desarrollan DBP muestran una gran permeabilidad capilar alveolar27. Los resultados se presentan mediante las proteínas totales, más familiares, pero la interpretación de los datos fue la misma al utilizar como denominador el componente secretor soluble.
TABLA 4. Valores iniciales de los neonatos tratados con iNO
Citoquinas proinflamatoriasLa IL-8 se genera en el pulmón tanto a partir de los macrófagos alveolares como de las células epiteliales, los fibroblastos, el epitelio microvascular y las células musculares aparentemente lisas. Tanto IL-1β como IL-8 participan en el reclutamiento de los leucocitos inflamatorios en el intersticio pulmonar y el espacio aéreo. Un informe anterior ha demostrado la abundante expresión de IL-8 mARN en los neonatos que progresan hasta desarrollar DBP28. La falta de un cambio de IL-1β, IL-8 y TGF-β en ambos grupos durante la administración del gas en estudio es congruente con la ausencia de un cambio significativo en la N-astil-β-glucosamini-dasa, un marcador de los macrófagos en las vías respiratorias. No hubo correlación entre la NAG y el recuento total de células en los grupos tratados con placebo o con iNO.
HialuronanoEl hialuronano, un componente de la matriz extracelular, ayuda a estimular la inflamación y la fibrosis tras la lesión pulmonar29, y se ha asociado con un aumento del agua pulmonar en los animales adultos. Las propiedades hidrodinámicas de hialuronano apoyan la migración de la célula pulmonar; el aumento de hialuronano probablemente favorece la agregación de los macrófagos pulmonares. No encontramos cambios en el hialuronano en el LAT con el tratamiento con iNO. La ausencia de cambios de hialuronano también es congruente con el hallazgo de una falta de aumento de NAG, sin cambio en las citoquinas proinflamatorias.
TGF-βLa TGF-β es una citoquina fibrogénica que se considera desempeña un papel crucial en la remodelación parenquimatosa pulmonar, especialmente la que resulta en espacios aéreos de mayor tamaño. Se ha asociado con un tratamiento prolongado con O2 tras una DBP30. En este estudio se identificó TGF-β activa en el LAT, pero no hubo un cambio significativo con la administración de iNO.
8-epi-PGF2La familia de las prostaglandinas no derivadas de la cicloxigenasa, los 8-isoprostanos como 8-epi-PGF2α, está generada por la oxidación directa de los fosfolípidos de membrana. Estas sustancias sirven de marcadores de la lesión oxidativa pulmonar31 y pueden contribuir a la hipertensión pulmonar16. No se encontró diferencia en la situación inicial o en cualquier momento del tratamiento entre las concentraciones en LAT de los pacientes de control y los tratados.
Reproducibilidad de las determinacionesCada una de las determinaciones se realizó por duplicado o por triplicado, promediando los resultados. Además, tratamos de garantizar que el transporte de las muestras y los necesarios segundos ciclos de descongelación y recongelación no modifican las mediciones. Limitamos el número de ciclos de descongelación/recongela-ción a uno con 8-epi-PGF2α, que se sabe sensible a este proceso. Las alícuotas para medir las sustancias a analizar fueron tratadas de forma idéntica, de forma que los efectos serían compartidos por las muestras de neonatos tratados con iNO y tratados con placebo. En una evaluación específica de tres ciclos de descongelación/reconge-lación no encontramos efectos sobre los resultados de la determinación de IL-1β (datos no ofrecidos).
Limitaciones del estudioEl LAT puede no representar, de forma predecible, las concentraciones de las células inflamatorias o sus productos en los espacios vasculares o intersticiales pulmonares. No obstante, se correlaciona con las mediciones del líquido de recubrimiento epitelial32,33 y el empleo de las proteínas totales o de la sSC-IgA ofrece una forma razonable de normalizar los datos34. No se encontró evidencia de exacerbación o inflamación, o de lesión oxidativa, con la administración de iNO.
No se determinaron los receptores de IL-1β ni de IL-8, ni se midió la citoquina antiinflamatoria IL-10. Otros autores han utilizado las proporciones IL-1 a IL-10 e IL-8 a IL-10 como manera de expresar el estado inflamatorio pulmonar35. El cuadro de sustancias medidas no incluyó otros mediadores vasoactivos que pudieran estar afectados por iNO, como la endotelina-136. Dada la limitada cantidad de líquido traqueal obtenido en cada momento, no pudimos realizar todas las determinaciones biológicamente verosímiles.
Los neonatos debían seguir intubados para realizar la recogida seriada de LAT. A medida que mejoraban, muchos fueron tratados con sistemas de ventilación a presión positiva continua nasal, y finalmente con oxígeno suplementario administrado por cánulas nasales. Nuestros resultados estuvieron limitados porque sólo se dispuso de muestras seriadas de los neonatos más gravemente afectados, que necesitaron un apoyo prolongado con ventilación a presión positiva administrada mediante tubo endotraqueal. Sin embargo, el número de abandonos durante los períodos de toma de muestras aquí presentados fue similar entre los dos grupos. No hubo una tendencia evidente, ni siquiera en el conjunto de datos de neonatos con recogidas seriadas inicial, a los 4 días y luego semanal.
Análisis post hocEn el estudio progenitor, el número de tratamientos necesarios para conseguir 1 neonato menos con DBP fue de 14 en el estudio global y 5 en el grupo de enrolamiento temprano4. Dado el coste y la complejidad de la administración de iNO durante muchos días, es crucial identificar los marcadores clínicos o de laboratorio que predicen el beneficio del tratamiento con iNO.
En el análisis post hoc tratamos de identificar, entre el cuadro de marcadores utilizado en este estudio, si una o más de las sustancias medidas en la situación inicial (media de 16 días de edad) predicen una respuesta favorable al iNO. La 8-epi-PGF2α inicial en el LAT fue mayor en los neonatos tratados con iNO que respondieron favorablemente al iNO. Una suposición de esta actividad generadora de hipótesis es que el NO puede producir una respuesta más favorable si se introduce en un ambiente pulmonar que contenga factores contribuyentes a una elevada resistencia vascular pulmonar. Sin embargo, no hubo disminución de gravedad en los 21 neonatos entre la situación inicial y los 4 días de tratamiento. Podría esperarse una disminución de la puntuación de gravedad si disminuyó la resistencia vascular pulmonar con mejoría concomitante de la igualdad ventilación perfusión y mejoró la tensión y la saturación arterial de oxígeno. Alternativamente, una 8-epi-PGF2α elevada en la situación inicial puede indicar un ambiente de aumento del daño oxidativo, situación específica en la que el iNO sería beneficioso.
CONCLUSIONES Y RESUMENNuestros hallazgos de ausencia de cambio significativo identificable en el cuadro de los marcadores y mediadores proinflamatorios o de lesión pulmonar utilizados en este estudio indican que la administración de iNO a la dosis y la duración aquí utilizada fue segura. No se identificó aumento de la inflamación o la lesión asociada a iNO. Esto sugiere que, si las mejorías clínicas asociadas con iNO resultan de cambios del medio proinflamatorio del pulmón, el mecanismo debe ser indirecto. En la subpoblación de neonatos que recibió iNO, sólo la 8-epi-PGF2α fue identificada como posiblemente asociada con los neonatos que progresaron a DBP, comparados con los que no mostraron tal progresión. Se está realizando nuevos trabajos para distinguir los dos grupos tratados con iNO y con resultado favorable y desfavorable.
AGRADECIMIENTOSEste trabajo fue financiado por becas de los National Institutes of Health (becas U01 HL62514; P50 HL56401; P30 HD26979; MRDDRC P30 HD26979; R01 HL070560, HL62472, HL62868, HL75930 y HL73896, y las becas del General Clinical Research Centers Programs M01 RR00240, M01 RR00084, M01 RR00425, M01 RR001271, M01 RR00064 y M01 RR00080). Todos los autores recibieron financiación del NHLBI.
Damos las gracias a los investigadores del NO-CLD, las enfermeras, los residentes, los especialistas, los médicos de plantilla y los terapeutas respiratorios que hicieron posible el estudio. Damos las gracias a Cheri Castor de Kansas City y a Theresa McDevitt de Filadelfia por la supervisión del procesamiento de las muestras. Damos las gracias a Mary S. Bailey por su ayuda en la preparación del manuscrito y a Christopher Norberg, MS, y Steve Simon, PhD, por su ayuda en el manejo de los datos. Damos las gracias a INO Therapeutics por el suministro del gas de estudio y su instrumental en el ensayo progenitor.
La actual filiación del Dr. P.L. Ballard y la Dra. R.A. Ballard es el Department of Pediatrics, University of California, San Francisco, School of Medicine, San Francisco, California, Estados Unidos.
Correspondencia: William E. Truog, MD, Department of Pediatrics, Section of Neonatology, Children’s Mercy Hospitals and Clinics, 2401 Gillham Rd, Kansas City, MO 64108, Estados Unidos.
Correo electrónico: wtruog@cmh.edu