En febrero de 2006, la Food and Drug Administration (FDA) de Estados Unidos autorizó una nueva vacuna reagrupada con rotavirus humano-bovinos, RotaTeq (Merck and Co., West Point, Pensilvania). El Advisory Committee on Immnunization Practices (ACIP) de Estados Unidos recomendó vacunar sistemáticamente a los lactantes con tres dosis de RotaTeq administradas oralmente a los 2, 4 y 6 meses de edad1. En 1999, una vacuna anterior anti-rotavirus reagrupada rhesus-humana, Rotashield (Wyeth Laboratories, Mariette, Pensilvania), se retiró de la venta en Estados Unidos 9 meses después de su introducción, al asociarse con casos de invagina-ción2,3. La relación entre Rotashield e invaginación se descubrió a través del US Vaccine Adverse Event Reporting System4 (VAERS).
Dada la asociación demostrada entre una vacuna oral previa anti-rotavirus y la invaginación, se valoró la inocuidad de la nueva vacuna RotaTeq en un ensayo clínico pre-autorización a gran escala, realizado en 34.035 lactantes a quienes se administró la vacuna y 34.003 que recibieron un placebo5. En este ensayo controlado, cuya potencia estadística se calculó para excluir un aumento de 10 veces en el riesgo de invaginación durante un período de 42 días después de la vacunación con RotaTeq, no se observó un mayor riesgo de invaginación, estadísticamente significativo (6 casos en los vacunados y 5 en los controles). Se presentan aquí los datos post-autoriza-ción de los primeros 19 meses de control de la invaginación tras la vacunación infantil sistemática con RotaTeq en Estados Unidos.
MÉTODOSVaccine Safety Datalink (VSD)Vaccine Safety Datalink (VSD) es un proyecto en colaboración entre los Centers for Disease Control and Prevention (CDC) y diversas organizaciones sanitarias importantes de Estados Unidos, donde los datos vacunales computarizados pueden vincularse con las evoluciones clínicas6,7. Los niños que recibieron la vacuna RotaTeq a las 4 a 48 semanas de edad en uno de los seis centros VSD participantes se monitorizaron para controlar la aparición de invaginación durante los 30 días siguientes a la vacunación, con métodos previamente descritos6. A efectos comparativos, se monitorizó también a lactantes de los mismos grupos de edades que recibieron cualquier otra vacuna autorizada, distinta de RotaTeq, durante el mismo período. Se llevó a cabo un análisis para valorar el riesgo relativo bruto de invaginación y el IC del 95% con métodos exactos, para comparar los vacunados con RotaTeq y los que recibieron cualquier otra vacuna autorizada.
Se agruparon los datos del ensayo clínico con RotaTeq y los de la cohorte VSD acerca de los casos de invaginación ocurridos después de la primera dosis, para valorar mejor el riesgo en el breve plazo de 3 a 7 días tras la vacunación, que se había identificado como el período de máximo riesgo con la vacuna Rotashield. Se calculó el número esperado de casos que se habrían identificado mediante VSD y el ensayo clínico pre-auto-rización, si RotaTeq presentara un riesgo de invaginación similar al de Rotashield2 (es decir, 37 veces mayor durante los 37 días siguientes a la primera dosis). El número de niños que recibieron la primera dosis de RotaTeq en VSD y en el ensayo clínico se multiplicó por la tasa basal de invaginación estratificada por edades, según VSD (18 por 100.000 años-persona a las 6-14 semanas de edad), para el intervalo de 3-7 días, y luego se multiplicó este resultado por el factor de riesgo de Rotashield, de 37.
VAERSSe revisaron los informes de invaginación tras la vacuna Rota-Teq recibidos en VAERS desde el 1-2-2006 hasta el 25-9-2007. VAERS es un sistema nacional de vigilancia pasiva, gestionado conjuntamente por FDA y CDC, que recibe los informes de fenómenos adversos acaecidos tras la vacunación, emitidos por diversas fuentes: proveedores de asistencia sanitaria, programas de vacunación estatales y locales, receptores de las vacunas y laboratorios que las elaboran8-10. En todos los casos de invaginación se contacta con los proveedores de asistencia sanitaria para confirmar el diagnóstico y obtener información sobre las características clínicas, el tratamiento, el curso hospitalario y la historia vacunal. En el presente análisis se consideró que los casos de invaginación quedaban confirmados si reunían los criterios de nivel I incluidos en la definición de casos de Brighton Collaboration11.
Cálculo de los valores observados frente a los esperadosEl número de casos de invaginación tras la vacuna RotaTeq declarados a VAERS se comparó con el número esperado de casos de invaginación según la tasa basal de invaginación natural. Dado que la tasa basal de invaginaciones y el número de dosis vacunales administradas varían sustancialmente según la edad, se estratificó este análisis en tres grupos de edades: 6-14 semanas, 15-23 semanas y 24-35 semanas. Este agrupamiento sigue fielmente la recomendación de ACIP de administrar la primera dosis entre las 6 y 12 semanas de edad, y las siguientes dosis a intervalos de 4 a 10 semanas. Además, dado que cada una de las tres dosis puede suponer un riesgo variable de invaginación, se realizaron análisis por separado para cada dosis. Se valoró el riesgo en dos períodos principales (1-21 días y 1-7 días) de comienzo de los síntomas tras la vacuna RotaTeq; estos períodos se basaron en los homólogos de riesgo potencial identificados a partir de la experiencia con Rotashield2. Se emitió además la hipótesis de que cualquier riesgo de invaginación guarda una relación cronológica con la replicación del virus vacunal en el tracto intestinal1,5.
Para calcular las tasas basales de invaginación se examinaron los datos de VSD. La determinación de dichas tasas se realizó a partir de las altas hospitalarias con el código de la International Classification of Diseases, Ninth Revision para invaginación (560.0), en los centros de estudio de VSD durante 2000-2004, cuando no se utilizaba la vacuna anti-rotavirus. Para calcular el número basal esperado de casos para los períodos de riesgo, se multiplicó la tasa basal de invaginación en cada grupo de edades por el número estimado de dosis vacunales administradas como 1.ª, 2.ª o 3.ª dosis en ese grupo de edades.
Para estimar el número de dosis administradas se asumió que: 1) las dosis administradas de vacuna equivalían al número total de dosis de RotaTeq distribuidas por el fabricante desde el 1-2-2006 hasta el 31-8-2007, y 2) la proporción de dosis administradas en cada uno de los tres grupos de edades equivalía, a escala nacional, a la proporción de dosis vacunales administradas en cada uno de los tres grupos en los centros de VSD durante el mismo período de tiempo.
Los cocientes de las tasas observadas frente a las esperadas (riesgo relativo: RR), con los intervalos de confianza (IC) del 95%, se calcularon mediante la prueba exacta de Poisson estratificada por edades (StatXact 6, Cambridge, MA: CYTEL Software Corp, 2003).
Análisis de sensibilidadSe utilizaron los análisis de sensibilidad para valorar el impacto potencial de la variabilidad en dos presunciones clave sobre los resultados: 1) el porcentaje de casos declarados a VAERS, y 2) la proporción de dosis distribuidas que se administraron.
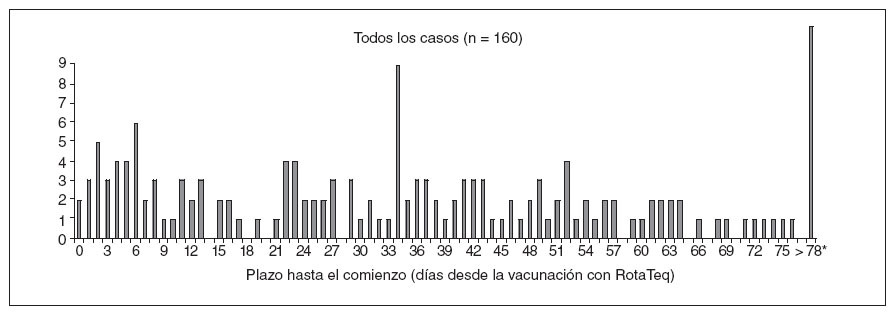
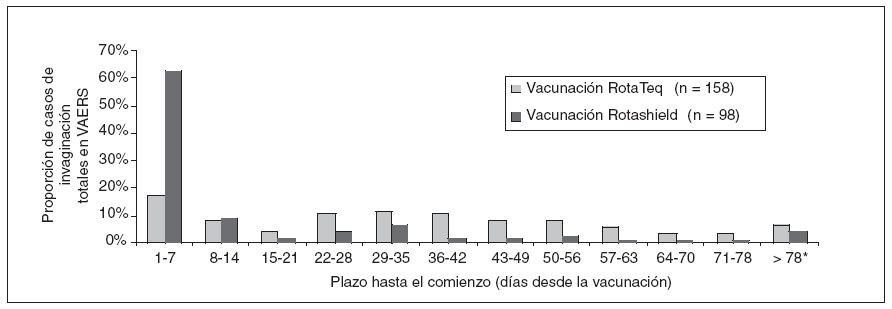
RESULTADOSVAERSDesde el 1-2-2006 hasta el 25-9-2007 se recibieron en VAERS 1.901 informes de fenómenos adversos tras la vacunación con RotaTeq, entre ellos 160 (8,4%) casos de invaginación confirmada (fig. 1). No ocurrieron fallecimientos entre los casos de invaginación declarados. De los 160 casos de invaginación, 47 (29%) ocurrieron en lactantes entre 1-21 días tras la vacunación, 27 (17%) de ellos entre 1-7 días. A título comparativo, más del 60% de los casos de invaginación declarados tras la vacunación con Rotashield ocurrieron entre 1-7 días después de administrar la vacuna (fig. 2).
Fig. 1. Número de declaraciones a VAERS de casos de invaginación después de la vacunación con RotaTeq, según el plazo en días hasta el comienzo. Estados Unidos, 1-2-2006 a 25-9-2007. *Once informes de invaginación > 78 días ocurrieron al cabo de 79, 87, 89, 99, 110, 118, 120, 122, 123, 153 y 170 días tras la vacunación.
Fig. 2. Proporción de declaraciones totales a VAERS de casos de invaginación tras la vacunación con RotaTeq (1-2-2006 a 25-9- 2007) y Rotashield (1-10-1998 a 15-8-1999), según el plazo en días hasta el comienzo. Incluye 158 casos después de RotaTeq (excluye 2 casos el día 0) y 98 casos después de Rotashield. * Para RotaTeq, 11 informes de invaginación > 78 días ocurrieron al cabo de 79, 87, 89, 99, 110, 118, 120, 122, 123, 153 y 170 días tras la vacunación. Para Rotashield, 4 informes de invaginación > 78 días ocurrieron al cabo de 97, 107, 111 y 112 días tras la vacunación. VAERS: Vaccine Adverse Event Reporting System.
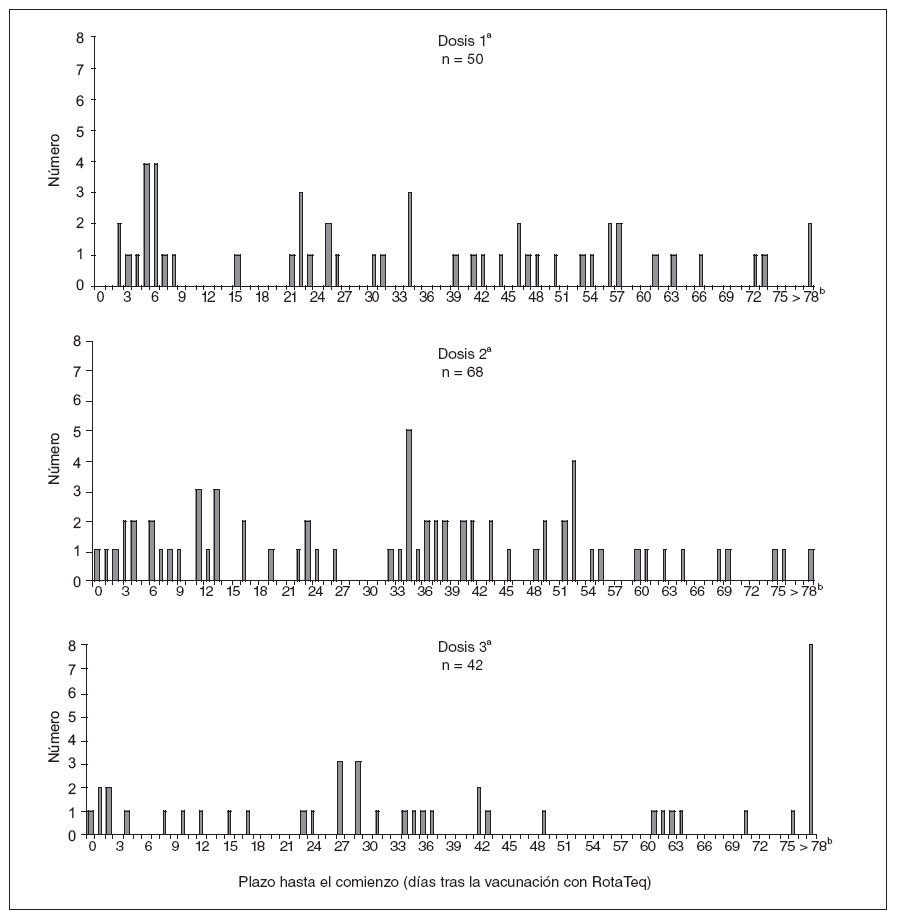
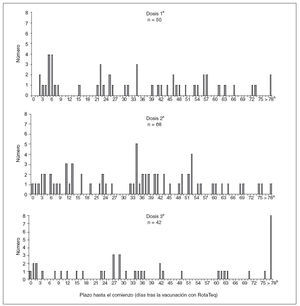
Los 47 casos de invaginación ocurridos 1-21 días después de la vacunación se confirmaron radiológicamente (por enema de bario o ecografía) o quirúrgicamente. En 22 (47%) lactantes se requirió la cirugía, incluidos 11 casos en que fue necesario practicar una resección intestinal. En los 25 (53%) restantes se resolvió la invaginación mediante enema. De los 47 casos, 16 (34%) ocurrieron después de la 1.ª dosis; 21 (45%), después de la 2.ª, y 10 (21%), después de la 3.ª dosis (fig. 3). Las edades medias en el momento de la vacunación eran de 11, 19 y 28 semanas para las dosis 1.ª, 2.ª y 3.ª, respectivamente. Sólo 3 (19%) de los 16 niños con inicio después de la 1.ª dosis la habían recibido a una edad > 90 días (a las edades exactas de 97, 103 y 129 días).
Fig. 3. Número de declaraciones a VAERS de casos de invaginación, según el número de dosis y el plazo en días hasta el comienzo. Estados Unidos, 1-2-2006 a 25-9-2007. aIndica la dosis de vacuna administrada más recientemente antes del comienzo de la invaginación. bLos 11 informes de invaginación > 78 días ocurrieron al cabo de 79, 87, 89, 99, 110, 118, 120, 122, 123, 153 y 170 días tras la vacunación.
Hasta el 31-8-2007, el fabricante había distribuido 9.120.726 dosis de RotaTeq (Merck, datos no publicados, 2007). De las dosis administradas en VSD, el 42%, 32% y 25% se administraron a niños de 6-14, 15-23 y 24-35 semanas, respectivamente; se estimó que el 45% fue como 1.ª dosis, el 33% como 2.ª, y el 22% como 3.ª dosis. El 92% y el 93% de las primeras dosis se administraron a niños de 6-12 y 6-14 semanas de edad, respectivamente.
El 13-2-2007, Merck modificó el prospecto de la vacuna al añadir la invaginación como fenómeno adverso descrito tras la vacunación con RotaTeq, y la FDA emitió un informe de salud pública sobre esta cuestión12,13. Estos comunicados, que tuvieron una amplia repercusión en los medios, se distribuyeron de un modo generalizado a los pediatras. Tras la notificación de la FDA se produjo un ascenso en el número total de casos de invaginación declarados a VAERS; de un total de 117 informes, 50 (43%) casos ocurrieron en el plazo de las 8 semanas siguientes a la notificación de la FDA. Treinta y siete (74%) de estos 50 casos se produjeron fuera del intervalo de 1-21 días. En cambio, sólo 18 de los 35 (49%) casos de invaginación declarados antes de la notificación de la FDA ocurrieron fuera del mencionado intervalo de 1-21 días (diferencia en las proporciones = 25%; p = 0,03). De los 50 casos informados tras la notificación de la FDA, 12 habían ocurrido antes de la fecha de la notificación, y 4 de estos 12 se produjeron 1-21 días después de la vacunación.
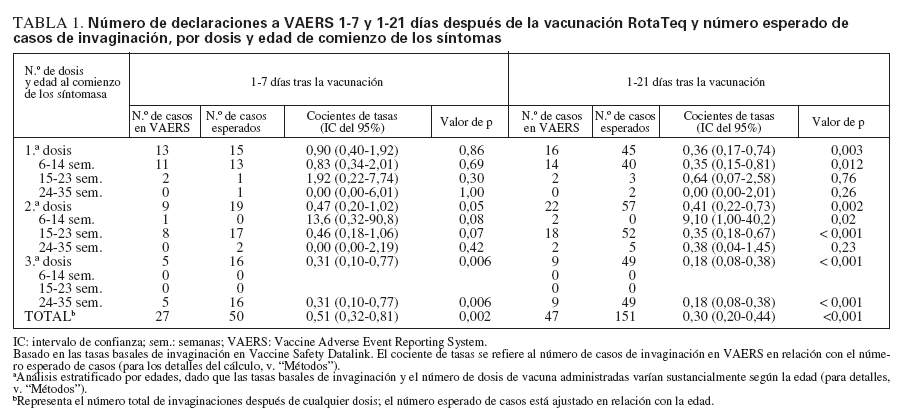
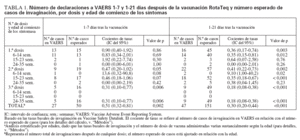
Cálculos de los casos esperados frente a los observadosLa tasa basal de invaginaciones registradas en VSD era de 18,1 por 100.000 años-persona a las 6-14 semanas de edad; 32,5 por 100.000 años-persona a las 15-23 semanas, y 42,5 por 100.000 años-persona a las 24-35 semanas de edad. Mediante la aplicación de estas tasas ba-sales al número de dosis administradas a cada grupo de edades, se calculó un número esperado de 151 casos de invaginación para el período de 1-21 días después de la vacunación; se esperaba que 50 de ellos ocurrieran 17 días después de administrar la vacuna. En cambio, 47 casos de invaginación declarados a VAERS ocurrieron 1-21 días después de la vacunación, 27 de ellos 1-7 días después. Si se asume que se declaró a VAERS el 75% de los casos ocurridos durante estos períodos, y que se administró el 75% de las dosis distribuidas, la tasa observada de invaginación no superó la tasa basal ajustada a la edad para 1-21 días (RR = 0,53; IC del 95% = 0,37-0,75) o 1-7 días (RR = 0,91; IC del 95% = 0,59-1,37) tras la vacunación RotaTeq (tabla 1). Los cocientes entre las tasas observadas y las esperadas fueron similares cuando se estratificaron por dosis o por grupos de edades (614 semanas, 15-23 semanas y 24-35 semanas) (tabla 1).
TABLA 1. Número de declaraciones a VAERS 1-7 y 1-21 días después de la vacunación RotaTeq y número esperado de casos de invaginación, por dosis y edad de comienzo de los síntomas
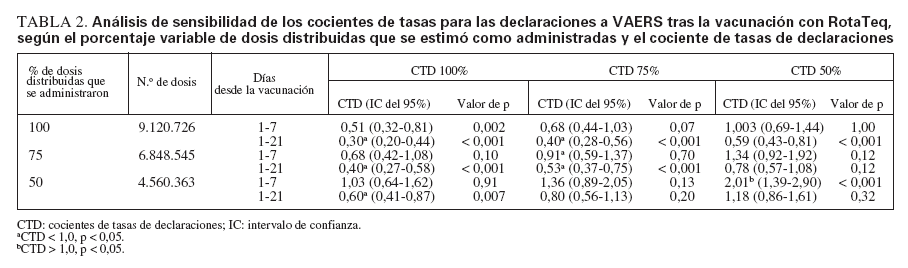
Análisis de sensibilidadSi se asume que se declaró el 100% de los casos y se administró el 100% de las dosis distribuidas, las tasas observadas de invaginación serían más bajas que las esperadas para 1-21 días (RR = 0,30; IC del 95% = 0,20-0,44) y 1-7 días (RR = 0,51; IC del 95% = 0,32-0,81) tras la vacunación con RotaTeq (tabla 2). El análisis de sensibilidad para el intervalo de 1-7 días indica que si se declaró el 50% de los casos y se administró el 50% (4.560.363) de las 9.120.726 dosis de RotaTeq distribuidas, se hallaría una asociación estadísticamente significativa (RR = 2,01; IC del 95% = 1,39-2,90) entre la vacunación y la invaginación (tabla 2). Si se limita el análisis de sensibilidad a la 1.ª dosis con las mismas presunciones conservadoras de declaración y administración de las dosis distribuidas, se obtendría un cociente de tasas de 3,7 (IC del 95% = 1,9-6,9).
TABLA 2. Análisis de sensibilidad de los cocientes de tasas para las declaraciones a VAERS tras la vacunación con RotaTeq, según el porcentaje variable de dosis distribuidas que se estimó como administradas y el cociente de tasas de declaraciones
VSDDurante el período del 21 de mayo al 25 de septiembre de 2007 se administró en VSD un total de 111.521 dosis de RotaTeq a lactantes. Se observaron 3 casos de invaginación en el plazo de 30 días tras la vacunación (1 caso después de la 1.ª dosis, a los 20 días; 2 casos después de la 2.ª dosis, a los 10 y 17 días) entre los vacunados con RotaTeq, en comparación con 9 casos entre 163.123 lactantes que recibieron otras vacunas, con un riesgo relativo de 0,49 (IC del 95% = 0,08-1,95).
Si RotaTeq presentara un riesgo de invaginación similar al de Rotashield se hubiera esperado la aparición de 8 casos de invaginación en el plazo de 3-7 días tras la vacunación, entre los cerca de 84.000 lactantes que recibieron la 1.ª dosis de RotaTeq, al combinar las vacunaciones realizadas en VSD (n = 49.902) y en el ensayo clínico pre-autorización (n = 34.035); en cambio, no se observó ningún caso.
DISCUSIÓNLos datos disponibles no indican que RotaTeq se asocie con la invaginación. El número global de casos de invaginación declarados a VAERS entre los lactantes vacunados con RotaTeq no supera el número basal esperado de casos en los plazos de 1-21 días o 1-7 días después de la vacunación. Sin embargo, ciertas limitaciones clave a la hora de interpretar los datos de VAERS, como la posibilidad de un número bajo de declaraciones de casos de invaginación y la incertidumbre sobre el número de dosis vacunales distribuidas que se administraron9,10, impiden una valoración definitiva del riesgo basándose sólo en estos datos. Los resultados de VSD aportan una información más precisa; mediante los controles sólo se detectaron 3 casos de invaginación en el plazo de 30 días tras la vacunación, después de administrar 111.521 dosis de RotaTeq, en comparación con 9 casos entre 163.123 lactantes que no recibieron Rota-Teq. Sin embargo, debido al número limitado de niños de VSD que se vacunaron con RotaTeq, no es posible excluir un cierto aumento de riesgo de invaginación. La monitorización y los estudios epidemiológicos en curso serán importantes para valorar el perfil de seguridad de las vacunas anti-rotavirus.
Aunque los 47 casos de invaginación declarados a VAERS que ocurrieron 1-21 días después de la vacunación con RotaTeq no superaron el número esperado para este período de riesgo, la mayoría de estos casos (n = 27 [57%]) ocurrió 1-7 días después de la vacunación (fig. 1). Se sabe que la declaración de los fenómenos adversos a VAERS es más completa en los casos más cercanos al momento de la vacunación, pero se desconoce si las tasas de declaración disminuyen sustancialmente para los fenómenos ocurridos 2 a 3 semanas después de la vacunación, en comparación con los producidos durante la primera semana14. Si el porcentaje de declaraciones es similar durante las tres primeras semanas después de la vacunación, el número en exceso de los casos declarados durante la 1.ª semana, en relación con la 2.ª y 3.ª, podría representar un mayor riesgo de invaginación poco después de la vacunación. La monitorización ulterior servirá de ayuda para interpretar la relevancia de estos hallazgos.
Es necesario adoptar una actitud cautelosa en la comparación directa del riesgo de invaginación con RotaTeq y Rotashield, debido a las diferencias en su pauta de administración (la vacunación de recuperación con la primera dosis de Rotashield se permitía hasta los 6 meses de edad, mientras que la primera dosis de RotaTeq debía administrarse antes de las 12 semanas) y en los patrones de diseminación del virus vacunal. Sin embargo, si RotaTeq presentara un riesgo de invaginación similar al de Rotashield2 (es decir, 37 veces mayor durante los 37 días siguientes a la 1.ª dosis), se esperaría que hubiera 8 casos de invaginación durante dicho período al combinar los resultados de VSD y del ensayo clínico pre-auto-rización; sin embargo, no se identificó ningún caso de invaginación durante este período de riesgo.
Los datos de VAERS deben interpretarse con precaución a causa de varias limitaciones importantes. En primer lugar, no sabemos cuántos casos de invaginación tras la administración de RotaTeq no se declararon a VAERS. El alto nivel de conocimiento de la asociación entre la vacuna anterior Rotashield y la invaginación, por parte de los pediatras y los médicos de familia15, y la presentación clínica de la invaginación, grave y llamativa, incrementaron probablemente las declaraciones a VAERS16,17. Esta conclusión viene avalada por el hecho de que el informe inicial de salud pública sobre Rotashield, emitido el 16-7-199918, dio lugar a 83 declaraciones estimuladas de invaginación a VAERS en el plazo de 1 mes, 58 (70%) de los cuales se produjeron en el plazo de 1-21 días tras la vacunación17 (fig. 2). En cambio, aunque la notificación de FDA en febrero de 2007 incrementó considerablemente las declaraciones a VAERS (50 informes en 8 semanas, frente a 35 en los 12 primeros meses post-autorización), la proporción de casos que ocurrieron en el plazo de 1-21 días disminuyó desde el 49% antes de la notificación hasta el 29% después de la misma. Además, sólo 4 de 12 casos estimulados (es decir, que ocurrieron antes de la notificación de FDA) se produjeron 1-21 días después de la vacunación. Si las declaraciones en dicho período hubieran sido sustancialmente bajas, la notificación hubiera generado más informes durante este potencial período de riesgo, lo que induce a sospechar que el porcentaje de declaraciones ha sido elevado en el mencionado período.
Una segunda limitación importante del análisis VAERS es que no podemos determinar cuál es la proporción de dosis distribuidas de RotaTeq que se administraron. Por término medio, a partir de mayo de 2006 se distribuyeron cada mes unas 450.000 dosis de vacuna, y los contratos para la adquisición de la vacuna antirotavirus, a través del programa Vaccines for Children19 (que adquiere la vacuna para casi el 45% de los niños de Estados Unidos), han estado en vigor durante más de 12 meses; estos hechos indican que las condiciones son favorables para el consumo de la vacuna. Debemos señalar que con la vacuna anterior Rotashield, los datos de National Immunization Survey indicaron que cerca del 66% de las dosis distribuidas se administraron durante los 9 meses de utilización de la vacuna20.
Una limitación clave final se refiere a las tasas basa-les de invaginación. Aunque en nuestros cálculos sobre las cifras esperadas utilizamos los datos de VSD, y es posible que éstos no sean representativos de la población general de donde proceden los datos de VAERS, VSD es una sólida fuente de datos y sus tasas basales de hospitalizaciones por invaginación son similares a las que se han publicado en la literatura. Sin embargo, no se han comprobado la exactitud y lo completo de estos datos y de otras fuentes nacionales. En un estudio realizado en un importante hospital infantil de Cincinnati se halló que, durante 1995-2000, cerca del 40% de los lactantes con invaginación recibió tratamiento sólo en un servicio de estancias breves o de urgencias, y estos pacientes no se habrían identificado por el examen aislado de las altas hospitalarias, lo que llevaría a subestimar la incidencia basal de la invaginación21. Nuestro análisis de sensibilidad no tuvo en cuenta la posibilidad de que hubiera unas tasas más elevadas de invaginación, por lo cual es posible que se haya sobreestimado el riesgo.
CONCLUSIONESCon más de 9 millones de dosis de vacuna distribuidas durante los primeros 19 meses post-autorización, los datos de VAERS y VSD post-autorización no indican que RotaTeq se asocie con la invaginación. Sin embargo, debido al número relativamente pequeño de lactantes vacunados con RotaTeq en VSD, así como a las limitaciones inherentes a los datos VAERS y a las presunciones empleadas en su análisis, no puede excluirse la posibilidad de que a lo largo del tiempo se halle un mayor riesgo de invaginación, aunque de menor magnitud que el observado con Rotashield. La monitorización en curso, especialmente la evaluación del patrón de inicio tras la vacunación en los casos de invaginación declarados a VAERS, así como el examen periódico de los datos de VSD y de otros datos epidemiológicos, al ir aumentando la aceptación de la vacuna, serán importantes para valorar plenamente el perfil de inocuidad de RotaTeq.
Correspondencia: Manish Patel, MD, Centers for Disease Control and Prevention, National Center for Immunizations and Respiratory Diseases, 1600 Clifton Rd, MS A-47, Atlanta, GA 30333, Estados Unidos.
Correo electrónico: aul3@cdc.gov