Se han planteado preocupaciones acerca del posible efecto de timerosal, un compuesto mercurial utilizado como conservante en las vacunas, sobre el desarrollo neuropsicológico en los niños1. El autismo2, los tics motores3,4, el retraso mental, los trastornos del lenguaje y el trastorno de deficiencia de la atención e hiperactividad5 han sido mencionados como acontecimientos adversos atribuibles al timerosal integrado en las vacunas. Por el contrario, los resultados de estudios grandes y bien diseñados no apoyan estas asociaciones entre la exposición a timerosal y el desarrollo neuropsicológico6-12.
Varias agencias internacionales recomiendan distintos límites de seguridad en la exposición al etilmercurio (un metabolito de timerosal) según el peso corporal, basándose en los datos farmacocinéticos disponibles del metilmercurio, un compuesto similar12,13. Sin embargo, la semivida sanguínea del etilmercurio proveniente del timerosal integrado en las vacunas es menor que la del metilmercurio14. Además, ninguno de los estudios realizados hasta ahora ha podido demostrar qué cantidad del timerosal administrado con las vacunas se asocia con acontecimientos neurotóxicos adversos9,12,13. No obstante, desde 1999, las agencias reguladoras de Estados Unidos y de Europa han recomendado eliminar el timerosal de las vacunas en la medida de lo posible, como medida de precaución15-17.
La evaluación de los efectos del timerosal de las vacunas mucho después de la inmunización está complicada por una serie de factores que pueden afectar a la calidad de los datos sobre la exposición a la vacuna y las mediciones del desarrollo neuropsicológico. En los estudios de observación sobre la población general puede ser difícil el control respecto a factores sociales y de estudios y algunas alteraciones sanitarias en ausencia de registros de gran calidad que incluyan información sobre cada uno de estos factores.
En 1992 se inició en Italia18 un ensayo clínico controlado, aleatorizado, sobre la eficacia de las vacunas acelulares contra la tos ferina, que incluyó una vacuna acelular contra la difteria, el tétanos y la tos ferina (DTaP) fabricada por Chiron Biocine que contenía timerosal y una vacuna DTaP fabricada por SmithKline Beecham que contenía 2-polifenoxietanol (un compuesto sin neurotoxicidad conocida) como conservante. Como los lactantes incluidos en este ensayo fueron asignados aleatoriamente a recibir las distintas vacunas, también se expusieron aleatoriamente a distintas cantidades acumulativas de timerosal en su primer año de vida. Además, los niños fueron controlados activamente, con comunicaciones mensuales hasta los 6 años de edad, y no recibieron otras vacunas que contuvieran timerosal durante este período. En este estudio comparamos los resultados neuropsicológicos a los 10 años de la vacunación en los niños que habían sido expuestos a distintas cantidades de timerosal.
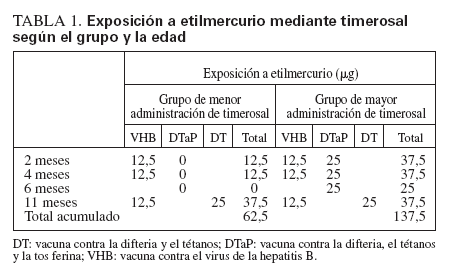
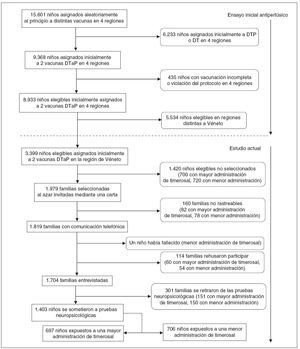
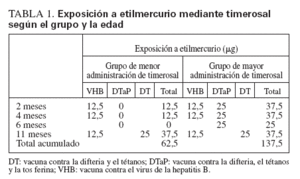
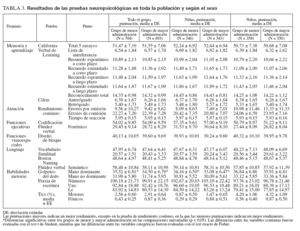
MÉTODOSExposición a timerosalEn 1992-1993, el Italian Trial on Pertussis Vaccines18-20 incluyó a 15.061 lactantes sanos de 2 meses de edad. En este ensayo, los lactantes fueron seleccionados de la población general en 4 de 20 regiones italianas (fig. 1) y fueron asignados aleatoriamente a recibir, en condiciones de doble ocultación, 3 dosis de una de 4 vacunas, de las que 2 eran vacunas DTaP de 2 fabricantes distintos. Una vacuna DTaP contenía 50 μg de timerosal (o 25 μg de etilmercurio) por dosis, y la otra carecía de timerosal (utilizó 2-fenoxietanol como conservante). Las 3 dosis de la vacuna DTaP se administraron a los 2, 4 y 6 meses de edad. Para cumplir con la pauta italiana de vacunación, todos los niños recibieron además 3 dosis de vacuna contra el virus de la hepatitis B (formulación infantil), cada una de las cuales contenía 25 μg de timerosal (o 12,5 μg de etilmercurio), a los 2, 4 y 12 meses de edad, y una cuarta dosis de vacuna contra la difteria y el tétanos que contenía 50 μg de timerosal (o 25 μg de etilmercurio) a los 11 meses de edad. La tabla 1 muestra la pauta de vacunación y las cantidades acumuladas de etilmercurio, el metabolito mercurial timerosal, administradas a los lactantes en el ensayo según la edad. Estos niños no recibieron otras dosis de vacunas que contuvieran timerosal hasta los 6 años de edad, cuando recibieron una dosis de recuerdo de la vacuna contra la difteria y el tétanos o de la vacuna DTaP, según la pauta de vacunación italiana. Por lo tanto, en los 12 primeros meses de vida, la recepción acumulada de etilmercurio, el metabolito mercurial de timerosal, fue de 137,5 μg en los niños asignados aleatoriamente a recibir la vacuna DTaP que contenía timerosal (“grupo de mayor administración”) y de 62,5 μg para los que recibieron la vacuna DTaP sin timerosal (“grupo de menor administración”).
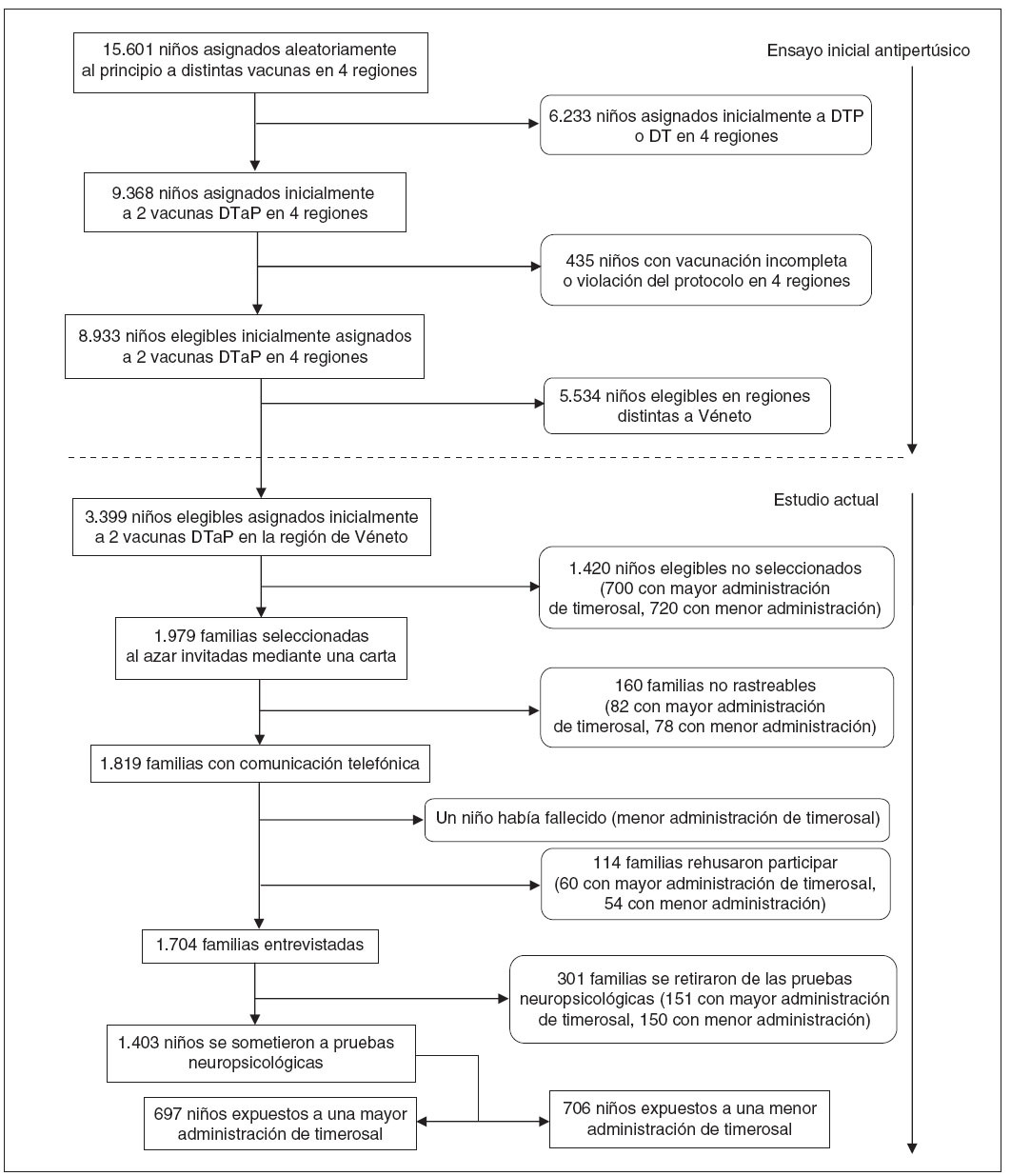
Fig. 1. Proceso de selección de la población de estudio. DT: vacuna contra la difteria y el tétanos; DTaP: vacuna acelular contra la difteria, el tétanos y la tos ferina; DTP: vacuna celular contra la difteria, el tétanos y la tos ferina.
TABLA 1. Exposición a etilmercurio mediante timerosal según el grupo y la edad
Inclusión y valoración neuropsicológicaLa población de estudio de este estudio incluyó a los niños que vivían en la región del Véneto y habían sido vacunados con 3 dosis de una de las 2 vacunas DTaP durante el ensayo. Se tomó progresivamente una muestra aleatoria de los 3.399 sujetos inicialmente incluidos en el ensayo en esta región, hasta conseguir el tamaño deseado de la muestra. Se remitió a los padres una carta de invitación; una vez que otorgaron por escrito el consentimiento informado fueron entrevistados telefónicamente por enfermeras entrenadas para actualizar la información sobre la historia clínica y las características sociodemográficas de los niños. Se programó una visita para la administración de las pruebas neuropsicológicas a los niños. No se ofreció incentivo económico a los participantes. Uno de los 10 psicólogos entrenados (que desconocía el tipo de vacuna que recibió cada niño) administró las pruebas durante una sola sesión de 2 h durante el horario escolar habitual.
Se administraron 11 pruebas neuropsicológicas, que habían sido seleccionadas en estudios anteriores3,21, a los niños incluidos. Las pruebas exploraron áreas de la función cognitiva supuestamente afectadas por la exposición a timerosal, eran adecuadas a la edad y habían sido normalizadas para la población italiana. Se valoraron los siguientes dominios: 1) memoria y aprendizaje, con la California Verbal Learning Test-Children Version22 y la prueba de recuerdo de cifras23 Wechsler Intelligence Scale for Children-Revised (WISC-R); 2) la atención, con la prueba de rendimiento continuo (versión de Conners), una prueba informatizada que valora la atención sostenida, la inhibición y la impulsividad24; 3) las funciones ejecutivas, con la prueba de codificación23 WISC-R y la prueba de fluidez verbal fonémica, que valora la capacidad de acceder a un léxico mediante claves fonémicas y fijar las oportunas estrategias de búsqueda verbal25; 4) las funciones visuoespaciales, con la prueba del diseño de bloques23 WISC-R; 5) el lenguaje, con las pruebas de vocabulario y de similitudes23 WISC-R, el Boston Naming Test26, y la prueba de fluidez verbal semántica, que valora la capacidad de acceder a un léxico según las categorías semánticas25, y 6) las habilidades motoras, con la prueba del golpeteo digital27, que ofrece una valoración de la velocidad y la coordinación de la motilidad fina, y la prueba de praxis escrita28, que mide la velocidad de escritura del niño.
El autismo se consideró como un resultado distinto del estudio y fue evaluado mediante la revisión de la historia clínica con los padres y los registros médicos de los pediatras de la familia, según los criterios del Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition29. Los psicólogos buscaron cualquier tic motor o fónico mediante la observación directa de los niños durante las valoraciones neuropsicológicas. Los psicólogos se entrenaron en el reconocimiento de los comportamientos de tic y se crearon 2 variables binarias para indicar la presencia de tics motores y fónicos.
Los niños tenían de 10 a 12 años de edad al realizar las evaluaciones neuropsicológicas, entre finales de 2003 y comienzos de 2005. Los comités de ética del Istituto Superiore di Sanità y de la región de Véneto aprobaron el estudio.
Recogida de otras informacionesLas variables sociodemográficas y la información sanitaria de todos los niños incluidos en el presente estudio, al nacer y en la lactancia, se tomaron de la base de datos del ensayo inicial. Las alteraciones médicas identificadas durante las entrevistas telefónicas y los tratamientos relevantes se verificaron con los pediatras de la familia mediante la revisión de los registros médicos locales. Se tomó la siguiente información de cada niño: sexo, peso al nacer, edad gestacional, edad de la madre en el parto, inmunoglobulinas Rh durante el embarazo, vacunación contra la hepatitis B al nacer, tipo de parto, duración de la lactancia materna, composición de la familia, años de escolarización de los padres, presencia de enfermedades del sistema nervioso central u otras enfermedades crónicas, y la prescripción actual de antihistamínicos o de antiepilépticos.
Tamaño de la muestra y análisis de los datosSe comparó a los 2 grupos de niños (de mayor y menor recepción de timerosal) respecto a 24 resultados neuropsicológicos.
Suponiendo que los niños del grupo de menor recepción tuvieron unas puntuaciones medias de las pruebas neuropsicológicas iguales a los valores de referencia, un tamaño de muestra de 700 niños en cada grupo (de un total de 1.400 niños) sería suficiente para ofrecer un poder estadístico del 90% para identificar diferencias de al menos ± 5%, con un valor de significación del 5% en una prueba bilateral.
Evaluamos las diferencias entre los grupos mediante el empleo del test t de Student para variables continuas. La diferencia entre las puntuaciones medias de la prueba neuropsicológica, con intervalos de confianza (IC) del 95%, se utilizó como medida del tamaño del efecto. Se utilizó el test U de Mann y Whitney para validar los resultados en los casos de violación de la normalidad y en presunciones de homoscedasticidad. Se utilizó el test χ2 o el de la probabilidad exacta de Fisher en las variables categóricas. También calculamos las razones de riesgo (RR), con los IC 95%, para evaluar la asociación entre la exposición a timerosal y la presencia de tics en condiciones univariadas.
Realizamos análisis de regresión separados, ordinarios, de mínimos cuadrados, multivariados, lineales, utilizando la puntuación bruta de cada prueba como la variable dependiente, para evaluar la asociación entre la administración de timerosal y los resultados de las pruebas neuropsicológicas, con ajuste respecto a los siguientes factores de posible confusión: edad a la administración de la prueba, sexo, peso al nacimiento, edad gestacional, tipo de parto, duración de la lactancia materna, composición de la familia, edad de la madre al parto, escolarización de los padres, presencia de enfermedades del sistema nervioso central o de otras enfermedades crónicas, prescripción actual de antihistamínicos o antiepilépticos, inmunoglobulinas Rh durante el embarazo y vacunación contra la hepatitis B al nacer. Se utilizaron los coeficientes de regresión estándar (CRE) como medida del tamaño del efecto, donde el CRE representó la diferencia cuantitativa en las puntuaciones del resultado, expresada en unidades DE, para el grupo de menor administración de timerosal frente al de mayor administración. También valoramos el efecto de la exposición a timerosal en análisis separados según el sexo. En los análisis secundarios realizamos los análisis de regresión logística utilizando como variable dependiente la presencia de tics motores y fónicos. La RR ajustada se utilizó como medida del tamaño del efecto. Durante los análisis estadísticos se ocultó la cantidad de la exposición a timerosal en los 2 grupos de estudio. No corregimos respecto a las comparaciones múltiples para mantener la máxima sensibilidad posible durante los análisis estadísticos.
RESULTADOSSe remitió la carta de invitación a 1.979 familias de la cohorte regional de 3.399 (fig. 1). No pudimos comunicarnos telefónicamente con 160 familias (8,1%), de las 1.819 familias restantes, 114 (6,3%) declinaron la participación y un niño (0,05%) había fallecido. Se realizó la entrevista telefónica con las 1.704 familias restantes (87,9% de la población elegible). Mediante las entrevistas telefónicas con los padres y las revisiones de las historias clínicas detectamos un caso de autismo entre los 856 niños del grupo de menor administración de timerosal y ninguno entre los 848 niños del grupo de mayor administración de timerosal.
Trescientos un niños de las 1.704 familias entrevistadas no se sometieron a la valoración neuropsicológica. Por lo tanto, 1.403 niños (70,9%) fueron incluidos en el análisis, 697 en el grupo de mayor administración y 706 en el de menor administración.
Las proporciones de familias cuyo hijo no se sometió a las pruebas neuropsicológicas no difirieron significativa-mente entre los 2 grupos. Los padres no llevaron a evaluar a sus hijos por las siguientes razones: falta de tiempo para participar, temor de que el niño se sienta incómodo durante la evaluación o falta de cumplimiento con la cita para las pruebas (grupo de mayor administración: n = 150; grupo de menor administración: n = 146); en algunos casos, el niño tenía alguna alteración médica (grupo de menor administración: epilepsia, n = 1; autismo, n = 1; leucemia, n = 1; retinitis pigmentaria, n = 1; grupo de mayor administración: traumatismo craneal, n = 1).
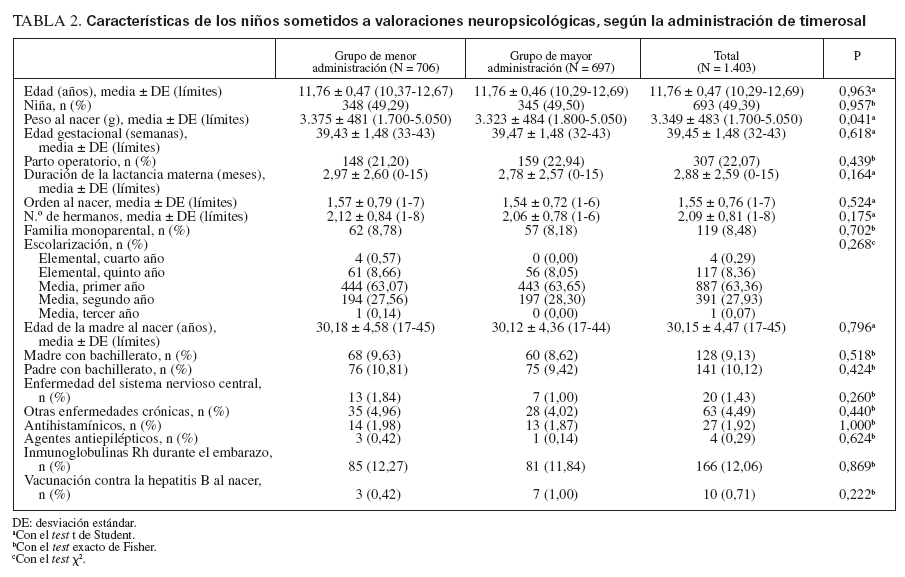
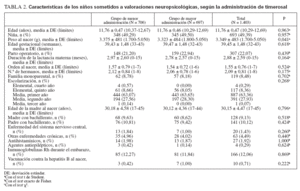
La tabla 2 cita las características de los 1.403 niños sometidos a valoraciones neuropsicológicas. Los 2 grupos fueron similares respecto a las características socio-demográficas, las características clínicas y el grado de escolarización de los padres, mientras que el peso al nacimiento fue ligeramente menor en el grupo de mayor administración.
TABLA 2. Características de los niños sometidos a valoraciones neuropsicológicas, según la administración de timerosal
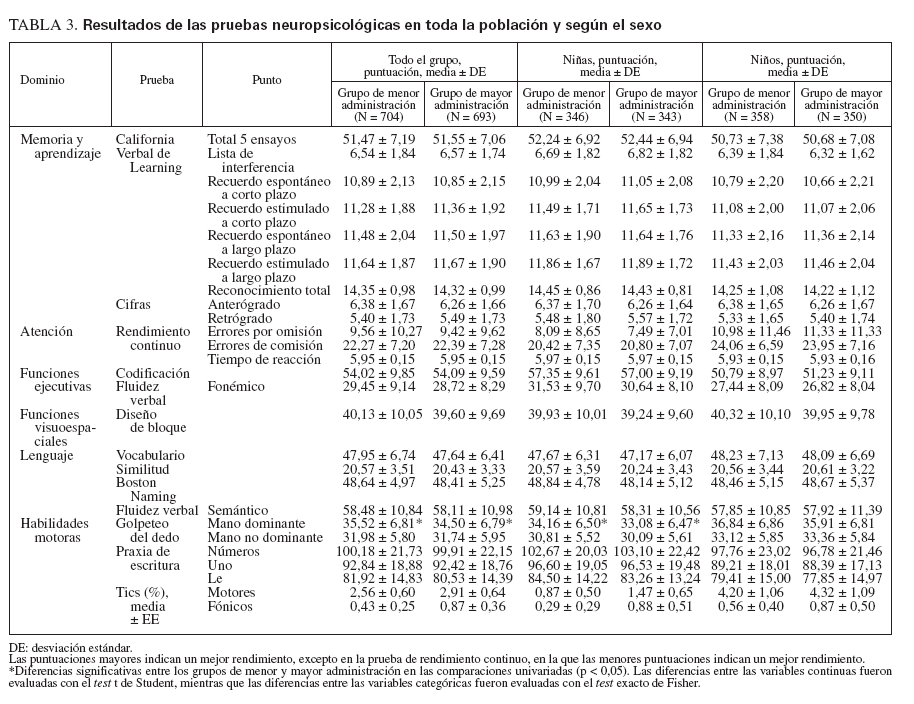
La tabla 3 informa de la media y la DE de las puntuaciones de cada prueba neuropsicológica según la exposición a timerosal de toda la población incluida en el estudio y dividida por sexo. Todas las puntuaciones medias estuvieron en la gama normal según los patrones de re-ferencia23-28, y los grupos de estudio fueron similares con respecto a casi todos los resultados neuropsicológicos. Los niños del grupo de mayor administración tuvieron un rendimiento significativamente peor que los del grupo de menor administración sólo en la prueba del golpeteo del dedo con la mano dominante, aunque la diferencia de las puntuaciones medias fue modesta (diferencia: 1,01; IC 95%: 0,30-1,73; p = 0,006, test t de Student). Se observaron tics motores en el 2,56% de los pacientes del grupo de menor administración de timerosal y en el 2,91% de los pacientes del grupo de mayor administración (RR: 1,13; IC 95%: 0,60-2,13; p = 0,744, test de probabilidad exacta de Fisher). Se detectaron tics fónicos en el 0,43% de los pacientes del grupo de menor administración y en el 0,87% de los pacientes del grupo de mayor administración (RR: 2,04; IC 95%: 0,51-8,13; p = 0,338, test de probabilidad exacta de Fisher).
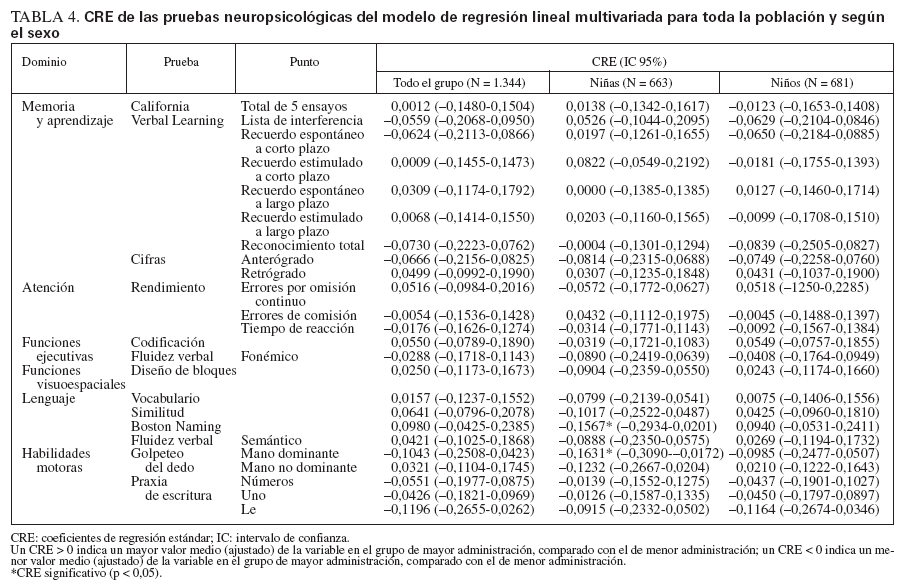
TABLA 3. Resultados de las pruebas neuropsicológicas en toda la población y según el sexo
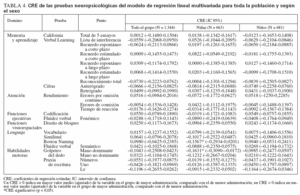
Las niñas del grupo de mayor administración rindieron significativamente peor que las del grupo de menor administración en la prueba del golpeteo del dedo con la mano dominante (diferencia de las puntuaciones: 1,08; IC 95%: 0,11-2,05; p = 0,029, test t de Student) (tabla 3). En los análisis multivariados no encontramos asociación alguna estadísticamente significativa en el grupo global ni en el de varones (tabla 4). Encontramos un peor rendimiento en el grupo de mayor administración en el Boston Naming Test (CRE: –0,16; p = 0,025) y en la prueba del golpeteo del dedo con la mano dominante (CRE: –0,16; p = 0,029) en las niñas. Finalmente, no encontramos asociación significativa en los análisis de regresión logística de los tics fónicos y motores, tanto en toda la población como según el sexo.
TABLA 4. CRE de las pruebas neuropsicológicas del modelo de regresión lineal multivariada para toda la población y según el sexo
ANÁLISISUno de los principales problemas en la evaluación de los efectos de la exposición a timerosal durante la lactancia sobre el desarrollo neuropsicológico estriba en identificar los grupos de niños con buenos registros de vacunación, los que recibieron distintas cantidades de timerosal y los que, muchos años después, todavía son comparables respecto a la aparición de factores que pueden afectar al desarrollo neuropsicológico. En este sentido, nuestra población de estudio, como subgrupo de niños que habían participado en el Italian Trial on Pertussis Vaccines, tiene varias ventajas, especialmente las siguientes: 1) los niños pertenecieron a grupos que habían sido asignados aleatoriamente a recibir distintas exposiciones a timerosal mediante las vacunas del primer año de la vida, 2) los niños no recibieron otras vacunas que contuvieran timerosal hasta los 6 años de edad, 3) las vacunas fueron administradas según normas estrictas y se controlaron meticulosamente, 4) los registros de vacunación fueron muy exactos, se tomaron en condiciones de un ensayo clínico riguroso y 5) los niños fueron controlados activamente durante 6 años. Además, la población italiana tiene poca movilidad poblacional, lo que contribuyó a la gran tasa de respuesta 10 años después de la inclusión en el estudio inicial. Además, el currículo escolar hasta los 13 años de edad está normalizado en todo el país, y los niños tuvieron experiencias de aprendizaje similares. Finalmente, las valoraciones neuropsicológicas y los análisis estadísticos se realizaron en condiciones ocultas respecto a la exposición a timerosal.
Según nuestros resultados, la mayor exposición a timerosal mediante las vacunas administradas en el primer año de vida se asoció de forma significativa con las menores puntuaciones de 2 resultados neuropsicológicos, en los dominios de la función motora (prueba del golpeteo del dedo) y del lenguaje (Boston Naming Test), entre las niñas. Sin embargo, las diferencias de las puntuaciones medias fueron muy pequeñas y de dudosa relevancia clínica. También se observaron diferencias neuropsicológicas en los dominios del lenguaje y, en menor medida, de las funciones motoras en una cohorte de niños expuestos prenatalmente al metilmercurio21, aunque la comparación directa puede ser inadecuada porque el etilmercurio, el metabolito de timerosal, tiene aspectos toxicocinéticos específicos14,30. Hasta ahora, los efectos del timerosal en las vacunas no han ofrecido un patrón claro de asociaciones, y muchos autores encuentran resultados del desarrollo neurológico aún mejores en los niños expuestos a timerosal4,7,9. Un estudio del Vaccine Safety Datalink3 y un reciente estudio en 4 organizaciones asistenciales estadounidenses9 encontraron asociación entre el timerosal contenido en las vacunas y los retrasos del lenguaje. Sin embargo, en el último de estos estudios, el resultado del Boston Naming Test no se alteró por la exposición a timerosal. No pudimos observar asociaciones con los tics, al contrario que los hallazgos de algunos estudios de observación3,4,9.
Como no corregimos por las comparaciones múltiples en los análisis estadísticos, esperamos encontrar 4 asociaciones significativas en los 78 tests estadísticos univariados con un valor de significación del 5% (tabla 3), y 4 en los 72 análisis multivariados (tabla 4) por efecto del azar. Como sólo encontramos 2 asociaciones significativas entre la exposición a timerosal y los resultados neuropsicológicos, las asociaciones observadas podrían reflejar en realidad los efectos del azar. Además, las asociaciones se basaron en pequeñas diferencias de puntuaciones, sólo se detectaron en las niñas y no fueron congruentes con los resultados de otros estudios.
En la interpretación de nuestros resultados se debe tener en cuenta ciertas limitaciones. La administración acumulativa de timerosal fue relativamente escasa, comparada con la de otros países, incluyendo Estados Unidos, donde las pautas de vacunación incluyen más vacunas que contienen timerosal en el primer año de vida. Además, no hubo grupo de comparación sin exposición a timerosal, aunque nuestro marco fue adecuado para identificar un efecto de respuesta a la dosis en ausencia de una prueba que indica una dosis umbral para la observación de un efecto. Nuestro análisis sólo incluyó a los niños sanos que fueron seleccionados durante la inclusión en el ensayo inicial, y algunas familias pudieron declinar su participación en este estudio porque sus hijos tenían problemas del desarrollo cognitivo. Esto podría haber disminuido la prevalencia de las situaciones neuropsicológicas adversas y dificultar la detección de posibles diferencias. Los criterios de selección del ensayo original también limitaron la participación de los niños de bajo peso al nacimiento, y sólo 55 niños con peso al nacimiento < 2.500 g fueron sometidos a la valoración neuropsicológica (datos no ofrecidos). Además, sólo el 1% de los niños de este estudio recibió la vacuna contra el virus de la hepatitis B al nacer. Aunque el análisis multivariado no detectó un efecto del peso al nacimiento según la administración de timerosal, nuestro estudio no tuvo potencia suficiente para detectar una asociación entre la exposición a timerosal y el desarrollo neuropsicológico en los lactantes de bajo peso al nacimiento.
CONCLUSIONESNingún estudio de los realizados hasta ahora pudo ofrecer pruebas concluyentes de un efecto del timerosal sobre el desarrollo neuropsicológico. Los juicios finales acerca de esta asociación deben basarse sobre el conjunto global de resultados de los estudios realizados en distintos marcos y con diferentes grados de validez y en la coherencia de los resultados. La falta de congruencia entre los resultados de nuestro estudio y los de otros estudios indica que la asociación entre la exposición a time-rosal mediante la vacunación durante la lactancia y las deficiencias neuropsicológicas es poco probable o clínicamente despreciable. Nuevos datos de poblaciones con gamas más amplias de exposición a timerosal y otras valoraciones neuropsicológicas pueden ayudar a aclarar las posibles asociaciones entre el timerosal y los resultados del desarrollo neurológico.
AGRADECIMIENTOSEl estudio fue financiado parcialmente por los US Centers for Disease Control and Prevention, mediante el contrato 2002-N-00448 con el Istituto Superiore di Sanità.
Damos las gracias a las autoridades sanitarias regionales de Véneto, a todas las familias que participaron en el Italian Trial on Pertussis Vaccines, los miembros del personal de las escuelas infantiles y los pediatras de la región del Véneto, que contribuyeron a la logística y la realización de las valoraciones neuropsicológicas. También damos las gracias a los miembros del personal, que fueron financiados con las becas de los US Centers for Disease Control and Prevention, incluyendo a los consultores (Michela Cendron y Bernardo dalla Bernardina), los psicólogos (Katia Battistella, Alessia Ciccola, Francesca Gnoato, Laura Mattiuzzi, Sonia Mele, Andrea Melendugno, Francesca Offredi, Davide Paganini, Sara Prioni, Gabriella Scala e Irene Spera) y a las enfermeras del estudio (Gianna Ceccato, Liliana Cortese, Mara Girelli, Nadia Grandin, Ave Marchesin, Loretta Meneghin y Emma Nami), sin cuya ayuda no hubiera sido posible realizar un estudio de tal tamaño. También agradecemos a Francesca Romana Meduri, del Istituto Superiore di Sanità, el manejo administrativo del contrato, a Mark Kanieff su ayuda en la revisión del manuscrito y a Nancy Binkin, MD, su amable y eficaz apoyo. Durante el contrato, el Dr. Tozzi se trasladó del Istituto Superiore di Sanità al Bambino Gesù Hospital, manteniendo su papel de investigador principal.
Correspondencia: Alberto E. Tozzi, MD, Epidemiology Unit, Bambino Gesù Hospital, Piazza S. Onofrio 4, 00165 Roma, Italia.
Correo electrónico: alberto.tozzi@gmail.com