Desde hace mucho tiempo, se reconoce que los fármacos estimulantes simpaticomiméticos (es decir, las diversas formas de metilfenidato y anfetamina) son el tratamiento más eficaz y mejor documentado del trastorno por déficit de atención con hiperactividad (TDAH). El TDAH es un síndrome del neurodesarrollo, caracterizado por la falta de atención crónica, facilidad para distraerse, impulsividad e hiperactividad incesante1-3, que deteriora el funcionamiento en el hogar, en la escuela y en la comunidad (y, con frecuencia, más tarde, en la vida laboral y conyugal). Los estimulantes han sido la clase de fármacos de elección para este síndrome desde 1937, cuando Bradley4 describió una mejora tanto conductual como en el ámbito académico con la administración de estimulantes a niños con alteraciones conductuales y emocionales. Las directrices de consenso establecidas por los expertos continúan respaldando la administración de fármacos estimulantes como tratamiento de primera línea del TDAH5,6. El cociente ries-go:beneficio es muy favorable y está bien documentado, como se demostró en un metaanálisis publicado en 1996, que evaluó 155 estudios controlados, efectuados en 5.768 niños, adolescentes y adultos. Spencer et al1 documentaron una eficacia media del 70% para los fármacos estimulantes. En representación del Council on Scientific Affairs for the American Medical Association, Goldman et al7 concluyeron que, con una titulación apropiada de la dosis, hasta el 90% de niños con un diagnóstico correcto del trastorno responderán, como mínimo, a un estimulante sin experimentar importantes efectos adversos.
Por desgracia, los estimulantes fabricados originalmente (es decir, las formulaciones de liberación inmediata) se caracterizan por una semivida breve y una duración limitada del efecto, lo que hace que el control de los efectos de la medicación durante el día sea difícil. La necesidad de administrar una dosis a mediodía en la escuela hace que las formulaciones de estimulantes de liberación inmediata sean tanto de coste elevado como estigmatizantes para el paciente pediátrico, los padres y la escuela. Además, se ha prestado a las críticas del público y ha sido el blanco de algunas críticas políticas desde algunos ámbitos. La necesidad de recordar la hora exacta en que debe repetirse la dosis es especialmente problemática y poco práctica para un trastorno para el que uno de los 18 síntomas definitorios es la mala memoria en las actividades de la vida diaria (DSM-IV-TR).
Como respuesta a estos problemas, se han desarrollado una serie de preparados de liberación modificada y de sistemas de distribución para compensar la curva diurna y eliminar la necesidad de tomar una dosis durante la jornada lectiva. Estos desarrollos incluyen comprimidos revestidos de una cubierta-film u otras formas de comprimidos de liberación modificada; microesferas encapsuladas con una cubierta de liberación diferida; un sistema de distribución osmótica por vía oral; una nueva molécula de acción más prolongada (la atomoxetina), una molécula de d-anfetamina conjugada (lisdexanfetamina) y un parche transdérmico (sistema transdérmico de metilfenidato) (STM).
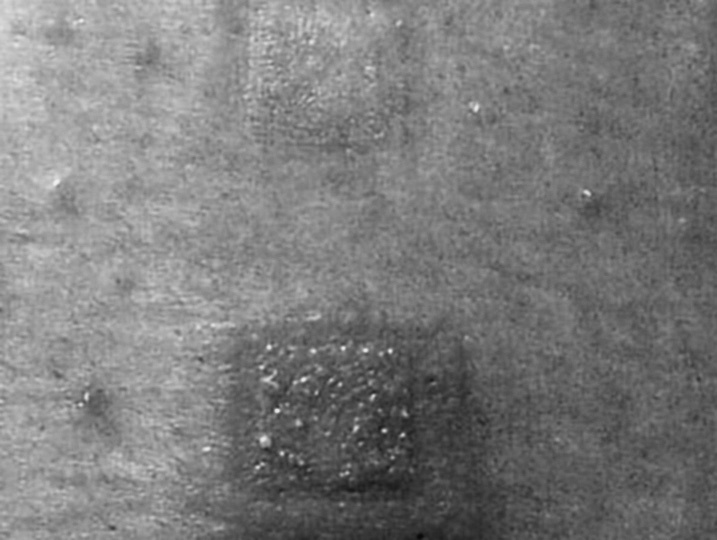
El uso de estos nuevos preparados estimulantes de acción prolongada por vía oral sólo requiere un ligero cambio del modo de pensar del médico (esencialmente agregar dosis de un preparado de acción corta dos veces o tres veces al día a una dosis de un preparado de acción prolongada, administrada por la mañana). Sin embargo, el tratamiento del TDAH utilizando el parche STM incluye un cambio del paradigma en la forma de pensar: desde una dosis oral fija, no recuperable administrada en mg/día, a una formulación transdérmica flexible, que se retira, prescrita en función del ritmo horario de distribución del fármaco (es decir en mg/h) y el tiempo ajustable de uso del parche (total de mg/día). La ventaja de conocer este cambio de paradigma es la mayor flexibilidad y control sobre la cronología del efecto clínico, duración de los beneficios y efectos adversos, la posible evitación de algunos problemas gastrointestinales, y una distribución sistémica del fármaco más uniforme que con la mayor parte de tratamientos por vía oral8. Según es característico de la distribución transdérmica de fármacos, comparado con la administración oral8, durante el período de uso los parches STM se caracterizan por una absorción y biodisponibilidad sistémica más constantes que la mayor parte de preparados administrados por vía oral9. En la tabla 1 se citan algunas de las ventajas y desventajas del parche STM en relación con los preparados orales de acción prolongada.
TABLA 1. Ventajas y desventajas del parche STM
Posiblemente una ventaja de este parche es un menor potencial de abuso. Algunos padres temen que el uso de fármacos estimulantes aliente en su hijo el consumo de drogas.
Los médicos pueden tranquilizarlos indicándoles que no se han publicado pruebas de que el tratamiento estimulante de este trastorno de la infancia se asocie con un mayor riesgo de un ulterior consumo de drogas o abuso de fármacos. Se han puesto en duda las afirmaciones de que en realidad el tratamiento precoz con estimulantes sería protector frente a un posterior consumo de dro-gas/abuso10-12. La mayor parte de estimulantes de acción prolongada administrados por vía oral disuaden la conducta de prensar y esnifar o inyectarse droga (los métodos preferidos de consumo); pero, con cierto esfuerzo, las microesferas de liberación inmediata pueden separarse del comprimido de liberación inmediata o el 22% de la cubierta puede disolverse en el comprimido de distribución osmótica. La incorporación del metilfenidato en un STM adhesivo es más eficaz para disuadir al paciente de esnifar o inyectarse. Sin embargo, en este momento carecemos de datos empíricos que respalden estas expectativas.
Los candidatos más evidentes del parche transdérmico incluyen los pacientes con problemas para tragar comprimidos, aquellos con un metabolismo o una absorción enteral rápida o imprevisible, aquellos que experimentan malestar gastrointestinal a partir de preparados orales, aquellos para los que no es suficiente la duración del efecto de los preparados por vía oral de acción prolongada y aquellos que necesitan una flexibilidad en la duración del efecto de un día a otro. Aunque se estima que un 26% de adultos tienen dificultades para tragar comprimidos, la proporción de niños con este problema se considera incluso mayor9,13,14. Los comprimidos masticables y la suspensión oral de metilfenidato son posibles alternativas en niños que tienen dificultades para tragar comprimidos, pero estas formulaciones son de liberación inmediata sin la comodidad y la regularidad de la administración de una vez al día. Espolvorear las microesferas de las cápsulas de acción prolongada en la comida del niño (p. ej. compota de manzana, helado, budín) puede ser problemático para los niños que ponen objeciones a su sabor mientras comen o que no pueden evitar masticarlas. Las cápsulas de atomoxetina pueden abrirse con una disolución del polvo en infusiones, caldo, o simplemente agua pero en ocasiones el sabor continúa siendo inaceptable.
En el presente artículo se revisan las estrategias de tratamiento clínico para obtener un beneficio óptimo del nuevo sistema de distribución del metilfenidato. Se abordan tres principales categorías de problemas: 1) los relacionados con el inicio, dosificación y control de la evolución diaria del beneficio clínico; 2) los relacionados con la selección del lugar de aplicación del parche y las técnicas de aplicación; y 3) los relacionados con la higiene cutánea. Las tres categorías necesitan una educación del médico, el paciente y los padres/cuidador.
DOSIFICACIÓN Y CONTROL DE LA EVOLUCIÓN DEL EFECTOAunque los preparados de metilfenidato por vía oral de acción prolongada sólo ofrecen la manipulación de la dosis como método de titulación, el parche STM ofrece la manipulación tanto de la tasa de distribución horaria del fármaco como el tiempo de uso como posibles medios de dosificarlo hasta una exposición clínica óptima. La “dosis” del parche tiene dos componentes independientes: el tamaño del parche, que varía desde 12,5 cm2 (nominalmente 10 mg) hasta 37,5 cm2 (nominalmente 30 mg) y un tiempo de uso ajustable, que, en conjunto, determinan los miligramos de metilfenidato absorbidos al día por un paciente dado. Naturalmente, la variación interpaciente de las tasas de absorción también afecta a la dosis eficaz y ha de considerarse con independencia de que la vía de absorción sea la piel o la mucosa intestinal. Las diferencias de la absorción cutánea se reducen a un mínimo mediante una selección sistemática de los lugares de aplicación proximales para cada paciente (cadera). Los lugares distales (brazo, pierna) se caracterizan por una mayor variabilidad de absorción tanto entre como intrapaciente.
Al igual que con los preparados orales de metilfenidato, el médico debe iniciar el tratamiento de los pacientes pediátricos nunca tratados con estimulantes, en particular aquellos con un bajo índice de masa corporal, con la cantidad conveniente más baja, el parche STM de 12,5 cm2. Con este tamaño, un tiempo de uso de 9 h representa una dosis diaria total nominal de alrededor de 10 mg pero ésta produce el mismo efecto que 15 mg (5 mg tres veces al día) por vía oral porque evita el metabolismo hepático de primer paso. Esto es aproximadamente igual a una cápsula de distribución osmótica de 18 mg que no se absorbe por completo. Aunque no se recomienda en el prospecto incluido en el envase, el tratamiento puede iniciarse con parches más grandes para pacientes que eran tratados con dosis orales de más de 20 mg/día. Por ejemplo, el parche de 18,75 cm2 distribuye una dosis nominal de 15 mg en 9 horas de uso, que produce el mismo efecto que una cápsula osmótica de 27 mg o un preparado de microesferas encapsuladas de 20 mg. En la tabla 2 se citan las dosis del parche STM que se han investigado y sus equivalentes aproximados de metilfenidato de liberación inmediata por vía oral.
TABLA 2. Equivalentes aproximados de dosis diaria suponiendo un tiempo de uso de 9 h
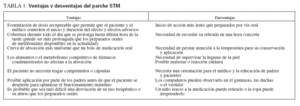
Inicialmente debe ensayarse un tiempo de uso de 9 h (fig. 1) que se aumentará o disminuirá de acuerdo con lo rápidamente que el efecto se desvanezca después de retirar el parche (habitualmente unas 3 h). En general, la retirada del parche 3 h antes de acostarse se traduce en un tiempo de uso apropiado, que suele ser de 9-11 h para niños en edad escolar, a pesar de que el parche puede usarse durante hasta 16 h si se requiere un efecto prolongado8. Es útil retirarlo mucho antes de la hora de acostarse para que el niño tenga buen apetito al tomar un tentempié a la hora de acostarse. El efecto clínico se evalúa al cabo de una semana, y, si los resultados son insuficientes durante la mañana y la tarde, se aumenta el tamaño del parche. Si el beneficio clínico es satisfactorio durante la jornada lectiva pero no por la noche, ésta se cubre simplemente aumentando el tiempo de uso sin cambiar el tamaño del parche. Es preciso recordar que prolongar el tiempo de uso sin cambiar el tamaño del parche aumenta la dosis diaria.
Fig. 1. Algoritmo del control clínico del parche STM.
La supervisión sistemática de los efectos clínicos y secundarios sigue siendo un componente esencial del tratamiento y contribuirá a la titulación de la dosis. La American Academy of Pediatrics (AAP), junto con la National Initiative for Children’s Healthcare (NICHQ), desarrolló un instrumento que facilita el diagnóstico del síndrome y la monitorización sistemática del tratamiento15.
Si el beneficio clínico es satisfactorio pero se ve dificultado por la interferencia con el sueño u otros efectos adversos a última hora del día, el tiempo de uso puede reducirse gradualmente hasta cualquier otro que permita la supresión del efecto adverso. Sin embargo, es preciso destacar que los efectos adversos, como el insomnio y la anorexia, documentados con todos los estimulantes al inicio del tratamiento, se resuelven con el uso repetido, incluso sin cambios del tiempo de uso en el 40-60% de casos16,17. Este hallazgo coincide con los resultados descritos para la administración oral. Algunos niños presentan un metabolismo tan lento que un tiempo de retirada a las 3-4 de la tarde y el período posterior de descanso farmacológico proporcionan una duración suficiente del efecto. En cada evaluación semanal, debe tomarse una decisión acerca tanto del tamaño del parche (mg/h) como del tiempo de uso (total de mg/día), en función de la respuesta de cada paciente, hasta obtener el tamaño y la duración de uso del parche óptimos.
Si no se encuentra el tamaño óptimo entre los disponibles comercialmente, la pregunta que naturalmente se plantea es si podría obtenerse con una “fabricación casera” un tamaño intermedio recortando el de mayor tamaño. Los protocolos en los estudios previos a la comercialización no permitieron esta estrategia y, en consecuencia, no se disponen de pruebas que la respalden. Sin embargo, no existe ninguna razón lógica por la que no pueda ponerse en práctica, puesto que el metilfenidato está dispersado uniformemente por todo el adhesivo. Si se efectúa, las esquinas deben redondearse para impedir que el parche quede oculto en la ropa. Una vez se determinan el tamaño y tiempo de uso correctos del parche para el paciente individual, se requiere una evaluación cada 2 semanas durante un mes (incluida la inspección del lugar donde se ha adherido el parche), y, acto seguido, cada mes.
Merece una consideración especial el comienzo y el final del día. Al igual que las medicaciones orales de liberación modificada, la distribución transdérmica de metilfenidato (en particular, en las dosis iniciales) puede caracterizarse por un inicio algo más lento del efecto clínico que el de los preparados orales de acción corta (liberación inmediata). Para compensar este inicio más lento, el parche debe aplicarse algo más temprano por la mañana de lo que se administraría un preparado oral de liberación inmediata. Es importante observar que el parche no tiene tendencia a interferir con el apetito del niño a la hora del desayuno si su aplicación precede a dicha comida en menos de una hora. En un niño que manifiesta dificultades significativas por la mañana antes de la medicación, los padres pueden aplicar el parche antes de que se despierte, para que, al levantarse, esté presente un cierto efecto terapéutico.
SELECCIÓN DEL LUGAR Y APLICACIÓN DEL PARCHEEl parche de STM está diseñado para usarse en la cara lateral de la cadera, debajo de la ropa interior y evitando la línea de la cintura. En el prospecto incluido en el envase se ilustra el lugar y el proceso de aplicación. La colocación del parche STM en la cara lateral de la cadera cumple la doble finalidad de ocultarlo y estandarizar la tasa de absorción previsible. Es importante destacar que la absorción se produce a ritmos diferentes en las distintas regiones corporales y la variabilidad de un paciente a otro e intrapaciente es mayor en las áreas distales comparadas con las proximales. Una absorción óptima depende del mantenimiento de la higiene e integridad de la piel en el lugar de aplicación del parche así como del uso de técnicas de colocación apropiadas.
Es importante que el parche se coloque en lugares donde la ropa y otras prendas ajustadas, en particular los cinturones, no puedan rozarlo. Además de causar irritación, esta abrasión puede dar lugar al desprendimiento o enrollado del parche sobre sus bordes interfiriendo con su absorción. El parche debe aplicarse sobre la piel seca, limpia e intacta, libre de polvos, aceites, lociones, cortes, abrasiones o irritación. Una ducha corriente es suficiente para satisfacer el requisito de “higiene”; el lugar donde está adherido el parche no debe frotarse o limpiarse con alcohol u otros agentes que puedan comprometer la integridad de la piel. Se puede dejar el contorno de adhesivo residual del parche (que recuerda a un aro para bañera o el de una “tirita”); aunque si padres o paciente desean retirarlo por razones estéticas, pueden hacerlo frotando con cuidado con un poco de algodón impregnado en aceite o una loción vegetal/mineral.
Para que la piel se recupere entre aplicaciones, es preciso alternar a diario los lugares de aplicación del parche y ambas caderas. A menos que el parche STM sea demasiado grande o la cadera demasiado pequeña, cada una se dividirá en dos lugares de aplicación (cara anterior lateral y cara posterior lateral), lo que produce un total de 4 lugares de aplicación y permite un intervalo de 3 días entre aplicaciones en un lugar concreto. Por lo tanto, la rotación del lugar de aplicación sería la siguiente: cara anterior derecha, cara anterior izquierda, cara posterior derecha, cara posterior izquierda y, acto seguido, vuelta a empezar. Una norma apropiada es dejar un dedo de ancho entre el lugar previo de aplicación y el actual. En ocasiones el niño es lo suficientemente corpulento y el tamaño óptimo del parche STM es lo suficientemente pequeño para dividir cada cadera en cuatro cuadrantes, lo que permite que cada sitio de aplicación del parche se utilice sólo una vez cada 8 días, pero este grado de complejidad sólo es necesario en los raros casos de sensibilidad sustancial de la piel. Es preciso evitar cualquier área propensa a los estiramientos o fruncimientos, como las superficies flexoras/extensoras (p. ej. el área inguinal o los glúteos), para impedir el malestar y la falta de adhesión del parche.
La manipulación apropiada del STM justo antes de la aplicación favorece una perfecta adhesión del parche. Los parches se suministran en un sobre cerrado herméticamente y están contenidos en bolsas individuales también cerradas herméticamente. Antes de la aplicación, debe enfriarse para facilitar la retirada de su funda protectora rígida (de 10 a 15 min en el frigorífico son útiles en la época estival aun cuando son aptos para conservarse a temperatura ambiente). La bolsa debe cortarse con cuidado de no dañar el parche STM, que se aplicará de inmediato tras retirarlo de aquélla. Se requiere precaución para no tocar la superficie adhesiva con los dedos. La mitad de la funda protectora rígida, que está predividida diagonalmente en dos secciones, puede eliminarse sin tocar directamente el adhesivo expuesto doblando primero el parche tres o cuatro veces para aflojar el ángulo agudo en la abertura. Si esta acción no es suficiente para aflojar el ángulo, se doblará y se ejercerá presión en la funda con un movimiento deslizante. Con la mitad intacta de la funda protectora como mango, se aplicará la superficie adhesiva expuesta del parche en el área seleccionada de la cadera, ejerciendo una firme presión sobre el lugar y alisándolo. Al mismo tiempo que se mantiene la mitad del parche ya adherido a la piel, se doblará el parche. Esta acción separará el ángulo agudo de la otra mitad de la funda protectora, y podrá extraerse con cuidado. Se efectuará una presión firme sobre el resto del parche y a continuación se alisará todo el parche STM. Después de la aplicación, se ejercerá presión sobre el parche y se calentará con la palma de la mano durante 30 s a un minuto para aumentar su adhesión. Diversos estudios han demostrado una buena adhesión del STM aplicado apropiadamente en ámbitos de campamentos de verano muy activos17,18 (p. ej., natación y deportes).
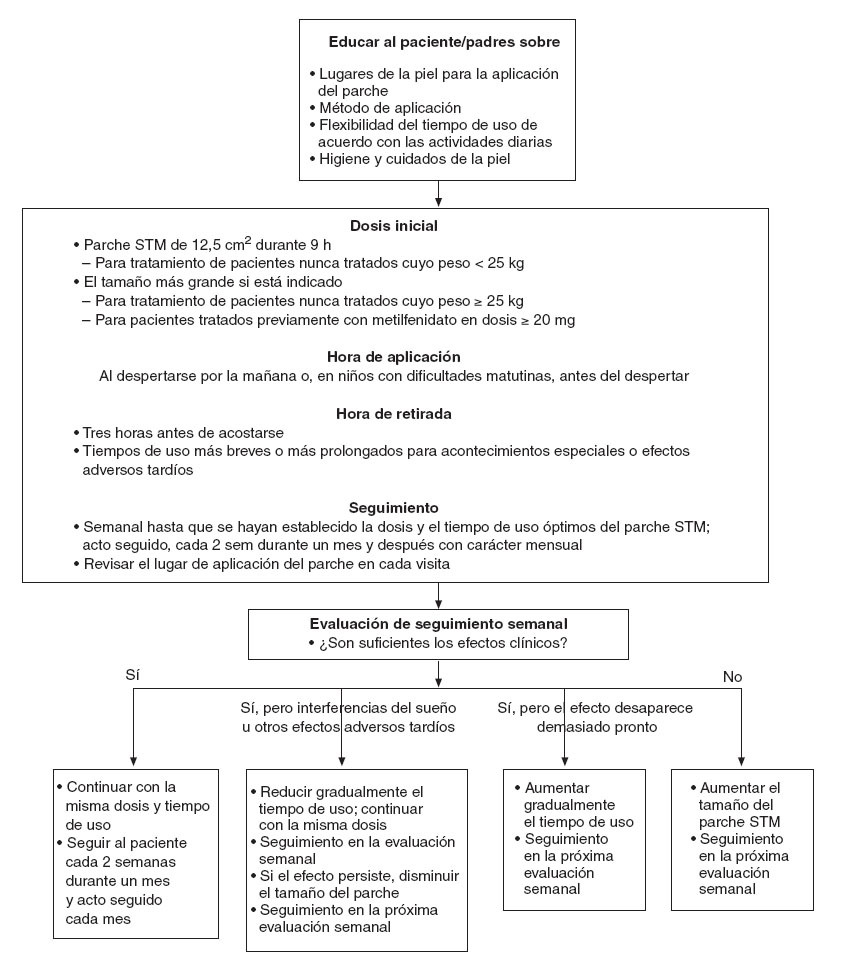
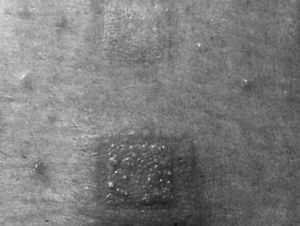
HIGIENE DE LA PIELEl metilfenidato, un estimulante simpaticomimético, es un ligero irritante que provoca una vasodilatación, induciendo un enrojecimiento (rubefacción) de la piel bajo el parche, que es normal y benigno desde un punto de vista clínico. Este eritema normal no debe confundirse con una erupción o exantema, o una reacción alérgica. La clave para identificar un eritema normal es que el enrojecimiento está confinado en el área del parche, es “plano”, sin edema o pápulas, y suele resolverse a las 24-36 h tras la retirada del parche. Se recomendará a los padres que, si el eritema persiste más de 2 días o se asocia con pápulas o edema, soliciten atención médica. En la figura 2 (de una prueba cutánea dermatológica y no una aplicación real del parche STM) se ilustra el tipo de reacción excepcional que debe traducirse en la terminación del tratamiento con el parche y el cambio por medicación oral.
A pesar de que los estimulantes no son alergenos conocidos habituales, es posible que el niño experimente una reacción alérgica al adhesivo (excepcional). Además, otras dermatitis tópicas o irritación mecánica rara vez son consecuencia de la aplicación y retirada repetidas del parche. Si el efecto es de la gravedad suficiente, se interrumpirá el tratamiento con el parche. Es importante mencionar que la mayoría de exantemas (dermatitis) y otras reacciones son prevenibles con una adhesión a las instrucciones de aplicación y prestando atención al mantenimiento de la integridad de la piel.
Además de la rotación de los lugares de adhesión del parche alternando las caderas y, si es posible, áreas específicas de cada cadera, pueden tomarse otras medidas para preservar la integridad de la piel. Se proporcionarán instrucciones a los padres y al niño sobre el aseo diario con jabones hidratantes para piel seca y sensible, no comedogénicos, y el uso de aceite vegetal o mineral para eliminar suavemente las resinas del adhesivo. La inclusión del niño en la discusión introduce un ritual para la retirada del parche parecido al de cepillarse los dientes. El médico recomendará que el paciente no se frote el área tras la retirada del parche y resista la tendencia natural a frotar los restos de adhesivo alrededor del contorno del parche. La abrasión producida por la fricción irrita más la piel que los restos de adhesivo. Pueden usarse emolientes como la vaselina para hidratar la piel y contribuir a su curación.
Fig. 2. Ilustración de una prueba cutánea dermatológica que compara una rubefacción benigna (parte superior), que sólo precisa una higiene apropiada de la piel, con una reacción con edema y pápulas (parte inferior), que indica la interrupción del tratamiento y un cambio por medicación oral
TABLA 3. Lista de control para pacientes y/o padres sobre el uso del parche STM
La recomendación para el lugar de adhesión del parche es su limpieza y secado pero no implica el uso de agentes especiales que puedan irritar la piel; es suficiente una ducha normal con un jabón hidratante, sin fragancia. Si se desarrolla irritación de la piel, se aplicará una crema hidratante hidrosoluble o una pomada de cortisona al 1% (de dispensación libre) en el lugar de uso más reciente del parche. El emoliente/pomada sólo debe aplicarse en el momento de la retirada del parche, lo que permite que entre aplicaciones el paciente tome 4 duchas diarias y use de nuevo el lugar previamente irritado (suponiendo la rotación de 4 lugares descrita previamente). Es importante que no se apliquen los emolien-tes/pomada en el lugar justo antes de la aplicación del parche debido a la posible interferencia tanto con la adhesión como con la absorción.
EDUCACIÓN DE LOS PACIENTES Y LOS PADRESEs preciso que no sólo el clínico sino también el paciente o, en el caso de los niños más pequeños, los padres conozcan la gran mayoría de principios descritos previamente. En la tabla 3 se proporciona una lista de control de la información importante que debe comunicarse a pacientes y padres para obtener resultados óptimos y favorecer la cooperación y el cumplimiento. Puede fotocopiarse y entregarse para que aquéllos la lean mientras reciben instrucciones y después la conserven como recordatorio.
El niño debe adiestrarse gradualmente para que asuma la responsabilidad de la higiene de la piel y la aplicación del parche. La autoaplicación se efectúa mejor con la ayuda de un espejo que contribuye a asegurarse de que no se superpone el lugar de aplicación previo de dos días antes. Al igual que con cualquier fármaco administrado para este trastorno, las visitas iniciales han de ser frecuentes y prolongarse lo suficiente no sólo para titular la dosis con precisión sino también para educar y favorecer la comunicación entre todos los que pueden ayudar al niño (padre, maestro, entrenador y paciente). Una tarjeta de evolución diaria3 es una buena forma de favorecer la comunicación entre el hogar y la escuela. Como “estrella del equipo terapéutico”19, el niño debe asumir gradualmente más responsabilidad en la comunicación al igual que en la supervisión de los efectos adversos y la higiene de la piel, empezando por la retirada del parche en el momento apropiado a indicación de los padres.
DISCUSIÓNOptimizar el beneficio clínico con cualquier fármaco administrado para el trastorno por déficit de atención con hiperactividad requiere la capacidad tanto de los médicos como de los pacientes para controlar con precisión tanto la robustez de la respuesta como la evolución diaria de dicha respuesta. En la actualidad, el tratamiento farmacológico del trastorno no consiste en un medicamento ideal, individual, y son clínicamente valiosas opciones terapéuticas adicionales. La disponibilidad de un sistema de distribución de metilfenidato a través de un parche transdérmico amplía las opciones de médicos y pacientes en diversos sentidos: evita el intestino y, por consiguiente, una absorción impredecible; obvia la necesidad de tragar los comprimidos; permite unos efectos clínicos constantes durante el día mientras se necesitan; produce una duración más prolongada del efecto que las pautas disponibles de metilfenidato oral; y, quizá lo más importante, ofrece un control completo sobre tanto el inicio como la desaparición del efecto, lo que hace que los padres y el niño controlen los síntomas y favorece una relación de cooperación entre el niño, los padres y el médico. El parche es una elección obvia para pacientes con problemas para tragar comprimidos. También es útil para pacientes que requieren una duración variable de los efectos de un día a otro; tienen un metabolismo rápido (lo que requiere una segunda dosis incluso con los preparados orales de liberación modificada); requieren un tratamiento flexible de los efectos secundarios al final del día o requieren sistemáticamente un control prolongado de los síntomas durante más tiempo de lo que ofrecen los preparados orales. Por consiguiente, el tiempo necesario para llegar a dominar esta nueva opción de tratamiento aprendiendo la información y las habilidades resumidas en el presente artículo parece bien empleado.
Conflictos de interés: el Dr. Arnold recibió financiación, honorarios como consultor y conferenciante de Shire, Lilly, Novartis, McNeil, Sigma Tau, y Noven. El Dr. López ha recibido financiación para investigación, ha trabajado como consultor y/o como miembro del departamento de conferenciantes de Shire, Novartis, Noven, NewRiver Pharmaceuticals, Celltech-Medeva, Bristol-Myers Squibb, GlaxoSmithKline, Lilly, y Cephalon. El Dr. Jacob ha recibido honorarios como conferenciante de Shire, Connetics y Astellas. El Dr. Findling recibe o ha recibido financiación para investigación, ha trabajado como consultor y/o como miembro del departamento de conferenciantes para Abbott, AstraZeneca, Bristol-Myers Squibb, Celltech-Medeva, Forest, GlaxoSmithKline, Johnson & Johnson, Lilly, New River Pharmaceuticals, Novartis, Otsuka, Pfizer, Sanofi-Aventis, Shire, Solvay, y Wyeth. El resto de los autores han indicado que no tienen ninguna filiación financiera importante que revelar.
Correspondencia: L. Eugene Arnold, MD, Department of Psychiatry, Ohio State University, 479 S Galena Rd, Sunbury, OH 43074, Estados Unidos.
Correo electrónico: arnold.6@osu.edu