Las causas genéticas más frecuentemente asociadas con infertilidad masculina son las anomalías cromosómicas y microdeleciones del cromosoma Y.
ObjetivoDeterminar la frecuencia de alteraciones cromosómicas en pacientes con alteraciones seminales y de microdeleciones del cromosoma Y en aquéllos con una concentración espermática <5 millones/ml, así como conocer la decisión reproductiva.
Material y métodosDe enero de 2011 a agosto de 2014 se realizó cariotipo a 100 hombres infértiles referidos por el Servicio de Andrología; en 70 de ellos, que presentaban una concentración espermática <5 millones/ml y cariotipo normal, se estudiaron microdeleciones del cromosoma Y.
ResultadosDos pacientes presentaron alteraciones cromosómicas estructurales, uno con criptozoospermia: 46,XY,t(13;18)(q11;p11) y otro con criptoteratozoospermia: 46,X,t(Y;6)(q12;p12). En cinco de estos 70 casos se detectaron microdeleciones del cromosoma Y cuatro de ellos presentaron deleción de la región AZFc, de los cuales dos cursaban con oligoastenoteratozoospermia, uno con azoospermia y otro con criptozoospermia. Un paciente con azoospermia presentó deleción de la región AZFa. Los pacientes con translocaciones cromosómicas abandonaron su seguimiento. Los dos hombres con deleción de AZFc y el paciente con deleción en AZFa solicitaron reproducción asistida con semen heterólogo; los otros dos pacientes con deleción de AZFc optaron por embarazo con técnicas de reproducción asistida y semen homólogo.
DiscusiónLa valoración y los estudios genéticos de pacientes con infertilidad masculina son importantes para conocer la causa y otorgar un adecuado asesoramiento genético.
Chromosomal abnormalities and Y chromosome microdeletions are the genetic causes most frequently associated with male infertility.
ObjectivesTo determine the frequency of chromosomal abnormalities in patients with impaired seminal parameters, and Y chromosome microdeletions in those men with a sperm concentration <5 mill/ml, as well as to know their reproductive decision.
Material and methodsDuring the period from January 2011 to August 2014, karyotyping was performed on 100 patients referred from the Andrology Service. Y chromosome microdeletions were studied in 70 patients with a sperm concentration <5 mill/ml and a normal karyotype.
ResultsTwo patients had structural chromosome abnormalities: 1 with cryptozoospermia of 46,XY,t(13;18)(q11;p11) and 1 with cryptoteratozoospermia of 46,X,t(Y;6)(q12;p12). Five of the 70 had Y chromosome microdeletions and 4 of them had a deletion of the AZFc region; of these last 4, 2 presented oligoasthenoteratozoospermia, 1 azoospermia and another, cryptozoospermia. A patient with azoospermia presented deletion in the AZFa region. Patients with chromosomal translocations abandoned their medical follow-up. The 2 men with AZFc deletion and the patient with deletion in AZFa requested assisted reproduction with heterologous semen. Two patients with AZFc deletion opted for pregnancy with assisted reproductive techniques and homologous semen.
DiscussionThe assessment and genetic studies of patients with male infertility are important to determine the cause and provide appropriate genetic counselling.
De acuerdo con la Organización Mundial de la Salud (OMS), el 10-15% de las parejas en edad reproductiva sufren infertilidad y el 40-50% de los casos de infertilidad se asocia con factores masculinos1, entre los cuales las causas genéticas representan del 10 al 15% de los casos2. Las alteraciones cromosómicas, las microdeleciones del cromosoma Y y las mutaciones monogénicas influyen, a diferentes niveles, en los procesos fisiológicos involucrados en la reproducción masculina principalmente en el eje hipotálamo-hipófisis-testículo y en la producción espermática3.
Las anomalías cromosómicas se presentan en, aproximadamente, el 5% de los hombres infértiles aunque aumentan a un 15% en varones con azoospermia. Dichas alteraciones incluyen tanto alteraciones numéricas como estructurales4,5.
Las microdeleciones en el brazo largo del cromosoma Y (Yq) son la causa molecular más frecuente y la segunda causa genética de infertilidad masculina. Se detectan en el 10-15% de los casos con azoospermia no obstructiva6,7 y en el 5-10% de los pacientes con oligozoospermia grave7,8.
La región del factor de azoospermia (AZF) en Yq11 desempeña un papel clave en la espermatogénesis, que incluye la regulación de la meiosis de las células germinales9. La región AZF se subdivide, según la ubicación, en AZFa, AZFb y AZFc. Las deleciones en estas regiones son responsables de diversos grados de disfunción de la espermatogénesis. El tipo de deleción más frecuente es el de la región AZFc (∼80%), seguido por el de las regiones AZFb (1-5%), AZFa (0.5-4%) y AZFb/c (1-3%)10.
El objetivo principal de este estudio fue determinar la frecuencia y el tipo de anomalías cromosómicas en pacientes con alteraciones en el seminograma, así como la frecuencia de microdeleciones del cromosoma Y en aquellos pacientes con una concentración espermática inferior a 5 millones/ml y cariotipo normal. El objetivo secundario fue conocer las decisiones reproductivas de los pacientes en que se determinó una causa genética de infertilidad masculina.
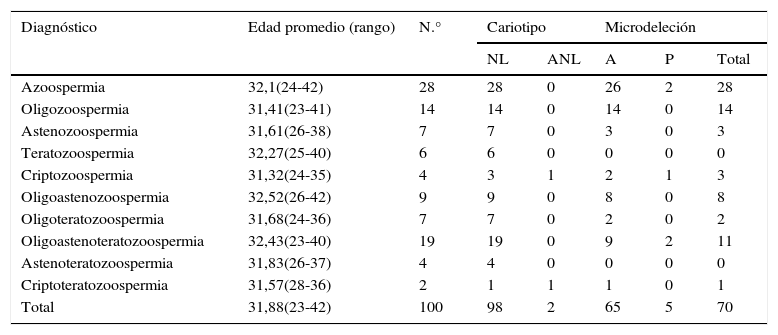
Material y métodosLos pacientes con alteraciones en los parámetros seminales y valorados por el Servicio de Andrología fueron remitidos a la Consulta de Genética. Las alteraciones del semen se consideraron de acuerdo con las directrices de la OMS del año 2010. El estudio incluyó el período comprendido entre enero de 2011 y agosto de 2014, durante el cual 100 pacientes con alteraciones seminales fueron valorados por Genética (tabla 1).
Resultados de cariotipo y el estudio de microdeleción del cromosoma Y
| Diagnóstico | Edad promedio (rango) | N.° | Cariotipo | Microdeleción | |||
|---|---|---|---|---|---|---|---|
| NL | ANL | A | P | Total | |||
| Azoospermia | 32,1(24-42) | 28 | 28 | 0 | 26 | 2 | 28 |
| Oligozoospermia | 31,41(23-41) | 14 | 14 | 0 | 14 | 0 | 14 |
| Astenozoospermia | 31,61(26-38) | 7 | 7 | 0 | 3 | 0 | 3 |
| Teratozoospermia | 32,27(25-40) | 6 | 6 | 0 | 0 | 0 | 0 |
| Criptozoospermia | 31,32(24-35) | 4 | 3 | 1 | 2 | 1 | 3 |
| Oligoastenozoospermia | 32,52(26-42) | 9 | 9 | 0 | 8 | 0 | 8 |
| Oligoteratozoospermia | 31,68(24-36) | 7 | 7 | 0 | 2 | 0 | 2 |
| Oligoastenoteratozoospermia | 32,43(23-40) | 19 | 19 | 0 | 9 | 2 | 11 |
| Astenoteratozoospermia | 31,83(26-37) | 4 | 4 | 0 | 0 | 0 | 0 |
| Criptoteratozoospermia | 31,57(28-36) | 2 | 1 | 1 | 1 | 0 | 1 |
| Total | 31,88(23-42) | 100 | 98 | 2 | 65 | 5 | 70 |
A: ausente; ANL: anormal; NL: normal; P: presente.
A todos los pacientes se les realizó cariotipo de cultivos de linfocitos de sangre periférica estimulados por fitohemaglutinina. Para el análisis microscópico, los cromosomas en metafase se tiñeron con la técnica de tripsina-Giemsa (bandas GTG). Se analizaron 20 metafases por cada paciente. A los pacientes que cursaron con una cuenta espermática inferior a 5 millones/ml se les realizó también el estudio de la región AZF (Yq11) en búsqueda de microdeleciones.
El ADN genómico se extrajo de leucocitos de sangre periférica mediante procedimiento estándar. El ADN fue amplificado por reacción en cadena de la polimerasa multiplex (PCR multiplex). Se utilizaron los siguientes cebadores: para la región AZFa, SR82 de 264 pb, SR84 de 326 pb y SY87 de 252 pb; para la región AZFb, SY130 de 133 pb, SY132 de 160 pb, SY125 de 200 pb, SY129 de 194 pb, SY134 de 301 pb, SY136 de 23 pb y SY143 de 311 pb; para la región AZFb/c, SY90 de 176 pb; para la región AZFc, SY148 de 202 pb, SY153 de 139 pb, SY154 de 245 pb, SY157 de 286 pb, SY158 de 231 pb, SY254 de 380 pb, SY277 de 312 pb y SY279 de 823 pb; SRY de 270 pb, y SY160 de 236 pb.
Una vez que se obtuvieron los resultados, se les brindó asesoramiento genético a todos los pacientes y en la Clínica de Andrología se les dio consejo reproductivo. La opción considerada por la pareja quedó consignada en cada expediente.
ResultadosSe estudió a un total de 100 hombres con alteraciones en los parámetros seminales, de los cuales 28 presentaron azoospermia; 19, oligoastenoteratozoospermia; 14, oligozoospermia; 9, oligoastenozoospermia; 7, astenozoospermia grave; 7, oligoteratozoospermia; 6, teratozoospermia; 4, criptozoospermia; 4, astenoteratozoospermia, y 2 criptoteratozoospermia (tabla 1).
Estudio citogenético. De los 100 casos, 98 presentaron cariotipo masculino normal (46,XY); dos casos (2%) presentaron cariotipo anormal, con alteraciones cromosómicas estructurales equilibradas. El primer paciente con diagnóstico de criptozoospermia presentó una translocación recíproca: 46,XY,t(13;18)(q11;p11). El otro paciente con diagnóstico de criptoteratozoospermia presentó una translocación entre el cromosoma Y y un autosoma (tabla 1): 46,X,t(Y;6)(q12;p12). Ambos pacientes, después de recibir consejo genético y reproductivo, abandonaron su seguimiento en el Instituto.
Microdeleciones del cromosoma Y. El estudio de microdeleciones del cromosoma Y se realizó en 70 de los 100 pacientes, los cuales presentaron una concentración de espermatozoides inferior a 5 millones/ml. Los 70 pacientes mostraron cariotipos normales. En cinco (7.14%) se detectó microdeleción del brazo largo del cromosoma Y. De estos cinco casos, dos presentaron azoospermia; dos, oligoastenoteratozoospermia, y uno, criptozoospermia. En cuatro de los cinco casos con microdeleción del cromosoma Y, la deleción se encontró en la subregión AZFc, de los cuales dos casos presentaron oligoastenoteratozoospermia, uno azoospermia y otro criptozoospermia. Dos pacientes consideraron la opción de semen heterólogo y dos, semen homólogo. En un caso con azoospermia, la deleción se observó en la subregión AZFa. Éste optó por semen heterólogo.
DiscusiónEn este estudio se encontró que el 2% de los pacientes presentó alteraciones cromosómicas, cifra menor a la reportada en la literatura médica4,5. Esto puede deberse al hecho de que los pacientes remitidos al Servicio de Genética son valorados previamente por el Servicio de Andrología, que sólo solicita la valoración si considera que existe alguna posibilidad reproductiva para la pareja. En este estudio se analizaron 20 células de cada paciente, con lo cual excluimos un mosaico cromosómico del 14% con un intervalo de confianza del 95%11.
Las translocaciones autosómicas son 4-10 veces más comunes en pacientes infértiles11,12. Las translocaciones recíprocas ocurren en el 0,7% de los hombres con oligozoospermia grave o azoospermia13. Las dos translocaciones encontradas, 46,XY,t(13;18)(q11;p11) y 46,X,t(Y;6)(q12;p12), se han reportado en hombres infértiles aunque con diferentes puntos de ruptura de los cromosomas involucrados.
El paciente con cariotipo 46,XY,t(13;18)(q11;p11) presentaba criptozoospermia y ello podría deberse al hecho de que los puntos de ruptura causan interrupción de genes importantes en la espermatogénesis, a un efecto de posición en que un gen se transloca a una región en la cual su expresión ya no puede ser regulada por un elemento trans o cis, o a un silenciamiento meiótico y heterocromatización de la cromatina asináptica. Estos procesos podrían estar involucrando a uno o varios genes críticos para la progresión meiótica en la etapa de paquiteno de la espermatogénesis14–17. Existen reportes en la literatura médica de translocaciones que involucran a los cromosomas 13 y 18 en hombres con infertilidad. Uno de ellos presentaba aspermia18 y el otro, oligoastenoteratozoospermia19.
Las translocaciones entre el cromosoma Y y algunos autosomas tienen una frecuencia en la población general del 0.02%, pero la frecuencia aumenta al 0.2% en pacientes oligozoospérmicos y al 0.9% en individuos sometidos a inyección intracitoplasmática de espermatozoides20. En nuestro estudio, el paciente con la translocación 46,X,t(Y;6)(q12;p12) presentó criptoteratozoospermia. Uno de los mecanismos propuestos es la alteración durante la profase meiótica I masculina debido a un mal apareamiento entre los cromosomas X y Y en los espermatocitos primarios en las etapas de cigoteno y paquiteno. Esto causa que el acto de recombinación obligatorio en el segmento homólogo de ADN situado en Xpter y Ypter durante la meiosis no se lleve a cabo de forma correcta, lo cual es esencial para promover el apareamiento meiótico y garantizar la producción de esperma21. La falta de dicho proceso ocasiona que se active el punto de control de paquiteno, el cual ocasiona el paro de las células germinales y provoca la degeneración de la mayoría de los espermatocitos por apoptosis, lo que conduce a una pérdida progresiva de las células germinales en los túbulos seminíferos22–24. Otro mecanismo involucrado muestra que los segmentos del autosoma incluidos en la vesícula sexual experimentan hipercondensación y la consiguiente inactivación, lo cual puede ocasionar una degeneración del espermatocito después de la etapa de paquiteno por activación de una respuesta apoptótica25–27. Se ha reportado la translocación que involucra los cromosomas Y y 6 en pacientes con disminución en la concentración espermática28, en oligoteratozoospermia, criptozoospermia29 y azoospermia30,31. A los pacientes portadores de la translocación recíproca equilibrada se les sugirió la realización de la prueba de hibridación in situ por fluorescencia en esperma para identificar la proporción de gametos desequilibrados y poder ofrecer asesoramiento genético más específico. Ambos pacientes abandonaron su seguimiento en el Instituto.
En nuestro estudio detectamos microdeleción de Yq en cinco de los 70 pacientes estudiados con una concentración espermática de <5 millones/ml. La deleción más frecuente involucra la región AZFc (80%). Esta microdeleción puede producir una amplia gama de fenotipos, muchos de los cuales están asociados con una baja concentración de espermatozoides32. Se ha reportado que algunos pacientes con deleción de AZFc pueden lograr la fertilización con técnicas de reproducción asistida33 ya que más de la mitad de los pacientes con azoospermia tienen espermatozoides que pueden ser recuperados por extracción testicular33. Los pacientes con esta microdeleción trasmiten la alteración al 100% de su descendencia masculina34. Los pacientes de nuestro estudio que presentaban dicha deleción recibieron asesoramiento genético y reproductivo, por lo cual los pacientes optaron por diferentes opciones reproductivas.
En un caso se detectó la deleción de la región AZFa, donde se encuentran los genes USP9Y y DDX3Y5. Esta deleción ocasiona el «síndrome de sólo células de Sertoli», enfermedad que se caracteriza por azoospermia y la única existencia de células de Sertoli en los testículos32,35. A este paciente no se le ofreció extracción testicular de espermatozoides ya que implica la virtual imposibilidad de recuperación de éstos, por lo cual se le sugirió considerar la opción de semen heterólogo, opción aceptada tanto por el paciente como por su pareja.
ConclusiónLa frecuencia de las anomalías cromosómicas en pacientes con alteraciones en los parámetros seminales, en especial en aquéllos con criptozoospermia y criptoteratozoospermia, así como de microdeleciones del cromosoma Y en varones con una concentración espermática inferior a 5 millones/ml, respalda la importancia de la valoración por el Servicio de Genética, así como realización de cariotipo y el estudio de microdeleciones de AZF. Los resultados y el asesoramiento genético son útiles para conocer la causa de la infertilidad masculina y para brindar un adecuado consejo reproductivo.