Desde mediados de la década de 1950 se aceptó el concepto que el número de ovocitos primarios está determinado desde el nacimiento. En 2004 inició el cambio de este paradigma de la fisiología ovárica al identificarse células madre de la línea germinal mitóticamente activas durante la vida posnatal en el ovario murino. En 2012 se identificó el equivalente de estas células en el ovario humano producto de un protocolo de clasificación de células activadas por fluorescencia que permitió su purificación y caracterización. La potencial aplicación de las células madre de origen ovárico hará posible asegurar la conservación de la función ovárica en condiciones clínicas, en donde la actividad reproductiva podría verse afectada, como es el caso de mujeres jóvenes con cáncer, que requieren de tratamiento que en la mayoría de los casos resulta en alteraciones de la función hormonal y gametogénica del ovario.
Since the early 1950s it was accepted the concept that primary oocyte number is determined since the newborn period. In 2004 initiated the change of this paradigm of ovarian physiology through identification of mitotically active germ line stem cells during postnatal life in the murine ovary. In 2012, it was identified the equivalent of these cells in the human ovary using a fluorescence-activated cell sorting based protocol that permitted the purification of mitotically active ovarian cells. The potential application of ovarian stem cells could in the future improve the actual strategies of conservation of reproductive capacity in clinical conditions where reproductive ability may be impaired, as in the case of women with breast cancer, who require treatment that would cause disturbances of hormonal and gametogenic function.
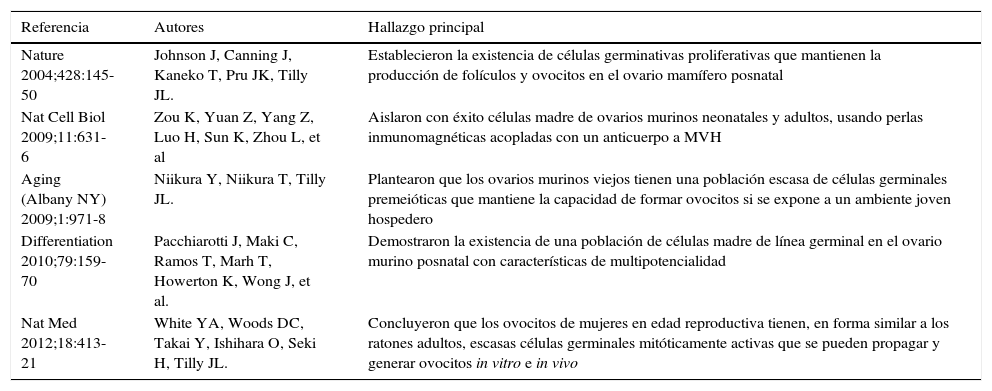
En 1921 Pearl y Schoppe1 plantearon como una doctrina biológica básica que “durante la vida de un individuo del sexo femenino no hay ni habrá un incremento en el número preestablecido de los ovocitos primarios prenatalmente”. Este concepto se convirtió en uno de los dogmas más representativos de la Biología de la Reproducción desde mediados del siglo pasado y persistió así por más de 50 años2. Sin embargo, hace tan solo una década Tilly y cols.3 reportaron en el ovario murino la presencia de células madre mitóticamente activas dando lugar al cambio del paradigma y al inicio del debate sobre la capacidad regenerativa de la línea germinal ovárica durante la vida posnatal3. El objetivo de este trabajo es revisar de la literatura las evidencias que apoyan la existencia de células madre de origen ovárico (Tabla 1) y que plantean, al mismo tiempo, nuevas opciones preventivas o terapéuticas en ciertos casos de infertilidad en la mujer.
Hallazgos que apoyan la existencia de células madre de origen ovárico
| Referencia | Autores | Hallazgo principal |
|---|---|---|
| Nature 2004;428:145-50 | Johnson J, Canning J, Kaneko T, Pru JK, Tilly JL. | Establecieron la existencia de células germinativas proliferativas que mantienen la producción de folículos y ovocitos en el ovario mamífero posnatal |
| Nat Cell Biol 2009;11:631-6 | Zou K, Yuan Z, Yang Z, Luo H, Sun K, Zhou L, et al | Aislaron con éxito células madre de ovarios murinos neonatales y adultos, usando perlas inmunomagnéticas acopladas con un anticuerpo a MVH |
| Aging (Albany NY) 2009;1:971-8 | Niikura Y, Niikura T, Tilly JL. | Plantearon que los ovarios murinos viejos tienen una población escasa de células germinales premeióticas que mantiene la capacidad de formar ovocitos si se expone a un ambiente joven hospedero |
| Differentiation 2010;79:159-70 | Pacchiarotti J, Maki C, Ramos T, Marh T, Howerton K, Wong J, et al. | Demostraron la existencia de una población de células madre de línea germinal en el ovario murino posnatal con características de multipotencialidad |
| Nat Med 2012;18:413-21 | White YA, Woods DC, Takai Y, Ishihara O, Seki H, Tilly JL. | Concluyeron que los ovocitos de mujeres en edad reproductiva tienen, en forma similar a los ratones adultos, escasas células germinales mitóticamente activas que se pueden propagar y generar ovocitos in vitro e in vivo |
En 2004 Tilly y col.3 informaron que los ovarios de ratones jóvenes y adultos poseen células germinales con la actividad mitótica necesaria para mantener a la poza de folículos; respaldado en la tasa observada de degeneración de ovocitos (atresia) y su aclaramiento. Este grupo de trabajo primero identificó, en la superficie epitelial ovárica de ratones jóvenes y adultos, células ovoides grandes semejantes a células germinales de ovarios murinos fetales4, positivas para MVH (Mouse Vasa Homologue), gen evolutivamente conservado que se expresa en células germinales y que regula además el ciclo celular por su actividad de RNA helicasa5,6. El potencial proliferativo de estas células se comprobó mediante la incorporación de 5-bromodesoxiuridina y su importancia para repoblar la poza de folículos posnatales se validó con busulfán7, un agente tóxico para las células germinales, que elimina la reserva de folículos primordiales sin inducir atresia.
Por otra parte, los ovarios de ratones silvestres injertados, en ratones hembra transgénicos con expresión ubicua de la proteína verde fluorescente8 (Green Fluorescence Protein, GFP) mostró infiltrarse con células germinales positivas a GFP y rodearse de células somáticas GFP negativas en los injertos. Lo anterior sugirió que las células germinales transgénicas iniciaron foliculogénesis con las células somáticas residentes de tipo silvestre. En conjunto, estos datos apoyaron que las células germinales ovoides grandes en la superficie del epitelio ovárico podrían ser células germinales proliferativas que sostienen la producción de ovocitos y folículos en el ovario del mamífero en la etapa posnatal3.
Los resultados obtenidos de esta publicación establecieron la posibilidad de la existencia de células madre de la línea germinal (Germinal Stem Cells, GSC) en ovarios de mamíferos y de una población estable de células germinales (folículos primodiales) no renovable durante la función reproductiva del ovario. Tilly y cols.9 sugirieron que es factible que ambos puntos de vista coexistan, es decir la presencia de una población fija de ovocitos al nacimiento que normalmente no es renovable y la presencia de GSC en el ovario que posean la capacidad de activarse y diferenciarse en folículos primordiales bajo circunstancias especiales. Para resolver este debate fue necesario demostrar la presencia de GSC funcionales en ovarios en etapa pospuberal.
Identificación de células madre ováricas en el modelo murinoEn 2009 el grupo de Zou aisló con éxito GSC de ovarios de ratones neonatos y adultos10. Las células se identificaron en el epitelio de la superficie ovárica con base a los mismos criterios utilizados por Tilly: la expresión de marcadores específicos de la línea germinal evolutivamente conservados (MVH) y la evidencia de actividad mitótica9. Las líneas murinas de GSC se establecieron mediante el uso de anticuerpos específicos a MVH con la finalidad de purificarlas de ovarios tanto de ratones neonatos como adultos. Las poblaciones (GSC neonatales y adultas), discriminadas por esta metodología, mostraron su capacidad de proliferar en cultivo durante más de 15 meses9,10 y viabilidad después de su criopreservación. La caracterización de estas líneas celulares a través del uso de diferentes biomarcadores confirmó su naturaleza germinal, además de mostrar un cariotipo normal, elevada actividad de telomerasa y un patrón de impronta femenino10.
La evaluación funcional de las GSC en términos de su citodiferenciación en folículos primordiales en ratones hembras depletados de células germinales y transplantados con células transgénicas con expresión constitutiva de GFP, mostró la capacidad de estas células de diferenciarse en folículos primordiales con diferentes grados de desarrollo. Estos resultados, apoyan estudios previos3 y confirman la presencia de una poza renovable de células germinales en el ovario con la capacidad de diferenciación en folículos maduros y con potencial reproductivo conservado10.
Por otra parte, en 2010 Pacchiarotti y colaboradores11 demostraron la existencia de una población de células madre de línea germinal en el ovario murino posnatal con la característica de multipotencialidad, utilizando un modelo transgénico en el que la proteína GFP se expresa bajo el promotor de Oct-4 específico de la línea de células germinales. Las FGSC aisladas mantuvieron después de un año de cultivo sus características y actividad de telomerasa, expresaron marcadores de células madre y de línea germinal y presentaron cariotipo normal11. En forma paralela, el grupo de Tilly reportó que las células madre ovogónicas inactivas en ovarios atróficos de ratones viejos tienen la capacidad de reiniciar la ovogénesis in vivo cuando se exponen a un ambiente ovárico de adultos jóvenes, lo cual sugirió que el envejecimiento ovárico puede ser reversible12. Este mismo grupo de trabajo también logró obtener ovocitos maduros empleando como célula precursora a las células madre ovogénicas con la finalidad de injertarlas a un modelo de ovario murino sin folículos primordiales probando su completa funcionalidad.
Sin embargo, para considerar la posibilidad de la utilidad clínica de estas células fue necesario demostrar que existen células productoras de ovocitos semejantes en ovarios de mujeres en edad reproductiva13.
Identificación de células madre en ovarios humanosEn 2012 Telfer y colaboradores14 identificaron y purificaron células ováricas mitóticamente activas (células madre ovogónicas: OSC, oogonial stem cells) caracterizadas por un perfil de expresión génica compatible con células germinales primitivas aisladas por la técnica de clasificación de células activadas por fluorescencia (FACS, por sus siglas en inglés). Estos hallazgos ofrecen la oportunidad de desarrollar nuevas estrategias de preservación de la fertilidad en ciertas circunstancias clínicas particulares. Un ejemplo claro, es su utilidad en el campo de la oncofertilidad, en mujeres jóvenes afectadas con cáncer, en quienes el tratamiento resulta generalmente en la pérdida de la función reproductiva15. A este respecto, existen diferentes alternativas para la preservación y rescate de la función hormonal y reproductiva del ovario. Por ejemplo, la transposición ovárica, la criopreservación de embriones y de los ovocitos, así como la criopreservación de tejido ovárico16.
Es relevante señalar que en mujeres en estadios prepuberales, la criopreservación del tejido ovárico representa, hasta el momento, la única opción disponible para la conservación de la capacidad reproductiva, sobre todo cuando el tratamiento oncológico por las condiciones clínicas de la mujer, no puede retrasarse17,18. Esta posibilidad permite que el tejido ovárico criopreservado, recupere, aún meses después, su capacidad funcional al ser reimplantado in situ en las mujeres afectadas19,20.
Por otra parte, la utilización de células madre de origen ovárico, ofrece también la posibilidad, como es el caso de mujeres afectadas de enfermedades malignas, de obtener, a partir de ellas, células germinales con la capacidad de citodiferenciarse en folículos ováricos funcionalmente activos. Esta importante observación, de la presencia de células madre en el ovario y su capacidad in vitro de citodiferenciarse en células germinales, representó las bases para el desarrollo exitoso del denominado ovario artificial21,22. Esta nueva y revolucionaria alternativa de tratamiento, ya probada en modelos murinos y primates no humanos, resultará indudablemente en su aplicación en el modelo humano23,24. En relación con este punto, existe todavía un largo camino por recorrer, sobre todo para descartar alteraciones en el proceso de la impronta genética y de la conservación de los mecanismos epigenéticos responsables del desarrollo ovocitario en condiciones normales25,26.
ConclusionesLos avances recientes en fisiología ovárica han permitido cuestionar paradigmas tradicionales en el área de la endocrinología reproductiva y en particular los relacionados con la población no renovable de células germinales al nacimiento. La aplicación que resulte de estos hallazgos será de invaluable ayuda en mujeres en quienes el tratamiento de enfermedades malignas resulta en la pérdida de la función hormonal y reproductiva del ovario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.