Comparar las concentraciones plasmáticas de 8-isoprostano en pacientes con preeclampsia y eclampsia.
Material y métodosSe seleccionaron pacientes que asistieron al Hospital Central Dr. Urquinaona de Maracaibo (Venezuela). Se incluyeron 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia severa (grupo B) y 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener una edad y un índice de masa corporal similares a los grupos en estudio y consistió en 30 embarazadas sanas (grupo D). Solo se incluyeron pacientes nulíparas. Las muestras de plasma para la determinación de 8-isoprostano se recogieron antes del parto, y en los grupos de estudio, inmediatamente después del diagnóstico.
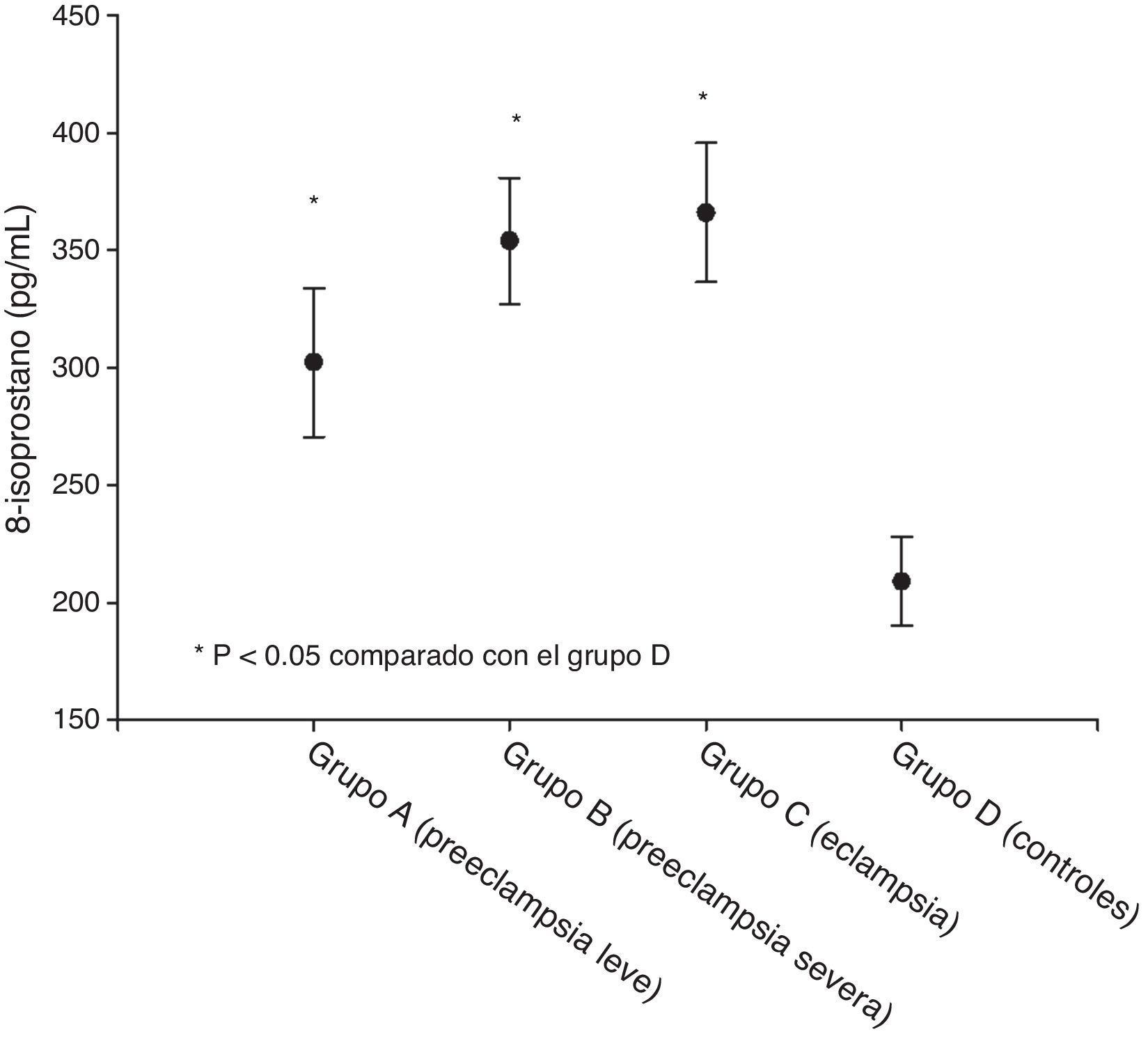
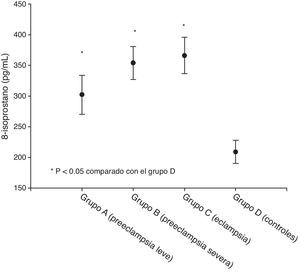
ResultadosSe encontraron diferencias estadísticamente significativas en la edad gestacional entre los grupos B y C frente al de los controles (p<0.05). Los valores más altos de 8-isoprostano se observaron en el grupo de pacientes eclámpticas (366.0±29.7pg/mL) junto al de aquellas con preeclampsia severa (354.2±26.9pg/mL). Se encontraron valores más bajos en las que tenían preeclampsia leve (302.2±31.6pg/mL). Los grupos de estudio presentaron valores de 8-isoprostano significativamente superiores que el control (209.3±19.1pg/mL; p<0.05). El análisis de regresión lineal mostró que el factor que se relacionaba significativamente con la concentración plasmática de 8-isoprostano fue la proteinuria de 24h (p<0.05).
ConclusiónLas pacientes eclámpticas y preeclámpticas presentan concentraciones plasmáticas de 8-isoprostano significativamente más elevadas que las embarazadas normotensas sanas.
To compare plasma vascular 8-isoprostane concentrations in pregnant women with pre-eclampsia and eclampsia.
Material and methodsPatients attending the Hospital Central Dr. Urquinaona in Maracaibo, Venezuela, were selected. The study included 30 patients with mild pre-eclampsia (group A), 30 patients with severe pre-eclampsia (group B), and 30 patients with eclampsia (group C). A control group was also included, consisting of 30 healthy pregnant women (group D) of similar age and body mass index to studied groups. Only nulliparous patients were included. Plasma samples were collected for the 8-isoprostane determination from all patients before delivery, and in the studied groups immediately after diagnosis.
ResultsStatistically significant differences were found in gestational age between groups B and C compared with the control group (p<.05). Higher values of plasma 8-isoprostane were observed in severe pre-eclampsia patients (366.0±29.7pg/mL), as well as in eclampsia patients (354.2±26.9pg/mL). Lower values were found in mild pre-eclampsia patients (302.2±31.6pg/mL). The studied groups had significantly higher values of plasma 8-isoprostane compared with controls (209.3±19.1pg/mL; p<.05). Linear regression analysis found that the factor that was significantly associated with 8-isoprostane concentrations was the 24-h urine protein level (p<.05).
ConclusionEclampsia and pre-eclampsia patients had higher plasma 8-isoprostane concentrations than healthy normotensive pregnant women.
La preeclampsia está caracterizada por un aumento de la resistencia vascular sistémica materna, una activación plaquetaria y una disminución del flujo sanguíneo placentario1,2. La causa de este desorden es desconocida y está asociada con un aumento de la generación y la activación de radicales libres de oxígeno por los leucocitos circulantes3.
Los radicales libres de oxígeno y los peróxidos lipídicos son compuestos altamente reactivos capaces de dañar las células endoteliales. Diferentes estudios han encontrado que las concentraciones de productos de peroxidación lipídica y de anticuerpos contra las lipoproteínas de baja densidad oxidadas están elevadas en la preeclampsia comparadas con las halladas en los embarazos normales4.
Los isoprostanos son marcadores estables del estrés oxidativo, los cuales se forman in situ a partir de los fosfolípidos de la membrana celular y son liberados a la circulación en su forma libre, presumiblemente por la fosfolipasa A25,6. La 8-epi-prostaglandina F2alfa u 8-isoprostano, el isoprostano más importante generado de la peroxidación enzimática del ácido araquidónico, ha demostrado ser un indicador confiable del estrés oxidativo. Es un vasoconstrictor potente, mediador del crecimiento celular del músculo liso, activador de las plaquetas e inductor de alteraciones en la función de la barrera celular endotelial5. Se ha demostrado que su elevación en las concentraciones urinarias se asocia con hipercolesterolemia y diabetes7.
En contraste con el acuerdo general de aumento del estrés oxidativo placentario descrito en la preeclampsia, aún existen controversias con relación a las concentraciones en la circulación materna8. Se han demostrado concentraciones elevadas de 8-isoprostano libre en tejido decidual, al igual que se ha encontrado un aumento en la producción placentaria ex vivo de 8-isoprostano en placentas de las preeclámpticas comparadas con las controles9. Sin embargo, existen informes contradictorios de valores de 8-isoprostano en la circulación materna en las preeclámpticas, con resultados que no muestran diferencias en las concentraciones10 o presentan un aumento de estas11.
El objetivo de la investigación fue comparar las concentraciones plasmáticas de isoprostano-8 en preeclampsia y eclampsia.
Material y métodosEste estudio de casos y controles se realizó en el Servicio de Obstetricia del Hospital Central Dr. Urquinaona en Maracaibo (Venezuela), de enero del 2009 a febrero del 2016. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo el consentimiento por escrito de todas las pacientes. Se incluyeron 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia severa (grupo B) y 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener una edad materna y un índice de masa corporal similares a los grupos de estudio y consistió en 30 embarazadas sanas sin enfermedades obstétricas o sistémicas (grupo D). Solo se incluyeron pacientes nulíparas en la investigación. En las pacientes con eclampsia el consentimiento informado se obtuvo luego de la desaparición del episodio convulsivo o de coma.
Se consideró la preeclampsia como severa si la presión arterial diastólica estaba por encima de 110mmHg y la presión arterial sistólica superaba los 160mmHg, 3 cruces de proteinuria en un examen cualitativo o 5g en una muestra de orina de 24h, presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500mL/24h), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1.0mg/dL), trombocitopenia (menos de 150,000/mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación. Las pacientes que cumplieron los criterios para el diagnóstico de preeclampsia, pero no para ser consideradas en el grupo de preeclampsia severa, fueron asignadas al grupo de preeclampsia leve. La eclampsia se definió como la aparición de convulsiones o coma en pacientes con signos y síntomas de preeclampsia. La presión sanguínea se midió en posición sedente después de 15min de descanso.
Se excluyó a las embarazadas con polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor del percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre o gestacional, hábito tabáquico. También se excluyeron las pacientes que se negaron a participar en la investigación.
Se tomó una muestra de 10mL de sangre en un tubo libre de pirógenos con EDTA (1mg/mL) en todas las pacientes antes del parto, y en los grupos de estudio, inmediatamente después del diagnóstico y antes de cualquier intervención. Las muestras se centrifugaron inmediatamente a 1,500g durante 10min. El plasma fue separado, protegido de la oxidación al agregarle hidroxitolueno butilado (Sigma Chemical, St. Louis, EE. UU.), y almacenado a −70°C. Las concentraciones totales de 8-isoprostano se midieron usando un kit de inmunoanálisis enzimático comercial según las instrucciones del fabricante (Cayman Chemical, Ann Arbor, EE. UU). El intervalo de la curva estándar fue de 3.9 a 500pg/mL. Las muestras fueron evaluadas en 50picoL después de una dilución de 1:10 o 1:20. Las muestras se leyeron a 420nm en un autolector Spectra (Tecan, Research Triangle Park, EE. UU.) y los valores se expresan en pg/mL. Todas las mediciones fueron hechas por duplicado y el promedio fue el resultado final. Los coeficientes de variación intra e interensayo fueron menores del 10%.
El análisis estadístico usó los procedimientos disponibles en el programa del Sistema de Análisis Estadístico (SAS Institute, EE. UU.). Los datos se presentan como valores promedios±desviación estándar. El análisis estadístico entre los grupos se realizó con la prueba de ANOVA con posprueba de Dunnett para comparar las características demográficas, el promedio de presión arterial y las concentraciones de isoprostano-8 entre los grupos, tomando como controles a las normotensas sanas (grupo D). Los coeficientes de correlación entre isoprostano-8 y los parámetros de laboratorio en las preeclámpticas y eclámpticas se evaluaron usando la prueba de Pearson. Se consideró un valor p<0.05 como estadísticamente significativo.
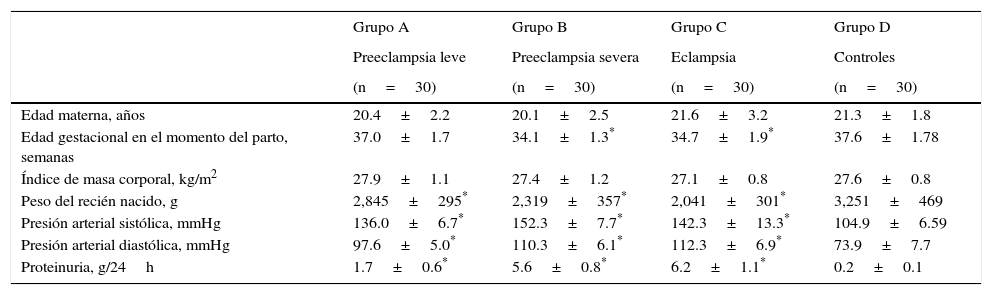
ResultadosLas características generales de las pacientes de los 4 grupos se muestran en la tabla 1. No hubo diferencias significativas en la edad materna ni el índice de masa corporal entre el grupo control y los grupos de estudio. Se encontraron diferencias estadísticamente significativas en la edad gestacional en el momento del parto entre los grupos B y C comparados con el control (p<0.05). También se encontraron diferencias estadísticamente significativas entre el grupo control y los 3 grupos de estudio con respecto al peso de los recién nacidos (p<0.05). Se observaron diferencias estadísticas en los valores promedio de presión arterial sistólica, presión arterial diastólica y proteinuria de los 3 grupos en estudio comparados con el control (p<0.05).
Características generales de los grupos de estudio y control
| Grupo A | Grupo B | Grupo C | Grupo D | |
|---|---|---|---|---|
| Preeclampsia leve | Preeclampsia severa | Eclampsia | Controles | |
| (n=30) | (n=30) | (n=30) | (n=30) | |
| Edad materna, años | 20.4±2.2 | 20.1±2.5 | 21.6±3.2 | 21.3±1.8 |
| Edad gestacional en el momento del parto, semanas | 37.0±1.7 | 34.1±1.3* | 34.7±1.9* | 37.6±1.78 |
| Índice de masa corporal, kg/m2 | 27.9±1.1 | 27.4±1.2 | 27.1±0.8 | 27.6±0.8 |
| Peso del recién nacido, g | 2,845±295* | 2,319±357* | 2,041±301* | 3,251±469 |
| Presión arterial sistólica, mmHg | 136.0±6.7* | 152.3±7.7* | 142.3±13.3* | 104.9±6.59 |
| Presión arterial diastólica, mmHg | 97.6±5.0* | 110.3±6.1* | 112.3±6.9* | 73.9±7.7 |
| Proteinuria, g/24h | 1.7±0.6* | 5.6±0.8* | 6.2±1.1* | 0.2±0.1 |
Datos expresados como promedio±desviación estándar.
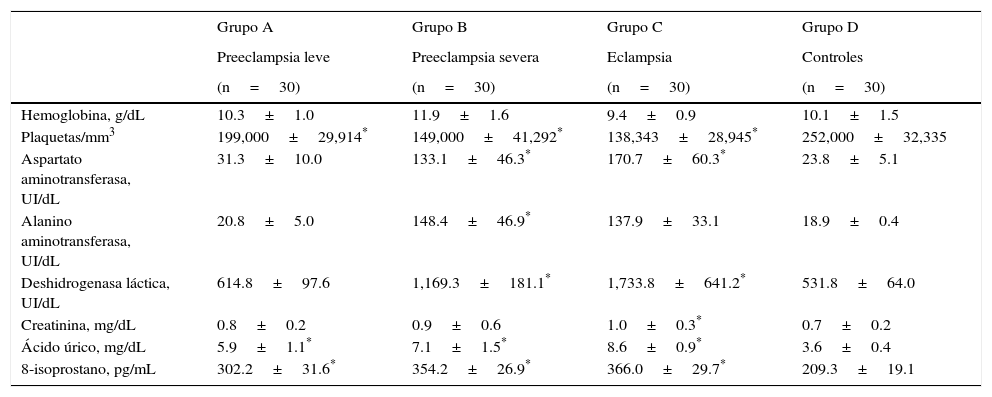
Las pacientes con preeclampsia severa presentaron las mayores concentraciones de hemoglobina de los 4 grupos estudiados, siendo esta diferencia estadísticamente significativa comparada con el grupo control (p<0.05). Las pacientes con preeclampsia severa y las eclámpticas presentaron valores más altos de transaminasas, deshidrogenasa láctica y ácido úrico comparadas con los sujetos control (p<0.05; tabla 2). Los niveles promedio de plaquetas fueron significativamente menores en los 3 grupos de estudio comparados con el control (p<0.05).
Parámetros de laboratorio de los grupos de estudio y control
| Grupo A | Grupo B | Grupo C | Grupo D | |
|---|---|---|---|---|
| Preeclampsia leve | Preeclampsia severa | Eclampsia | Controles | |
| (n=30) | (n=30) | (n=30) | (n=30) | |
| Hemoglobina, g/dL | 10.3±1.0 | 11.9±1.6 | 9.4±0.9 | 10.1±1.5 |
| Plaquetas/mm3 | 199,000±29,914* | 149,000±41,292* | 138,343±28,945* | 252,000±32,335 |
| Aspartato aminotransferasa, UI/dL | 31.3±10.0 | 133.1±46.3* | 170.7±60.3* | 23.8±5.1 |
| Alanino aminotransferasa, UI/dL | 20.8±5.0 | 148.4±46.9* | 137.9±33.1 | 18.9±0.4 |
| Deshidrogenasa láctica, UI/dL | 614.8±97.6 | 1,169.3±181.1* | 1,733.8±641.2* | 531.8±64.0 |
| Creatinina, mg/dL | 0.8±0.2 | 0.9±0.6 | 1.0±0.3* | 0.7±0.2 |
| Ácido úrico, mg/dL | 5.9±1.1* | 7.1±1.5* | 8.6±0.9* | 3.6±0.4 |
| 8-isoprostano, pg/mL | 302.2±31.6* | 354.2±26.9* | 366.0±29.7* | 209.3±19.1 |
Datos expresados como promedio±desviación estándar.
Las concentraciones de isoprostano-8 en cada uno de los grupos se muestran en la tabla 2 y la figura 1. Los valores más elevados se observaron en el grupo de eclámpticas (366.0±29.7 pg/mL) junto a las que tienen una preeclampsia severa (354.2±26.9pg/mL). También se encontraron valores elevados en las que tenían preeclampsia leve (302.2±31.6 pg/mL). Los grupos de estudio presentaron valores de isoprostano-8 significativamente menores que el control (209.3±19.1pg/mL; p<0.05).
Al correlacionar las concentraciones de isoprostano-8 con los diferentes parámetros de laboratorio se observó una correlación positiva y significativa con los valores de proteinuria de 24h (r=0.445; p<0.05), la alanino aminotransferasa (r=0.356; p<0.05), la aspartato aminotransferasa (r=0.314; p<0.05), el ácido úrico (r=0.219; p<0.05) y la creatinina (r=0.054; p<0.05), y una correlación negativa y significativa con el número de plaquetas (r=−0.170; p<0.05). El análisis de regresión lineal mostró que el factor que se relacionaba significativamente con la concentración plasmática de isoprostano-8 era el valor de la proteinuria de 24h (p<0.05).
DiscusiónLos hallazgos de un aumento de las concentraciones de 8-isoprostano en esta investigación indican un incremento del estrés oxidativo en la circulación materna en el grupo de preeclámpticas y eclámpticas comparado con el grupo de embarazadas normotensas sanas. Estos hallazgos son similares a los reportados por Barden et al.11 y contrarios a lo reportado en otras investigaciones previas10,12.
El estrés oxidativo es un fenómeno normal en las embarazadas normotensas. Sin embargo, el estrés oxidativo en la preeclampsia es exagerado13,14. Esta inflamación exagerada inducida por la exposición del endotelio a sustancias proinflamatorias, al igual que el estrés oxidativo, puede llevar a una disfunción vascular. Varios estudios han involucrado al estrés oxidativo como un intermediario clave en el desarrollo de la preeclampsia15,16. Todos estos efectos pueden ser evaluados y monitorizados por la determinación de las concentraciones de biomarcadores como malondialdehído e isoprostano17.
El incremento de las concentraciones de 8-isoprostano en las preeclámpticas de está investigación indica un aumento de la conversión de isoprostano de la forma esterificada a la forma libre, por lo cual estaría disponible para su paso a la circulación materna y fetal. El aumento de estos valores en la preeclampsia puede ser secundario al incremento en la actividad de la fosfolipasa A2 placentaria, la cual está aumentada en la preeclampsia18. Por otra parte, los explantes de placenta normal expuestos al anión superóxido (generados por la xantina más la oxidasa de xantina) producen isoprostano a una tasa equivalente a los explantes placentarios de las preeclámpticas. Esto evidencia que el incremento de las concentraciones de isoprostano en la preeclampsia ocurre en respuesta al estrés oxidativo9.
Las diferencias en las concentraciones de 8-isoprostano entre los grupos de pacientes seleccionadas no son inesperadas debido a que estas ya presentaban manifestaciones clínicas de la enfermedad en el momento de la toma de la muestra. Al igual que varios estudios previos que demostraban que las concentraciones de 8-isoprostano eran más elevadas en las preeclámpticas leves y severas que en las embarazadas normotensas19. Los resultados de esta investigación demostraron un aumento en los valores séricos de 8-isoprostano con relación a la gravedad del síndrome. Estos hallazgos difieren de informes previos que reportan concentraciones de isoprostano urinario similares entre las preeclámpticas y las controles20.
El estrés oxidativo se ha asociado tanto con aterosclerosis como con el desarrollo de disfunción endotelial observado en la preeclampsia21. Este aumento del estrés oxidativo con posterior liberación de 8-isoprostano a la circulación materna fue demostrado por Walsh et al.9 en placentas de preeclámpticas ex vivo. Por lo tanto, es posible que las elevaciones de las concentraciones de 8-isoprostano observadas en la circulación materna de las preeclámpticas pueda ser un reflejo de la relativa hipoxia en la circulación uteroplacentaria.
Se ha demostrado que el 8-isoprostano ejerce una potente actividad vasoconstrictora en pulmón, riñón, arteriolas cerebrales y vena porta hepática, aparentemente actuando a través de los receptores de endoperóxido-tromboxano A2 (prostaglandina H2)22. Estos hallazgos pueden explicar las alteraciones renales y hepáticas en presencia de un aumento de las concentraciones del isoprostano en las preeclámpticas. También se ha descrito el aumento de la secreción de la endotelina 1 en la preeclampsia23 y el estímulo que esta produce sobre la liberación de isoprostanos24. Diferentes estudios han planteado la posible presencia de un receptor para isoprostanos, lo cual explicaría los efectos sobre la actividad endotelial24.
La elevación de las concentraciones de 8-isoprostano en la preeclampsia (y su correlación positiva con los valores de la proteinuria de 24h, el ácido úrico y la creatinina) posiblemente puede explicar la alteración de la función renal en las preeclámpticas, ya que las concentraciones de peróxidos lipídicos son las responsables del síndrome materno en las preeclámpticas. También ha sido implicado como un mediador causal del síndrome hepatorrenal con toxicidad pulmonar. Las concentraciones elevadas indican una deficiencia de mecanismos antioxidantes sistémicos y altos niveles de estrés25.
Un elemento importante es que las concentraciones de 8-isoprostano permanecen sin alteraciones durante el embarazo de bajo riesgo de las mujeres que no desarrollan preeclampsia26. Por lo tanto, es poco probable que las diferencias en la edad gestacional disminuyan las desigualdades observadas en las concentraciones de 8-isoprostano entre los 4 grupos. Se necesitan estudios longitudinales para demostrar en qué momento del embarazo en mujeres que desarrollan preeclampsia para demostrar las modificaciones de las concentraciones plasmáticas en comparación con las mujeres que no desarrollan la enfermedad y si la severidad de esta se asocia con la elevación de las concentraciones de este marcado de estres oxidativo.
ConclusiónLos hallazgos de esta investigación demuestran que las pacientes eclámpticas y preeclámpticas presentan concentraciones plasmáticas de 8-isoprostano significativamente más elevadas que las embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.