La persistencia del conducto arterioso hemodinámicamente significativo incrementa la morbimortalidad de los recién nacidos prematuros.
ObjetivoConocer la incidencia de persistencia del conducto arterioso, porcentaje de éxito y fracaso al cierre con ibuprofeno y causas de fracaso.
Material y métodosEstudio retrospectivo de pacientes que recibieron uno o 2 ciclos de ibuprofeno para cierre de persistencia del conducto arterioso de junio 2011 a octubre 2012 en la Unidad de Cuidados Intensivos Neonatales del Instituto Nacional de Perinatología: dosis inicial (10mg/kg/día) y 2 dosis de mantenimiento (5mg/kg/día) cada 24h.
ResultadosSe presentaron 64 casos de 295 ingresos (21.6%), se excluyeron 22 casos por no reunir los criterios de inclusión, quedando para el análisis 42 pacientes. Edad al diagnóstico 5 días (±3.1), edad al tratamiento 5.3 días (±5.6), porcentaje de éxito con el primer ciclo de tratamiento del 47.7%. Para el segundo ciclo: edad al tratamiento 9 días (±2.9), éxito del 42.8%, fracaso del 57.1%. De los pacientes que ameritaron cierre quirúrgico, la edad al tratamiento fue 19.1 días (±7.0). Cuatro pacientes (6%) desarrollaron insuficiencia renal aguda asociada a ibuprofeno.
ConclusionesNo se encontró diferencia en el éxito para el primer o segundo ciclo (47.7 vs. 42.8%) (p=1). Con las dosis de ibuprofeno actualmente utilizadas, el porcentaje de éxito en un segundo ciclo es menor pero no significativo. No encontramos diferencias en cuanto al porcentaje de éxito que se relacionen con los líquidos administrados, la presencia de sepsis, el uso de ventilación mecánica y/o furosemida, y tampoco el inicio posterior al quinto día de vida se asocia a incremento en el porcentaje de fracaso.
Haemodynamically significant patent ductus arteriosus increases morbidity-mortality rates in premature newborns.
ObjectiveTo determine the incidence of patent ductus arteriosus in our population, as well as the closure rates of success and failure with ibuprofen and other related causes for failure.
Materials and methodsA retrospective study was conducted on of 42 patients treated with one or 2 cycles of ibuprofen for patent ductus arteriosus closure from June 2011 to October 2012 at Instituto Nacional de Perinatología, Mexico City. The initial dosage was10mg/kg/day, and 2 additional doses of 5mg/kg/day.
ResultsThere were 64 cases out of 295 admissions. Age at diagnosis: 5.0 days (±3.1); age at beginning of treatment: 5.3 days (±5.6). Rate of success for first cycle: 47.7%. If a second cycle was necessary the age at treatment was 9 days (±2.9), the success rate was 42.8% and the failure rate was 57.1%. If surgical closure was necessary, treatment was administered at 19.1 days (±7). Four patients (6%) developed acute renal failure associated with the use of ibuprofen.
ConclusionsThere were no statistical differences in the rate of success for the closure of patent ductus arteriosus with the first or second cycle of ibuprofen (47.7% vs 42.8%) (p=1). With ibuprofen dosages actually used, the success rate for the closure of PDA is less with the second cycle than with the first one, but is not significant. There were no differences as regards IV fluids, neonatal sepsis, mechanical ventilation, or diuretics. Starting treatment after the 5th day is associated with an increase in the failure rate.
El conducto arterioso es la estructura encargada de mantener el cortocircuito que desvía la sangre del sistema de alta resistencia que representa la vasculatura pulmonar hacia la circulación sistémica, perfundiendo así los órganos durante la vida fetal. Al nacer ocurren varios cambios que propician su obliteración: cesa la circulación placentaria, las resistencias vasculares sistémicas cambian de 18-28mmHg en la etapa fetal a 40-60mmHg tras el nacimiento1–4.
De acuerdo al estudio realizado por Koch et al.2, el conducto arterioso puede continuar permeable incluso a los 10 días de vida extrauterina hasta en el 40% de los prematuros extremos sin que estos presenten repercusión clínica, datos radiológicos o complicaciones5. La mayoría de los estudios epidemiológicos retrospectivos han evidenciado la asociación entre un conducto arterioso significativo y diversas enfermedades tales como:
- 1)
Hemorragia pulmonar: Kluckow y Evans mediante ecocardiografía demostraron una relación entre el diámetro del conducto, el tamaño del cortocircuito y el flujo sanguíneo pulmonar6.
- 2)
Displasia broncopulmonar: Marshall et al. encontraron un riesgo relativo de 1.9 para el desarrollo de displasia broncopulmonar en los pacientes con conducto hemodinámicamente significativo sometidos a ventilación mecánica7.
- 3)
Hipotensión: Sarkar et al. tras evaluar a 89 recién nacidos encontraron asociación entre hipotensión refractaria a aminas y la presencia de persistencia del conducto arterioso (PCA), estableciendo un riesgo relativo de 7.68.
- 4)
Enterocolitis necrosante: Dollberg et al. realizaron un estudio en recién nacidos de muy bajo peso al nacer, encontrando una asociación entre la persistencia del conducto arterioso y la presencia de enterocolitis con riesgo relativo de 1.89.
- 5)
Hemorragia intraventricular: Evans y Kluckow demostraron que los pacientes con PCA que genera repercusión (grandes y con gasto ventricular derecho bajo) mostraron mayor evidencia de hemorragia intraventricular severa10.
Estas morbilidades en forma aislada o combinada incrementan la mortalidad de los recién nacidos prematuros, especialmente de aquellos con peso extremadamente bajo al nacer11.
La descripción de la relación entre las prostaglandinas y la persistencia del conducto fue observada por primera vez por Arcilla et al. en la década de los sesenta cuando describieron el cierre del conducto anticipado en un recién nacido de una madre que fue tratada con salicilatos para poliartritis aguda por lo que dedujeron que los inhibidores de prostaglandinas tienen efecto en el cierre del conducto arterioso12. Coceani et al. encontraron en un modelo animal que el ibuprofeno y otros fármacos antiinflamatorios no esteroideos son adecuados para el manejo de la PCA13. Desde entonces varios medicamentos han sido utilizados de manera anecdótica para el tratamiento del cierre del conducto arterioso tales como: paracetamol14,15, ácido mefenámico16,17, ácido acetilsalicílico18 y el sulindaco19.
Pese a los diferentes protocolos de manejo y métodos empleados, los medicamentos más estudiados tanto para la profilaxis como para el tratamiento de la PCA son la indometacina y el ibuprofeno20. El mecanismo no selectivo de inhibición de la enzima ciclooxigenasa de la indometacina es el responsable de los efectos adversos o no deseados que pueden ocurrir durante su administración, tales como lesión a la sustancia blanca por disminución del flujo sanguíneo, enterocolitis necrosante, perforación intestinal, daño renal y disfunción plaquetaria, que la mayoría de las veces son reversibles y afectan solo de forma transitoria21,22.
La búsqueda de un tratamiento con eficacia similar a la indometacina para el cierre del conducto arterioso y menores efectos adversos evidenció al ibuprofeno como una alternativa. Ohlsson et al. en la revisión sistemática de Cochrane determinaron su eficacia y seguridad al ser comparado con la evolución sin tratamiento o con placebo en prematuros de bajo peso al nacer; no encontraron diferencia estadística significativa en la efectividad del ibuprofeno comparado con la indometacina, reduce el riesgo de enterocolitis necrosante (riesgo relativo: 0.68, IC del 95% 0.47, 0.99 y tiene pocos efectos adversos en la función renal ya que con su uso hay menor disminución del gasto urinario (riesgo relativo: 0.28, IC del 95% 0.14, 0.54) y menor elevación de los niveles séricos de creatinina (WMD -15.9mmol/L, IC del 95% -31.8, -0.04). Dentro de las conclusiones afirman que tanto el ibuprofeno como la indometacina pueden utilizarse para el cierre de PCA, pero que el clínico debe conocer que ambos fármacos están asociados a efectos adversos23.
Por otra parte y debido a que en México no se dispone de ibuprofeno intravenoso es importante reconocer los posibles beneficios del tratamiento con ibuprofeno vía oral, para lo cual Neumann et al. en una revisión sistemática compararon la eficacia entre 2 diferentes modalidades de administración del fármaco, en la que reportaron una mayor tasa de cierre de PCA cuando se administra ibuprofeno vía oral versus intravenoso; a su vez no demostraron diferencia entre ibuprofeno oral e indometacina intravenosa. Cabe destacar que este metaanálisis no encontró diferencia significativa en el desarrollo de efectos adversos entre las diferentes modalidades de tratamiento24.
El objetivo del presente trabajo fue conocer la incidencia de PCA en los pacientes tratados en la Unidad de Cuidados Intensivos Neonatales del Instituto Nacional de Perinatología y determinar el porcentaje de éxito del tratamiento farmacológico con ibuprofeno.
Material y métodosPoblaciónSe realizó un estudio retrospectivo donde se incluyó a todos aquellos recién nacidos que ingresaron a la Unidad de Cuidados Intensivos Neonatales del Instituto Nacional de Perinatología en el periodo comprendido entre junio del 2011 y octubre del 2012, que durante su estancia fueron diagnosticados con PCA.
El diagnóstico de PCA se sospechó ante la presencia de datos clínicos (taquicardia, precordio hiperdinámico, deterioro del estado respiratorio, taquipnea, apnea, soplo, pulsos «saltones», dependencia o dificultad para retiro de CPAP o ventilación mecánica, acidosis metabólica) y se confirmó por ecocardiografía doppler bidimensional a color realizada por un cardiólogo pediatra considerándolo hemodinámicamente significativo si se evidenciaba un cortocircuito de izquierda a derecha y distensión de la aurícula izquierda.
Cada ciclo de ibuprofeno se administró con una dosis inicial a 10mg/kg/día, seguido de 2 dosis adicionales a 5mg/kg/día por vía intravenosa con un intervalo de 24h entre cada una.
Los ecocardiogramas de control se efectuaron cuando los datos clínicos de PCA persistían a pesar de la maniobra terapéutica o al término de cada ciclo de ibuprofeno.
Recolección de datosDel expediente clínico se obtuvieron las características demográficas de los pacientes: edad gestacional, peso al nacer, edad al momento del diagnóstico y al inicio del tratamiento médico con ibuprofeno, cierre exitoso (definido como el cierre anatómico o funcional corroborado por ecocardiograma), así como necesidad de tratamiento quirúrgico.
Se analizaron las variables que pudieran contribuir a la falla en el cierre de PCA como sepsis neonatal (definida como la presencia de datos de respuesta inflamatoria sistémica, cambios en la biometría hemática sugerentes de infección o reporte de cultivos positivos 24h previas al diagnóstico de PCA), líquidos parenterales administrados al momento del diagnóstico y uso de diuréticos de asa.
Análisis estadísticoLa muestra estuvo constituida por el número total de pacientes con diagnóstico de PCA que iniciaron tratamiento con ibuprofeno para cierre farmacológico en el periodo establecido. Para la descripción de las variables demográficas se utilizaron promedios, desviaciones estándar y porcentajes. Las variables cuantitativas se analizaron mediante t de Student y las cualitativas mediante X2, considerándose significación estadística al obtener un valor de p≤0.05.
El análisis estadístico fue realizado mediante el programa Statistical Package for Social Sciences (SPSS) versión 18.0.
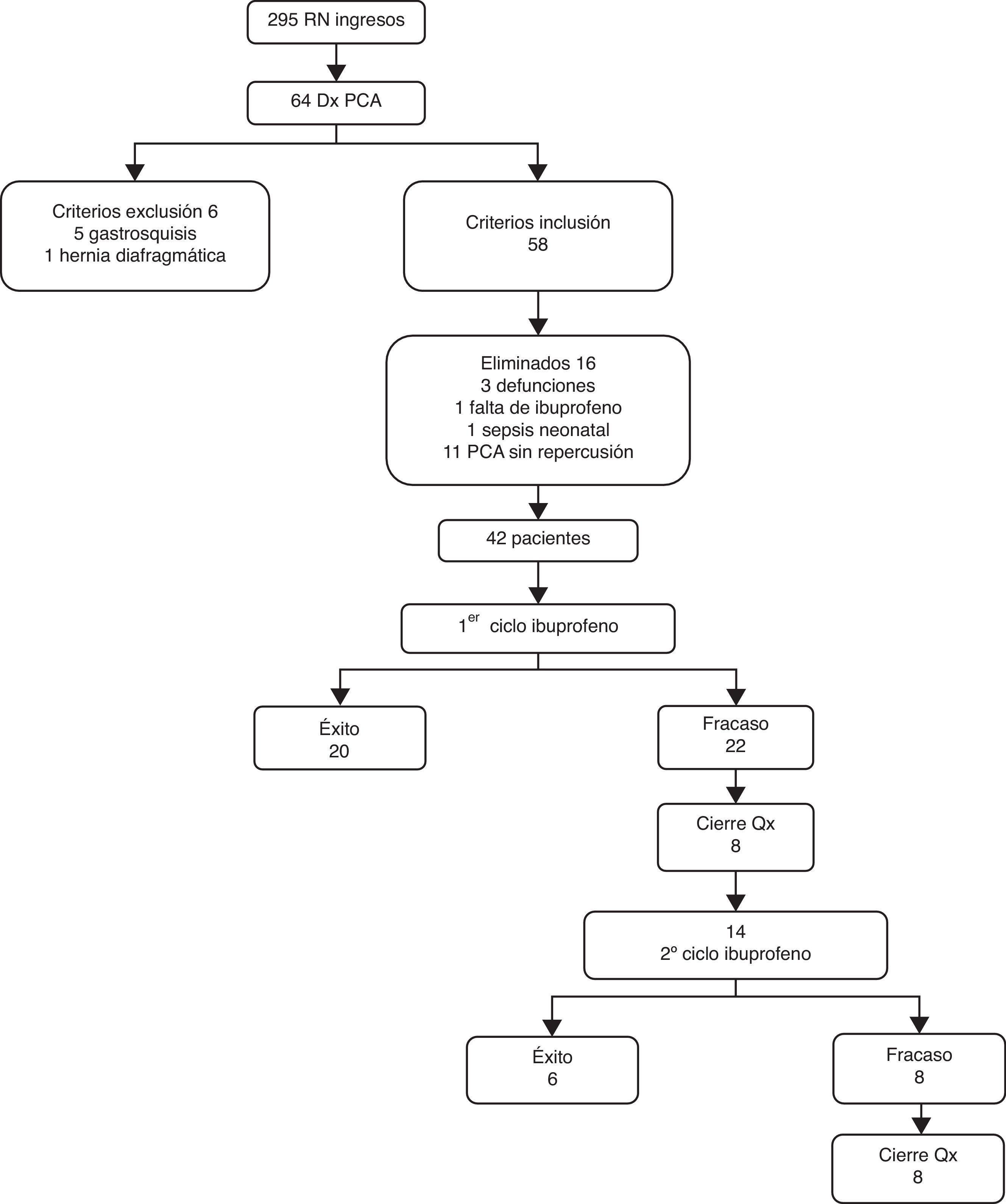
ResultadosDurante el periodo de estudio ingresaron a la Unidad de Cuidados Intensivos Neonatales 295 pacientes. La incidencia de PCA fue del 21.6% (64/295). Se excluyeron del estudio 6 pacientes por presentar malformaciones congénitas mayores, siendo la principal gastrosquisis (5 pacientes) seguido de hernia diafragmática (un paciente). Se eliminaron del análisis 3 pacientes por defunción previo al inicio del tratamiento, un paciente por no contar con ibuprofeno, uno por sepsis al momento del diagnóstico y 11 por no tener repercusión hemodinámica en el ecocardiograma y por ende no ameritar tratamiento (fig. 1).
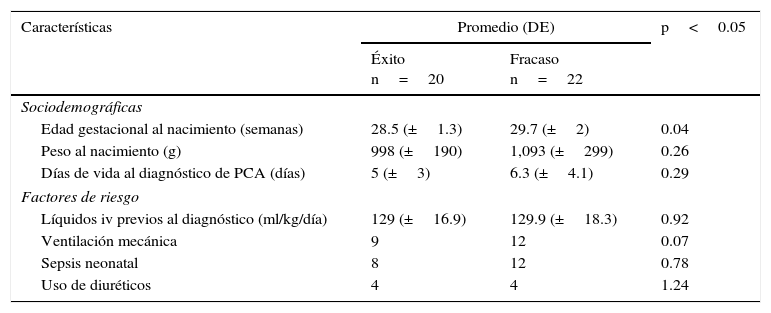
Al analizar el diagnóstico de PCA comparando los grupos de éxito y fracaso, este se realizó en promedio dentro de la primera semana de vida. No se encontraron diferencias significativas para las variables estudiadas al inicio del tratamiento (primer ciclo), excepto la edad gestacional al nacimiento que fue menor para el grupo de éxito (tabla 1). De los 42 pacientes que recibieron el primer ciclo de tratamiento, el 47.7% tuvo éxito y el 52.3% fracaso al cierre farmacológico (p=1). Durante el primer ciclo de tratamiento, el promedio de días de vida del grupo de éxito fue 5 (±3.1) contra 6.3 (±4) de los que fracasaron (p=0.12). Para el segundo ciclo, el promedio del grupo de éxito fue de 9 (±2.9) contra 13.6 (±4.8) días del grupo que fracaso (p=0.05) (tabla 2).
Características de la población del primer ciclo con ibuprofeno (n=42)
| Características | Promedio (DE) | p<0.05 | |
|---|---|---|---|
| Éxito n=20 | Fracaso n=22 | ||
| Sociodemográficas | |||
| Edad gestacional al nacimiento (semanas) | 28.5 (±1.3) | 29.7 (±2) | 0.04 |
| Peso al nacimiento (g) | 998 (±190) | 1,093 (±299) | 0.26 |
| Días de vida al diagnóstico de PCA (días) | 5 (±3) | 6.3 (±4.1) | 0.29 |
| Factores de riesgo | |||
| Líquidos iv previos al diagnóstico (ml/kg/día) | 129 (±16.9) | 129.9 (±18.3) | 0.92 |
| Ventilación mecánica | 9 | 12 | 0.07 |
| Sepsis neonatal | 8 | 12 | 0.78 |
| Uso de diuréticos | 4 | 4 | 1.24 |
DE: desviación estándar; iv: intravenosos; PCA: persistencia del conducto arterioso.
p: valor de p al comparar los promedios por la prueba t de Student o X2 para los grupos (éxito vs. fracaso).
Al comparar el promedio de los días de vida al inicio del tratamiento, 5.3 para los del primer ciclo y 9 días para los del segundo ciclo, se encontró una significación limítrofe (p=0.054).
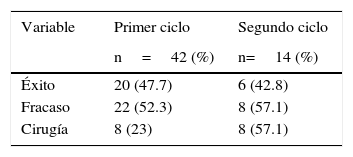
En la tabla 3 se presentan los pacientes que recibieron cierre quirúrgico: De los pacientes del primer ciclo el 23% necesitó cierre y del segundo el 57.1% con una p significativa de 0.002. Los días de vida en los que se realizó el cierre quirúrgico fueron más para el segundo ciclo con significación de p=0.04.
Pacientes con cierre quirúrgico por falla al ibuprofeno
| Variable | Primer ciclo | Segundo ciclo | p |
|---|---|---|---|
| n=42 | n=14 | ||
| Pacientes cierre quirúrgico | 8 (23%) | 8 (57.1%) | 0.009 |
| Días de vida al cierre quirúrgico (promedio ±DE) | 17.7 (±4.5) | 21.3 (±7.7) | 0.049 |
DE: desviación estándar.
p: valor de p al comparar los promedios por la prueba t de Student.
Los resultados de este estudio mostraron que la incidencia de PCA fue del 21.6%, pero cuando se agruparon por peso al nacimiento se reportó una incidencia del 26% para pacientes<1,000g y de 29% para pacientes<1,500g comparable a lo reportado por Lee et al. de 28% para la misma población25.
Estos hallazgos confirman la asociación inversamente proporcional entre la edad posnatal avanzada al inicio del primer ciclo de tratamiento medicamentoso y la falla en el cierre del conducto. El porcentaje de éxito es mayor cuando se inicia antes del término de la primera semana de vida (5±3.1), similar a lo descrito por van der Lugt et al.26 en un estudio retrospectivo donde la tasa de cierre después del primer ciclo de ibuprofeno se incrementaba significativamente si el tratamiento con ibuprofeno se empezaba antes de los 5 días de vida posnatal con una significación estadística (p=0.036).
Diversos estudios comparan indometacina vs. ibuprofeno para profilaxis o tratamiento de la PCA, y este último es considerado menos nefrotóxico23, pero no está exento de causar efectos adversos a nivel renal como incremento de la creatinina sérica y oliguria (1-20% de los casos)26,27. En nuestro estudio se encontraron 4 pacientes (9.5%) que presentaron insuficiencia renal aguda, 3 de ellos se diagnosticaron posterior al término del primer ciclo por lo que se indicó el cierre quirúrgico, y el último se detectó tras la segunda dosis del primer ciclo, sin embargo en el ultrasonido de control se encontró que el conducto ya se encontraba cerrado por lo que se consideró un cierre farmacológico exitoso.
Lee et al. recientemente reportaron que en 68 recién nacidos prematuros menores de 34 semanas de gestación el uso de furosemida en combinación con indometacina incrementa la incidencia de falla renal aguda comparada con un grupo control (58 vs. 10%) (p<0.001) pero no afecta el porcentaje de cierre de la PCA28. No encontramos ningún estudio que explore la combinación de furosemida con ibuprofeno. Sin embargo en nuestro estudio no se encontró diferencia estadísticamente significativa en cuanto al éxito o fracaso en el cierre con ibuprofeno cuando se utilizó furosemida.
Referente a la administración de líquidos intravenosos previos al diagnóstico de PCA, Niwas et al.29 estudiaron la morbimortalidad de 2 cohortes históricas de pacientes con peso al nacimiento<900g a los que se les administró líquidos iniciales a 155 vs. 125ml/kg/día, sin diferencias entre los grupos. Stephens et al. encontraron que la administración de líquidos alta (>170ml/kg/día) tanto en el primer día como en el tercero se asoció con un incremento en el riesgo de PCA (OR primer día 1.014, IC del 95% 1.001,1.028 y en el día 3 OR 1.02, IC del 95% 1.004,1.040)30. En nuestro estudio el promedio de líquidos intravenosos administrados previos al diagnóstico de PCA fue de 129ml/kg/día para el grupo de éxito y 129.9ml/kg/día para el grupo de fracaso sin significación estadística.
El porcentaje de éxito para el cierre del conducto con ibuprofeno se reporta en la literatura mundial desde el 46.6% hasta 93%20,27,31. Para nuestra población el porcentaje de éxito posterior al primer ciclo fue del 47.7% y para el segundo ciclo del 42.8%, lo que nos sitúa dentro de los porcentajes menores de éxito, probablemente debido a los días de vida extrauterina en que se inicia el tratamiento (primer ciclo 5, segundo ciclo 9) (tabla 4).
Tratando de explicar el alto porcentaje de falla al tratamiento con el ibuprofeno en nuestra población se puede argumentar que este es metabolizado por el complejo enzimático del citocromo P450 y más específicamente por las subfamilias CYP2C9 y CYP2C8 las cuales se encuentra en menores proporciones en los recién nacidos y se incrementa constantemente durante la primera semana de vida hasta alcanzar un tercio del valor normal del adulto al final del primer mes32. Este efecto sobre la madurez fisiológica podría explicar el aumento significativo en el aclaramiento del fármaco conforme avanza la edad posnatal. Este conocimiento se correlaciona con los hallazgos encontrados por Hirt et al.33 donde el éxito de cierre con ibuprofeno a dosis estándar (10-5-5mg/kg/día) fue menor conforme avanzó la edad postnatal: el 100% de éxito para pacientes menores de 30h, el 91% para menores de 70h, el 87% para neonatos entre 70-108horas y solo el 70% para mayores de 108h de vida. De acuerdo a las características farmacocinéticas del ibuprofeno en función de la edad posnatal y para mejorar el éxito del tratamiento para la PCA sugieren el siguiente esquema de tratamiento independientemente de la edad gestacional: 10-5-5mg/kg/día para neonatos menores de 70h, 14-7-7mg/kg/día para neonatos entre 70-108h y 18-9-9mg/kg/día para neonatos entre 108-180h.
Desfrere et al.34 encontraron que con las dosis actuales recomendadas de ibuprofeno la probabilidad de éxito para el cierre de la PCA en pacientes menores de 27 semanas de gestación es solo del 30.6% y fueron los primeros en proponer el uso de dosis mayores, con una dosis inicial de 20ml/kg/día seguidos de 2 dosis de 10mg/kg/día con intervalo cada 24h con incremento de la probabilidad de éxito de hasta el 54.8%.
En un estudio aleatorizado que comparó la eficacia para el cierre de la PCA con dosis estándar de tratamiento con ibuprofeno (10-5-5mg/kg/día) versus dosis altas (20-10-10mg/kg/día) se encontró un porcentaje de falla menor cuando se utilizaron dosis mayores (37 vs. 14%). Los autores proponen que un abordaje racional para el tratamiento precoz de la PCA en neonatos extremadamente prematuros sería administrar un primer curso a dosis estándar seguida de un ciclo a dosis altas en los pacientes que no responden al tratamiento35. Este enfoque tiene en consideración que los primeros días de vida son particularmente críticos para la función renal y, como ya se mencionó anteriormente, el aclaramiento del ibuprofeno aumenta después del nacimiento.
Reconocemos que hay muchas limitaciones potenciales de este estudio, entre ellas el diseño ya que se trata de un estudio retrospectivo además de incluir una muestra relativamente pequeña de población, sin embargo puede ser la base de un futuro estudio controlado aleatorizado en donde se pueda determinar los resultados del tratamiento con segundos ciclos a dosis mayores y su porcentaje de éxito.
Conclusiones- -
El mayor porcentaje de éxito para el cierre de PCA con ibuprofeno a dosis estándar (10-5-5mg/kg/día) se obtiene cuando se diagnostica y maneja en la primera semana de vida
- -
Al utilizar un segundo ciclo de ibuprofeno a partir de la segunda semana de vida no hay diferencias significativas entre iniciarlo de manera temprana o tardía
- -
Con las dosis de ibuprofeno actualmente utilizadas, el porcentaje de éxito en un segundo ciclo es menor que con el primer ciclo pero sin diferencias significativas
- -
No encontramos diferencias en cuanto al porcentaje de éxito que se relacionen con los líquidos administrados, la presencia de sepsis, el uso de ventilación mecánica y/o furosemida.
Los autores declaran no tener ningún conflicto de intereses.