Comentario
Edición Española
"EFECTO DEL ANTAGONISMO DEL RECEPTOR A1 DE LA ADENOSINA EN LA REANUDACIÓN DE LA CIRCULACIÓN ESPONTÁNEA Y EN LA SUPERVIVENCIA A CORTO PLAZO EN LA FIBRILACIÓN VENTRICULAR PROLONGADA"
Fernando Rosell Ortiz
Médico. Emergencias Sanitarias de Andalucía. Servicio provincial 061- Almería. Almería. España
LA INFLUENCIA DEL TIEMPO DE EVOLUCIÓN DE LA PARADA CARDIORRESPIRATORIA (PCR) EN LA SUPERVIVENCIA DE LOS PACIENTES ESTÁ BIEN ESTABLECIDA. Incluso se sabe que la probabilidad de éxito en la atención de la PCR extrahospitalaria de un servicio de emergencias, depende de la capacidad de sus recursos de alcanzar al paciente en los primeros minutos de evolución del paro1. Esta lucha contra el tiempo se ha plasmado en diferentes líneas de trabajo. La primera, la más extendida y contrastada, es la concienciación y la participación ciudadana en la ayuda al paciente que presenta una PCR. Está demostrado que las paradas presenciadas y aquellas en las que se inician maniobras de reanimación por testigos presentan mejores datos de supervivencia2. Es la constatación de que una atención precoz es la mejor garantía de éxito. La formación y la lucha contra las barreras para que los ciudadanos participen es, por tanto, uno de los ejes para la mejora de la supervivencia3,4. Otra línea de trabajo e investigación es trasladar el tratamiento eléctrico de la fibrilación ventricular (FV) y la taquicardia ventricular sin pulso al escenario más próximo al paciente. El avance tecnológico de los desfibriladores externos semiautomáticos, la posibilidad de utilización por personal no sanitario gracias a su simplicidad y facilidad de uso, así como la progresiva reducción de su precio, ha permitido acercar un eslabón de la cadena de supervivencia al paciente con resultados tangibles en supervivencia5. La tercera línea de lucha contra el tiempo tiene una sólida base fisiopatológica centrada en cómo evoluciona una PCR a medida que van transcurriendo los minutos. El reconocimiento de que una PCR evoluciona con el tiempo, atravesando 3 fases, fase eléctrica, circulatoria y metabólica6, ha supuesto cambios conceptuales que se han trasladado a la práctica asistencial intentando poner el acento en cómo atender una PCR en función del momento en que se alcanza al paciente7,8.
Esta línea abre otras consideraciones sobre alternativas de tratamiento, ¿podemos retrasar el deterioro de la FV para prolongar el momento óptimo de tratamiento?, ¿sería posible retrasar la fase circulatoria mediante un tratamiento farmacológico?
La constatación de valores altos de adenosina endógena en situaciones de isquemia miocárdica y su posible efecto protector, ha sido uno de los caminos explorados en el tratamiento de la isquemia miocárdica y de la FV asociada a ésta9. La adenosina endógena aumenta progresivamente durante la isquemia miocárdica, alcanzando valores cada vez más altos a medida que transcurre el tiempo. Su función mediada por 2 receptores (A1 y A2a), sería favorecer el cociente entre aporte y demanda de oxígeno en estos períodos isquémicos. Esta acción favorece el enlentecimiento de la degeneración dependiente del tiempo de las ondas de FV. El Dr. Mader y su grupo demostraron, en un modelo animal, que el bloqueo del receptor A1, impidiendo la acción de la adenosina endógena, aceleraba la descomposición de las ondas de FV10, es decir se aceleraría la transición entre la fase eléctrica y la fase circulatoria. Esta investigación dejaba abierta la puerta a un posible efecto beneficioso de la adenosina en la recuperación de pulso e incluso supervivencia a corto plazo en la FV prolongada. En un elegante trabajo publicado en este número11, Mader et al han testado, en un modelo animal, la influencia del bloqueo del receptor A1 de la adenosina endógena en el resultado final de una FV prolongada. Se evaluaron 2 estrategias frente al grupo control, pretratamiento y tratamiento a los 8 min de inducir la FV con el bloqueador del receptor A1 de la adenosina endógena. Desafortunadamente, ninguno de los grupos de tratamiento mostró diferencias sobre el resultado final en términos de rescuperación de circulación espontánea y supervivencia a corto plazo. A pesar del resultado negativo, siguen abiertas interesantes hipótesis de trabajo ya que faltan preguntas por responder. Además de algunas limitaciones de carácter técnico que constatan los propios autores, no se conoce bien la cinética de la adenosina endógena y podría ser relevante su papel en función del tiempo de evolución de la parada, pudiendo tener mayor relevancia en fases tempranas de la FV, los primeros 5 min. En cualquier caso, la hipótesis general de trabajo, retrasar la fase circulatoria de la PCR a favor de la fase eléctrica, es tan atractiva que requiere nuevos esfuerzos de investigación.
Bibliografía
1. Eisenberg MS. Predicting survival from out of hospital cardiac arrest. Ann Emerg Med. 1993;22:1652-8.
2. Hollenberg J, Herlitz J, Lindqvist J, Riva G, Bohm K, Rosenqvist M, et al. Improved survival after out-of-hospital cardiac arrest is associated with an increase in proportion of emergency crew-witnessed cases and bystander cardiopulmonary resuscitation. Circulation. 2008;118:389-96.
3. The International Liaison Committee on Resuscitation. 2005 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Part 4: advanced life support. Resuscitation. 2005;67:181-9.
4. Abella BS, Aufderheide TP, Eigel B, Hickey RW, Longstreth WT Jr, Nadkarni V, et al. Reducing barriers for implementation of bystander-initiated cardiopulmonary resuscitation. A scientific statement from the American Heart Association for healthcare providers, policymakers, and community leaders regarding the effectiveness of cardiopulmonary resuscitation. Circulation. 2008;117:704-19.
5. Valenzuela TD, Roe DJ, Nichol G, Clark LL, Spaite DW, Hardman RG. Outcomes of rapid defibrillation by security officers after cardiac arrest in casinos. N Engl J Med. 2000;343:1206-9.
6. Weisfeldt ML, Becker LB. Resuscitation after cardiac Arrest. A 3-phase time-sensitive model. JAMA. 2002;288:3035-8.
7. Weil M H, Wanchun Tang W, Bisera J. Cardiopulmonary resuscitation. one size does not fit all. Circulation. 2003;107:794.
8. The International Liaison Committee on Resuscitation. 2005 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Part 4: advanced life support. Resuscitation. 2005;67:213-47.
9. Stark U, Brodmann M, Lueger A, Stark G. Antiarrhythmic effects of adenosine on ischemia-induced ventricular fibrillation. J Crit Care. 2001; 16:8-16.
10. Mader TJ, Menegazzi JJ, Betz AE, Logue ES, Callaway CW, Sherman LD. Adenosine A1 receptor antagonism hastens the decay in ventricular fibrillation waveform morphology during porcine cardiac arrest. Resuscitation. 2006;71:254-9.
11. Mader TJ, Menegazzi JJ, Rittenberger JC, Suffoletto BS, Callaway CW, Salcido DD, et al. The effect of adenosine A1 receptor antagonism on return of spontaneous circulation and short-term survival in prolonged ventricular fibrillation. Prehospital Emergency Care. 2008;12:352-8.
EFECTO DEL ANTAGONISMO DEL RECEPTOR A1 DE LA ADENOSINA EN LA REANUDACIÓN DE LA CIRCULACIÓN ESPONTÁNEA Y EN LA SUPERVIVENCIA A CORTO PLAZO EN LA FIBRILACIÓN VENTRICULAR PROLONGADA
INTRODUCCIÓN
La adenosina es un nucleótido endógeno que actúa como mensajero extracelular para regular el aporte y la demanda miocárdicos de oxígeno durante los períodos de perfusión coronaria insuficiente.
La hipoxia celular es un potente estímulo para el aumento en la producción y liberación de adenosina endógena hacia el intersticio del corazón, en donde —a través de al menos 2 receptores específicos de la superficie celular (A1 y A2a)— actúa para modificar favorablemente el cociente entre el aporte y el consumo de oxígeno.
A los 5 min de una fibrilación ventricular (FV) no tratada la concentración de adenosina en el seno coronario alcanza un valor casi 13 veces superior al basal.
HIPÓTESIS
Dado que el antagonismo del RA1A acelera el deterioro natural de la morfología electrocardiográfica (ECG) de la FV durante la fase circulatoria de la FV porcina, los animales tratados con un antagonista del RA1A antes de la inducción de la FV podrían presentar tasas menores de reanudación de la circulación espontánea (REC) y de supervivencia a los 20 min, en comparación con los animales del grupo control.
MÉTODOS
Un conjunto de 36 cerdos fue distribuido mediante asignación aleatoria en bloque a uno de 3 grupos: un grupo que solamente recibió un excipiente (grupo control), un grupo de pretratamiento con un antagonista del RA1A (grupo de pretratamiento) y un grupo que recibió un antagonista del RA1A durante la reanimación (grupo de tratamiento).
Cinco minutos después de que cada animal recibiera el pretratamiento asignado (BG9719 o excipiente) se indujo la FV y se permitió la progresión del ritmo sin ninguna intervención.
A los 8 min de la FV no tratada se inició la reanimación mediante un dispositivo mecánico de reanimación programable y alimentado con oxígeno, que aplicó compresiones torácicas estandarizadas con ventilación con presión positiva. La ventilación se llevó a cabo con oxígeno al 100%, un volumen corriente de 400 ml, una frecuencia respiratoria de 6 movimientos respiratorios por minuto y una presión inspiratoria que se mantuvo en 10-12 cmH2O.
La reanimación de los 18 primeros animales en este experimento se llevó a cabo mediante un dispositivo con umbral de impedancia, según se recomienda en el protocolo Advance Cardiac Life Support de 2005, colocado directamente sobre el extremo proximal de la sonda endotraqueal.
La primera descarga de rescate (150 J, bifásica) se aplicó a los 11 min de la FV (a los 3 min de la reanimación cardiopulmonar con medicamentos). Todas las descargas se aplicaron con una dosis fija de energía (150 J) y con una morfología de desfibrilación bifásica, exponencial, truncada y con compensación de la impedancia aplicada por un único investigador (JJM).
En los casos en los que la descarga de rescate dio lugar a la REC (definida en este estudio como una presión sistólica de 80 mmHg mantenida durante al menos 1 min consecutivo), el animal recibió las medidas estandarizadas de soporte y sobrevivió durante al menos 20 min (en simulación del tiempo de traslado al hospital).
En los casos en los que la primera descarga de rescate no dio buenos resultados, se reanudaron las compresiones torácicas y la ventilación asistida durante 1 min antes de aplicar una segunda descarga. Este patrón se repitió mientras que la FV fue el ritmo que aparecía en el ECG.
RESULTADOS
¿ Las características basales y los valores bioquímicos correspondientes a los animales de los 3 grupos fueron matemáticamente los mismos.
¿ En el grupo de tratamiento hubo una proporción mayor de animales de sexo femenino (7 de 12), en comparación con el grupo control (2 de 12).
¿ El antagonismo del RA1A aceleró el deterioro de la morfología de la FV tal como ya se ha demostrado previamente, pero la tasa de REC fue la misma en todos los grupos: grupo control = 7 de 12; grupo de pretratamiento = 6 de 12, y grupo de tratamiento = 7 de 12.
¿ No hubo diferencias en la REC ni en la supervivencia a corto plazo entre los 3 grupos.
¿ El número de descargas de rescate necesario para la REC y, por tanto, los tiempos transcurridos hasta la REC, no presentaron diferencias entre los distintos grupos.
¿ Tampoco hubo diferencias en la supervivencia a corto plazo: grupo control = 4 de 12; grupo de pretratamiento = 5 de 12, y grupo de tratamiento = 7 de 12.
CONCLUSIONES
En nuestro estudio, el antagonismo del RA1A aceleró el deterioro natural de la morfología ECG de la FV durante la fase circulatoria de la parada cardíaca, pero no dio lugar a ningún efecto en la evolución, tanto si el antagonismo del RA1A se realizó antes de la inducción de la FV como si se llevó a cabo a partir de los 8 min de la parada cardíaca porcina por FV no tratada.
Nuestra conclusión es que la función que desempeña la adenosina endógena en la FV prolongada sigue sin estar clara.
Dadas las limitaciones de nuestro estudio, consideramos justificada la realización de nuevos análisis.
INTRODUCCIÓN
La adenosina es un nucleótido endógeno que actúa como mensajero extracelular para regular el aporte y la demanda miocárdicos de oxígeno durante los períodos de perfusión coronaria insuficiente1,2. La hipoxia celular es un potente estímulo para el aumento en la producción y liberación de adenosina endógena hacia el intersticio del corazón, en donde —a través de al menos 2 receptores específicos de la superficie celular (A1 y A2a)— actúa para modificar favorablemente el cociente entre el aporte de oxígeno y el consumo de oxígeno1,3-9.
Dada la inexistencia de un gasto cardíaco cuantificable durante la parada cardíaca por FV, el miocardio sufre una isquemia profunda. En estas condiciones extremas de hipoxia, se acelera la producción endógena de adenosina y se observa una acumulación intersticial rápida de ésta. A los 5 min de una FV no tratada la concentración de adenosina en el seno coronario alcanza un valor casi 13 veces superior al basal10.
En un estudio previo, nuestro grupo demostró que el antagonismo del receptor A1 de la adenosina (RA1A) acelera el deterioro dependiente del tiempo de la morfología de la FV durante la fase circulatoria de la parada cardíaca11. El objetivo del estudio presente ha sido determinar el efecto del antagonismo del RA1A en la reanudación de la circulación espontánea (REC) y en la supervivencia a corto plazo en la FV prolongada. BG9719 (Biogen Idec, Boston, MA) es un antagonista potente y selectivo del subtipo A1 del receptor de la adenosina e intermedia los efectos cronotrópico, dromotrópico e inotrópico negativos de la adenosina endógena sobre el corazón. En nuestro estudio se ha intentado evaluar los efectos de BG9719 en la FV y en la reanimación. Nuestra hipótesis ha sido que, dado que el antagonismo del RA1A acelera el deterioro natural de la morfología electrocardiográfica (ECG) de la FV durante la fase circulatoria de la FV porcina, los animales tratados con un antagonista del RA1A antes de la inducción de la FV podrían presentar tasas menores de REC y de supervivencia a los 20 min, en comparación con los animales del grupo control.
MÉTODOS
El University of Pittsburgh Institutional Animal Care and Use Committee aprobó el estudio (protocolo número 0509919). Un conjunto de 36 cerdos domésticos mestizos de ambos sexos (con una masa corporal de entre 23 y 29 kg) se distribuyó mediante un procedimiento de asignación aleatoria en bloque a 1 de 3 grupos: grupo de pretratamiento con un excipiente y con administración del excipiente durante la fase de reanimación (grupo control); grupo de pretratamiento con BG9719, 0,6 mg/kg y con administración del excipiente durante la reanimación (grupo de pretratamiento), y grupo de pretratamiento con un excipiente y administración de BG9719, 0,6 mg/kg durante la reanimación (grupo de tratamiento). BG9719 se preparó inmediatamente antes de su uso mediante la disolución de la forma en polvo en 2 ml de etanol, después en 3 ml de polietilenglicol (PEG) y, finalmente, en 5 ml de agua estéril, con mezcla mediante un agitador Vortex entre cada 2 pasos.
Preparación de los animales
Todos los animales se prepararon de manera convencional. Se realizó su sedación mediante la administración intramuscular de ketamina (10,0 mg/kg) y de xilazina (4,0 mg/kg). Después, se aplicó una cánula intravenosa (i.v.) a través de una vena periférica de la oreja y se inició un plano quirúrgico de anestesia mediante un bolo i.v. rápido de alfa-cloralosa (50 mg/kg). A continuación se aplicó una perfusión de mantenimiento con 40 mg/kg/h durante todo el experimento.
En los animales se llevó a cabo la intubación orotraqueal mediante una sonda endotraqueal con manguito del tamaño apropiado, utilizando para ello un laringoscopio directo y un respirador Ohmeda 7000 (Ohmeda, BOC Health Care, Madison, WI). La ventilación se inició con un volumen corriente de 15-18 ml/kg, una frecuencia de 12 movimientos respiratorios por minuto y un cociente inspiración/espiración de 0,5. La ventilación minuto se ajustó durante el transcurso de los procedimientos para el mantenimiento de una presión del dióxido de carbono (CO2) al final del volumen corriente de entre 35 y 45 kilopascales, determinada mediante capnometría con chorro lateral (LifePak 12 Monitor-defibrillator, Medtronic Physio-Control, Redmond, WA). La temperatura corporal central se controló mediante una sonda de temperatura (Bi-Temp Temperature Monitor, Respiratory Supply Products, Inc., Irving, CA) introducida aproximadamente 10 cm en el esófago del animal. Se colocaron 3 derivaciones de miembros correspondientes a una derivación II estándar del ECG. El trazado ECG se monitorizó y registró de manera continua durante la ejecución del protocolo completo.
La parálisis neuromuscular se indujo mediante la administración de pancuronio (bolo i.v. inicial de 4 mg y bolos adicionales de 2 mg, según lo necesario). Fue necesaria la parálisis debido a que se utilizó un respirador con ciclos de volumen y la alfa-cloralosa no elimina el estímulo respiratorio del animal; además, se quería evitar el riesgo de barotraumatismo y eliminar las respiraciones agónicas que aparecen con frecuencia durante los primeros minutos posteriores a una parada cardíaca. Por otra parte, el nervio femoral es prominente y comparte la fascia con la arteria femoral. El contacto con el nervio durante la cirugía induce un movimiento violento del miembro posterior si dicho contacto tiene lugar en un animal en el que no se ha realizado la parálisis neuromuscular, lo que incrementa el riesgo de contratiempos quirúrgicos.
Se realizó la sección de los vasos femorales derechos con colocación de cánulas arterial y venosa (9 Fr) en la arteria y la vena femorales derechas. Se introdujeron catéteres de presión con micromanómetro en la punta (Mikro-Tip Catheter Transducer, modelos SPR 471A y SPC-370-S, Millar Instruments, Houston, TX) y se desplazaron hasta la aorta ascendente y la aurícula derecha.
El trazado ECG y los datos correspondientes a las presiones arterial y venosa fueron adquiridos digitalmente con una frecuencia de muestreo de 1.000 puntos/s mediante un sistema de adquisición de datos de alto rendimiento (PowerLab ML870, ADInstruments, Colorado Springs, CO) y con uso de un programa informático comercializado (Chart v. 5.3 para Macintosh, AD Instruments, Castle Hill, Australia). La presión de perfusión coronaria (PPC) se calculó como la presión aórtica menos la presión diastólica de la aurícula derecha.
El análisis de la gasometría en sangre arterial (GSA) se realizó con un dispositivo apropiado (I-Stat Portable Clinical Analyzer, Heska Corp., Waukesha, WI) tras el establecimiento adecuado de la cánula arterial y en cualquier momento en el que se modificaron los parámetros del respirador. La FV se indujo mediante la aplicación de una corriente alterna transtorácica durante 3 s, con una frecuencia de 60 Hz y una intensidad de 100 mA, para ello se utilizó un transformador variable PowerStat (Superior Electric, Farmington, CT). También se registró el tiempo de anestesia, definido como el tiempo transcurrido entre el bolo inicial de alfa-cloralosa y el momento de la inducción de la FV.
Diseño experimental
Cinco minutos después de que cada animal recibiera el pretratamiento asignado (BG9719 o excipiente) se indujo la FV y se permitió la progresión del ritmo sin ninguna intervención. Al minuto 8 de la FV no tratada se inició la reanimación mediante un dispositivo mecánico de reanimación programable y alimentado con oxígeno (Thumper, Model 1007, Michigan Instruments, Grand Rapids, MI) que aplicó compresiones torácicas estandarizadas con ventilación con presión positiva. El ciclo de trabajo fue del 50% y el cociente compresión/ ventilación se estableció en 15:1 (el máximo permitido por este dispositivo en aquel momento). Las compresiones torácicas se aplicaron con una frecuencia de 100/min y con una profundidad de 38 mm. La ventilación se llevó a cabo con oxígeno al 100%, un volumen corriente de 400 ml, una frecuencia respiratoria de 6 movimientos respiratorios/min y una presión inspiratoria que se mantuvo en 10-12 cmH2O.
La reanimación de los 18 primeros animales en este experimento se llevó a cabo mediante un dispositivo con umbral de impedancia (DUI; ResQPOD, Advanced Circulatory Systems, Eden Prairie, MN), según se recomienda en el protocolo Advance Cardiac Life Support (ACLS) de 2005, colocado directamente sobre el extremo proximal de la sonda endotraqueal. Después, la válvula del ventilador del dispositivo Thumper se colocó directamente sobre el DUI. El uso del DUI se interrumpió durante la segunda mitad del experimento, cuando se observó que la tasa de reanimación en los animales control era significativamente inferior a la que se podría predecir a través de los datos de carácter histórico.
Al comienzo de la reanimación todos los animales recibieron la solución asignada (BG9719 o excipiente) y una mezcla estándar de medicamentos que incluía adrenalina (0,10 mg/kg), vasopresina (40 U), propranolol (1,0 mg) y bicarbonato sódico (1,0 meq/kg) en sucesión rápida. Más tarde, las compresiones torácicas y la ventilación con presión positiva se continuaron durante 3 min sin interrupción. La primera descarga de rescate se aplicó 11 min después de la inducción de la FV (a los 3 min de la reanimación cardiopulmonar [RCP] con medicamentos). Todas las descargas se aplicaron con una dosis fija de energía (150 J) y con una morfología de desfibrilación bifásica, exponencial, truncada y con compensación de la impedancia (LifePak 12, Medtronic Physio-Control, Redmond, WA) aplicada por un único investigador (JJM). En los casos en los que la descarga de rescate dio lugar a la reanudación de la circulación espontánea (REC) (definida en este estudio como una presión sistólica de 80 mmHg mantenida durante al menos 1 min consecutivo), el animal recibió las medidas estandarizadas de soporte y sobrevivió durante al menos 20 min (en simulación del tiempo de traslado al hospital). En los casos en los que la primera descarga de rescate no dio buenos resultados, se reanudaron las compresiones torácicas y la ventilación asistida durante 1 min antes de aplicar una segunda descarga. Este patrón se repitió mientras que la FV fue el ritmo que aparecía en el ECG. Se administraron dosis estándar de adrenalina (0,015 mg/kg) cada 3 min. No se administraron otros medicamentos a menos que hubiera tenido lugar la REC. En los casos en los que se produjo una recidiva de la fibrilación tras la REC se reanudaron las maniobras de reanimación según lo ya señalado y se continuaron durante un total de 20 min. Los animales con REC sostenida se trataron con medidas estandarizadas que incluyeron la administración de adrenalina (con la dosis necesaria para el mantenimiento de la presión sistólica por encima de 80 mmHg) y de bicarbonato sódico para corregir la acidosis (NaHCO3 = 0,3 meq × peso corporal en kg × déficit de base).
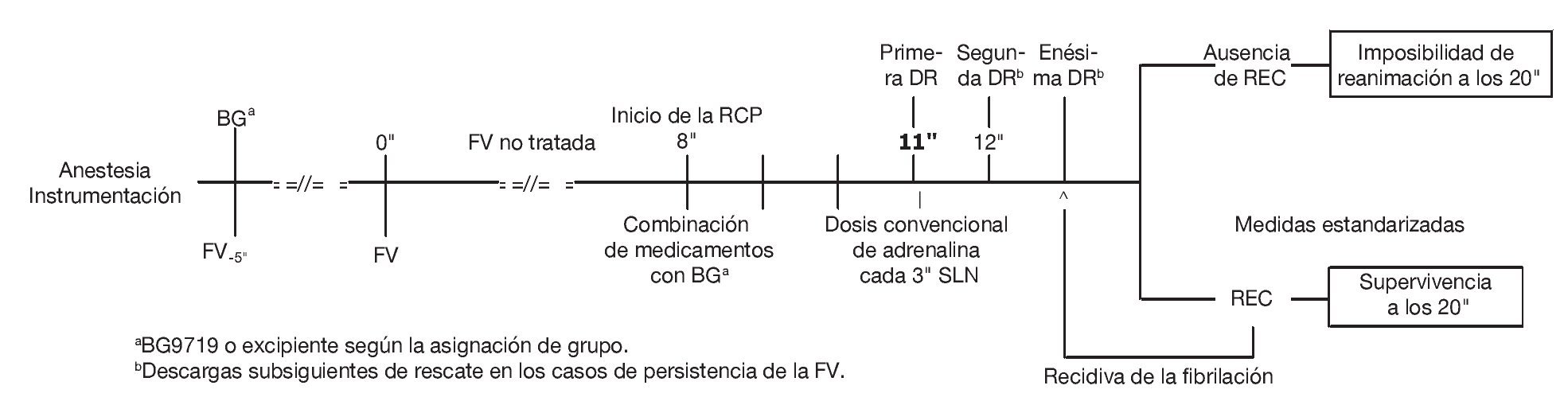
En los animales en los que no fue posible el restablecimiento del pulso de manera sostenida se continuaron las intervenciones de reanimación durante 20 min desde el momento de inicio de dichas intervenciones (es decir, 28 min después de la inducción de la FV). Todos los animales que sobrevivieron al criterio principal de valoración a los 20 min fueron sometidos a eutanasia mediante una inyección i.v. rápida de 40 meq de cloruro potásico. Por tanto, los criterios principales de valoración en el estudio fueron la supervivencia a los 20 min tras la REC y la imposibilidad de reanimación a los 20 min. En la figura 1 se muestra el cronograma del experimento. Las variables dependientes primarias en este estudio fueron la REC y la supervivencia a los 20 min.
FIGURA 1. Cronograma del experimento: tras la anestesia, la instrumentación, el pretratamiento y la inducción de la fibrilación ventricular (FV), los animales permanecieron sin recibir ningún tipo de tratamiento durante 8 min. Después, se inició la reanimación con una combinación estándar de medicamentos, con o sin administración del compuesto de prueba (BG9719). La primera descarga de rescate (DR) se aplicó en el minuto 11 y, después, las descargas de rescate se aplicaron cada 60 s mientras persistió un ritmo susceptible de respuesta a las propias descargas. Los animales con reanudación de la circulación espontánea (REC) recibieron las medidas de apoyo convencionales y los que presentaron una recidiva de la FV se sometieron de nuevo a desfibrilación. La reanimación se continuó en todos los animales durante un mínimo de 20 min antes de la interrupción de todas las medidas. Epi: adrenalina; q3": cada 3 min (los minutos se indican con comillas ["] en toda la figura); RCP: reanimación cardiopulmonar; SLN: según las necesidades.
Análisis de los datos
Las comparaciones basales entre los grupos se llevaron a cabo mediante parámetros estadísticos descriptivos, la prueba de la t de Student respecto a las variables continuas y la prueba exacta de Fisher respecto a las variables dicotómicas, con un nivel alfa de 0,05 para determinar la significación. Los ficheros de datos registrados digitalmente se convirtieron en ficheros de texto y en cada uno de los 36 registros se realizaron los cálculos del exponente de escalado (ExE) de la morfología de la FV en el ECG, para ello se utilizaron rutinas MATLAB (TheMathWorks, Natick, MA) y con un procedimiento de promediado en intervalos de 5 s. Las líneas de la tendencia de la regresión lineal se ajustaron respecto a cada conjunto de datos y se llevó a cabo un análisis de la varianza (ANOVA, analysis of variance) sobre las mediciones repetidas para la comparación del grupo de pretratamiento (n = 12) con el grupo control y con el grupo de tratamiento (n = 24) en el ExE y a lo largo de los 8 min de FV no tratada. Con respecto a esta parte del análisis de los datos fue posible la combinación de los grupos control y de tratamiento debido a que presentaron las mismas características durante esta parte del estudio, es decir, antes de la fase experimental los animales de estos 2 grupos no recibieron nada excepto el excipiente. Sin embargo, el grupo de pretratamiento fue distinto debido a que todos los animales recibieron BG9719 antes de la inducción de la FV, de manera que en el estudio se comparó básicamente el pretratamiento con BG9719, por un lado, y el pretratamiento con un excipiente en animales con FV no tratada durante 8 min, con objeto de confirmar la aparición real del efecto BG9719 que se suponía. Se calcularon las proporciones con intervalos de confianza (IC) del 95% respecto al número de descargas de rescate necesario para conseguir la REC, la tasa de REC y la supervivencia a los 20 min. Todos los cálculos estadísticos se llevaron a cabo mediante un programa informático comercializado (Stata v. 8.1 for Macintosh, College Station, TX).
RESULTADOS
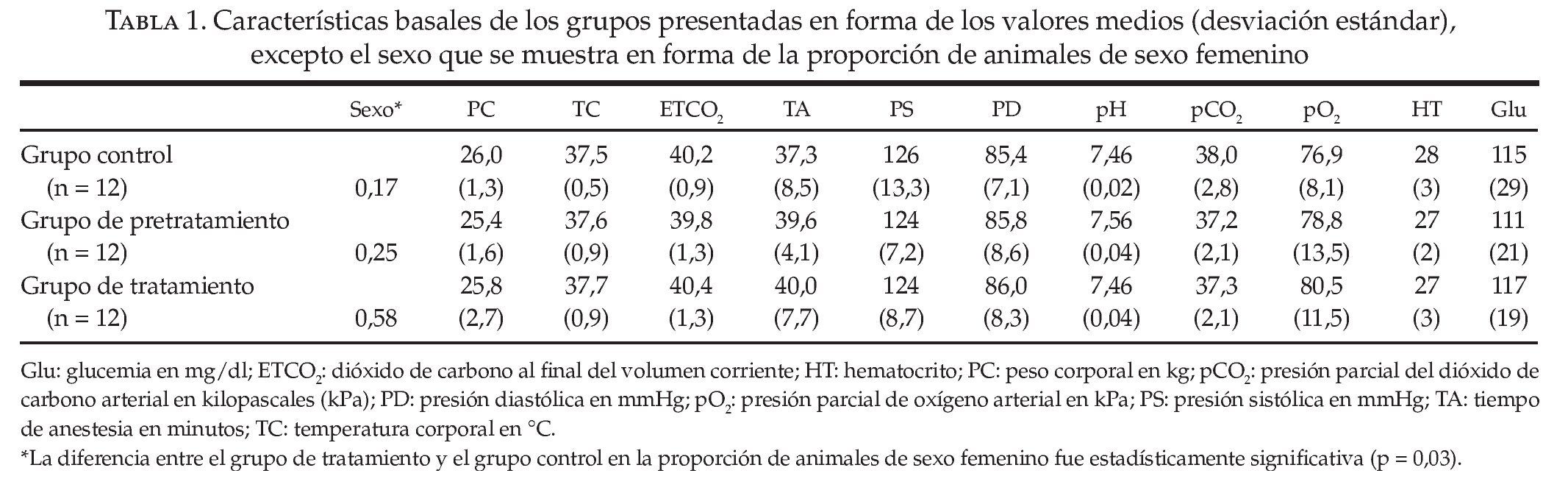
Las características basales (peso corporal, temperatura corporal central, CO2 al final del volumen corriente, presiones arteriales y tiempos de anestesia) de los animales de los 3 grupos no presentaron diferencias entre sí (tabla 1). Los valores bioquímicos basales determinados en la GSA inicial fueron matemáticamente similares en los 3 grupos. En el grupo de tratamiento hubo una proporción mayor de animales de sexo femenino (7 de 12), en comparación con el grupo control (2 de 12) (p = 0,03).
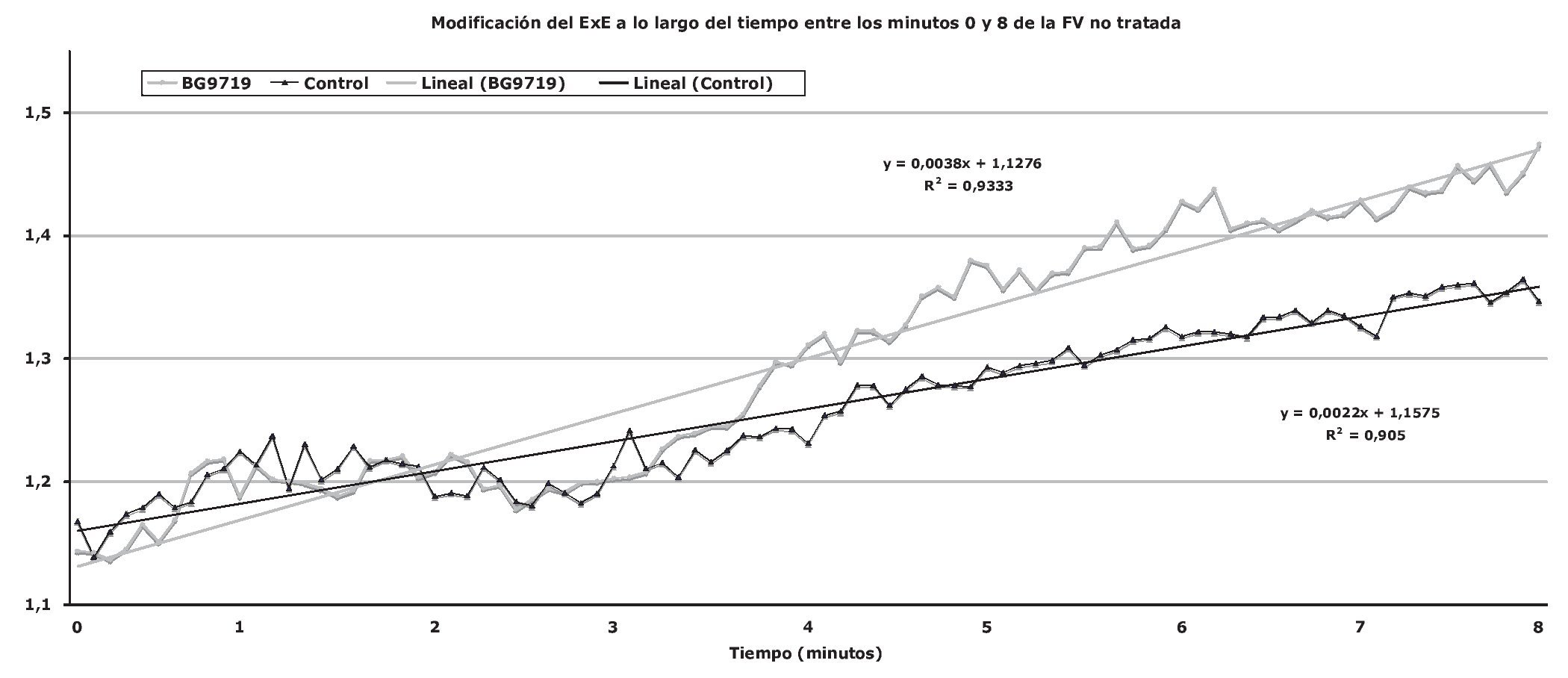
En función de la comparación de los grupos control y de tratamiento combinados, por un lado, y el grupo de pretratamiento, por otro, volvimos a observar la aceleración de la degeneración dependiente del tiempo en la morfología de la FV durante la fase circulatoria de parada con el antagonismo del RA1A que ya habíamos demostrado en nuestro estudio previo11 (fig. 2). Los resultados principales se muestran en la tabla 2. No hubo diferencias en la REC ni en la supervivencia a corto plazo entre los 3 grupos. El número de descargas de rescate necesario para la REC y, por tanto, los tiempos transcurridos hasta la REC, no presentaron diferencias entre los distintos grupos (tabla 3). El modelado de la regresión con uso del tiempo hasta la anestesia, el sexo de los animales, la asignación de grupo y el uso del DUI demostró que únicamente el uso del DUI fue un factor predictivo de la REC y de la supervivencia. En este tipo de modelado, el tiempo transcurrido hasta la anestesia, el uso de BG9719 y el sexo femenino no fueron factores predictivos independientes de la REC ni de la supervivencia (tabla 4).
FIGURA 2. Efecto de BG9719 en el deterioro a lo largo del tiempo en la morfología de la fibrilación ventricular (FV) determinado a través del exponente de escalado (ExE) durante todo el período de 8 min de FV no tratada. A lo largo del periodo de FV no tratada desde el minuto 0 al minuto 8, los grupos control y de tratamiento fueron exactamente iguales debido a que los animales de los éstos solamente recibieron el excipiente; por tanto, en este análisis ambos grupos se consideraron de manera combinada.
DISCUSIÓN
En nuestro estudio hemos observado que el bloqueo de los efectos de la adenosina endógena al nivel del RA1A mediante la administración de BG9719 no dio lugar a ningún efecto en la tasa de REC ni en la supervivencia a corto plazo en un modelo porcino de parada cardíaca por FV prolongada. La adenosina endógena induce un efecto cardioprotector durante la isquemia1-9 y su concentración en el miocardio aumenta durante la FV no tratada10. Dados sus efectos cardioprotectores durante la isquemia miocárdica aguda, nuestro grupo consideró que el incremento observado en la concentración miocárdica de adenosina durante la FV no tratada podría dar lugar a un efecto fisiológico de carácter beneficioso. En nuestro estudio previo se obtuvieron resultados que apoyaban esta posibilidad debido a que el antagonismo del RA1A aceleró el deterioro dependiente del tiempo en la morfología de la FV entre los minutos 5 y 8 de FV no tratada, según se determinó a través del ExE de la morfología ECG de la FV11.
En nuestro estudio previo se utilizó DTI-0017 (5 mg/kg), un potente antagonista específico del RA1A elaborado por Aderis Pharmaceuticals, Inc. (Hopkinton, MA). Este compuesto ya no existía cuando se inició el estudio presente. Por tanto, se decidió utilizar otro antagonista del RA1A bien definido, BG9719, un compuesto que tiene una afinidad por el RA1A 10 veces mayor que la correspondiente a DTI-0017, administrado con la dosis recomendada (0,5 mg/kg) por el bioquímico jefe del fabricante y director de la investigación. No podemos estar seguros de que el uso de este compuesto concreto no influyera de alguna manera en nuestros resultados, pero los cálculos del ExE indican que se utilizó una dosis apropiada, que se alcanzó el órgano objetivo y que se consiguió el efecto pretendido.
El ExE, derivado de la dimensión fractal de autosimilitud fundamentada en el método de Higuchi para los datos obtenidos en series de tiempo, es un parámetro cuantitativo carente de dimensión que indica la «tosquedad» relativa de la actividad eléctrica en la FV12.
Sus valores oscilan entre 1,0 (valor mínimo) en la FV tosca y 2,0 (valor máximo) a medida que la FV evoluciona hasta asistolia. El ExE es reproducible, muestra una concordancia excelente con otros elementos descriptivos de la morfología ECG cuantitativa, ha demostrado constituir una estimación precisa de la duración de la FV, permite predecir el buen resultado de la desfibrilación, se correlaciona con las intervenciones que se sabe influyen en la evolución y puede tener utilidad para determinar el tratamiento más apropiado13-20.
Mediante un análisis morfológico cuantitativo, nuestro grupo ha descubierto que el sexo femenino se puede asociar a un deterioro natural más lento en la morfología ECG de la FV a lo largo del tiempo; además, a través de nuestros datos históricos se ha observado que los animales de sexo femenino pueden presentar una tasa de REC y de supervivencia a corto plazo significativamente mayores que los animales de sexo masculino21,22. Si se asume que estas observaciones son ciertas, no está clara la manera con la que la distribución desproporcionada de los sexos entre los grupos de nuestro estudio influyó en los resultados. Sólo se puede suponer que la mayor proporción de animales de sexo masculino en el grupo control pudo haber contribuido a la obtención de resultados peores respecto a la REC y a la supervivencia a los 20 min en este grupo, en comparación con lo observado en los grupos de tratamiento y de pretratamiento, lo que posiblemente redujo nuestras posibilidades de detectar la presencia de diferencias entre los grupos, en el caso de que éstas hubieran existido. También es posible que, dado que las diferencias entre ambos sexos son más pronunciadas durante las fases iniciales de la parada cardíaca, carecen de consecuencias en la FV prolongada21. Sin embargo, el sexo de los animales no fue un factor predictivo independiente de la evolución.
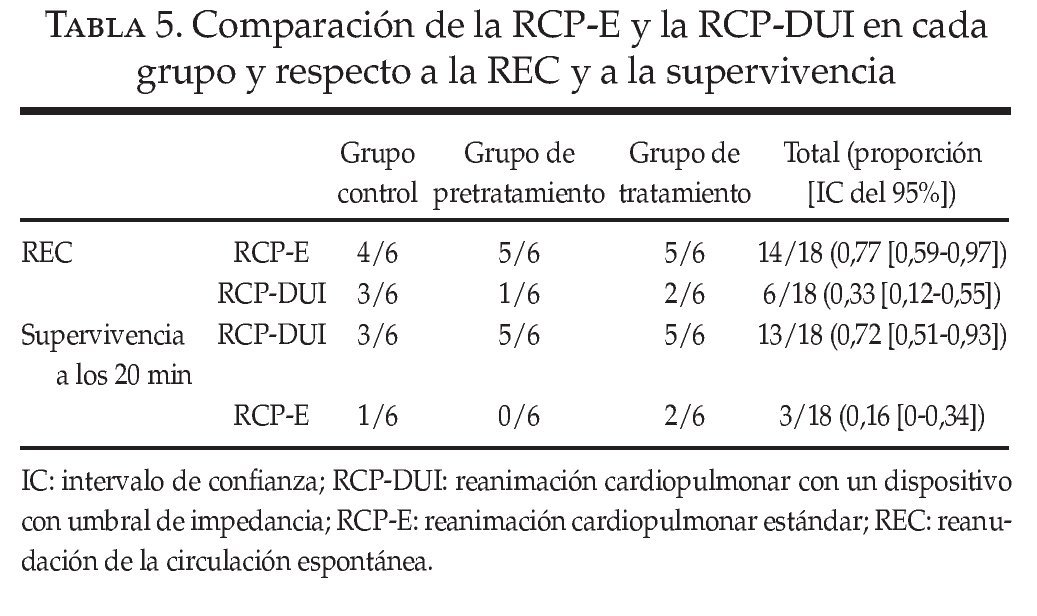
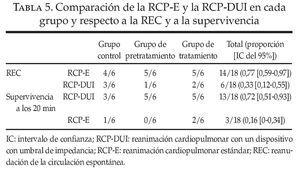
Se ha señalado que ResQPOD, un DUI, potencia la circulación durante la RCP23-30. Este dispositivo actúa mediante la eliminación de la inspiración pasiva que tiene lugar durante la fase de relajación de las compresiones torácicas. Este efecto crea una presión intratorácica progresivamente negativa a medida que el tórax muestra la recuperación elástica en cada serie de compresiones entre los movimientos respiratorios activos. Esta presión intratorácica negativa potencia el retorno venoso e incrementa la PPC. En el protocolo de directrices ACLS correspondiente a 2005, publicado inmediatamente antes de la realización de este estudio, se incluye el uso del DUI como una recomendación de clase IIa31. Nuestro grupo decidió incorporar el dispositivo en el algoritmo RCP en todos los animales (RCPDUI). Tras la inclusión de la primera mitad de la muestra, se hizo aparente que las tasas de REC y de supervivencia a los 20 min eran sustancialmente inferiores a las esperadas en función de los datos históricos. Sospechamos que la supervivencia inferior a la esperada se debió al uso del DUI debido a que fue la única modificación realizada en el modelo establecido. En consecuencia, tras la finalización de la inclusión de los 18 primeros animales, con un número igual en cada uno de los 3 grupos, se decidió retirar el DUI y realizar la RCP estándar (RCP-E) para valorar el efecto del DUI en la evolución.
En la tabla 5 se resumen las comparaciones entre los grupos RCP-DUI y RCP-E22. El DUI influyó claramente las variables primarias de evolución y podría haber reducido nuestra capacidad para determinar si el antagonismo del RA1A podía mejorar o no la REC y la supervivencia a los 20 min en nuestro estudio.
Desconocemos la cinética y la actividad de la adenosina endógena a lo largo de la evolución de la FV no tratada. Solamente sabemos que a los 5 min aumenta hasta 816 ± 257 nmol/l desde una concentración basal de 64 ± 16 nmol/l (p = 0,01)10, y que el antagonismo del RA1A modifica la tasa de deterioro de la FV durante los episodios de FV de duración intermedia11. Podría ocurrir que las concentraciones de adenosina aumenten rápidamente hasta un valor máximo a los 5 min o antes de la FV no tratada, al tiempo que después de los 8 min las concentraciones endógenas disminuyen rápidamente a medida que la adenosina acumulada se metaboliza y se agota el sustrato miocárdico para la producción de adenosina. Esta secuencia eliminaría cualquier posibilidad de detectar un efecto del antagonismo del RA1A en la evolución en la fase de la parada cardíaca evaluada en nuestro estudio.
CONCLUSIONES
En nuestro estudio el antagonismo del RA1A aceleró el deterioro natural de la morfología ECG de la FV durante la fase circulatoria de la parada cardíaca, pero no dio lugar a ningún efecto en la evolución, tanto si el antagonismo del RA1A se realizó antes de la inducción de la FV como si se llevó a cabo a partir de los 8 min de la parada cardíaca porcina por FV no tratada. Nuestra conclusión es que la función que desempeña la adenosina endógena en la FV prolongada sigue sin estar clara. Dadas las limitaciones de nuestro estudio, consideramos justificada la realización de nuevos análisis.
Los autores agradecen y aprecian de manera destacada la donación sin límites del compuesto utilizado en el estudio (BG9719) por parte de Biogen Idec Pharmaceuticals, Inc.
El Dr. Mader ha recibido ayuda económica a través de una Academic Emergency Medicine Scholarly Sabbatical Grant. Los Dres. Menegazzi, Callaway, Rittenberger, Sherman y Suffoletto han recibido ayuda económica a través del contrato 1RO1HL080483-02 con el National Heart, Lung, and Blood Institute. Los Dres. Callaway, Menegazzi, Rittenberger y Suffoletto también han recibido ayuda económica a través del contrato 5UO1HL077871-02 ofrecido por el National Heart, Lung, and Blood Institute. El Dr. Suffoletto ha recibido ayuda económica a través de una Institutional Research Training Grant de la Society for Academic Emergency Medicine.
Presentado en la reunión anual de la National Association of EMS Physicians, Naples, Florida, enero de 2007.
Dirección para correspondencia y solicitud de separatas: Timothy J. Mader, MD, Department of Emergency Medicine, 759 Chestnut Street, Springfield, MA 01199.
Correo electrónico: timothy.mader@bhs.org
Recibido el 5 de julio de 2007 por parte del Department of Emergency Medicine, Baystate Medical Center/Tufts University School of Medicine (TJM), Boston, Massachusetts; el Department of Emergency Medicine, University of Pittsburgh School of Medicine (JJM, JCR, BSS, CWC, DSS, ESL), Pittsburgh, Pennsylvania, y el Department of Emergency Medicine, St. Francis Hospital (LDS), Federal Way, Washington. Revisión recibida el 17 de octubre de 2007; aceptado para publicación el 12 de diciembre de 2007.
doi: 10.1080/10903120802101223