Los linfomas primarios de mama (LPM) son un rarísimo proceso patológico maligno de la mama que se puede confundir fácilmente con un carcinoma de mama. El conocimiento de esta entidad nos permitirá un abordaje diagnóstico-terapéutico correcto de los pocos casos que encontramos (0,04-0,5% de cánceres de mama).
Material y métodosEsta actualización se basa en un estudio analítico retrospectivo sobre la serie de casos recogida en el Hospital Príncipe de Asturias y una exhaustiva revisión de la literatura ginecológica y oncológica.
DiscusiónLos LPM son una entidad cuyo diagnóstico es prácticamente indistinguible del carcinoma de mama, por su similar distribución por edad, clínica e imagen radiológica. Solo la histología permite diferenciarlos. El tratamiento más eficaz es el combinado, basándose en la quimioterapia (siendo el régimen CHOP-R el más utilizado). La cirugía y radioterapia tienen un papel secundario. La evolución de la enfermedad es muy variable, desde la diseminación precoz a la remisión completa, teniendo gran importancia los factores pronósticos de los linfomas. Un diagnóstico precoz es fundamental para mejorar el pronóstico de esta enfermedad.
ConclusiónLos LPM suponen un reto diagnóstico-terapéutico por su baja prevalencia. Las pautas de tratamiento no están consensuadas y su evolución es muy variable. Es necesario un estudio más profundo para lograr unificar criterios y conocimientos sobre esta enfermedad.
Primary breast lymphomas (PBL) are a rare malignant disease of the breast that can be mistaken for breast carcinoma. Knowledge of PBL allows a correct diagnostic-therapeutic approach to this uncommon malignancy (0.04- 0.5% of breast cancers).
Material and methodsThis update is based on an analytic retrospective study of a series of cases recorded at the Hospital Príncipe de Asturias and a comprehensive review of the oncologic and gynecologic literature available.
DiscussionPBL are virtually indistinguishable from breast carcinomas because of their similar age distribution, clinical presentation and imaging features. Diagnosis can only be confirmed by histology. The most effective treatment is combined therapy based on chemotherapy (the most widely used being the CHOP-R regimen). Surgery and radiotherapy play a secondary role. The course of PBL varies widely, from early dissemination to complete remission. Prognostic factors play an important role in PBL. Prompt diagnosis is essential to improve outcome.
ConclusionBecause of their low prevalence, PBL are a diagnostic-therapeutic challenge. There is no agreement on treatment regimens, and outcome is highly variable. New in-depth studies are required to unify criteria and knowledge of this entity.
Los linfomas primarios de mama (LPM) son poco prevalentes. Su frecuencia oscila entre el 0,04-0,5%1,2–5 de los cánceres de mama y en torno al 0,7%1,3 de todos los linfomas. Se ha descrito un aumento de la incidencia en los últimos años1,6.
El rango de edad media se encuentra entre 60-65 años, aunque se han encontrado casos en edades extremas, entre 9 y 86 años1,3,5–7.
El tipo histológico más frecuente es el linfoma no Hodgkin (LNH). Su localización mamaria oscila entre el 0,39-2,2%1,2. El de mayor prevalencia es el de células B2,3, concretamente el subtipo de células grandes difuso1,6–8.
El modo de presentación más frecuente es la aparición de un nódulo palpable, unilateral, no doloroso6,7,9.
No existen hallazgos diagnósticos específicos de LPM, ni por clínica ni por pruebas de imagen, que son comunes a cualquier tipo histológico de cáncer de mama6. El diagnóstico definitivo se basa en la anatomía patológica3.
No existe acuerdo en cuanto al tratamiento de LPM, ya que no hay consenso respecto al papel de la cirugía ni de la radioterapia4 (RT), aunque la importancia de la quimioterapia (QT) como arma terapéutica está bien establecida1,3,5,7.
El objetivo de nuestro estudio es valorar la incidencia, las características, los métodos diagnósticos, las opciones terapéuticas y el pronóstico de las pacientes diagnosticadas de LPM en el Servicio de Ginecología y Obstetricia de nuestro hospital desde el año 1998 hasta 2011.
Material y métodosHemos realizado un estudio analítico, descriptivo y retrospectivo de los casos de LPM diagnosticados y tratados desde 1998 hasta 2011 en el Servicio de Ginecología y Obstetricia del Hospital Universitario Príncipe de Asturias de Alcalá de Henares (Madrid).
Siete pacientes fueron incluidas en este estudio, analizando historia clínica, exploración física, pruebas de imagen, diagnóstico anatomopatológico, tratamiento, seguimiento e incidencias.
Las variables estudiadas han sido: edad, forma de presentación (nódulo palpable/no palpable), localización, diagnóstico por imagen (nódulo/aumento de densidad/sin hallazgos), anatomía patológica (LNH tipo B/LNH tipo T), tipo de tratamiento (quirúrgico [tumorectomía/mastectomía], médico [RT/QT/terapia biológica]), supervivencia libre de enfermedad, complicaciones derivadas del tratamiento, seguimiento y supervivencia.
Los procedimientos de estadificación y evaluación de la respuesta incluyeron exploración física, tomografía computarizada (TC) y analítica, así como biopsia de médula ósea, ecocardiografía y evaluación del sistema nervioso central con TC o resonancia magnética bajo indicación clínica.
El seguimiento se realizó al final del tratamiento y cada 3 meses durante los 2 primeros años, y después según el criterio del oncólogo o hematólogo responsable de cada paciente. La respuesta tumoral fue clasificada como remisión completa, remisión completa no confirmada, respuesta parcial, enfermedad estable o enfermedad en progreso, según los criterios del International Working Comittee10.
Los datos se obtuvieron mediante la revisión sistemática de las historias clínicas, y el análisis de las variables se realizó mediante el programa estadístico SPSS 15.0.
ResultadosLa edad media de las pacientes analizadas fue de 65,7 años y el rango de edad de 53 a 86 años (tabla 1).
Características demográficas (n=7)
| Edad (rango en años) | 53-86 |
| Presentación | |
| Asintomática | 1 |
| Nódulo palpable | 3 |
| Rotura extracapsular de prótesis | 1 |
| Nódulo palpable+afectación de piel | 1 |
| Nódulo palpable+adenopatías axilares | 1 |
| Imagen sospechosa en mamografía | 2 |
| Método diagnóstico | |
| PAAF | 1 |
| BAG | 1 |
| Biopsia de piel y tejido mamario | 1 |
| Escisión quirúrgica | 3 |
| Hallazgo casual tras retirada de prótesis | 1 |
| Tipo histológico | |
| Linfoma difuso de células grandes B | 3 |
| Linfoma linfoblástico tipo B | 1 |
| Linfoma folicular | 2 |
| Linfoma anaplásico de células T | 1 |
De las 7 pacientes analizadas 5 consultaron por un nódulo mamario palpable (71%) y en 2 se presentó como un hallazgo mamográfico (29%).
A 6 de las 7 pacientes se les realizó mamografía (85%). La paciente sin estudio mamográfico (14%) se diagnosticó al realizar una biopsia de un nódulo, sobre la cápsula de una prótesis de mama, implantada tras mastectomía por carcinoma ductal infiltrante de mama 10 años antes.
El método diagnóstico empleado fue:
- -
Punción-aspiración con aguja fina (PAAF) en 2 casos (28%).
- -
PAAF+biopsia con aguja gruesa (BAG) en un caso (14%).
- -
BAG en un caso (14%).
- -
PAAF y exéresis tumoral en 2 casos (28%).
- -
Hallazgo casual en un caso (14%) al retirar una prótesis mamaria por rotura extracapsular.
La localización del tumor fue en un caso (14%) UCS de la mama derecha, en 2 casos (28%) cuadrante superoexterno (CSE) de la mama derecha, en 3 casos (42%) CSE de la mama izquierda y en un caso (14%) en la cápsula periprotésica de la mama derecha.
El estudio anatomopatológico reveló que 6 de las 7 pacientes presentaban LNH de células B (86%) y una paciente LNH de células T (14%).
El abordaje quirúrgico fue tumorectomía en 3 casos (28%), una de las cuales fue guiada por arpón, y exéresis de prótesis mamaria en un caso (14%). En el 42% de las pacientes —3 casos— no se empleó cirugía (una paciente [14%] falleció por sepsis tras infección de la herida quirúrgica, otra paciente por no desear la intervención terapéutica, debido a pluripatología, y la tercera paciente por tratamiento exclusivo con QT).
El tratamiento médico con QT se realizó de forma exclusiva en una paciente (14%), la cirugía con QT y RT se empleó en una paciente (14%), la cirugía y QT en una paciente, solo cirugía en otra paciente y en las últimas 3 pacientes (56%) no se empleó ningún tipo de tratamiento médico, en 2 casos por fallecimiento (una por sepsis y otra por diseminación linfomatosa fulminante) y en el último por abstención terapéutica.
En el momento actual se encuentran en seguimiento 4 pacientes, 2 de ellas (28%) en remisión completa. Otro 28% ha fallecido por las causas relatadas anteriormente, y en un caso (14%) se decide no tratar por el mal estado general de la paciente.
La supervivencia media fue de 28,7 meses, siendo el rango de uno a 76 meses.
El tiempo libre de enfermedad fue de 17,7 meses (rango de 0 a 76 meses).
La causa de muerte de 2 pacientes fue sepsis tras absceso de la herida de biopsia a los 2 meses de la cirugía, y diseminación linfomatosa de forma fulminante, respectivamente.
Las complicaciones relacionadas con el tratamiento empleado fueron mucositis (28%) y absceso de la herida quirúrgica (14%) (tabla 2).
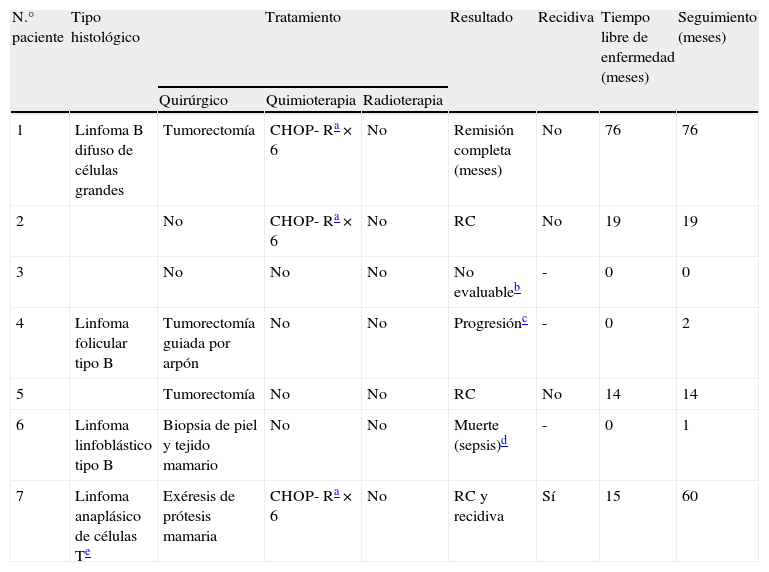
Tratamiento y evolución
| N.° paciente | Tipo histológico | Tratamiento | Resultado | Recidiva | Tiempo libre de enfermedad (meses) | Seguimiento (meses) | ||
| Quirúrgico | Quimioterapia | Radioterapia | ||||||
| 1 | Linfoma B difuso de células grandes | Tumorectomía | CHOP- Ra×6 | No | Remisión completa (meses) | No | 76 | 76 |
| 2 | No | CHOP- Ra×6 | No | RC | No | 19 | 19 | |
| 3 | No | No | No | No evaluableb | - | 0 | 0 | |
| 4 | Linfoma folicular tipo B | Tumorectomía guiada por arpón | No | No | Progresiónc | - | 0 | 2 |
| 5 | Tumorectomía | No | No | RC | No | 14 | 14 | |
| 6 | Linfoma linfoblástico tipo B | Biopsia de piel y tejido mamario | No | No | Muerte (sepsis)d | - | 0 | 1 |
| 7 | Linfoma anaplásico de células Te | Exéresis de prótesis mamaria | CHOP- Ra×6 | No | RC y recidiva | Sí | 15 | 60 |
Pérdida del estudio por decisión de abstención terapéutica por la propia paciente, debido a su edad y pluripatología de base.
Fallecida por diseminación linfomatosa al pulmón, hígado, hueso, adenopatías retroperitoneales, mesentéricas y mediastínicas de forma fulminante.
Linfoma diagnosticado en la cápsula periprotésica, tras exéresis de la misma por rotura. A los 15 meses del diagnóstico y tratamiento se produce una recidiva, tratada con quimioterapia, radioterapia y terapia inmune (ciclofosfamida, vincristina y prednisolona combinada con factor estimulante de colonias de granulocitos).
Los LPM son poco prevalentes, representando el 0,04-0,5% de todos los carcinomas mamarios5. La edad media en nuestro estudio, 66 años, corresponde con la bibliografía consultada (60-65 años), siendo el rango de edad entre 53 y 86 años1,5–7. Según el National Cancer Institute la edad media de presentación del carcinoma primario de mama es 61 años, al igual que los LPM.
El motivo más frecuente de consulta fue la aparición de un nódulo palpable no doloroso, similar a los hallazgos encontrados por otros autores5,6,7,11.
Se han descrito algunos casos de bilateralidad7, aunque en nuestro estudio únicamente hemos hallado linfomas unilaterales. Esta atípica localización es más frecuente en mujeres jóvenes gestantes o puérperas7. Así mismo, la bibliografía describe un predominio sobre la mama derecha3,5,7, pero nosotros no hemos podido constatarlo, ya que hemos observado que en 4 pacientes el linfoma se localizó en la mama derecha y en 3 en la izquierda, aunque sí observamos que la localización de estos tumores es más frecuente en el CSE.
La mamografía permite orientar el diagnóstico en el resto de los casos, aunque de manera muy poco específica, ya que no lo distingue de un carcinoma primario de mama3,5,6,11. El 56% de las mamografías realizadas presentaban un nódulo sospechoso de malignidad, mientras que el aumento de densidad solo se describía en el 14%. Es importante señalar que en los carcinomas primarios de mama son frecuentes las microcalcificaciones sospechosas que no se objetivan en los linfomas.
En conclusión, el diagnóstico por imagen de los linfomas de mama no es capaz de distinguir entre estos y los adenocarcinomas mamarios, ya que solo detecta imágenes sugestivas de malignidad, por lo que es necesario un diagnóstico histológico de confirmación3,5,11.
La PAAF permite orientar el diagnóstico, que será definitivo mediante BAG o mediante la exéresis de la lesión5. Sin embargo, en los casos en que el resultado de la PAAF sea dudoso (ya que dicha técnica puede infradiagnosticar esta enfermedad) se recomienda siempre biopsia para realizar un diagnóstico adecuado.
El tipo histológico más frecuente es el LNH difuso de células B1–3,5–7. En nuestro estudio el 14% de los casos fue diagnosticado como linfoma linfoblástico B, el 42% como linfoma difuso de células grandes tipo B y otro 28% como linfoma folicular. El caso restante fue el único LNH de estirpe T. El LNH de células T aparece en muy pocos casos y se asocia a prótesis mamaria, en particular el subtipo linfoma anaplásico de células grandes2,9. Este es también el único caso de LNH de células T diagnosticado por nódulo en la cápsula periprotésica de una prótesis de mama retirada por rotura extracapsular, implantada tras mastectomía por carcinoma ductal infiltrante. Características de presentación similares se describen en otros estudios2.
Otro subtipo de LNH de células T es el linfoma T asociado a mucosas (MALT)1,5,7, que se ha visto asociado a un mejor pronóstico. No hemos encontrado ninguno en nuestra casuística. El tratamiento de elección de este tipo de LNH es la cirugía1.
Los factores inmunohistoquímicos más importantes para el pronóstico de los linfomas de mama son el grado tumoral y la expresión de determinados marcadores moleculares como p53, BCL-2, Ki-67 y marcadores de células linfoides como CD-20 (presente en células B), CD-3 o CD- 79a4,5. Los linfomas con positividad para BCL-2 se correlacionan con un menor intervalo libre de enfermedad, siendo el factor pronóstico celular más aceptado5.
No existe consenso en la bibliografía sobre la actitud terapéutica en los LPM4,7. Debemos tener presente que la cirugía no es el tratamiento de primera línea5,8. El abordaje quirúrgico inicial es frecuente debido a la dificultad para realizar un diagnóstico diferencial con otros tipos de neoplasias mamarias, tanto clínica como radiológicamente5,7. En aquellos casos en los que se realiza un procedimiento quirúrgico, la elección del tipo de cirugía (tumorectomía versus mastectomía) se basa en los mismos criterios que el resto de los carcinomas de mama, y la linfadenectomía axilar permite completar la estadificación, ya que no pretende una función terapéutica1. No se recomienda mastectomía en términos generales, ya que no ofrece beneficio alguno en cuanto a supervivencia o riesgo de recurrencia12.
La QT es la clave en el tratamiento de los LPM1,5,7. Se considera el único factor pronóstico significativo para el control de la enfermedad a distancia y el intervalo libre de enfermedad6. En general, el tratamiento del linfoma primario de mama sigue las recomendaciones para linfomas del mismo grado e histología en otras localizaciones. Actualmente, la terapia combinada se considera el tratamiento más útil en LPM, incluso en los estadios más iniciales6.
En nuestra serie de casos se administró QT en el 42%, de los cuales 2 pacientes han alcanzado remisión completa, no disponiendo datos del 33% (un caso) restante. El resto no recibió QT. El 28% falleció sin este tratamiento.
En un 14% se decidió abstención terapéutica por la edad, pluripatología y mal estado general que presentaba la paciente. El último 14% no requirió QT.
El régimen quimioterápico más utilizado en los LPM se basa en el esquema terapéutico ciclofosfamida, doxorrubicina, vincristina, prednisona (CHOP-R) junto con rituximab, anticuerpo monoclonal anti CD207,12, cuya introducción ha aumentado el intervalo libre de enfermedad y la supervivencia global.
Sin embargo, a diferencia del resto de los carcinomas de mama en los que la QT únicamente se administra en aquellas mujeres con factores de peor pronóstico, en los LPM se administra en todos los estadios de Ann Arbor de la enfermedad11. La RT se empleó en una de las 7 pacientes de nuestra serie, siendo combinada con QT y cirugía. Se considera que la RT como único tratamiento no es efectiva (aumenta la incidencia de recidivas locales), no siendo recomendada como tratamiento adyuvante exclusivo6,8.
El tratamiento de elección de los LPM, por tanto, es la QT. Recientes estudios, como el de Niitsu, sugieren que la modalidad combinada de CHOP- R y RT puede ser efectiva a corto plazo, pero a largo plazo la supervivencia se iguala y se ven recurrencias fuera del campo de irradiación13, por lo que se recomienda reservar la RT para casos seleccionados5,7. En pacientes jóvenes no se recomienda RT por el riesgo a largo plazo de desarrollar un carcinoma mamario13.
La evolución de esta enfermedad es muy variable. Se pueden identificar grupos de riesgo basándose en el índice pronóstico internacional, que se calcula con los siguientes datos de las pacientes: edad, estadio Ann Arbor, número de localizaciones extraganglionares, estado basal de la paciente y niveles séricos de lactato deshidrogenasa11. En nuestro estudio la remisión completa ha sido alcanzada en el 28%, un 28% está en seguimiento y en un 14% se decidió no hacer tratamiento ni seguimiento por la enfermedad concomitante de las pacientes. El 28% (2pacientes) falleció, una por sepsis tras infección de la herida quirúrgica y otra paciente por enfermedad diseminada con metástasis a nivel cutáneo, pulmonar, hepático y óseo, adenopatías retroperitoneales, mesentéricas, laterocervicales y mediastínicas. No se ha hallado en nuestro estudio ningún otro caso de enfermedad diseminada. En cambio, hemos encontrado artículos que describen recidiva a distancia, en especial a nivel del SNC (en un 20% de los LNH tipo B de intermedio y alto grado)6. Existe controversia respecto a la necesidad de tratamiento profiláctico en estos casos, pudiendo ser una alternativa la vigilancia estricta de clínica neurológica6,14.
Conclusiones- 1.
Los LPM son una neoplasia poco prevalente en nuestro medio.
- 2.
Su diagnóstico precoz conlleva una gran complejidad, puesto que ni la clínica ni las pruebas de imagen permiten diferenciarlo del resto de carcinomas mamarios, siendo el estudio histológico imprescindible para el diagnóstico.
- 3.
La PAAF orienta en muchos casos el diagnóstico.
- 4.
El diagnóstico precoz es de gran importancia para la actitud terapéutica, responsable del pronóstico de la enfermedad y de la supervivencia de estas pacientes.
Los autores declaran que no existe ningún conflicto de interés respecto al desarrollo y publicación de este artículo.