INTRODUCCION
Un 0,3-0,8% de los cánceres de mama se presentan en forma de nódulo metastásico axilar sin signos clínicos o radiológicos de tumor primario en la mama1. Aunque Halsted2 describió el primer caso en 1907, son escasas las series realizadas de una cierta relevancia, lo que dificulta el establecimiento de pautas diagnósticas y terapéuticas óptimas.
Pese a la amplia disponibilidad actual de métodos diagnósticos, la aparición de un nódulo metastásico axilar en ausencia de primario conocido en la mama sigue planteando dificultades diagnósticas y terapéuticas. El diagnóstico diferencial es complejo --adenocarcinoma mamario, endometrial, ovárico, gástrico y tiroideo, linfoma, melanoma, carcinoma de células escamosas de cabeza y cuello, pulmón o piel, tumores neurogénicos y de glándulas sudoríparas--. Una vez descartada la mayoría de estas opciones, si el estudio histológico es indicativo de adenocarcinoma o carcinoma indiferenciado, el tumor primario oculto probablemente se encontrará en la mama3. Aunque inicialmente la mastectomía radical o modificada era el único tratamiento aceptado para estos casos, las opciones terapéuticas han ido aumentando con el paso del tiempo.
En este artículo actualizamos la evidencia disponible sobre el manejo clínico de las metástasis axilares de primario desconocido. Para ilustrar estos datos presentamos un caso clínico recientemente diagnosticado y tratado por nosotros. Por último, recogemos una sugestiva hipótesis que contribuye a explicar la patogenia de estos tumores. La mayoría de ellos son de muy pequeño tamaño --en muchos casos inferior a 2 mm-- e incapaces de establecerse como entidades clínicas. Es sorprendente, por tanto, que sean capaces de desarrollar metástasis clínicas en la axila.
CASO CLINICO
Una paciente de 51 años acudió a nuestra consulta por haberse detectado un nódulo doloroso en la axila izquierda. No presentaba antecedentes familiares de interés y entre los personales destacaba una histerectomía con anexectomía bilateral a los 47 años por metropatía secundaria a miomatosis uterina, y posterior terapia hormonal sustitutiva (THS) durante 2 años por síntomas vasomotores graves.
La primera inspección mamaria mostró unas mamas simétricas sin áreas de retracción dérmica ni otros hallazgos significativos. A la palpación el tacto era homogéneo, parcialmente sustituido por grasa, siendo algo más denso en ambos cuadrantes superoexternos (CSE). No se detectaron nódulos sospechosos. La paciente no presentaba telorrea a la expresión y la exploración axilar derecha era normal. En mama izquierda se palpaba un nódulo de 3 × 3 cm, móvil, muy bien delimitado, en el límite entre la cola axilar de la mama y el primer nivel de Berg. Aunque podría tratarse de un fibroadenoma de la cola axilar de la mama, no se podía descartar a priori que se tratase de un ganglio metastásico.
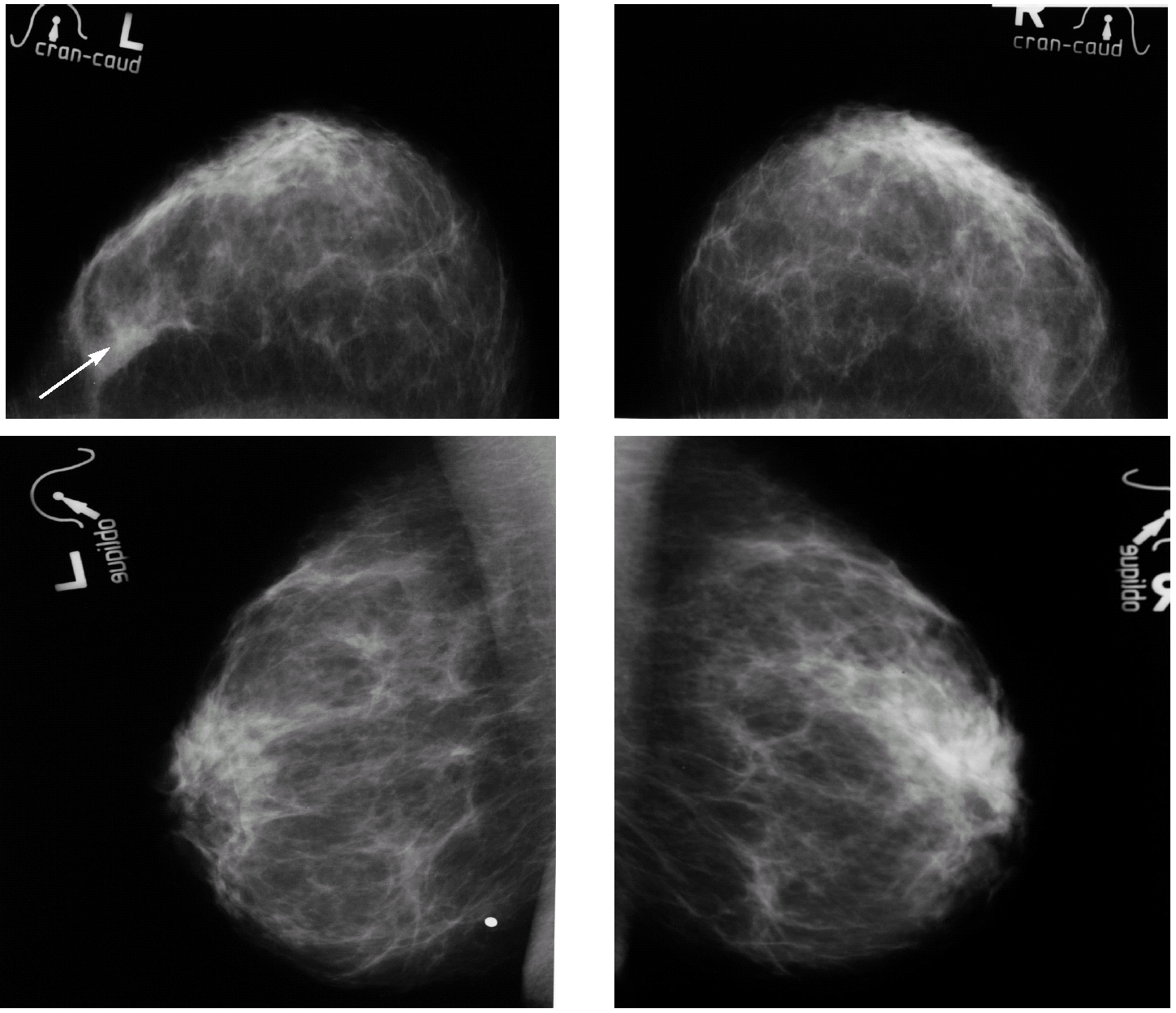
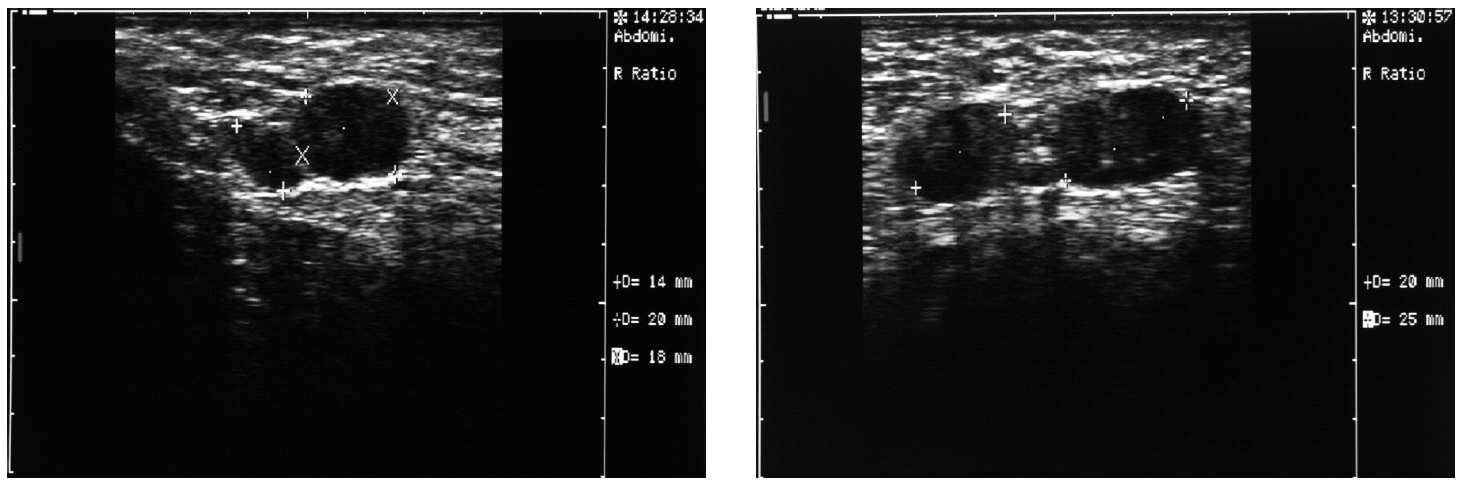
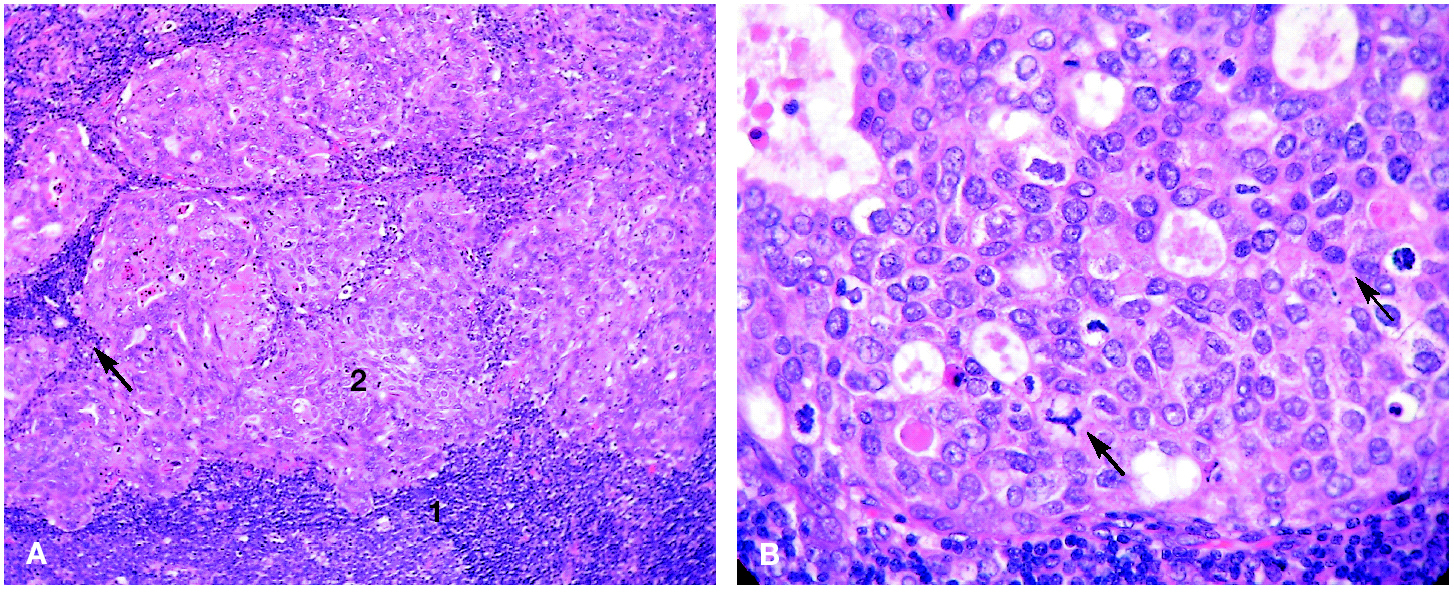
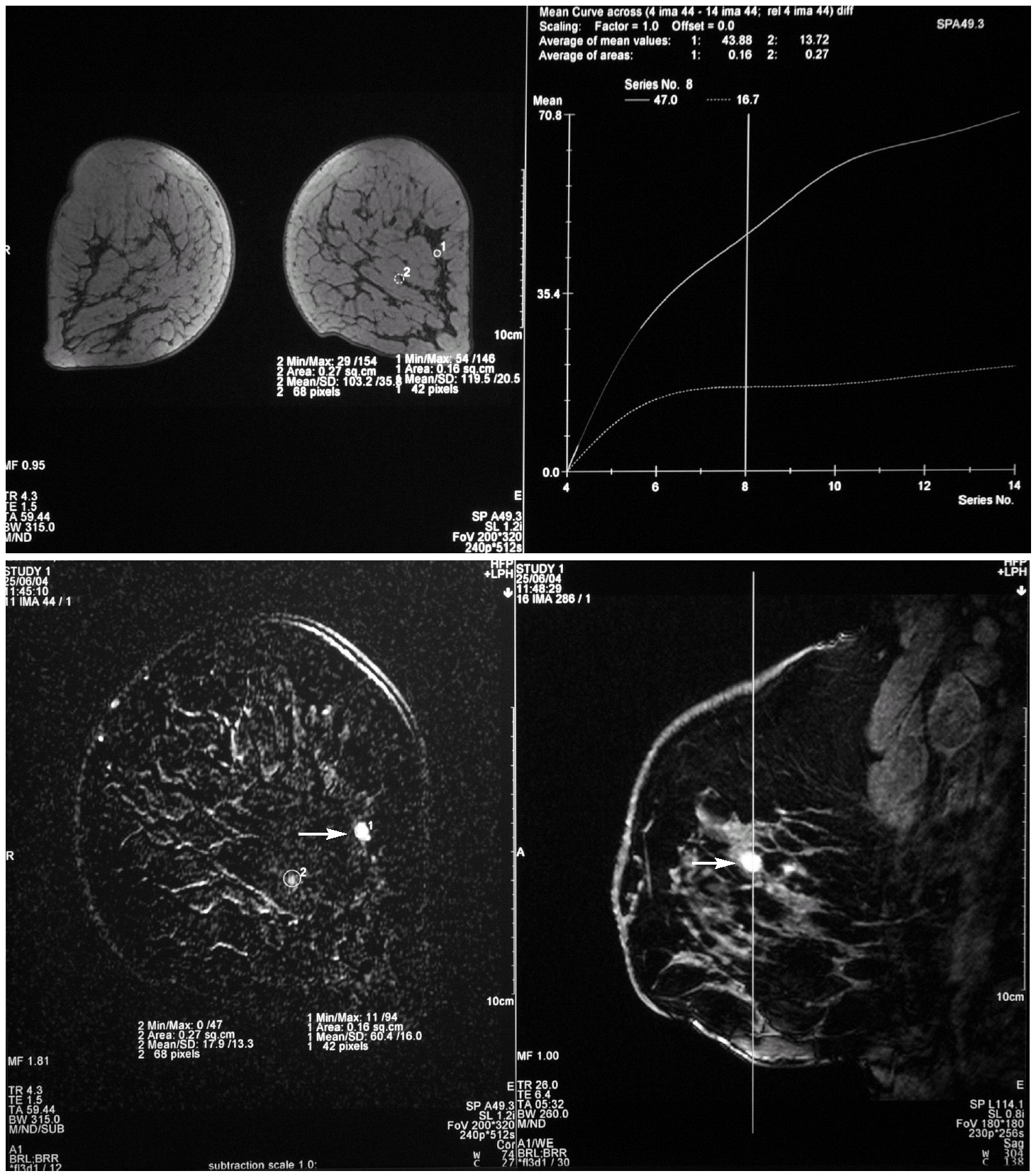
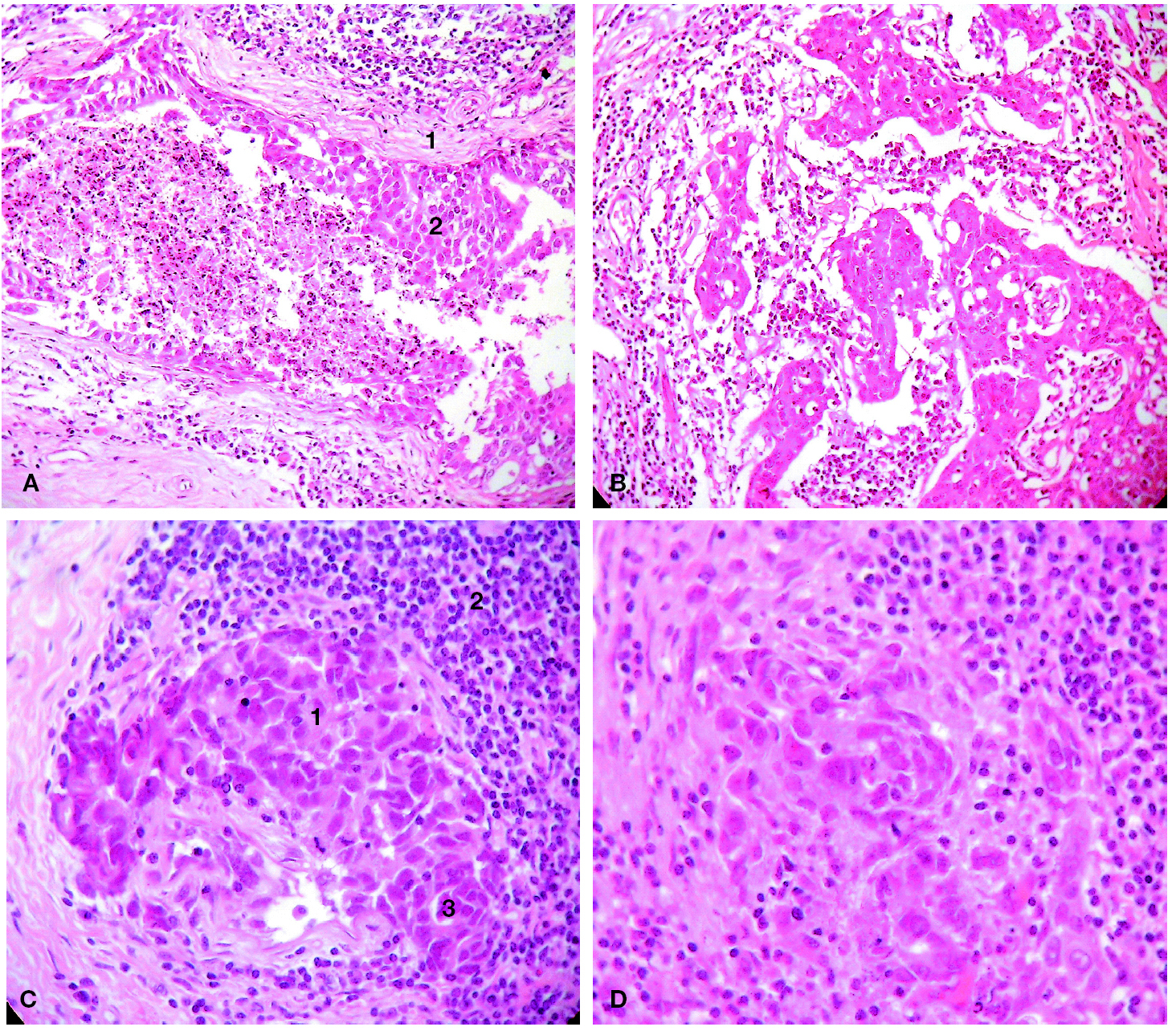
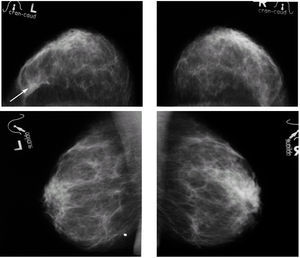
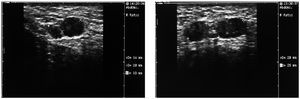
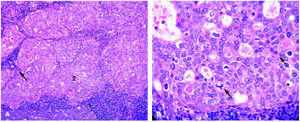
Tras interrumpir la THS se realizaron mamografías y ecografías. Las primeras no mostraron imágenes sospechosas (fig. 1) y, tras la comparación con las mamografías realizadas 2 años antes, no se apreció diferencias significativas. El estudio ecográfico de ambas mamas y de la axila derecha fue normal, pero la ecografía de la axila izquierda mostró 3 nódulos (fig. 2), el mayor de ellos se biopsió bajo anestesia local. El estudio macroscópico describió una masa bien delimitada de 4 cm, con superficies lisas de color rojizo, blanquecino a la sección y de aspecto neoplásico que correspondía a una adenopatía. El estudio microscópico reveló que se encontraba infiltrada masivamente por un adenocarcinoma (fig. 3). La citoqueratina 20 y los receptores hormonales no se expresaban en la pieza, pero sí lo hacían la citoqueratina 7 y la GCDFP (gross cystic disease fluid protein) 15 (fig. 4). El diagnóstico definitivo fue de adenocarcinoma de probable origen mamario.
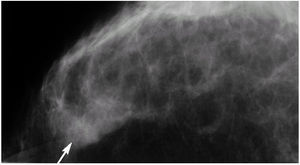
Figura 1. Mamografías bilaterales en proyecciones craneocaudal y oblicua. Mamas con tejido fibroglandular de predominio graso, homogéneas, con aumento de densidad parcialmente definido en el cuadrante externo de la mama izquierda (flecha). Ausencia de imágenes estrelladas, calcificaciones y asimetrías sospechosas. Marcaje metálico de verruga en el cuadrante inferior de la mama izquierda.
Figura 2. Ecografía axilar izquierda. Presencia de, al menos, 3 adenopatías, de las cuales destacan las 2 de mayor tamaño, entre 2 y 2,5 cm.
Figura 3.Estudio anatomopatológico de la adenopatía axilar. A) Linfocitos ganglionares (1) que rodean islotes de células epiteliales (2) y estructuras glandulares (flecha). B) A mayor aumento, se pueden identificar células de núcleo polimorfo, con citoplasma más o menos bien definido, necrosis y mitosis (flechas).
Figura 4.Marcadores inmunohistoquímicos en las células tumorales de la adenopatía axilar. A) Citoqueratina 7 positiva. B) Receptores de estrógenos negativos. C) GCDFP-15 positiva (flecha).
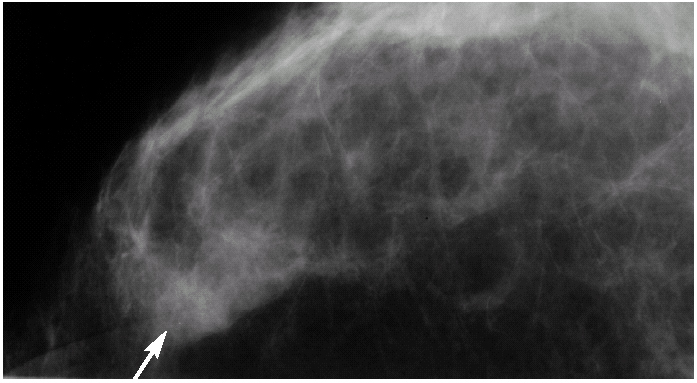
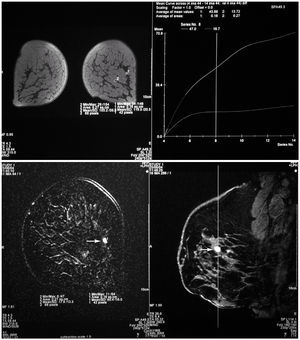
Con el diagnóstico de metástasis axilar de primario desconocido se realizó una mamografía magnificada del CSE de la mama izquierda que no mostró más que un ligero aumento de densidad sin otros hallazgos relevantes (fig. 5). Se solicitó una resonancia magnética (RM) bilateral que mostró un nódulo con características sugestivas de benignidad en el CSE de la mama izquierda (fig. 6). Finalmente, se realizó un cribado diagnóstico completo que resultó sin hallazgos patológicos --anamnesis minuciosa, exploración física completa, estudio analítico (hemograma, marcadores tumorales), radiografía de tórax, rastreo óseo y tomografía computarizada (TC) abdominopélvica--. La paciente fue informada de que, tras un estudio diagnóstico completo negativo y en presencia de una neoplasia axilar compatible con un adenocarcinoma, la probabilidad de encontrar un tumor primario en la mama homolateral era muy alto3. Tras explicarle las distintas opciones terapéuticas, se decidió realizar una cuadrantectomía de CSE de la mama izquierda y un vaciamiento axilar de los niveles I y II de Berg.
Figura 5. Proyección magnificada del cuadrante superoexterno (CSE) de la mama izquierda. Aumento de densidad parcialmente definido en CSE (flecha) sin microcalcificaciones asociadas.
Figura 6.Resonancia magnética (RM) mamaria. Mamas de tipo fibrolipomatoso con imagen nodular de 9 mm (flechas) y límites bien definidos, situada en el cuadrante superoexterno de la mama izquierda. Su patrón de captación es típicamente benigno.
El estudio histológico de la pieza quirúrgica informó de la presencia de un carcinoma ductal infiltrante de grado 3 asociado a un carcinoma ductal in situ predominante (fig. 7), con bordes de resección libres de infiltración y metástasis ganglionar en 2 de las 9 adenopatías resecadas. Los estudios inmunohistoquímicos revelaron la ausencia de receptores hormonales (fig. 8) sin expresión de c-erbB2 (HER2/neu).
Figura 7.Estudio anatomopatológico de la pieza quirúrgica mamaria. A) Pared ductal íntegra (1), con proliferación de su epitelio hacia el interior de la luz (2), características celulares de malignidad y acumulación de material necrótico (3) característico del comedocarcinoma. B) Focos microscópicos malignos: 6 focos de 1-2 mm, en su mayoría de carácter intraductal (grado III comedo), y alguno con patrón infiltrante. C) Focos de proliferación con características celulares de malignidad, bien delimitados por fibras de colágeno (1) y claramente separados de la estroma circundante, compuesto por una reacción inflamatoria linfocitaria (2), reactiva a la presencia de la neoplasia. Otros focos con pérdida de la delimitación (3), en los que las células malignas (de citoplasmas mal definidos) se entremezclan con las estromales. D) Grupos celulares mal definidos que se estremezclan con las células estromales.
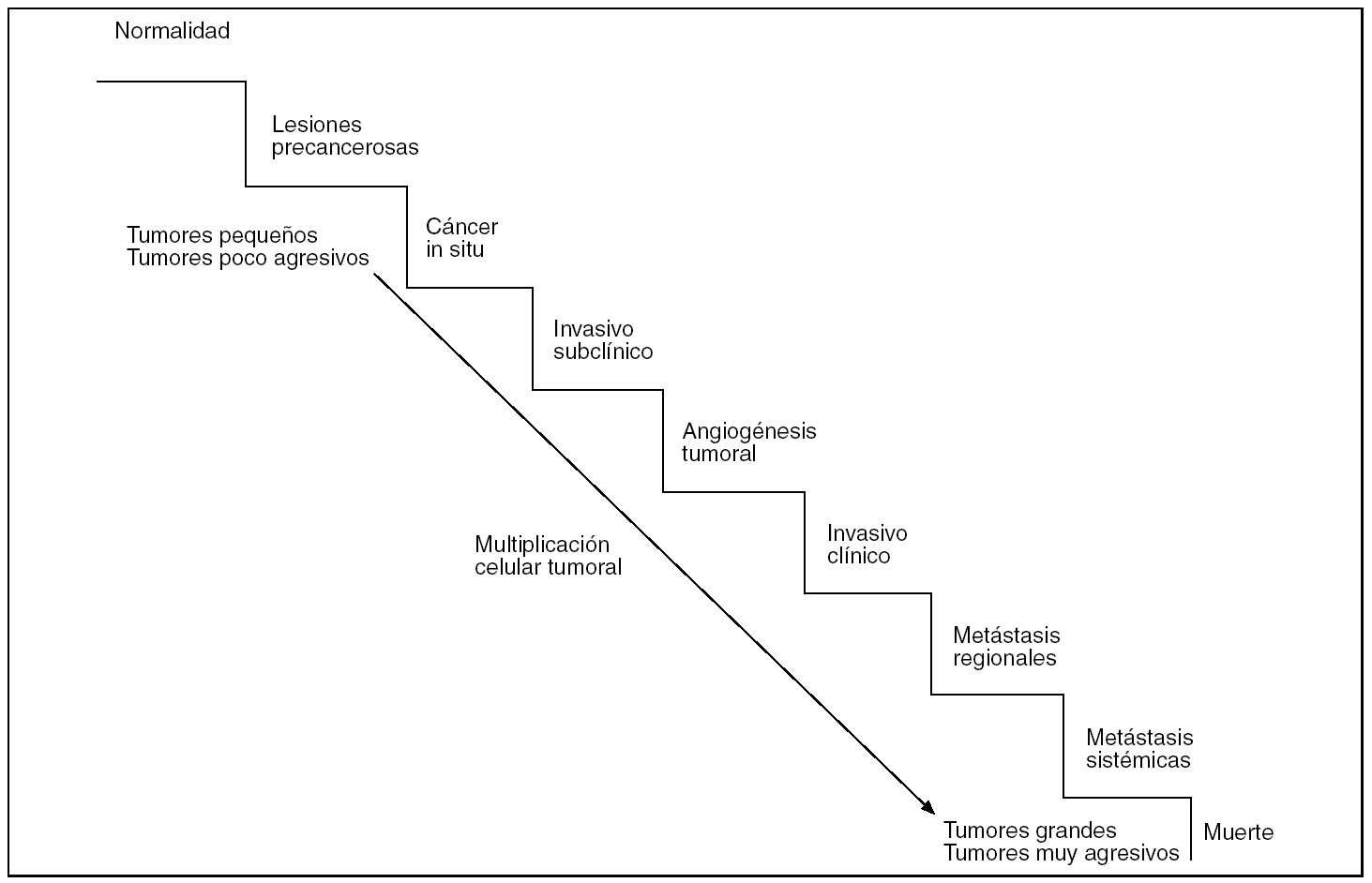
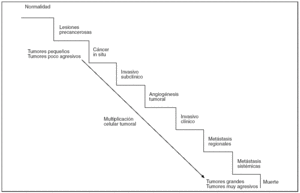
Figura 8.Modelo lineal de evolución tumoral. Las sucesivas multiplicaciones de las células tumorales suponen un aumento de la masa tumoral y su malignidad. Así, tumores pequeños serán menos agresivos que otros más grandes y más avanzados en la escala evolutiva, que han adquirido capacidad angiogénica primero y metastatizante después.
DISCUSION
El hallazgo de una adenopatía periférica supone un reto para el clínico. Éste debe determinar si se trata de una adenopatía aislada o se asocia a otras en diferentes localizaciones, ya que esto permite orientar la etiología (tabla 1). Las adenopatías aisladas sugieren causas locales en sus territorios de drenaje --en nuestro caso, el brazo y la mama izquierdos, parte de la pared torácica izquierda y la base del cuello--. En ausencia de signos sugestivos de infección deberá pensarse en una neoplasia, especialmente mamaria4,5. Hay ciertos datos clínicos que se asocian con un aumento de la probabilidad de neoplasia6: el tamaño de la adenopatía --por encima de los 2,25 cm2 hasta el 38% son neoplásicas--, la edad de la paciente --el 0,4% si la edad es menor de 40 años frente al 4% por encima de los 40 años7--, y el tiempo de evolución --en ausencia de otros signos sugestivos de malignidad se puede adoptar una actitud expectante durante 3-4 semanas, dando tiempo a resoluciones espontáneas o a que la causa de la adenopatía se ponga de manifiesto4.
Tras confirmar histológicamente el origen neoplásico de la adenopatía, si no podemos determinar la localización del tumor después de un estudio diagnóstico inicial (tabla 2), consideraremos que nos encontramos ante una neoplasia de primario desconocido. Este estudio no debe ser exhaustivo, sino dirigido a las localizaciones más frecuentes. Esta forma de presentación supone hasta el 5% de todos los cánceres diagnosticados (30.000 nuevos casos/año en Estados Unidos)8.
El estudio histológico no debe limitarse a probar la naturaleza maligna de la adenopatía, sino que debe intentar determinar el origen del tumor primario. El primer paso consiste en el análisis con microscopio óptico de la pieza teñida con hematoxilina-eosina, que permitirá, en función de las características morfológicas, encuadrar el tumor en ciertas categorías (tabla 3)8. Esta información es de gran ayuda, ya que cada tipo histológico se relaciona con un grupo de localizaciones más frecuentes (tabla 3). Habitualmente, las características morfológicas no son lo bastante específicas como para poder asegurar el origen del primario y será necesario recurrir a tests inmunohistoquímicos con anticuerpos monoclonales marcados con peroxidasa dirigidos contra antígenos específicos de tumor. Hay muchos marcadores pero ninguno absolutamente específico, por lo que el clínico debe comunicar al patólogo su sospecha inicial para que éste pueda seleccionar la batería de marcadores más adecuada. Los 2 marcadores más empleados son las citoqueratinas 7 y 20, que se expresan de forma preferente en determinados tumores: citoqueratina 7 positiva en pulmón, ovario, endometrio y mama, y citoqueratina 20 positiva en epitelio gastrointestinal, urotelio y células de Merkel8. El uso de las citoqueratinas 7 y 20 orienta hacia un tipo u otro de tumor, facilitando la elección de otros marcadores más específicos --en caso de sospecha de cáncer de mama se utilizarán los receptores de estrógenos, de progesterona y la GCDFP-15--. Los estudios histológico e inmunohistoquímico del nódulo axilar de nuestro caso orientan hacia un adenocarcinoma de origen mamario (figs. 3 y 4); este resultado en el contexto de una adenopatía axilar de primario desconocido corresponde, en el 90% de los casos, a una neoplasia mamaria homolateral3.
El cáncer de mama oculto se define como la neoplasia que se inica como una metástasis axilar, sin evidencia clínica ni radiológica del tumor primario en la mama, y supone un 0,3-1% de todos los cánceres de mama diagnosticados9,10. Dadas las limitaciones de la mamografía y la ecografía en estas condiciones, la resonancia magnética (RM) se considera actualmente la técnica de elección para la evaluación de estas pacientes, puesto que es capaz de detectar lesiones mamarias en el 57-85% de los casos9. La escasa especificidad de la técnica, sin embargo, aumenta el número de biopsias innecesarias. En nuestro caso, la RM no sirvió de nada, puesto que mostró un nódulo de morfología y patrón de captación benignos (fig. 6). Se ha propuesto el empleo de la tomografía de emisión de positrones (PET) en estos casos; esta técnica es capaz de detectar el tumor primario hasta en la mitad de los casos de neoplasia con primario desconocido. Sin embargo, las series son limitadas y generalmente de pacientes con carcinomas ocultos de cabeza y cuello, por lo que no se puede recomendar su uso de forma sistemática8.
Cuando todas las pruebas diagnósticas han resultado infructuosas, el clínico se enfrenta a un dilema terapéutico de difícil solución: ¿cómo tratar correctamente un tumor que tal vez se encuentra en la mama homolateral, pero cuya localización exacta se desconoce?
Se han barajado 2 enfoques terapéuticos de estas pacientes: vigilancia de la mama y no tratamiento hasta la aparición clínica o radiológica del tumor, o tratamiento «activo» (mastectomía frente a tratamiento conservador: cuadrantectomía de CSE asociada a radioterapia o radioterapia aislada).
La simple observación de la mama se asocia con una alta incidencia de cáncer de mama homolateral en los 5 años siguientes (50-60%), por lo que esta opción no se acepta actualmente1,11-13.
La mastectomía homolateral fue el tratamiento que se consideró de elección en estos casos hasta la década de los setenta3,13. Este procedimiento se basaba en estudios clásicos según los cuales en hasta el 90% de los casos de metástasis axilar y primario desconocido se encontraba una neoplasia en la pieza quirúrgica, cuando se realizaba una mastectomía2,14-16. Sin embargo, con el tiempo, estos hallazgos han sido discutidos: estaban basados en series cortas que se extendían durante muchos años y utilizaban técnicas de imagen distintas --pacientes exploradas sin mamografías, otras con mamografías y/o ecografías, y otras con métodos diagnósticos más sofisticados--. Resulta lógico pensar que con el desarrollo de métodos diagnósticos más fiables la probabilidad de encontrar un tumor «oculto» en una pieza de mastectomía tenderá a disminuir. Otro dato en contra de la mastectomía es que los tumores descubiertos en las piezas quirúrgicas son generalmente carcinomas in situ o infiltrantes de muy pequeño tamaño (< 1 cm)14,17. Por último, la mastectomía conlleva importantes mermas en la calidad de vida de las pacientes.
El pronóstico de las pacientes con metástasis axilar y primario oculto es similar al de las pacientes con tumores en estadio II11,18. Por tanto, es lógico pensar que podemos emplear el mismo tratamiento en ambos grupos: cuadrantectomía de CSE --probablemente el más afectado por su mayor densidad-- asociada a radioterapia. Sin embargo, esta opción sólo será superior a la mastectomía cuando el tumor esté en CSE (el 50% de los casos), los márgenes estén libres de infiltración y no se trate de un tumor multicéntrico15.
Ya que ni la mastectomía ni la cuadrantectomía de CSE son tratamientos óptimos en todos los casos, se ha propuesto irradiar la totalidad de la mama tras la biopsia o vaciamiento axilar. El pronóstico a 5 y 10 años de estas pacientes y el de las mastectomizadas es similar1,3,10,12,13. Por otra parte, la incidencia de cáncer de mama homolateral es del 10-20%, significativamente más baja que la de las pacientes observadas, pero no irradiadas1,11-13. No obstante, faltan datos sobre la eficacia de la radioterapia para controlar tumores «ocultos» extensos3,13.
En cuanto a la cirugía axilar, el vaciamiento de los niveles I y II asociado a cualquiera de las opciones anteriores es superior a la simple biopsia del ganglio metastático10. En general, el número de ganglios afectados suele ser reducido18. El pronóstico de estas pacientes está íntimamente relacionado con el grado de afección axilar: se han comunicado supervivencias a 5 años del 91% en pacientes con 1-3 ganglios afectados frente al 60% en pacientes con más de 3 ganglios afectados18.
En resumen, la simple observación mamaria no es aceptable y la historia natural de estos tumores aconseja su tratamiento «activo». El pronóstico de las pacientes mastectomizadas es similar al de las irradiadas, por lo que aconsejamos la RT en los casos en que no hay ningún indicio clínico ni radiológico que sugiera la localización tumoral. De lo contrario, aconsejamos la resección del cuadrante sospechoso. Cualquiera de estas opciones debe completarse realizando un vaciamiento axilar de los niveles I y II de Berg.
La quimioterapia adyuvante está indicada en estas pacientes y debe iniciarse lo antes posible tras la cicatrización completa del vaciamiento axilar y/o de la mastectomía. En las pacientes que optan por la irradiación mamaria, ésta se puede demorar hasta haber finalizado la quimioterapia sin menoscabo del control local de la enfermedad19.
Patogenia
Los modelos evolutivos lineales de las neoplasias sugieren que, tras la transformación inicial de una célula, el tumor crece con cada multiplicación celular, acumulándose las aberraciones genéticas que aumentan su agresividad. Así, los tumores más pequeños se corresponderían con tumores menos agresivos mientras que los tumores de mayor tamaño son también los más agresivos. En este proceso progresivo, la adquisición de capacidad neoangiogénica --por la secreción de factores angiogénicos por el propio tumor o las células vecinas-- es fundamental para que lleguen a manifestarse clínicamente; y suele ser previa a la adquisición de capacidad metastagénica (fig. 8).
En las etapas tempranas de crecimiento, los tumores se sirven de la vascularización del tejido sobre el que asientan para crecer. La respuesta defensiva del organismo condiciona la regresión de estos vasos, con la consiguiente hipoxia y muerte celular, limitando el tamaño tumoral a 1-2 mm. Sólo si el tumor es capaz de generar nuevos vasos en su periferia (neoangiogénesis) podrá seguir creciendo20.
¿Por qué entonces un tumor tan pequeño como el del presente caso, que no se manifiesta clínicamente, es capaz de generar metástasis a distancia si la capacidad metastagénica se adquiere más tarde en la escala evolutiva tumoral? ¿Por qué un tumor tan pequeño y en teoría poco avanzado biológicamente se comporta como uno mucho más agresivo?
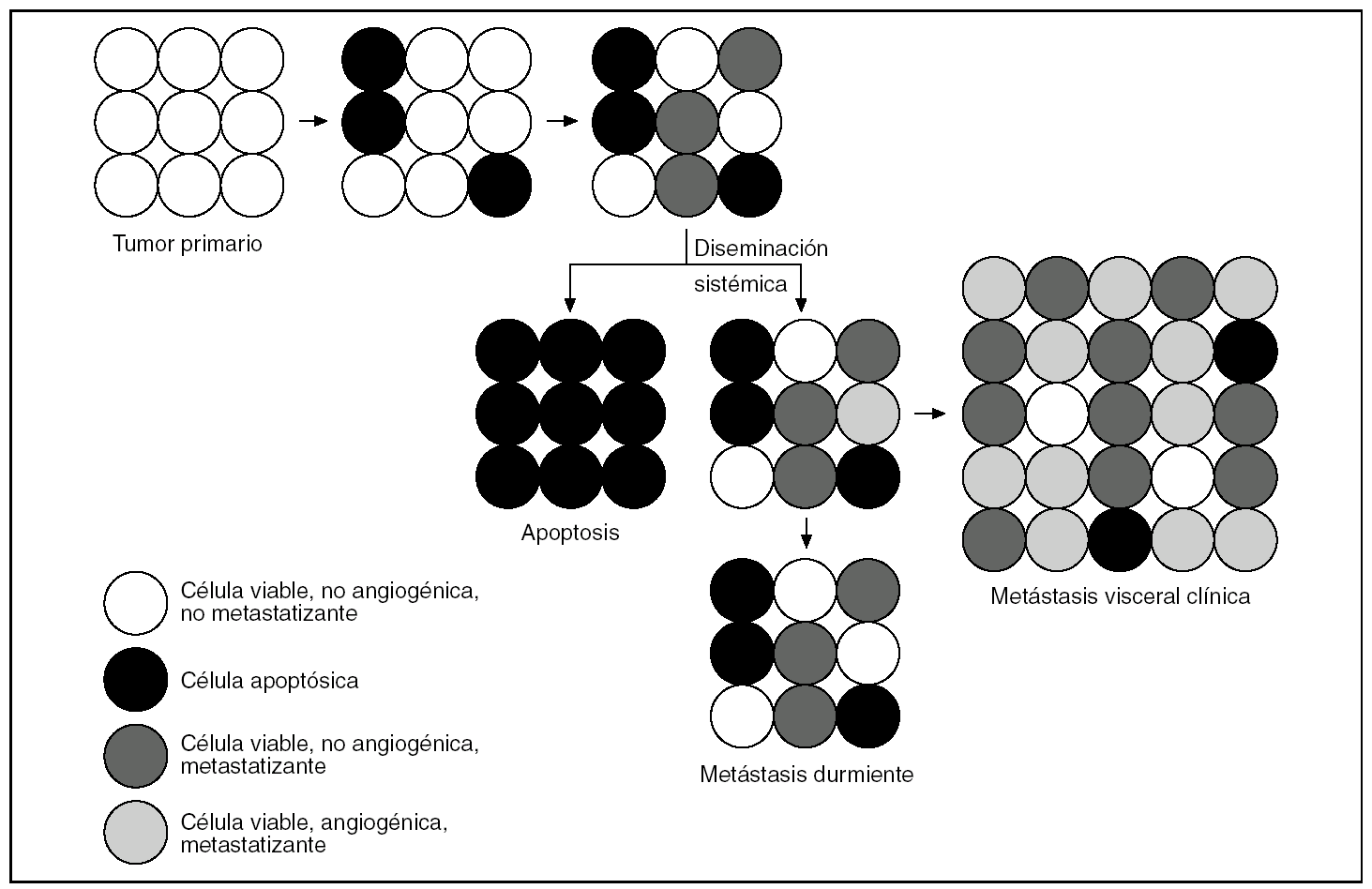
Se han propuesto varias hipótesis que intentan explicar esta aparente paradoja20-22. La hipótesis de «incompetencia angiogénica» defiende que los sucesivos intentos de crecer más allá del umbral de 2 mm que puede soportar la vascularización local se acompañan de otros tantos ciclos de muerte y sustitución celular20. El tumor va avanzando biológicamente pero se mantiene subclínico dado que no puede crecer. Con el tiempo, alguna de sus células puede adquirir capacidad metastagénica y, si alcanzan algún vaso, diseminarse. Tras la diseminación, el tumor primario puede continuar siendo subclínico, adquirir capacidad angiogénica y hacerse clínico, o desaparecer20. En las metástasis, el proceso se repite de la misma manera: las metástasis clínicas de tumores primarios que permanecen silentes durante mucho tiempo son más agresivas (fig. 9). Sin embargo, este modelo no es aplicable a los procesos tumorales que asientan en los ganglios linfáticos: en ellos, el tumor dispone de una rica vascularización y aporte de nutrientes y no es necesario que adquiera capacidad neoangiogénica para crecer. Así, el tumor crecerá sin pasar por tantos ciclos de muerte/recambio celular y avanzará menos biológicamente; cuando se manifieste clínicamente lo hará en estadios menos agresivos.
Figura 9.Según la hipótesis de Narres, si un tumor no es capaz de desarrollar capacidad neoangiogénica, sus células van pasando por sucesivos ciclos de muerte y renovación que las hacen avanzar en la escala evolutiva, pero sin aumentar la masa tumoral, por lo que no se manifiestan clínicamente. Tendremos, por tanto, tumores pequeños subclínicos, pero avanzados evolutivamente, que son capaces de dar metástasis a distancia. En el lugar de asiento de estas metástasis, el proceso se repite de la misma manera, con la particularidad de que estas células, evolutivamente más avanzadas, son más agresivas.
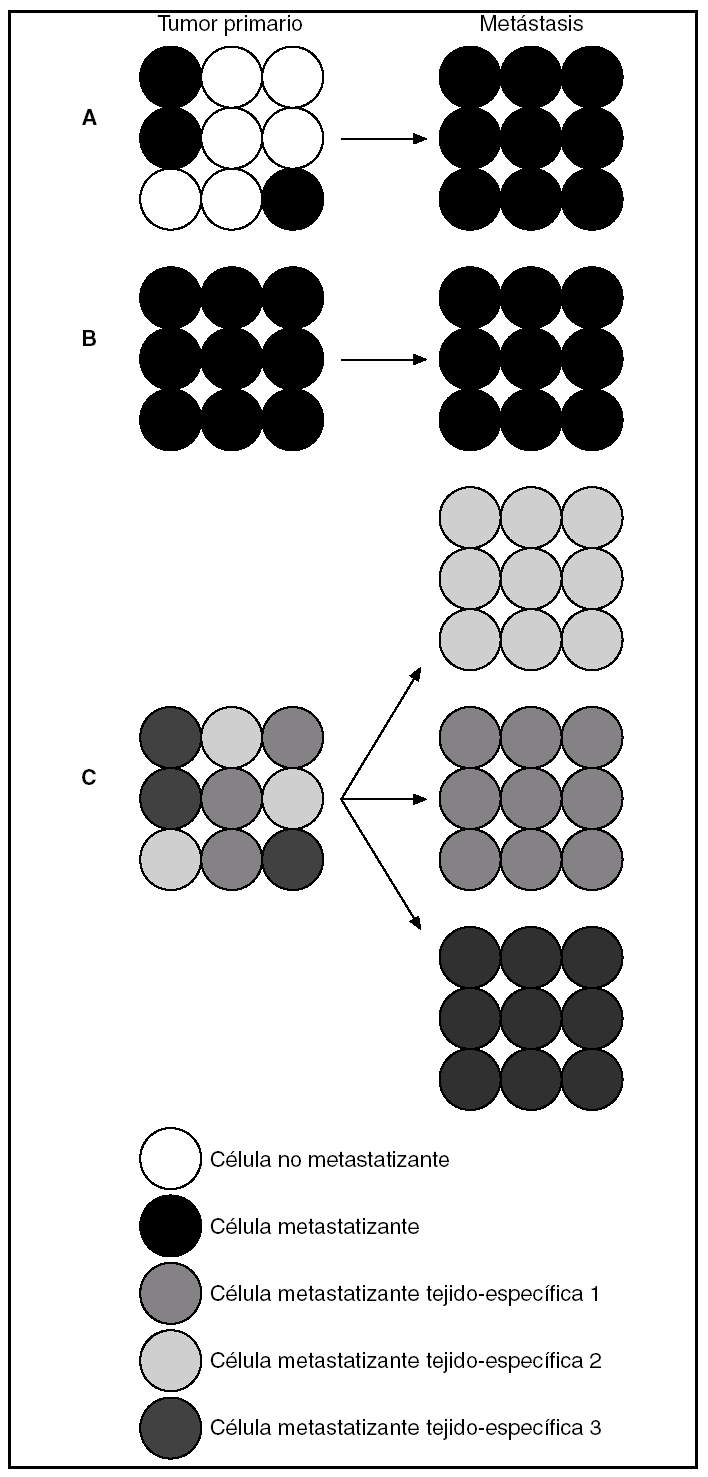
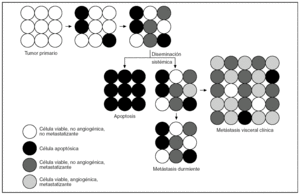
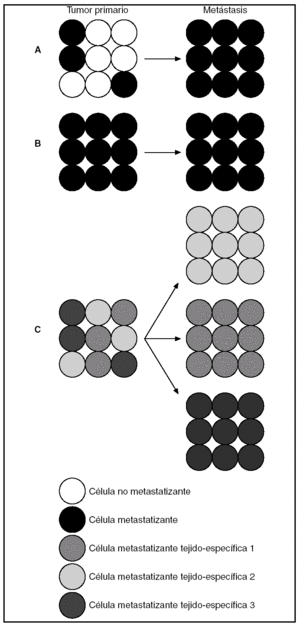
Otro enfoque diferente se baraja en la actualidad. De acuerdo con los modelos evolutivos aceptados, la capacidad metastatizante se adquiere rara vez y tarde en la escala evolutiva y sólo por una población celular de las muchas que componen un tumor21,23 (fig. 10 A). Otros autores, basándose en el hecho de que los perfiles de expresión génica de las células del cáncer mamario en humanos tienen valor pronóstico, añaden que la capacidad de un tumor para dar metástasis es un valor intrínseco del propio tumor, presente ya en etapas muy tempranas22 (fig. 10 B). Recientemente, se ha identificado en la línea de células humanas de cáncer de mama, sobre la que se estableció el supuesto anterior, un grupo específico de genes que median la capacidad de dar metástasis óseas de forma preferencial. Este hallazgo ha llevado a postular que los tumores primarios metastatizantes, además de ser intrínsecamente más agresivos, presentan subpoblaciones con un perfil de expresión génica predictivo del lugar de metastatización (fig. 10 C).
Figura 10.Modelo de predeterminación genética de evolución tumoral. A) Sólo algunas células de la masa tumoral avanzan evolutivamente lo suficiente para dar metástasis. B) La capacidad metastatizante de algunos clones celulares dentro del tumor es un valor intrínseco presente desde el principio. C) Los tumores primarios metastatizantes presentan subpoblaciones intrínsicamente más agresivas con capacidad para dar metástasis de forma preferencial en determinadas localizaciones.
En definitiva, es bastante probable que en las neoplasias de primario desconocido, el tumor primario sea intrínsecamente metastatizante desde un principio y angiogénicamente incompetente para manifestarse clínicamente, lo cual sintetiza ambos enfoques.
Correspondencia:
Dr. A. Millet Serrano.
Servicio de Obstetricia y Ginecología. Hospital Clínico Universitario.
Avda. Vicente Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: amillets@telefonica.net
Fecha de recepción: 18/4/05.
Aceptado para su publicación: 30/12/05.