La incidencia del cáncer de mama asociado a la gestación está entre el 0,2-2,6%, aumentando actualmente debido al retraso de la maternidad. Por ello es importante revisar y actualizar las posibilidades de tratamiento en estas pacientes. La cirugía puede hacerse de manera segura en cualquier momento y el embarazo no supone una contraindicación para la biopsia selectiva del ganglio centinela (BSGC). Tampoco está contraindicado el tratamiento con quimioterapia, evitando siempre el primer trimestre. Este artículo revisa un caso clínico de gestante con cáncer de mama en la que se realizó una tumorectomía con BSGC y que recibió quimioterapia durante su segundo y tercer mes de embarazo.
The incidence of pregnancy-associated breast cancer is between 0.2% and 2.6% and is currently increasing due to delayed childbearing. It is therefore important to review and update treatment options in these patients. Surgery can be done safely at any time. Pregnancy is not a contraindication for sentinel lymph node biopsy (SLNB) or for chemotherapy, except in the first trimester. This article reviews the case of a pregnant women with breast cancer who underwent a lumpectomy with SLNB and received chemotherapy her second and third month of pregnancy.
El cáncer de mama en el embarazo es aquel diagnosticado durante el embarazo y el primer año posparto. Aunque hay grupos que diferencian a las mujeres entre aquellas que son diagnosticadas durante la gestación y aquellas que se diagnostican en el primer año tras el parto1,2. La asociación entre el cáncer de mama y la gestación es un hecho infrecuente, con una incidencia estimada de 1/3.000 hasta 1/10.000 partos. La edad promedio de las pacientes es de 35 años. Debido a que cada vez más mujeres posponen la maternidad, se estima que aumentará aún más su incidencia en mujeres embarazadas y lactantes1–3.
Caso clínicoMujer de 31 años que consultó por nódulo en mama derecha a las 20 semanas de embarazo. Entre sus antecedentes familiares destacaban madre y abuela materna con cáncer de mama en premenopausia. No tenía antecedentes personales de interés, salvo un legrado por aborto espontáneo el año anterior. A la exploración se objetivaron unas mamas ingurgitadas y se palpó nódulo de 3cm en unión de cuadrantes superiores de mama derecha, duro, adherido a planos profundos. La axila era clínicamente negativa. La mamografía/ecografía confirmó la existencia de una formación pseudonodular mal definida de 3×1,5cm en cuadrantes superiores de la mama derecha y la existencia de un ganglio axilar prominente con ligero aumento de la densidad. Se catalogó de BIRADS 5 y se realizó biopsia con aguja gruesa. El resultado fue un carcinoma ductal infiltrante, grado III. La inmunohistoquímica fue la siguiente: receptores de estrógenos negativo, receptores de progesterona<10%, Ki 67 del 70%, E- cadherina (+), Her2 negativo, CK 19 positivo. Por lo que nos encontrábamos ante un carcinoma ductal infiltrante triple negativo. Se pidió una resonancia nuclear magnética que no identificó otros focos de captación patológica del contraste excepto el diagnosticado con anterioridad.
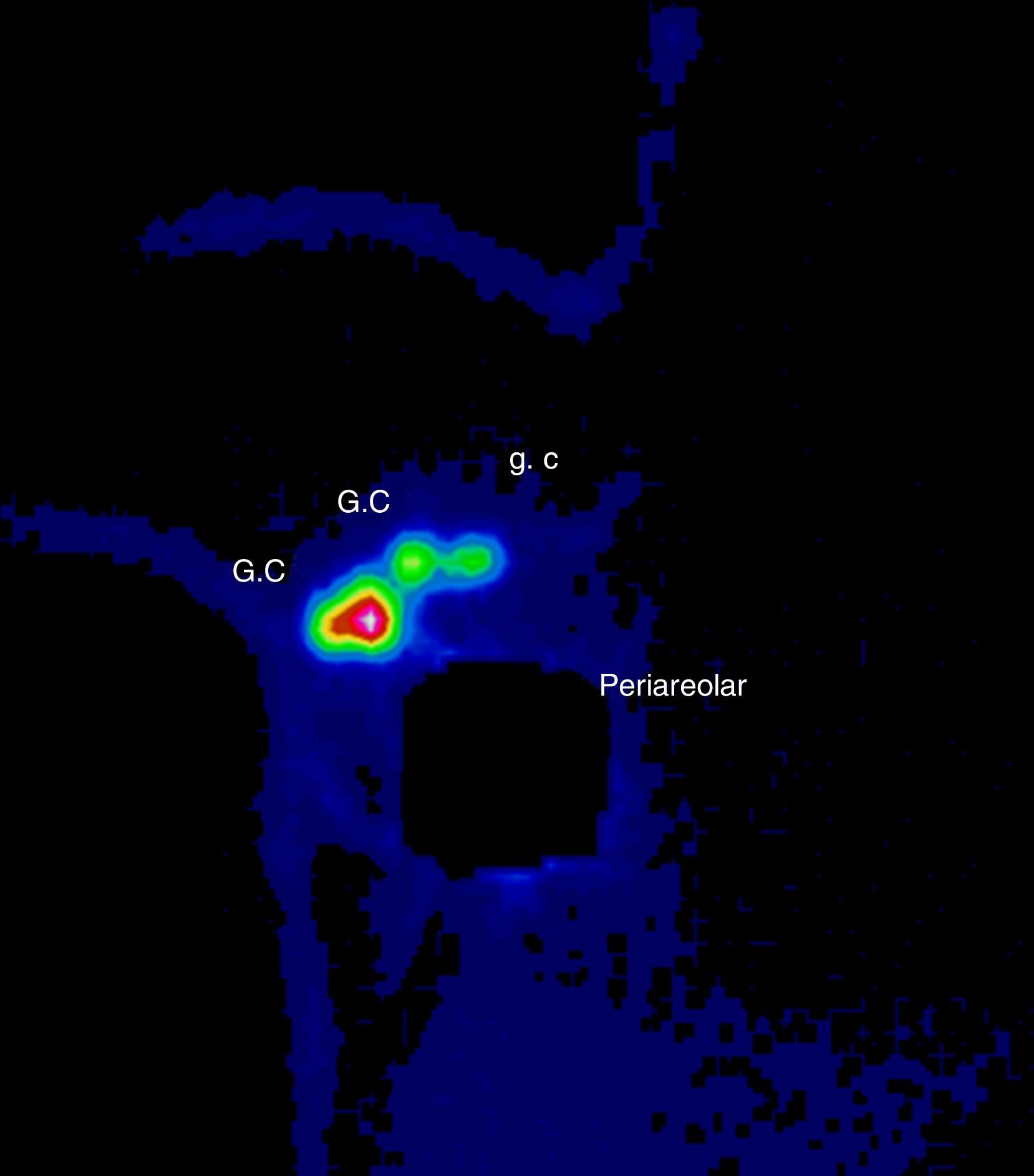
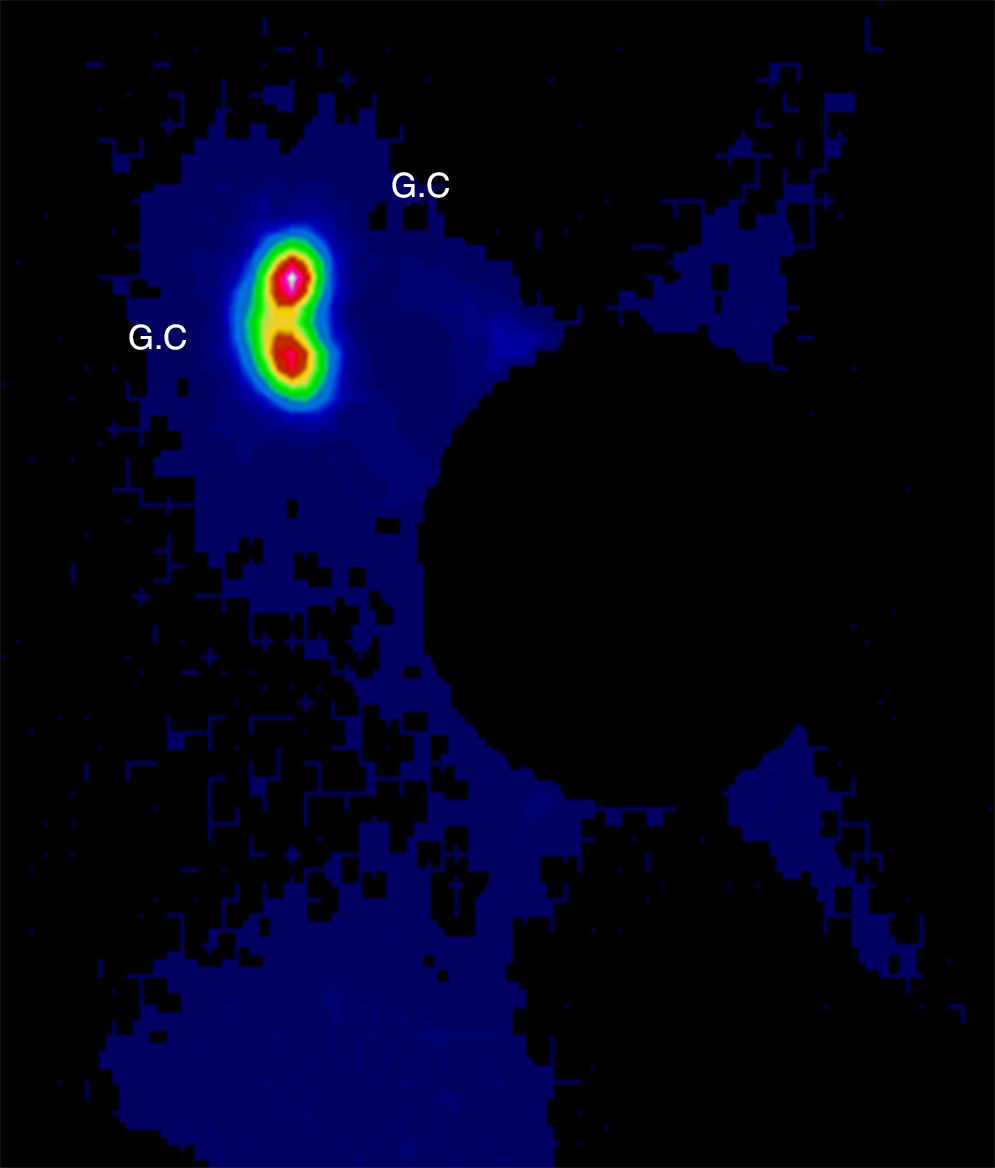
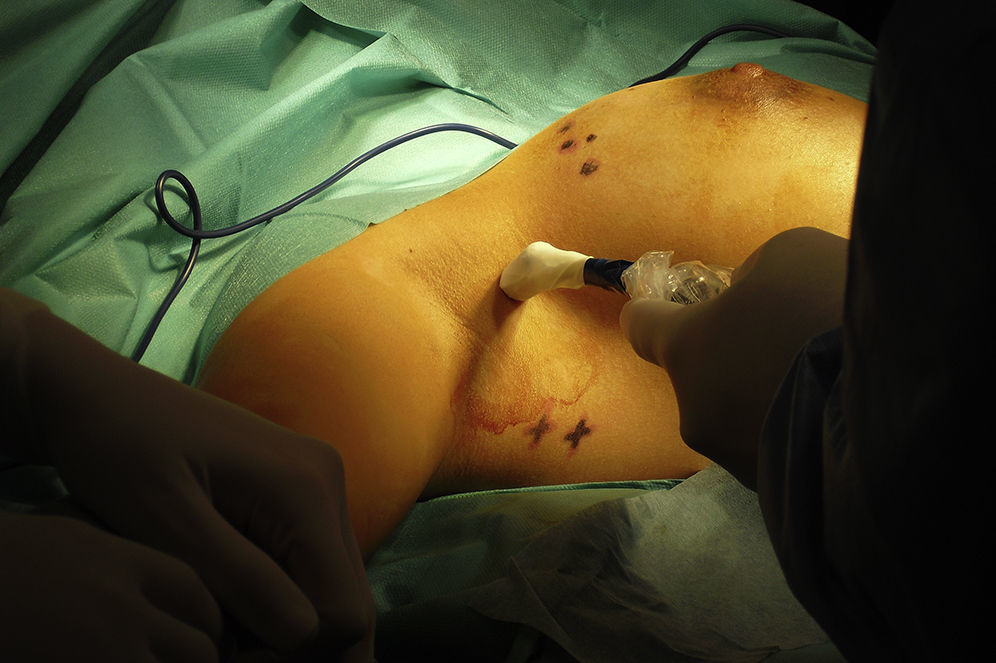
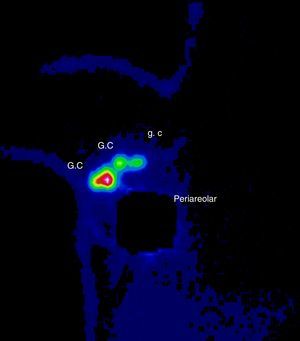
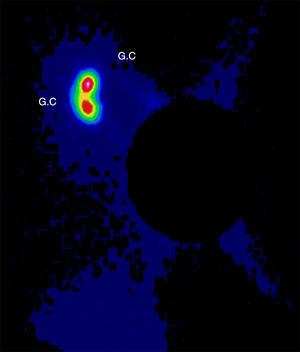
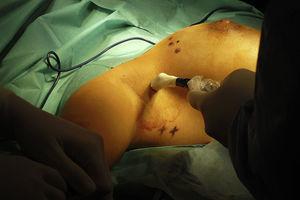
Se discutió el caso en el Comité de Tumores de la Unidad de Mama entre todos los componentes del equipo multidisciplinar: oncólogos, ginecólogos, radioterapeutas, médicos nucleares, etc. Tras valorar las diferentes opciones terapéuticas se decidió comenzar con el tratamiento quirúrgico para minimizar los daños sobre el feto y poder posponer algunas semanas la quimioterapia. Se realizó una tumorectomía y biopsia selectiva del ganglio centinela (BSGC) (figs. 1–3). El estudio intraoperatorio mediante OSNA de los ganglios centinelas fue negativo. El resultado anatomopatológico definitivo del estudio del tumor informó de carcinoma ductal infiltrante de 2,8cm, grado III, menos del 25% de componente intraductal, y bordes de resección libres.
Posteriormente durante el segundo y tercer trimestre del embarazo se llevó a cabo el tratamiento sistémico con quimioterapia. La paciente recibió 3 ciclos antes del parto. (doxorrubicina 50mg/m2 (80mg dosis total) y ciclofosfamida 500mg/m2 (800mg dosis total). Antiemesis con sentrones y ondansetrón. Tuvo una buena tolerancia al tratamiento, sin apenas efectos secundarios, salvo alopecia parcial y un episodio diarreico. Se inició estudio genético por la edad de presentación del cáncer en esta paciente y por los antecedentes familiares y se siguió un estricto control de la gestación en consulta de alto riesgo obstétrico. Como complicación al tratamiento el feto presentó un crecimiento intrauterino retardado, con estudio doppler normal. Se realizó cesárea electiva por pelviana a las 38+6 semanas, nació una mujer de 2.515g, Apgar 9-10-10. Tras la recuperación de la cirugía la paciente continuó con el tratamiento: quimioterapia y radioterapia.
DiscusiónEl cáncer de mama durante el embarazo es de difícil diagnóstico por los cambios fisiológicos de la mama durante la gestación y el tratamiento, y con frecuencia hay retraso y suelen diagnosticarse como lesiones más grandes y con mayor afectación ganglionar. Además, el fenotipo es la mayoría de las veces más agresivo1,4. La interrupción del embarazo no ha demostrado que comporte mejor pronóstico2–4.
El tratamiento no debe ser retrasado a causa del embarazo y debe ser individualizado según las características de la gestante y del tumor4. En cuanto al tratamiento locorregional durante la gestación, se puede realizar tanto mastectomía como cirugía conservadora, y BSGC o linfadenectomía según esté indicado1,5. Las mujeres gestantes o puérperas lactantes no constituyen un criterio de contraindicación para BSGC. Se recomienda utilizar la mínima dosis posible de trazador y el mismo día de la cirugía. Está contraindicado el uso de colorante vital y se debe retirar la lactancia las 24h previas6. Se evaluó el riesgo para el embrión/feto asociados con la biopsia del ganglio centinela y linfogammagrafía de la mama realizado en pacientes embarazadas. La distribución por todo el cuerpo del radiofármaco se evaluó usando una gammacámara una hora después de la inyección y a continuación se calculó la dosis absorbida por el feto y resultó que una hora después de la inyección radiofármaco no había ninguna radiactividad excepto en la vecindad del sitio de inyección. La dosis máxima absorbida para el feto fue de 4,3mGy, calculados para el peor de los casos y está muy por debajo del 50mGy que se cree que es la dosis umbral absorbida para provocar efectos adversos. Así, la linfogammagrafía de mama durante el embarazo parece presentar un riesgo muy bajo para el embrión/feto7. Se ha demostrado, por lo tanto, que el embarazo no es una contraindicación para la BSGC y se justifica por el bajo riesgo del procedimiento en relación al riesgo de una linfadenectomía axilar tomando siempre en cuenta las precauciones necesarias que se deben tomar al ingresar a una paciente embarazada en un servicio de medicina nuclear: la semana de embarazo (evitar 1.er trimestre), la dosis, evitar el uso de colorante, protocolo de un día y valoración del riesgo beneficio6,8.
El tratamiento sistémico debe realizarse con las mismas dosis que en las no gestantes, evitándose la quimioterapia en el primer trimestre y 3-4 semanas previas al parto (para evitar la mielosupresión neonatal y la trombocitopenia y neutropenia materna)3,9. Está contraindicado en el embarazo la hormonoterapia por tener capacidad teratogénica, puede provocar sobre todo alteraciones cráneo-faciales, síndrome de Goldenhar10, genitales ambiguos11 o muerte fetal. Tampoco se debe administrar a gestantes el trastuzumab, que se ha demostrado que atraviesa la placenta y provoca en los fetos expuestos fallos renales, oligoamnios y muertes fetales. También está contraindicada en el embarazo la radioterapia, ya que provoca abortos en el primer trimestre y malformaciones en gestaciones más avanzadas12,13. Cuando el número de células en el embrión es pequeño, es decir, en la primera semana después de la concepción, el daño a estas células probablemente dará lugar a la falta de implante o la muerte indetectable. Las malformaciones son poco probables o muy raras. Durante la organogénesis, en las semanas 2-8 después de la concepción, la exposición a la radiación puede causar malformaciones que surgen, sobre todo, en los órganos en desarrollo en el momento de la exposición. Las malformaciones pueden producirse por encima de un umbral de dosis de 0,1 -0,2Gy13. Además, como resultado de la exposición a la radiación durante la gestación hay un mayor riesgo de cáncer en la infancia y leucemia12,13.
Con estas indicaciones generales, cada unidad de mama debe discutir en el Comité de Tumores el tratamiento más adecuado para cada caso individualizado de gestante en la que se diagnostica un cáncer de mama.
ConclusionesEl cáncer de mama es uno de los que con mayor frecuencia pueden ocurrir durante el embarazo, debido al aumento de la edad de maternidad, se espera un incremento en la incidencia de esta patología. Hay que recordar que se puede realizar tratamiento con quimioterapia durante el segundo y tercer trimestre de embarazo, cuando los beneficios del tratamiento superen el riesgo de efectos secundarios sobre el feto: crecimiento intrauterino retardado, prematuridad, muerte, alteraciones hematológicas, etc, no hay un aumento de malformaciones fetales, siempre que se evite la quimioterapia en el primer trimestre. También señalar que las mujeres gestantes o puérperas lactantes no constituyen un criterio de contraindicación para BSGC, ya que la dosis de radiofármaco absorbida por el feto se encuentra por debajo del umbral necesario para producir efectos adversos. Esto nos permite realizar una cirugía axilar conservadora en caso de ganglio centinela negativo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.