INTRODUCCIÓN
La bilis por transporte activo se secreta a través de los conductos epiteliales de los hepatocitos1. Durante el embarazo, existe una reducción en la formación biliar que combinada con un defecto subclínico preexistente en este sistema de transporte biliar (mutaciones heterocigotas en ciertos genes como MDR3, SEP, FIC 1)26 origina una forma reversible no obstructiva de colestasis intrahepática1.
La incidencia de colestasis intrahepática del embarazo (CIE) es de 10-100 casos por 10.000 embarazadas (4% de las embarazadas en Chile7, 1% en escandinavas y 0,1% en norteamericanas8-10).
El mecanismo de la reducción en la formación biliar durante el embarazo es desconocido, pero está relacionado con las altas concentraciones de hormonas circulantes (estrógenos8 y progesterona2,11) durante el último trimestre de la gestación, gestaciones gemelares8 y toma de anticonceptivos orales8,12.
Dicha patología desaparece tras el parto y recurre en el 45-70% de las pacientes2,13.
Ciertos factores exógenos como el invierno12 o el déficit de selenio en la alimentación provocan una mayor incidencia de CIE.
La sospecha diagnóstica se centra en la clínica del prurito severo (en palmas y plantas de la gestante que tiende a generalizarse e intensificarse durante la noche) y sólo un 10% de las embarazadas presentan ictericia, por el aumento de la bilirrubina en sangre2,14.
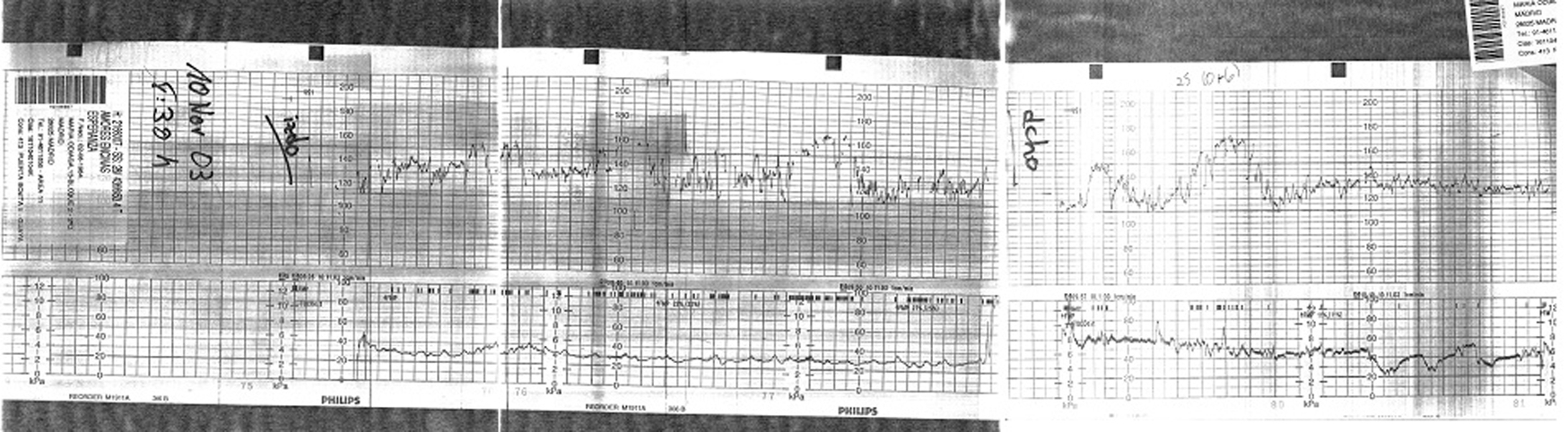
Figura 1.Registro cardiotocográfico realizado antes de la cesárea.
Podemos encontrar aumento de las transaminasas (20-60%), bilirrubina (10-20%) y tiempo de protrombina (con aumento en la incidencia de la hemorragia posparto8,10,15), aunque la confirmación diagnóstica se realiza por la elevación de los ácidos biliares en sangre (> 11 μmol/l). Dicha elevación favorece la contractilidad uterina aumentando los partos pretérmino (19-60%)2,14,16, estimula la motilidad colónica aumentando el meconio (26-58%)2 y aparece vasoconstricción de las vellosidades coriónicas placentarias con hipoxia aguda (muerte fetal intraútero o durante el parto del 10% sin tratamiento17 y del 0-2% cuando se inicia el parto antes de llegar a término)8,18.
En estos fetos el Doppler en la arteria umbilical es normal y el peso es adecuado para su edad gestacional, ya que la insuficiencia placentaria crónica no es la causa primaria de la muerte fetal2.
El objetivo del tratamiento es disminuir los ácidos biliares en sangre hasta conseguir la madurez pulmonar fetal.
El ácido ursodeoxicólico (10-16 mg/kg/día) es efectivo y seguro en pacientes con CIE19,20. Se administra preferentemente a pacientes con colestasis severa (antes de la semana 33) o con historia de muerte fetal anterior20. Alivia el prurito y disminuye los ácidos biliares, las transaminasas y la bilirrubina2,20.
CASO CLÍNICO
Gestante de 39 años. Embarazo gemelar bicorial biamniótico conseguido por fecundación in vitro (FIV). Ingreso hospitalario en la semana 32 + 5 por dinámica uterina. El control clínico, analítico y ecográfico realizado en su ambulatorio fue normal (ecografía realizada en el momento del ingreso, normal).
El registro cardiotocográfico en el momento del ingreso tuvo las siguientes características: primer gemelo con frecuencia cardíaca basal de 140 lat/min y reactivo, y segundo gemelo con frecuencia cardíaca fetal de 135 lat/min y reactivo.
Ante la dinámica uterina irregular diagnosticada por cardiotocografía y percibida por la paciente, se inició el tratamiento con nifedipino (Adalat retard 20 mg/6 h) y el protocolo de madurez pulmonar con betametasona (Celestone 12 mg/24 h, 2 dosis).
En la semana 33, la paciente refirió prurito generalizado que ya sentía una semana antes del ingreso. Se sospechó CIE y se confirmó con el perfil hepático en espera del resultado de las concentraciones de ácidos biliares en sangre (GPT, 732 UI/l; GOT, 372 UI/l; GGT, 48UI/l; FA, 544 UI/l; tiempo de protrombina 139%; el resultado final de ácidos biliares fue 25 μmol/l). Ante el diagnóstico de CIE, se inició el tratamiento con ácido ursodeoxicólico (300 mg en el desayuno y 450 mg en la cena) y se retiró el Adalat retard.
En la semana 33 + 1 se presentó el caso en sesión clínica y se decidió mantener una conducta expectante hasta la semana 34.
Ese mismo día se realizó ecografía, con el siguiente resultado: primer gemelo con CIR moderado (DBP, 75; DAT, 77; DAAP, 83; fémur, 59); segundo gemelo con biometría normal (DBP, 74; DAT, 81; DAAP, 83; fémur, 61); el Doppler en arteria umbilical y ductus venoso de ambos gemelos fue normal.
La monitorización fetal se realizó cada 8 h y fue normal, las cifras de las transaminasas descendieron sin llegar a normalizarse y el prurito mejoró y únicamente se localizaba en las palmas.
En la semana 33 + 4 (lunes), el equipo de guardia realizó el Doppler en la arteria umbilical de ambos fetos (7.30 h), y fue normal. Se presentó el caso en sesión clínica y se decidió realizar cesárea durante la misma mañana.
La monitorización fetal que se realizó previamente a la cesárea (9.28-10.20 h) fue normal. El registro tuvo las siguientes características: primer gemelo con frecuencia cardíaca basal de 130 y reactivo; segundo gemelo con frecuencia cardíaca basal de 130 y reactivo; sin dinámica uterina.
La cesárea se realizó con anestesia intradural sin incidencias a la hora de haber realizado el registro cardiotocográfico. La extracción del primer gemelo fue en cefálica sin signos de vitalidad y meconio muy espeso; mujer de 1.710 g, que fracasadas todas las maniobras de resucitación (8 min de reanimación por parte del servicio de neonatología) se consideró fallecimiento fetal (Apgar, 0/0; pH, 6,71). El segundo gemelo se extrajo en cefálica, líquido amniótico amarillo, varón de 1.700 g; Apgar, 10/10, y pH, 7,31.
Como hallazgos, destacar la presencia de 2 quistes de 2 cm en el ovario derecho con aspecto macroscópico de endometriomas que fueron extirpados. El diagnóstico inicial de endometriosis fue confirmado con el estudio anatomopatológico.
DISCUSIÓN
No está claro que elevaciones importantes de los ácidos biliares se correlacionen con un empeoramiento en el pronóstico perinatal2.
El pronóstico perinatal se beneficia terminando la gestación de manera electiva; siempre en función de la madurez pulmonar fetal o antes si se identifica afectación fetal10,15,17.
La monitorización fetal y/o el Doppler de la arteria umbilical no sirven para el control del bienestar fetal en este tipo de patología (la monitorización fetal y el Doppler no nos han ayudado a evitar esta muerte fetal intraútero).
En el manejo obstétrico "hay que situar en una balanza el riesgo del nacimiento de un prematuro y el riesgo de una muerte fetal intraútero"2.