Evaluar la efectividad del cribado combinado del primer trimestre para la detección prenatal del síndrome de Down tras 5 años de implantación en nuestro hospital y su repercusión en la disminución de pruebas diagnósticas invasivas.
Material y métodosSe evaluó el riesgo de anomalía cromosómica fetal en 10.669 gestaciones mediante cribado combinado del primer trimestre entre mayo de 2006 y diciembre de 2010. El punto de corte para indicar una técnica invasiva diagnóstica fue de 1/270. Asimismo se analizaron las amniocentesis realizadas entre los años 2005 y 2010.
ResultadosLa tasa de detección del cribado para trisomía 21 fue del 90% y la tasa de falsos positivos del 3,56%. En gestantes de 35 o más años, la tasa de detección fue del 96,7%. En el año 2005 se realizaron 496 amniocentesis. En el año 2010, tras 5 años de la implementación del cribado, se realizaron 148 amniocentesis, lo que implica una reducción de técnicas invasivas del 70%.
ConclusionesLa implantación del cribado combinado en nuestro medio ha demostrado su eficacia para la detección de trisomía 21 y ha supuesto una importante reducción en el número de procedimientos invasivos de diagnóstico prenatal. La edad materna avanzada como criterio aislado de indicación de técnicas invasivas para el estudio del cariotipo fetal debe cuestionarse si se ofrece un cribado universal y de calidad.
To assess the effectiveness of first-trimester combined screening in the prenatal detection of Down syndrome after 5 years of use in our hospital and its impact in reducing invasive diagnostic tests.
Material and methodsThe risk of fetal chromosomal anomalies was assessed in 10,669 pregnancies with first-trimester combined screening between May 2006 and December 2010. The cut-off to indicate an invasive diagnostic test was 1/270. The amniocenteses performed between 2005 and 2010 were also analyzed.
ResultsThe detection rate of screening for trisomy 21 was 90% and the false-positive rate was 3.56%. In pregnant women aged 35 years or more, the detection rate was 96.7%. In 2005 there were 496 amniocenteses. In 2010, 5 years after the introduction of screening, 148 amniocenteses were performed, representing a 70% reduction in invasive procedures.
ConclusionsThe introduction of combined screening in our environment has proven effective for the detection of trisomy 21 and has substantially reduced the use of invasive prenatal diagnostic procedures. The use of advanced maternal age as an isolated criterion to indicate invasive techniques to study fetal karyotype should be questioned if high-quality universal screening is to be offered.
La trisomía 21 o síndrome de Down es la aneuploidía más frecuente en recién nacidos, la que presenta una supervivencia postnatal más prolongada y la causa más común de retraso mental severo. La identificación de gestantes con riesgo de anomalía cromosómica fetal ha sido uno de los objetivos de los controles prenatales. Durante muchos años, la edad materna superior a 35 años fue el principal criterio de indicación de estudio del cariotipo fetal1. El aumento en la proporción de gestantes mayores de 35 años y la necesidad de un procedimiento invasivo para la obtención del cariotipo que conlleva riesgo de pérdida fetal, así como los costes sanitarios derivados del proceso, han llevado a la investigación de métodos de cribado más eficaces2,3.
El cribado poblacional de anomalías cromosómicas que combina la edad materna, los marcadores ecográficos, como la translucencia nucal (TN), y los marcadores bioquímicos del primer trimestre, como la proteína plasmática A asociada al embarazo (PAPP-A) y la fracción libre de la gonadotropina coriónica humana (fβ-hCG), ha demostrado su efectividad como método de selección de gestantes con riesgo de anomalía cromosómica fetal y especialmente de la trisomía 214. Todas las pacientes, independientemente de la edad, pueden optar por este cribado y obtener una información individualizada del riesgo de anomalía cromosómica fetal. Es deber de todos los profesionales implicados en el proceso conseguir un cribado accesible a toda la población gestante y con garantías de calidad.
El objetivo de este estudio es conocer los resultados del cribado combinado de anomalías cromosómicas en el primer trimestre de gestación tras 5 años de implantación en el área de influencia del Hospital Ramón y Cajal de Madrid (Área 4) y su repercusión en la disminución de pruebas invasivas de diagnóstico prenatal.
Material y métodosDesde mayo de 2006 hasta diciembre de 2010 hemos analizado 10.669 gestaciones procedentes de población general no seleccionada en las que se estudió el riesgo de aneuploidía fetal mediante cribado combinado en el primer trimestre.
El programa de cribado poblacional mediante test combinado en primer trimestre se puso en marcha en nuestro hospital en mayo de 2006. Se ofrece a todas las gestantes que acuden a la primera visita de control de embarazo antes de la 13+6 semanas. Durante esta primera consulta, el obstetra explica a la paciente las implicaciones del cribado y recaba su consentimiento informado por escrito. Si la paciente acude tarde a la primera visita (más allá de la semana 14.ª), o por los motivos que fuesen no se realiza el cribado del primer trimestre, se ofrece el cribado del segundo trimestre, que en nuestro medio se realiza mediante doble test bioquímico, determinándose alfafetoproteína (AFP) y hCG.
La indicación de técnicas invasivas para el estudio del cariotipo fetal por la edad materna ha variado en los últimos años. Hasta el año 2006, se ofrecía amniocentesis a todas las embarazadas con edad igual o superior a 35 años. En menores de 35 años se realizaba el cribado bioquímico del segundo trimestre. A partir del año 2006, con la implementación del cribado combinado de anomalías cromosómicas del primer trimestre, que contempla la edad materna para el cálculo del riesgo, se abandonó la indicación de amniocentesis por edad avanzada como criterio único. En los años 2006 y 2007, se ofrecía la técnica invasiva a embarazadas mayores de 35 años que no se habían realizado el cribado, y a partir del año 2008, se aumentó esta edad a los 38 años. El motivo del cambio de la edad de corte de los 35 a los 38 años fue reflejo de lo que se venía haciendo en otras comunidades autónomas, como Cataluña. Según la Instrucción 01/1998 del Servicio Catalán de Salud (CatSalut)5, previa redacción de un protocolo consensuado por un grupo de expertos (Armelles et al.)6, se consideraba la edad materna de 38 años como punto de corte para la recomendación de amniocentesis. Este protocolo fue actualizado en el año 20087. En el momento actual, la edad materna avanzada como criterio para la indicación de una prueba invasiva de estudio del cariotipo fetal no está contemplada en nuestro hospital, excepto en casos de gestantes con edad igual o superior a 38 años que no se han realizado ningún tipo de cribado por acudir a la consulta fuera de los plazos.
El cribado combinado del primer trimestre en nuestra área sanitaria se realiza en un solo paso. Se programa una exploración ecográfica entre las semanas 11+0 y 13+6 y se extrae sangre materna para la determinación sérica de PAPP-A y fβ-hCG en el mismo día o al día siguiente de la ecografía. La medición de la longitud cráneo-caudal (CRL) y la TN se realizan según los criterios de la Fetal Medicine Foundation8. Los datos de la ecografía, junto con la edad y otros antecedentes de la paciente, se transmiten al servicio de bioquímica del hospital, que se encarga de realizar la determinación bioquímica. Se ajustó la edad gestacional en el momento de la extracción de la sangre en función de la CRL. Los valores obtenidos de PAPP-A, fβ-hCG y TN se convirtieron en múltiplos de la mediana (MoM) para la correspondiente edad gestacional. Los datos se introdujeron en el programa PRISCA 4.0 Typolog software, con el que se calculó el riesgo de aneuploidías, emitiendo un informe que fue enviado al obstetra, quien informa a la gestante del resultado.
El punto de corte utilizado para ofrecer la realización de pruebas invasivas fue un riesgo estimado igual o superior a 1/2709. A estas pacientes se les explica el significado del resultado del cribado y los riesgos del procedimiento invasivo, y se les proporciona el documento de consentimiento informado. La obtención del cariotipo fetal se realizó mediante amniocentesis.
Las gestantes con un índice de riesgo combinado menor de 1/270 continúan el seguimiento habitual del embarazo. Si tras la ecografía morfológica del segundo trimestre se observan malformaciones o marcadores sugestivos de anomalía cromosómica, se informa a la paciente de los hallazgos y se ofrece amniocentesis.
ResultadosDurante el periodo estudiado, de mayo de 2006 a diciembre de 2010, se realizaron 10.669 pruebas de cribado combinado del primer trimestre. Se descartaron 14 casos por pérdida fetal sin cariotipo conocido. El grupo de estudio lo constituyen 10.655 gestantes, con una edad que osciló entre 14 y 45 años, siendo la media de 31,6 años. El 26,8% (2.851/10.655) de las embarazadas tenía una edad igual o superior a 35 años. La edad gestacional media en el momento de la ecografía fue de 12 semanas y 1 día, y en el momento de la extracción sanguínea, de 12 semanas y 2 días. La medida media de CRL fue de 58,4mm y la TN de 1,38mm.
Considerando el punto de corte para la indicación de una prueba invasiva un riesgo ≥1/270, la tasa de cribados positivos fue del 3,89% (414/10.655).
Tras el cribado combinado se detectaron, mediante estudio citogenético 49 anomalías cromosómicas (el 0,46% de la población estudiada), de las cuales 36 fueron trisomías 21, 4 trisomías 18, 3 trisomías 13 y 6 correspondían a otras anomalías cromosómicas.
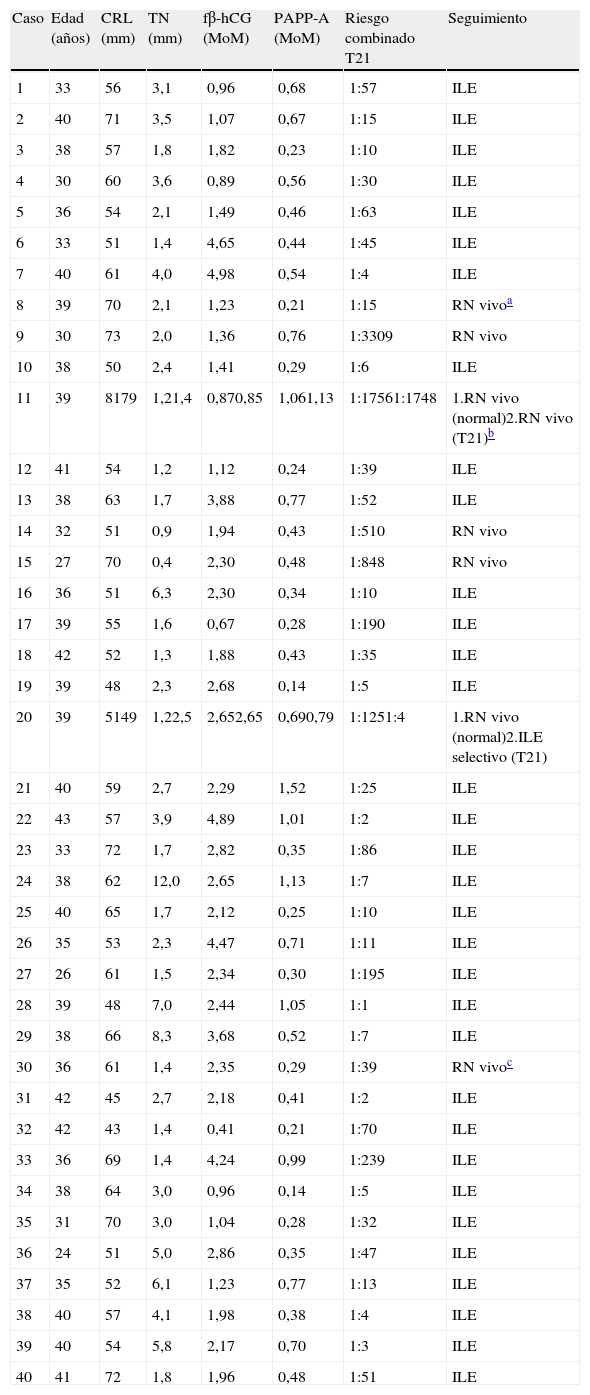
Entre las 10.655 pacientes a quienes se les realizó el cribado combinado del primer trimestre, se observaron 40 casos de trisomía 21. En la tabla 1 se muestran los datos del cribado. Los valores de los marcadores de las gestaciones con trisomía 21 se encontraron alterados: la PAPP-A estaba disminuida, con un valor medio de 0,54 MoM; la fβ-hCG estaba aumentada, con un valor medio de 2,23 MoM, y la TN presentaba un valor medio de 3,05mm. Se encontró una TN aumentada por encima del percentil 95 en el 52% de los fetos con trisomía 21.
Datos del cribado combinado del primer trimestre en gestaciones afectas de trisomía 21
| Caso | Edad (años) | CRL (mm) | TN (mm) | fβ-hCG (MoM) | PAPP-A (MoM) | Riesgo combinado T21 | Seguimiento |
| 1 | 33 | 56 | 3,1 | 0,96 | 0,68 | 1:57 | ILE |
| 2 | 40 | 71 | 3,5 | 1,07 | 0,67 | 1:15 | ILE |
| 3 | 38 | 57 | 1,8 | 1,82 | 0,23 | 1:10 | ILE |
| 4 | 30 | 60 | 3,6 | 0,89 | 0,56 | 1:30 | ILE |
| 5 | 36 | 54 | 2,1 | 1,49 | 0,46 | 1:63 | ILE |
| 6 | 33 | 51 | 1,4 | 4,65 | 0,44 | 1:45 | ILE |
| 7 | 40 | 61 | 4,0 | 4,98 | 0,54 | 1:4 | ILE |
| 8 | 39 | 70 | 2,1 | 1,23 | 0,21 | 1:15 | RN vivoa |
| 9 | 30 | 73 | 2,0 | 1,36 | 0,76 | 1:3309 | RN vivo |
| 10 | 38 | 50 | 2,4 | 1,41 | 0,29 | 1:6 | ILE |
| 11 | 39 | 8179 | 1,21,4 | 0,870,85 | 1,061,13 | 1:17561:1748 | 1.RN vivo (normal)2.RN vivo (T21)b |
| 12 | 41 | 54 | 1,2 | 1,12 | 0,24 | 1:39 | ILE |
| 13 | 38 | 63 | 1,7 | 3,88 | 0,77 | 1:52 | ILE |
| 14 | 32 | 51 | 0,9 | 1,94 | 0,43 | 1:510 | RN vivo |
| 15 | 27 | 70 | 0,4 | 2,30 | 0,48 | 1:848 | RN vivo |
| 16 | 36 | 51 | 6,3 | 2,30 | 0,34 | 1:10 | ILE |
| 17 | 39 | 55 | 1,6 | 0,67 | 0,28 | 1:190 | ILE |
| 18 | 42 | 52 | 1,3 | 1,88 | 0,43 | 1:35 | ILE |
| 19 | 39 | 48 | 2,3 | 2,68 | 0,14 | 1:5 | ILE |
| 20 | 39 | 5149 | 1,22,5 | 2,652,65 | 0,690,79 | 1:1251:4 | 1.RN vivo (normal)2.ILE selectivo (T21) |
| 21 | 40 | 59 | 2,7 | 2,29 | 1,52 | 1:25 | ILE |
| 22 | 43 | 57 | 3,9 | 4,89 | 1,01 | 1:2 | ILE |
| 23 | 33 | 72 | 1,7 | 2,82 | 0,35 | 1:86 | ILE |
| 24 | 38 | 62 | 12,0 | 2,65 | 1,13 | 1:7 | ILE |
| 25 | 40 | 65 | 1,7 | 2,12 | 0,25 | 1:10 | ILE |
| 26 | 35 | 53 | 2,3 | 4,47 | 0,71 | 1:11 | ILE |
| 27 | 26 | 61 | 1,5 | 2,34 | 0,30 | 1:195 | ILE |
| 28 | 39 | 48 | 7,0 | 2,44 | 1,05 | 1:1 | ILE |
| 29 | 38 | 66 | 8,3 | 3,68 | 0,52 | 1:7 | ILE |
| 30 | 36 | 61 | 1,4 | 2,35 | 0,29 | 1:39 | RN vivoc |
| 31 | 42 | 45 | 2,7 | 2,18 | 0,41 | 1:2 | ILE |
| 32 | 42 | 43 | 1,4 | 0,41 | 0,21 | 1:70 | ILE |
| 33 | 36 | 69 | 1,4 | 4,24 | 0,99 | 1:239 | ILE |
| 34 | 38 | 64 | 3,0 | 0,96 | 0,14 | 1:5 | ILE |
| 35 | 31 | 70 | 3,0 | 1,04 | 0,28 | 1:32 | ILE |
| 36 | 24 | 51 | 5,0 | 2,86 | 0,35 | 1:47 | ILE |
| 37 | 35 | 52 | 6,1 | 1,23 | 0,77 | 1:13 | ILE |
| 38 | 40 | 57 | 4,1 | 1,98 | 0,38 | 1:4 | ILE |
| 39 | 40 | 54 | 5,8 | 2,17 | 0,70 | 1:3 | ILE |
| 40 | 41 | 72 | 1,8 | 1,96 | 0,48 | 1:51 | ILE |
ILE: interrupción legal del embarazo; RN: recién nacido; T21: trisomía 21.
Casos 11 y 20: gestaciones gemelares bicoriales.
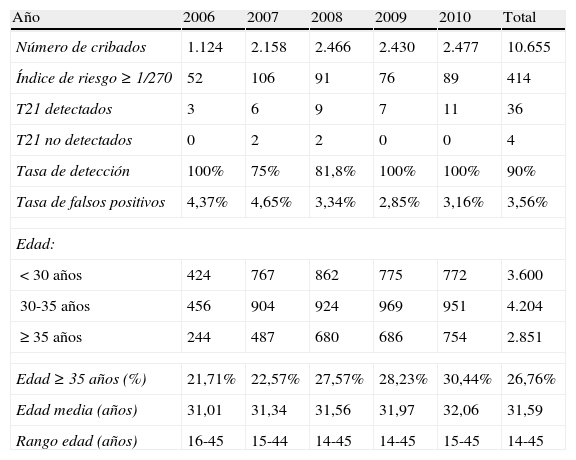
La tasa de detección del cribado para la trisomía 21 fue del 90% (36/40) (tabla 2). En uno de los casos detectados, la paciente rehusó realizarse un estudio del cariotipo fetal y decidió continuar el embarazo. En otro de los casos, se realizó la amniocentesis y la pareja optó por proseguir el embarazo conociendo el diagnóstico de trisomía 21 en el feto. En los restantes 34 casos, se realizó una amniocentesis y se optó por una interrupción legal del embarazo (ILE). De entre los 4 casos no detectados (falsos negativos del cribado), existe un embarazo gemelar en el que uno de los fetos presentaba una tetralogía de Fallot que se detectó prenatalmente, confirmándose además el diagnóstico de trisomía 21 posnatalmente (tabla 1).
Cribado combinado del primer trimestre. Evolución durante los primeros 5 años de implantación
| Año | 2006 | 2007 | 2008 | 2009 | 2010 | Total |
| Número de cribados | 1.124 | 2.158 | 2.466 | 2.430 | 2.477 | 10.655 |
| Índice de riesgo≥1/270 | 52 | 106 | 91 | 76 | 89 | 414 |
| T21 detectados | 3 | 6 | 9 | 7 | 11 | 36 |
| T21 no detectados | 0 | 2 | 2 | 0 | 0 | 4 |
| Tasa de detección | 100% | 75% | 81,8% | 100% | 100% | 90% |
| Tasa de falsos positivos | 4,37% | 4,65% | 3,34% | 2,85% | 3,16% | 3,56% |
| Edad: | ||||||
| <30 años | 424 | 767 | 862 | 775 | 772 | 3.600 |
| 30-35 años | 456 | 904 | 924 | 969 | 951 | 4.204 |
| ≥35 años | 244 | 487 | 680 | 686 | 754 | 2.851 |
| Edad≥35 años (%) | 21,71% | 22,57% | 27,57% | 28,23% | 30,44% | 26,76% |
| Edad media (años) | 31,01 | 31,34 | 31,56 | 31,97 | 32,06 | 31,59 |
| Rango edad (años) | 16-45 | 15-44 | 14-45 | 14-45 | 15-45 | 14-45 |
T21: trisomía 21.
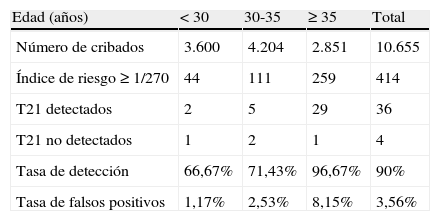
La tasa de falsos positivos fue del 3,56% (378/10.615) (tabla 2). En gestantes mayores de 35 años se observó una tasa de falsos positivos del 8,15%, para una tasa de detección del 96,7% (tabla 3).
Tasas de detección y falsos positivos de trisomía 21 según los grupos de edad materna
| Edad (años) | <30 | 30-35 | ≥35 | Total |
| Número de cribados | 3.600 | 4.204 | 2.851 | 10.655 |
| Índice de riesgo≥1/270 | 44 | 111 | 259 | 414 |
| T21 detectados | 2 | 5 | 29 | 36 |
| T21 no detectados | 1 | 2 | 1 | 4 |
| Tasa de detección | 66,67% | 71,43% | 96,67% | 90% |
| Tasa de falsos positivos | 1,17% | 2,53% | 8,15% | 3,56% |
T21: trisomía 21.
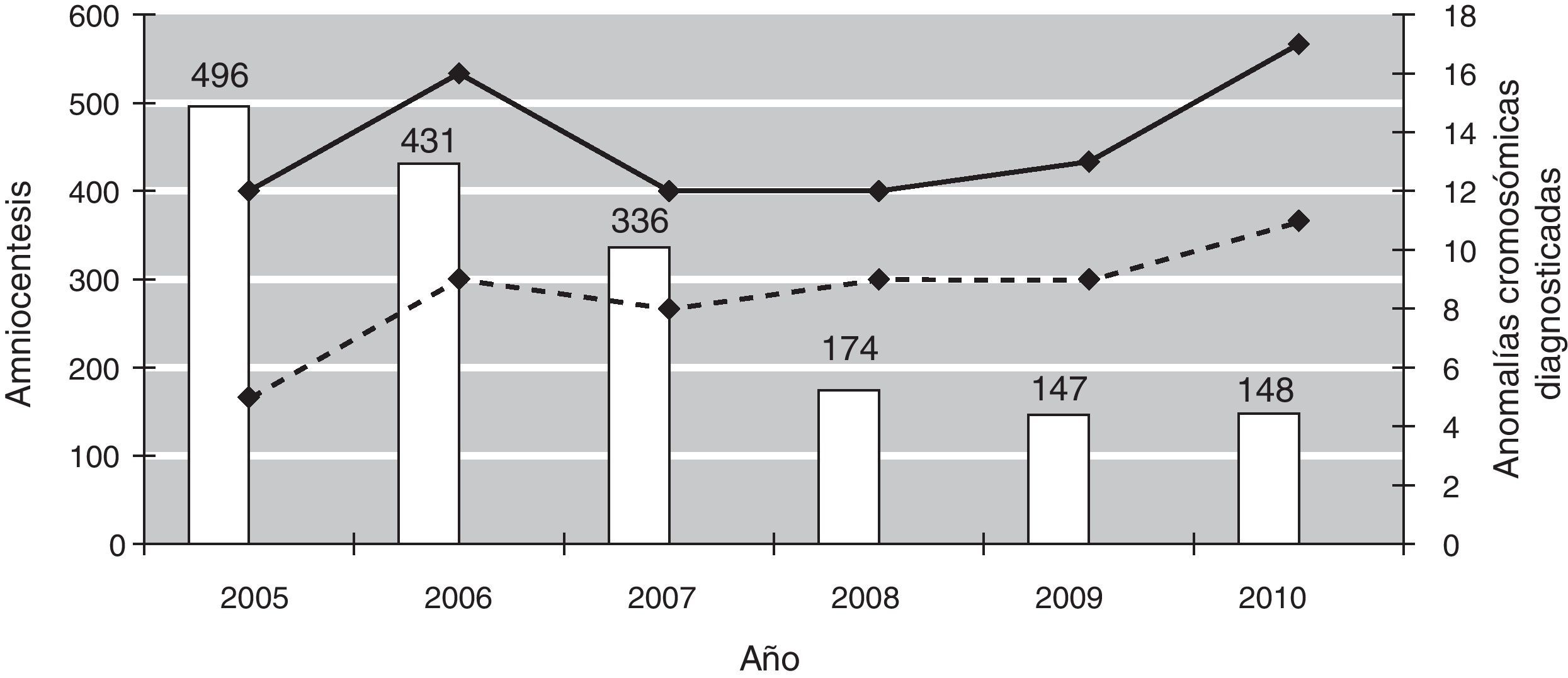
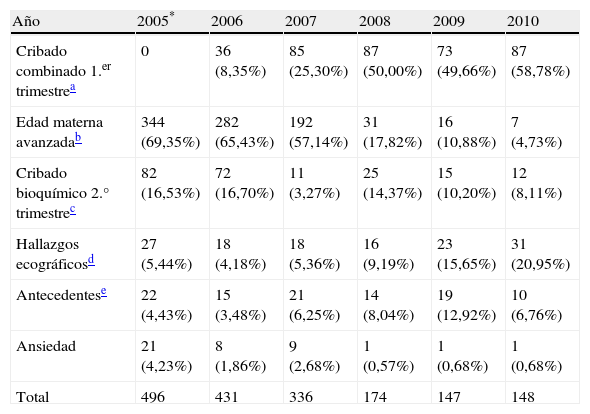
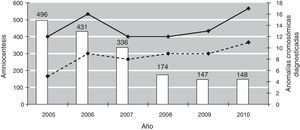
Durante el año 2005 (periodo anterior al establecimiento del cribado combinado), se realizaron 496 amniocentesis, la mayoría por edad materna igual o superior a 35 años. En la figura 1 se muestra la evolución en el número de amniocentesis y de anomalías cromosómicas fetales diagnosticadas prenatalmente entre los años 2005 y 2010. En el año 2010, tras 5 años de la implementación del cribado combinado del primer trimestre, se han realizado 148 amniocentesis (un 70% menos). La tasa global de pérdida fetal tras la prueba invasiva en los últimos 6 años es del 0,69%. En la tabla 4 se muestran las indicaciones de amniocentesis desde 2005 hasta 2010.
Evolución en el número de amniocentesis y de anomalías cromosómicas fetales diagnosticadas prenatalmente durante los años 2005-2010.
En columnas: número de amniocentesis. Línea continua: número total de anomalías cromosómicas diagnosticadas prenatalmente. Línea discontinua: número de fetos con trisomía 21 diagnosticados prenatalmente.
Evolución en la indicación de la amniocentesis tras 5 años de implantación del cribado combinado del primer trimestre (2006-2010)
| Año | 2005* | 2006 | 2007 | 2008 | 2009 | 2010 |
| Cribado combinado 1.er trimestrea | 0 | 36 (8,35%) | 85 (25,30%) | 87 (50,00%) | 73 (49,66%) | 87 (58,78%) |
| Edad materna avanzadab | 344 (69,35%) | 282 (65,43%) | 192 (57,14%) | 31 (17,82%) | 16 (10,88%) | 7 (4,73%) |
| Cribado bioquímico 2.° trimestrec | 82 (16,53%) | 72 (16,70%) | 11 (3,27%) | 25 (14,37%) | 15 (10,20%) | 12 (8,11%) |
| Hallazgos ecográficosd | 27 (5,44%) | 18 (4,18%) | 18 (5,36%) | 16 (9,19%) | 23 (15,65%) | 31 (20,95%) |
| Antecedentese | 22 (4,43%) | 15 (3,48%) | 21 (6,25%) | 14 (8,04%) | 19 (12,92%) | 10 (6,76%) |
| Ansiedad | 21 (4,23%) | 8 (1,86%) | 9 (2,68%) | 1 (0,57%) | 1 (0,68%) | 1 (0,68%) |
| Total | 496 | 431 | 336 | 174 | 147 | 148 |
*2005: periodo sin cribado combinado del primer trimestre.
El cribado basado en la edad materna avanzada como criterio aislado para la indicación de un estudio del cariotipo fetal no ha demostrado su validez. Hace cuatro décadas se estableció la edad de 35 años porque seleccionaba solo el 5% de la población, que representaba un porcentaje de amniocentesis que pareció razonable3. En los últimos años estamos asistiendo a un retraso progresivo en la edad de maternidad que conduciría a un aumento notable en el número de técnicas invasivas en caso de mantener los antiguos criterios de edad, con el consiguiente aumento de pérdidas fetales inherentes a las pruebas diagnósticas. La búsqueda de criterios de selección más eficaces es esencial para conseguir una mayor tasa de detección con un menor número de falsos positivos, que haga posible una mayor detección de anomalías cromosómicas con un menor número de procedimientos invasivos necesarios por cada anomalía diagnosticada. El descubrimiento de marcadores bioquímicos y ecográficos de riesgo de aneuploidías y, sobre todo, el diseño de estrategias que combinan distintos criterios epidemiológicos, bioquímicos y ecográficos hacen posible una mejor selección de gestantes candidatas a una prueba diagnóstica invasiva para el estudio del cariotipo fetal10,11.
El cribado combinado para la detección de anomalías cromosómicas en el primer trimestre de la gestación es la estrategia recomendada por diversas sociedades científicas9,12-16. Ofrece una mayor precocidad y fiabilidad en la selección de pacientes de riesgo, permite la aplicación de técnicas invasivas más tempranas que la amniocentesis, como la biopsia corial, lo cual disminuye el tiempo de espera para el diagnóstico y reduce la morbilidad materna en caso de ILE. La biopsia corial es una técnica que se está implantando paulatinamente en el medio sanitario. Durante el periodo estudiado no disponíamos todavía de la técnica, por lo que todos los procedimientos invasivos de diagnóstico prenatal se realizaron mediante amniocentesis.
Tras 5 años de implantación del cribado combinado del primer trimestre en nuestro hospital, la tasa de detección de trisomía 21 es de un 90%, para un 3,56% de falsos positivos. Estas cifras son muy similares a las observadas en amplias series publicadas por grupos con más experiencia y medios17-20.
Es reseñable que en nuestra serie el 26,8% de las gestantes tienen 35 años o más. La prevalencia de síndrome de Down depende del rango de edad materna de la población. Conforme aumenta la proporción de gestantes mayores, aumenta la prevalencia de síndrome de Down en la población. En nuestro estudio observamos una mayor prevalencia en gestantes mayores y una tasa de detección que aumenta cuanto mayor es la edad de la paciente sometida a cribado. En el grupo de gestantes con edad igual o mayor a 35 años, la tasa de detección es del 96,7%. Por tanto, disponemos de un método de cribado con alta sensibilidad en gestantes mayores, lo que permite una adecuada detección de fetos con trisomía 21 en este grupo de edad y una ulterior mejora de los resultados del cribado conforme aumente la prevalencia de síndrome de Down con el aumento de edad en la población gestante.
La efectividad de una prueba de cribado también debe medirse por su tasa de falsos positivos. La tasa global de falsos positivos en nuestro estudio (3,56%) se puede considerar adecuada para una prueba de cribado. Mantener una baja tasa de falsos positivos es importante a la hora de evitar pruebas invasivas innecesarias, que puedan conducir a la pérdida de fetos sanos y también para minimizar el impacto emocional en las gestantes y favorecer una mayor adhesión a las pruebas de cribado en futuros embarazos. Es importante percibir que a medida que aumenta la edad materna, aumenta la tasa de falsos positivos. En las gestantes mayores de 35 años de nuestro estudio, la tasa de falsos positivos fue del 8,15%. En caso de continuar la tendencia de aumento de la edad materna, se deberían diseñar estrategias de cribado con menores tasas de falsos positivos, que permitan mantener un número de procedimientos invasivos de diagnóstico adecuado, evitando un aumento en costes, tanto en pérdidas fetales, como económicos. En este sentido, diversos estudios muestran que el cribado contingente es una alternativa eficaz, segura y con la mejor relación coste-efectividad21-23. El cribado contingente consiste en la realización de una primera selección de pacientes mediante test combinado del primer trimestre, distribuyendo a estas pacientes en tres grupos: un primer grupo con riesgo alto, en quienes se ofrecería una prueba invasiva diagnóstica; un segundo grupo con riesgo bajo, en quienes no se realizarían más estudios, y un tercer grupo con riesgo intermedio, en quienes se ofrecería un segundo test de cribado consistente en la evaluación ecográfica de marcadores secundarios de aneuploidía (hueso nasal, flujo en ductus venoso y flujo transtricuspídeo) propuesto por Nicolaides19 o en el análisis de marcadores bioquímicos en el segundo trimestre (test cuádruple). Entre los riesgos intermedios se podrían considerar los comprendidos entre 1/100 y 1/1.000. En nuestra serie, posiblemente mejoraría la tasa de detección si consiguiéramos rescatar los casos de trisomía 21 con riesgo 1/271-1/.1000 y disminuiría la tasa de falsos positivos y pruebas invasivas si revaluáramos los riesgos entre 1/101 y 1/270 mediante un segundo test de cribado. Este supuesto requiere de estudios adicionales para comprobar su eficacia en nuestro medio.
La introducción del cribado combinado de anomalías cromosómicas del primer trimestre y el abandono de la edad materna avanzada como criterio aislado para la indicación de técnicas invasivas tienen como consecuencia la disminución en el número de amniocentesis observado año tras año desde el comienzo del programa. En nuestro hospital hemos conseguido reducir en un 70% el número de amniocentesis tras 5 años de utilización del cribado. En un estudio sobre población danesa, con una política nacional de cribado en primer trimestre en toda la población gestante, se informa de una reducción de un 53% de pruebas invasivas en 6 años17. Esta reducción en el número de amniocentesis se produce sin merma en la tasa de detección de síndrome de Down. En el año 2005 realizamos 41 amniocentesis por cada anomalía cromosómica diagnosticada y 99 por cada síndrome de Down. En cambio, en el año 2010 se realizaron 9 amniocentesis por anomalía cromosómica diagnosticada y 13 por cada síndrome de Down. Muller et al.24 atribuyen a la introducción del cribado combinado del primer trimestre una reducción de 35 a 15 en el número de procedimientos invasivos necesarios para diagnosticar un caso de anomalía cromosómica, y de 86 a 40 procedimientos para diagnosticar un caso de síndrome de Down. Arenas et al.25 informan de una reducción de 49 a 43 amniocentesis para diagnosticar un caso de síndrome de Down tras la introducción del cribado combinado del primer trimestre. En nuestro hospital no contemplamos la edad materna avanzada como criterio aislado para indicar una prueba invasiva, ya que el factor edad materna viene recogido en la propia técnica de cribado del primer trimestre, solo recomendamos la prueba invasiva en mujeres mayores de 38 años que no se han realizado ningún tipo de cribado. Así la indicación de amniocentesis por edad materna avanzada ha disminuido de un 69,3% en 2005 a un 4,7% en 2010. También es destacable que durante el año 2010, en el que se diagnosticaron prenatalmente 11 fetos con trisomía 21, todos fueron detectados por un cribado positivo en el primer trimestre.
La tendencia es a abandonar el criterio de edad materna avanzada como indicación de estudio del cariotipo fetal y ofrecer de manera universal a todas las gestantes un cribado de calidad, que genere confianza y seguridad, tanto en la embarazada, como en el profesional sanitario, y capaz de dar una información individualizada del riesgo de anomalía cromosómica fetal que desplace un criterio tan arraigado como la edad de riesgo para la realización de una prueba invasiva26-30.
Creemos fundamental la universalización del cribado a toda la población gestante. Un reciente estudio del EUROCAT (European Surveillance of Congenital Anomalies)31 demuestra que países europeos con una política sanitaria nacional de recomendación del cribado de síndrome de Down en todas las gestantes en el primer trimestre consigue tasas de detección mayores que aquellos países que no tienen una política común de cribado. En España, la gran variabilidad que se observa en los programas de cribado entre comunidades autónomas e incluso entre áreas sanitarias de una misma comunidad, justifica un mayor esfuerzo por parte de sociedades científicas, autoridades y profesionales sanitarios para diseñar protocolos comunes de cribado de anomalías cromosómicas fetales, con garantías de calidad y accesibilidad de toda la población gestante32.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.